2. 广东省医学科学院//广东省人民医院,广东 广州 510080;
3. 广东省医学科学院//广东省人民医院,麻醉科,广东 广州 510080
2. Medical Research Center, Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangdong Provincial Cardiovascular Institute, Guangzhou 510080, China;
3. Department of Anesthesiology, Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangdong Provincial Cardiovascular Institute, Guangzhou 510080, China
丙泊酚因起效快,作用迅速,持续时间短,消退快常用于麻醉的诱导和维持,成为临床麻醉应用最广泛的静脉麻醉药物。与此同时,丙泊酚对循环系统的影响受到麻醉工作者广泛关注。目前丙泊酚对于体循环的作用研究已证明,丙泊酚能降低体循环血管床阻力,引起体动脉包括大鼠主动脉[1] ,猪脑基底动脉,猪冠状动脉[2] ,大鼠肾动脉[3] 呈浓度依赖舒张,然而其对于肺循环的作用却存在较大争议。Machala等[4] 实施的一项临床研究观察丙泊酚诱导对循环影响发现,丙泊酚能明显增加肺动脉平均压力,增加右心室后负荷。Funayama等[5] 利用丙泊酚合并胸段硬膜外麻醉未观察到肺循环明显改变。Ogawa等[6] 以狗为实验对象,发现丙泊酚能增强去氧肾上腺素引起的血管收缩作用。课题组前期关于丙泊酚对大鼠肺动脉阻力作用研究发现,丙泊酚对大鼠肺内小动脉呈浓度依赖舒张[7] 。基于丙泊酚对肺动脉的作用因种属及部位不同存在较大差异,且以人离体肺血管为研究对象的研究很少。为进一步探究丙泊酚对人体肺循环的影响,本研究选择人体肺内小动脉作为研究对象,观察丙泊酚对离体人肺内小动脉血管张力影响。
环氧合酶(COX)是催化花生四烯酸合成前列腺素类物质和血栓素的限速酶,目前研究已证实前列腺素类物质和血栓素是一对影响血管壁张力的重要生物活性物质,在肺血管收缩反应中起重要作用[8] 。吲哚美辛是属非甾体类抗炎药,具有抗炎、镇痛及抗血栓的作用,同时作为一种较强的非选择性COX 抑制剂,能通过抑制COX合成影响前列腺素类物质及血栓素的合成,从而调节肺血管舒缩。作为术中经常联合使用的镇静镇痛药物,丙泊酚与吲哚美辛联合应用对血管收缩作用研究尚未见报导。故本研究探究丙泊酚与吲哚美辛联合应用对离体人肺内动脉的作用,为临床联合用药改善围术期肺动脉压力提供新思路。
1 资料和方法 1.1 资料本研究标本来源于2015年12月1日~2016年4月28日在广东省肺癌研究所因肺癌行肺叶切除术的38例病人,年龄30~65岁,男20例,女18例。ASA分级Ⅰ~Ⅱ级,肺功能正常,排除高血压、糖尿病、肺动脉高压。病人术前及术中均未使用用非甾类抗炎药物(NSAID)。术前均已告知患者标本的采集过程与标本用途,并签署相关标本采集知情同意书。本研究已通过广东省医学伦理委员会伦理批准(粤医科伦理2010079H号)。选取距离肿瘤组织5 cm以上正常肺组织作为实验标本,每一个病人提供1~4个血管环,同一个病人来源的血管环纳入不同的实验组别。
1.2 试剂与仪器 1.2.1 主要试剂丙泊酚、血栓素A2 类似物(U46619),吲哚美辛,乙酰胆碱(ACh)和二甲基亚砜(DMSO)均购于Sigma公司,其余试剂为国产分析纯。丙泊酚及血栓素A2 类似物溶于DMSO,其余试剂溶于超纯水,对照组已证明最高浓度DMSO(1∶500)对血管张力无影响。1.2.2 溶液K-H 液:(mmol/L:119 NaCl,4.7 KCl,2.5CaCl2,1 MgCl2· 6H2O,25 NaHCO3,1.2 KH2PO4,11.1葡萄糖);60 mmol 高钾:(mmol/L:63.7 NaCl,60 KCl,2.5CaCl2,1 MgCl2·6H2O,25 NaHCO3,1.2 KH2PO4,11.1葡萄糖)。
1.2.3 仪器PowerLab 8/30 生物信号采集处理系统(AD 公司,澳大利亚);610 M型多通道血管张力测定仪(DMT 公司,丹麦);Stemi DV4 型体式显微镜(ZEISS公司,德国);DK-8D 型电热恒温水槽(上海医用恒温设备厂)。
1.3 实验方法和步骤 1.3.1 血管环的制备手术标本取下后,选取距离癌组织5 cm 以上的正常肺组织,将肺组织放入装有预冷(4 ℃)且混合气(95% O2+5% CO2)饱和过的K-H液中,用冰盒在30 min 内转运至实验室。将标本固定于硅胶板上,体视显微镜下小心分离血管(直径2~4 mm)周围粘连的肺组织及支气管、肺静脉等,制备成长度为3~4 mm 的动脉环,固定于张力测定仪浴槽内的两个L型钳夹上。平衡60 min,期间每隔15 min 更换K-H液1次,调节基础张力至1.8~2.0 mN。浴槽内持续通入95% O2+5% CO2混合气,温度恒定在37 ℃,以模拟人体内环境。去内皮血管环制备采用不锈钢钢丝穿过血管腔时来回摩擦血管壁数次,以破坏血管内壁上的内皮细胞[9] 。
1.3.2 血管反应性测定制备好的肺动脉血管环在浴槽中模拟人体内环境平衡60 min后,调节基础张力至1.8~2 mN,前负荷变化稳定后把浴槽内的K-H 液换成预热的60 mmol/L高钾溶液。60 mmol/L高钾使肺内小动脉收缩,待血管收缩张力变化稳定至一平台期,用K-H液充分洗净(冲洗4 次,每次间隔5 min)至张力恢复至基线水平。重复上述过程至前后两次高钾刺激后血管收缩幅度相差不超过10%进行下一步实验。以加入高钾溶液前后平均血管张力改变幅度小于3 mN作为反应性差的界定标准,反应性差的血管舍弃不用[9] 。
1.3.3 血管内皮完整性测定内皮完整血管环用5-HT1 μmol/L收缩达到张力平衡时加入ACh 1mol/L,舒张率达到40%以上者认为内皮完整。去内皮的血管环用ACh舒张率小于5%者认为血管内皮去除完全。以K-H液反复洗去ACh,血管张力回复平衡后才能进行后续实验。
1.3.4 观察丙泊酚对于静息状态下肺动脉血管环张力的影响内皮完整和机械去内皮的血管环分别以累积加药法加入丙泊酚,使浴槽内浓度达到10、30、100、300 μmol/L,其对应的临床血药浓度分别为1.78、5.34、17.83、53.48 μg/mL。临床上丙泊酚使意识消失的血药浓度EC50为1.68 μg/mL,而其抑制体动的EC50为16 μg/mL[10] 。本研究将低于临床有效浓度(10~100 μmol/L)定义为低浓度,将高于临床有效浓度(100~300 μmol/L)定义为高浓度。记录血管张力变化。
1.3.5 观察丙泊酚对于经U46619预收缩肺动脉血管环张力的影响加入100 nmol/L U46619分别预收缩内皮完整和去内皮的血管环,待张力稳定后,采用累积加药法,使浴槽内丙泊酚浓度达到10、30、100、300 μmol/L,记录血管张力变化。
1.3.6 观察丙泊酚联合吲哚美辛对经U46619预收缩肺动脉血管环张力的影响内皮完整及去内皮血管环分别用100 μmol/L 吲哚美辛孵育30 min,再以100 nmol/LU46619 收缩血管,待张力稳定后,累计加入丙泊酚,使浴槽内丙泊酚浓度达到10、30、100、300 μmol/L,观察并记录血管张力变化。
1.4 统计学分析应用SigmaPlot10.0 软件处理数据,数据以均数±标准差形式表示,计量资料两组间比较采用t检验,3组以上组间比较采用one-way ANOVA 检验。应用Graphpad Prism 5.0 以非线性回归曲线拟合计算出pD2、EC50和Emax。EC50和pD2分别是产生50%最大收缩和舒张效应的药物摩尔浓度的负对数(-log),Emax 分别是最大收缩或舒张幅度。P<0.05 认为具有统计学差异。
2 结果 2.1 丙泊酚对于静息状态下肺动脉血管环张力的影响10~300 μmol/L的丙泊酚对于静息状态下内皮完整的肺内小动脉血管环张力无明显作用。
2.2 丙泊酚对U46619预收缩肺动脉血管环张力的影响丙泊酚对经U46619 预收缩内皮完整和去内皮人离体肺内小动脉血管环产生收缩舒张双相作用。
内皮完整组:低浓度(10~100 μmol/L)表现为浓度依赖收缩作用,EC50=4.525±0.37,Emax=(30.44±2.92)%;高浓度(100~300 μmol/L)表现为浓度依赖舒张作用;去内皮组:低浓度(10~100 μmol/L)表现为浓度依赖收缩作用,EC50=4.699±0.12 Emax=(31.19±5.10)%,高浓度(100~300 μmol/L)表现为浓度依赖的舒张作用;内皮完整组与去内皮组比较,丙泊酚浓度10、30、100 μmol/L浓度时去内皮组收缩最大值高于内皮完整组,差异有统计学意义(P<0.05);300 μmol/L浓度时舒张反应无明显差异(图 1)。
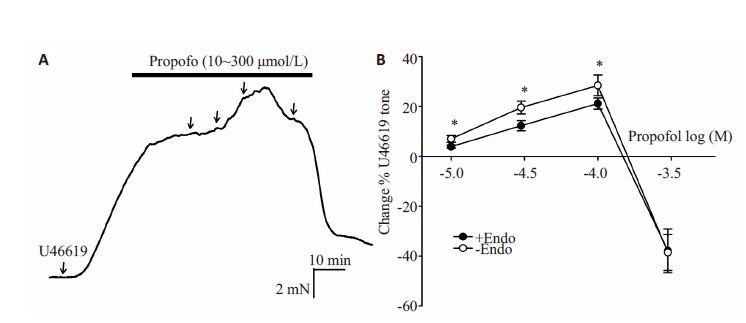
|
图 1 异丙酚对内皮完整和去内皮经U46619预收缩肺内小动脉的收缩舒张双相效应 Figure 1 Propofol induced changes in the pulmonary artery rings. A: Traces showing propofol-induced changes in the rings precontracted by U46619 (100 nmol/L); B: Graphs showing propofol-induced changes in endothelium-intact and denuded rings precontracted by U46619 (100 nmol/L). *P<0.05 (endothelium-intact vs endothelium-denuded) |
内皮完整和去内皮的肺小动脉环加入100 μmol/L吲哚美辛孵育后,丙泊酚对经U46619收缩的肺血管的收缩作用消失,表现为浓度依赖的舒张作用。
内皮完整组:pD50=3.713 ± 0.11,Emax=(98.72 ±0.34)%;去内皮组:pD50=3.54 ± 0.03,Emax=(94.56 ±0.53)%;内皮完整组与去内皮组相比300 μmol/L浓度时,P<0.05,10、30、100 μmol/L无明显统计学差异(图 2)。
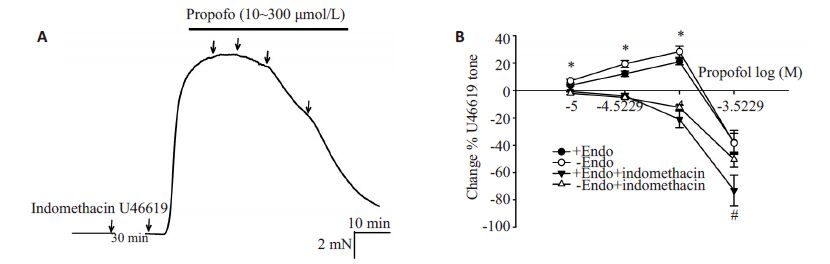
|
图 2 异丙酚对经吲哚美辛孵育之后U46619预收缩内皮完整和去内皮血管的作用及两组之间的比较 Figure 2 Comparison of propofol-induced change in pulmonary artery rings pretreated with indomethacin. A:Traces showing propofol-induced changes in the rings precontraeted by U46619 (XXX nmol/L) afterpretreatment with indomethacin; B: Graphs showing propofol-induced changes in endothelium-intact anddenuded rings. *P<0.05 (pretreated with indomethacin vs without indomethacin), #P<0.05 (endothelium intact vs endothelium denuded). |
本研究主要发现如下:(1)丙泊酚对静息状态下人离体肺血管张力无明显作用;(2)丙泊酚(10~300 μmol)对U46619预收缩的人离体肺内小动脉呈低浓度收缩、高浓度舒张双相作用;(3)丙泊酚引起的肺动脉收缩作用可以被环氧合酶(COX)抑制剂吲哚美辛阻断;(4)丙泊酚引起肺动脉舒张部分由内皮细胞参与。
目前关于丙泊酚对肺循环影响研究并不多,其作用及其机制在不同物种间存在较大争议。Rich等[11] 研究丙泊酚对大鼠离体肺的作用发现,对于正常的肺血管丙泊酚表现为直接的舒张作用,而对于内皮受损的肺血管,丙泊酚则增加血管阻力,由舒张作用转换为收缩作用。本研究发现相比于内皮完整组,去内皮组丙泊酚引起收缩幅度更高,说明其收缩作用与内皮无关,去内皮反而增加收缩幅度。一些关于丙泊酚对肺血管阻力影响的临床研究发现,丙泊酚并不增加肺循环的阻力及肺动脉平均压[4] ,说明在静息状态下,丙泊酚对肺血管无明显作用,但会增强经血栓素类似物U46619预收缩血管阻力,引起肺血管进一步收缩。血栓素(TXA2)为前列腺素类产物,由血小板产生,具有血小板凝聚及血管收缩作用,与前列环素作用相反,两者动态平衡以维持血管收缩功能及血小板聚集作用。目前几项研究表明,血浆中血栓素TXA2 及其同型产物TXB2 浓度于术中包括膝关节置换术[12] 、颈动脉内膜剥脱术[13] 、肝脏移植术[14] 、食管癌根治术[15] 、冠状动脉血管成形术[16] ,甚至手术切皮[17] 时都会升高,与围术期心脑血管事件有密切关联。因此本研究选用血栓素类似物U46619作为收缩剂预收缩血管,体外实验模拟围术期人体环境,探讨围术期丙泊酚对人体肺内小动脉的作用及其可能机制。U46619与细胞TP受体结合后激活PC信号通路,刺激生成花生四烯酸,花生四烯酸在特定酶的作用下转化为前列腺素和血栓素,参与血管舒缩调节[18] 。本研究假设丙泊酚在U46619激活PC通路后才发挥作用。环氧合酶(COX)是催化花生四烯酸合成前列腺素和血栓素的限速酶。分为COX-1和COX-2两型。已证明在血管组织中COX-1 和COX-2 均有表达。COX-1 表达较为稳定,合成的血栓素和内过氧化物参与内皮依赖的血管收缩[19] 。COX-2是诱导酶,可在大鼠肺动脉内皮,人类肾动脉及培养的肺动脉平滑肌细胞上持续表达[20-22] ,参与合成PGE2、PGH2、PGD2、PGF2等,COX源性收缩因子可通过受体作用,参与血管舒缩反应调节,其形态结构特性在不同血管床及不同物种间存在差异[23] 。病理状态下COX-2 表达上调,包括高血压、糖尿病。Morrell 和Knox等在低氧环境中培养人体肺血管及肺动脉平滑肌细胞,均发现COX-2表达上调,并发现同对照组相比,收缩性前列腺素系列因子如PGE2、PGD2、PGF2明显增多,低氧环境刺激肺动脉平滑肌细胞COX-2表达上调,并促进收缩因子释放增多,参与肺血管平滑肌增殖重构,与低氧性肺动脉高压形成密切相关[22] 。吲哚美辛为COX抑制剂,通过抑制环氧合酶阻断前列腺素类物质的生成,包括血管收缩因子PGE2、PGD2、PGF2,及血管舒张因子PGI2。本研究发现低浓度(10~100 μmol/L)丙泊酚对静息状态肺血管张力无明显作用,可引起U46619预收缩的人肺内小动脉产生收缩反应,并且该作用均可被吲哚美辛阻断,提示丙泊酚可能在U46619激活PC通路后,通过增强COX活性,增加COX源性收缩因子产生增强血管收缩作用,具体为何种收缩因子有待进一步探究。
关于丙泊酚是否引起血管舒张,先前研究间存在较大差异。Horibe等[24] 以狗为研究对象发现丙泊酚可通过抑制一氧化氮和内皮源性超极化因子生产减弱乙酰胆碱引起的血管舒张作用。而Tanaka等[25] 比较丙泊酚对大鼠肺内肺外动脉作用发现,丙泊酚通过一氧化氮途径舒张肺外动脉,其作用具有内皮依赖性。本研究则发现吲哚美辛孵育后内皮完整组与去内皮组比较,丙泊酚在10~100 μmol/L舒张作用并没有明显差异,但最大舒张幅度内皮完整组高于去内皮组,说明丙泊酚引起的血管舒张作用部分依赖内皮细胞。
综上所述,丙泊酚对人体肺内小动脉呈收缩、舒张双相反应。其收缩作用可能与丙泊酚增强肺动脉平滑肌COX活性,使COX源性收缩因子生成增多有关,丙泊酚联合吲哚美辛使用可以阻断单独使用丙泊酚引起的肺动脉血管环收缩。该研究提示对于肺动脉高压的病人,术中使用丙泊酚联合非甾类抗炎镇痛药物可降低肺动脉压力,但其在临床应用有待进一步的在体研究。
| [1] | Sakai Y, Kawahito S, et al. Propofol-induced relaxation of rat aorta is altered by aging[J]. J Med Invest, 2014, 61 (3-4): 278-84. |
| [2] | Klockgether-Radke AP, Schulze H, Neumann P, et al. Activation of the K+Channel BK(Ca)is involved in the relaxing effect of propofol on coronary arteries[J]. Eur J Anaesthesiol, 2004, 21 (3): 226-30. DOI: 10.1097/00003643-200403000-00012. |
| [3] | Liu Y, Chang HL, Niu LG, et al. Effects of propofol on responses of rat isolated renal arteriole to vasoactive agents[J]. Vascul Pharmacol, 2009, 51 (2/3): 182-9. |
| [4] | Machala W, Szebla R. Effects of propofol induction on haemodynamics[J]. Anestezjol Intens Ter, 2008, 40 (4): 223-6. |
| [5] | Funayama T, Aida S, Matsukawa T, et al. Systemic,but not pulmonary, hemodynamics are depressed during combined high thoraco-cervical epidural and general anesthesia in dogs[J]. Can J Anaesth, 2003, 50 (5): 454-9. DOI: 10.1007/BF03021056. |
| [6] | Ogawa K, Tanaka S, Murray PA. Propofol potentiates phenylephrine- induced contraction via cyclooxygenase inhibition in pulmonary artery smooth muscle[J]. Anesthesiology, 2001, 94 (5): 833-9. DOI: 10.1097/00000542-200105000-00022. |
| [7] | Zhang G, Cui J, Chen Y, et al. The relaxant effect of propofol on isolated rat intrapulmonary arteries[J]. Korean J Physiol Pharmacol, 2014, 18 (5): 377-81. DOI: 10.4196/kjpp.2014.18.5.377. |
| [8] | Su YC, Jin XR. Relation of TXA2 and PGI2 to the difference in hypoxic pulmonary vasoconstriction between different strains of rats[J]. J Tongji Med Univ, 1989, 9 (3): 148-52. DOI: 10.1007/BF02908965. |
| [9] | 农丽丹, 邓春玉, 邝素娟, 等. 右美托咪定抑制五羟色胺诱导的人离体肺内小动脉收缩[J]. 南方医科大学学报, 2014, 34 (3): 303-7. |
| [10] | Vanlersberghe C, Camu F. Propofol[J]. Handb Exp Pharmacol, 2008, 182 : 227-52. DOI: 10.1007/978-3-540-74806-9. |
| [11] | Rich GF, Roos CM, Anderson SM, et al. Direct effects of intravenous anesthetics on pulmonary vascular resistance in the isolated rat lung[J]. Anesth Analg, 1994, 78 (5): 961-6. |
| [12] | 葛叶盈, 成建庆, 席文娇, 等. 乌斯他丁对老年髋关节置换术后血栓素 B2水平和深静脉血栓形成的影响[J]. 中南大学学报, 2010, 35 (12): 1278-81. |
| [13] | Tachtsi M, Pitoulias G, Kostoglou C, et al. The proinflammatory mediator's production from ischemic brain during carotid endarterectomy[J]. Int Angiol, 2011, 30 (5): 429-33. |
| [14] | Hei ZQ, Huang HQ, Luo CF, et al. Changes of nitric oxide and endothelin, thromboxane A2 and prostaglandin in cirrhotic patients undergoing liver transplantation[J]. World J Gastroenterol, 2006, 12 (25): 4049-51. DOI: 10.3748/wjg.v12.i25.4049. |
| [15] | Aiko S, Yoshizumi Y, Tsuwano S, et al. The effects of immediate enteral feeding with a formula containing high levels of omega-3 fatty acids in patients after surgery for esophageal cancer[J]. JPEN J Parenter Enteral Nutr, 2005, 29 (3): 141-7. DOI: 10.1177/0148607105029003141. |
| [16] | Fracassi F, Niccoli G, Scalone G, et al. Prognostic role of multiple biomarkers in stable patients undergoing fractional flow reserveguided coronary angioplasty[J]. J Cardiovasc Med (Hagerstown), 2016, 17 (9): 687-93. DOI: 10.2459/JCM.0000000000000342. |
| [17] | Undas A, Siudak Z, et al. Simvastatin administration reduces thromboxane production in subjects taking aspirin:links between aspirin resistance and thrombin generation[J]. Int J Cardiol, 2012, 154 (1): 59-64. DOI: 10.1016/j.ijcard.2010.09.093. |
| [18] | Nakahata N, Takano H, Ohizumi Y. Thromboxane A2 receptormediated tonic contraction is attributed to an activation of phosphatidylcholine-specific phospholipase C in rabbit aortic smooth muscles[J]. Life Sci, 2000, 66 (5): PL 71-6. |
| [19] | Zhu N, Liu B, Luo W, et al. Vasoconstrictor role of cyclooxygenase- 1-mediated prostacyclin synthesis in non-insulin-dependent diabetic mice induced by high-fat diet and streptozotocin[J]. Am J Physiol Heart Circ Physiol, 2014, 307 (3): H319-27. DOI: 10.1152/ajpheart.00022.2014. |
| [20] | Therland KL, Stubbe J, Thiesson HC, et al. Cycloxygenase-2 is expressed in vasculature of normal and ischemic adult human kidney and is colocalized with vascular prostaglandin E2 EP4 receptors[J]. J Am Soc Nephrol, 2004, 15 (5): 1189-98. DOI: 10.1097/01.ASN.0000124673.79934.24. |
| [21] | Baber SR, Champion HC, Bivalacqua TJ, et al. Role of cyclooxygenase- 2 in the generation of vasoactive prostanoids in the rat pulmonary and systemic vascular beds[J]. Circulation, 2003, 108 (7): 896-901. DOI: 10.1161/01.CIR.0000084536.87322.BB. |
| [22] | Yang XD, Sheares KK, Davie N, et al. Hypoxic induction of Cox-2 regulates proliferation of human pulmonary artery smooth muscle cells[J]. Am J Respir Cell Mol Biol, 2002, 27 (6): 688-96. DOI: 10.1165/rcmb.2002-0067OC. |
| [23] | Feletou M, Huang Y, Vanhoutte PM. Endothelium-mediated control of vascular tone:COX-1 and COX-2 products[J]. Br J Pharmacol, 2011, 164 (3): 894-912. DOI: 10.1111/bph.2011.164.issue-3. |
| [24] | Horibe M, Ogawa K, Sohn JT, et al. Propofol attenuates acetylcholine- induced pulmonary vasorelaxation-role of nitric oxide and endothelium-derived hyperpolarizing factors[J]. Anesthesiology, 2000, 93 (2): 447-55. DOI: 10.1097/00000542-200008000-00024. |
| [25] | Tanaka H, Yamanoue T, Kuroda M, et al. Propofol relaxes extrapulmonary artery but not intrapulmonary artery through nitric oxide pathway[J]. Hiroshima J Med Sci, 2001, 50 (3): 61-4. |
 2017, Vol. 37
2017, Vol. 37

