2. 广州总医院神经康复一科,广东 广州 510010
2. First Department of Neurorehabilitation of General Hospital of Guangzhou Military Command, Guangzhou 510010, China
意识障碍是指人们对自身和环境的感知发生障碍,或人们赖以感知环境的精神活动发生障碍的一种状态。根据意识水平的不同分为脑死亡、昏迷、植物状态、微意识状态等[1] 。近年来,随着医疗水平的进步,脑损伤后度过急性期进入恢复期的患者越来越多。国外有研究显示每10万人口约有0.2~6.1个植物状态病人,约有1.5个微意识状态病人[2-3] 。然而,在人类意识本质的科学探索中意识障碍患者的诊断及治疗仍面临着巨大的挑战及特殊的机遇[4] 。意识障碍患者应该得到准确的诊断及循证的预后评估,从而得到合乎伦理、法律及医学的最佳治疗方案,而对于临床医生而言这是一项非常重要却又很困难的工作。目前对意识障碍患者意识水平评估的主要方法仍然是行为学量表的评估,主观性强,误诊率高达40%左右[5] 。因此临床上开始尝试用多种方法联合来评估意识障碍患者的意识水平[6-8] 。但目前尚缺乏对影响意识障碍患者意识恢复相关因素的研究,本文将对近5年来在我院就诊的114名意识障碍患者进行二分类Logistic回归分析,探寻影响意识恢复的因素,旨在为意识障碍患者的预后评估提供一定的依据。
1 资料和方法 1.1 研究对象所有病例均来自2010年1月~2014年12月就诊于我院的脑损伤后意识障碍的病人,共139人,剔除资料不全的25人,有114人最终被纳入建立回归模型。纳入标准:(1)入院24 h内修改版昏迷恢复量表(CRS-R)评分诊断为植物状态或微意识状态[9] ;(2)在我科康复治疗时间大于3个月;(3)脑损伤后意识障碍病程大于28 d,且小于180 d。排除标准:(1)意识障碍继发于肿瘤、代谢性疾病及炎性疾病;(2)病历资料不全。
研究的影响因素包括:性别,年龄,病因,脑电图分级,既往史的有无,血常规、尿常规、电解质及肝肾功能有无异常,感染、肌张力高、脑积水、中枢性发热、阵发性交感神经过度兴奋(PSH)、癫痫发作的有无及植物状态持续时间。其中病因分为脑外伤及非脑外伤两组,既往史中主要研究高血压及糖尿病病史的有无,脑电图按照Synek分级[10] 标准分级(Ⅰ、Ⅱ级为结果较好组,Ⅲ、Ⅳ、Ⅴ级为结果较差组),感染主要包括肺部感染、泌尿系感染及血流感染的有无。
所有病例分为意识恢复组(48人,占42%)及意识未恢复组(56人,占58%)。根据患者出院时CRS-R评分判定,交流项2分或运动项6分,即患者出现功能性交流或功能性运用,则可诊断患者为意识恢复,反之为意识未恢复[9] 。
1.2 数据采集所有检查均在患者入院后两周内进行,所有资料均通过回顾住院期间病历及向家属询问获得,其中CRS-R量表评分是由两名经过专业培训的神经科医生同时评得。
1.3 统计分析采用SPSS 19.0统计软件对数据进行分析。该研究主要分为3个步骤:第1步,单因素分析,对两组患者可能影响结局的因素的值或频率分布进行比较,计数资料采用χ2检验,计量资料进行t检验;第2步,将上一步中获得的差异有统计学意义的变量纳入建立logistic回归模型,逐步分析得出意识恢复的独立影响因素并对模型整体及各项系数进行检验;第3步,判断所得回归模型的拟合优度,用Hosmer-Lemeshow检验,以及做该模型预测概率的受试者最佳工作曲线(ROC曲线),若曲线下面积(AUC值)在0.7~0.8之间表示模型一般,0.8~0.9之间表示模型较好,大于0.9表示模型非常好[11] ,同时确定最佳临界值。
2 结果 2.1 单因素分析如表 1 所示,意识恢复组入院24 h 内CRS-R评分(8.52 ± 3.696)显著高于未恢复组(5.30 ± 1.655)(P=0.000)。未恢复组意识水平进入微意识状态的时间明显晚于意识恢复组(P=0.000)。另外,两组患者脑积水(P=0.037)、中枢性发热(P=0.035)、肌张力高(P=0.034)、PSH(P=0.004)出现与否的频率分布亦有明显差异(P<0.05)。同时,我们发现114 名病例中仅15%(17人)在入院时血常规无异常,仅16%(18人)在入院前及入院两周内未出现肺部、泌尿系或是血流的感染。
| 表 1 意识恢复组与意识未恢复组各因素的比较 Table 1 Comparison of factors between the two groups |
将单因素分析中两组有差异的变量,即植物状态持续时间、入院时CRS-R量表评分、脑积水、肌张力高、中枢性发热、PSH 6个影响因素纳入建立logistic回归模型(表 2)。最终得出意识恢复与否的显著影响因素为:植物状态持续时间(OR=1.016, P=0.008)、CRS-R 评分(OR=0.640,P=0.002)、中枢性发热(OR=4.056, P=0.044)及PSH(OR=4.502, P=0.034)。
| 表 2 Logistic回归分析结果 Table 2 Results of logistic regression |
用该模型预测该研究中的114例患者意识恢复与否的结局,准确率为85.1%。Hosmer-Lemeshow 检验的χ2值为10.214(P=0.250),做出该回归模型预测概率的ROC曲线,判断该模型拟合优度,得出AUC值为0.910,95%置信区间为(0.856,0.964),提示拟合优度非常好。ROC曲线最靠近左上方的点即最佳临界值所对应的敏感度和特异度分别为89.4%和79.2%,该点所对应的P值为0.481(图 1)。
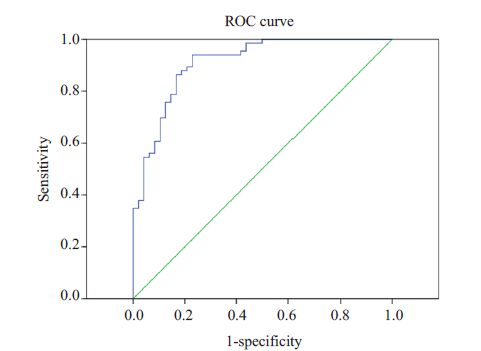
|
图 1 模型ROC曲线 Figure 1 ROC curve for the model. |
进一步分析发现,48例意识恢复患者脑损伤至意识恢复时间呈中位数为67,偏度为1.463的偏态分布,有21 例(44%)患者意识恢复时间分布在50~100 d,仅有4名(8%)患者在>150 d时恢复意识(图 2)。对未纳入模型的各因素,我们进行了相关的数据分析,对于服从正态分布的因素采用独立样本t检验,若不服从正态分布则采用曼-惠特尼U检验。结果发现脑外伤63.24±25.286 d与非脑外伤96.13±54.431 d差异有统计学意义(t=2.721, P=0.009),即脑外伤患者较非脑外伤患者更早恢复意识;未出现脑积水的患者恢复明显快于并发脑积水的患者(P=0.014)。然而,肌张力高及有无癫痫发作在该研究中对意识恢复速度未发现有明显影响。
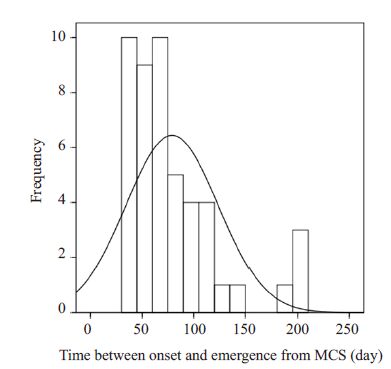
|
图 2 意识恢复患者从发病至意识恢复时间频率分布图 Figure 2 Frequency distribution histogram of the time between onset and recovery of minimal consciousness. |
欧美的一项多中心研究发现,脑创伤后意识障碍患者康复期间最常见的并发症是肌张力高、精神症状、尿路感染及睡眠障碍,最严重的并发症是脑积水、肺炎、胃肠道问题以及PSH[12] 。Ganesh等[13] 对157名意识障碍患者随访1年,将多种并发症的出现与否与患者预后作相关性分析,发现脑积水、癫痫发作、肌张力高及尿路感染均与患者功能的恢复有关,当随访期间出现3个以上并发症时,患者预后往往较差。另一项对缺血缺氧性脑病患者意识恢复影响因素的分析发现,年龄较大、入院时CRS-R评分较低及在ICU治疗的时间过长均预示着较差的恢复结局,成为永久性意识障碍的可能性较大[14] 。
本研究收集了前人做出的对意识障碍患者预后有影响的因素,同时又加入其他对意识恢复可能有影响的因素:植物状态持续时间、入院时的CRS-R评分、脑电图分级、既往高血压、糖尿病病史的有无、血常规、尿常规、电解质、肝肾功能、中枢性发热及PSH,采用了二分类Logistic回归分析对脑损伤后意识障碍患者意识恢复的影响因素进行了分析。单因素分析结果发现除前人已发现的癫痫发作、脑积水、肌张力高外,还发现植物状态持续时间、入院时CRS-R评分、中枢性发热及PSH与意识恢复结局显著相关。本研究得出病因并未影响意识恢复的结局,这与前人的研究[15] 有所出入,但在对48名意识恢复患者意识恢复时间的分析中发现,脑外伤患者意识恢复速度却明显快于非脑外伤患者。多因素Logistic回归分析得出中枢性发热、植物状态持续时间、PSH及入院时CRS-R 评分是意识恢复的独立影响因素,且PSH的出现是影响意识障碍患者意识恢复的首要因素;中枢性发热的出现,入院时CRS-R评分较差,植物状态持续时间过长是影响意识恢复的次要因素。
PSH是脑损伤后出现的以呼吸频率快、心率快、血压升高、发热、出汗及瞳孔扩大等为主要表现的交感神经兴奋症候群,同时可伴有去皮层强直或去大脑强直、肌紧张、磨牙、躁动等动作表现[16] 。目前临床对于PSH的了解较少,对于PSH的定义、诊断及治疗尚有争议,上述症状往往并不会同时出现[17] ,因而容易被忽视而导致错误的诊断及治疗。有文献报道[18] ,脑损伤后有25%~33%患者会出现PSH,本研究中有28.95%(33/114)的患者出现。有研究者将脑损伤后出现PSH的患者与未出现PSH的患者进行比较,发现两组间出院时的行为量表评分、6个月死亡率以及格拉斯高结局量表评分均有显著性差异[18-19] 。本研究亦发现PSH的出现是患者意识恢复的独立影响因素,并且该因素对应的OR值较高,与文献报道相符合。而该症候群的出现影响意识恢复的作用机制目前尚不明确,有学者猜测可能是由于PSH的出现导致患者代谢亢进、体质量减轻,增加异位骨化的可能,长期出现PSH会加剧心功能及免疫抑制的损害,从而对患者预后造成不良影响[20-22] 。
发热在危重症患者中相当常见,其中神经系统损伤的患者更易出现发热。一项研究显示ICU术后的患者有30%~45%出现发热,脑损伤后发热的患者却高达70%,这其中仅有50%是因感染而发热[23] 。本研究114名患者中有37名患者无明确的感染及非感染性发热病因,这其中有28名(76%)患者意识未恢复。有明确的证据表明脑损伤后出现中枢性发热的患者死亡率会增加[24-25] 。另外一项对390名脑卒中患者的研究显示,较高的体温与较差的预后结局显著相关,并且体温每升高1 ℃,预后差的危险度增加2.2倍[26] 。对于中枢性发热对脑损伤患者预后影响的机制有多种说法,如体温升高会增加新陈代谢的需要,不利于缺血缺氧的神经组织修复;体温升高与颅内压升高有统计学意义的关联;高热会使损伤的脑组织炎症反应加重、细胞因子及中性粒细胞增多;还有的认为可能由于发热给脑组织带来过高的兴奋性刺激,血脑屏障破坏以及蛋白质稳定性及功能的破坏等[27] 。中枢性发热多见于弥漫性轴索损伤、出血破入脑室的患者,常提示脑损伤较为严重,预后不良[28] 。因此,对中枢性发热尽早、准确地准段,可以减少患者不必要的抗生素的使用,同时能够有效地改善患者的预后。
植物状态是指患者能够觉醒,有睡眠觉醒周期,但是对自身及周围环境不能够自知,没有任何有意识的表现[1] 。早在1994年新英格兰杂志上一项研究已经提出意识障碍患者植物状态持续的时间越长,意识恢复的可能性则越小,对于非脑外伤的患者,植物状态持续时间超过3个月以及脑外伤患者持续时间超过1年时,意识恢复的概率仅为1%[29] 。因此,准确地评估患者的意识水平,才能有效地节约社会资源,同时也能减少对患者家庭带来不必要的经济负担。
入院时CRS-R评分较高的患者意识恢复结局明显优于评分较低的患者。CRS-R量表包括6个子量表(听觉、视觉、运动、言语、唤醒度及交流),是目前临床上诊断意识障碍患者意识水平的主要手段,美国康复医学会近期的一项系统性综述验证了CRS-R量表的信效度[30] 。
本研究通过文献阅读及临床观察选择与意识障碍患者意识恢复结局可能有影响的因素,并进行逐步分析,并且该研究样本量足够大,得出的结果可信。对于模型拟合优度的检验,我们采用Hosmer-Lemeshow检验及c检验进行评价,结果均提示该模型拟合优度好。
综上所述,影响意识障碍患者意识恢复结局的因素较多,PSH的出现是影响意识障碍患者意识恢复的首要因素;中枢性发热的出现,入院时CRS-R评分较差,植物状态持续时间过长是影响意识恢复的次要因素。
| [1] | Laureys S, Celesia GG, Cohadon FA, et al. Unresponsive wakefulness syndrome: a new Name for the vegetative state or apallic syndrome[J]. BMC Med, 2010, 8 (2): 68. |
| [2] | Donis J, Kraeftner B. The prevalence of patients in a vegetative state and minimally conscious state in nursing homes in Austria[J]. Brain Injury, 2011, 25 (11): 1101-7. DOI: 10.3109/02699052.2011.577047. |
| [3] | van Erp WS, Lavrijsen J, van de Laar FA, et al. The vegetative state/ unresponsive wakefulness syndrome: a systematic review of prevalence studies[J]. Eur J Neurol, 2014, 21 (11): 1361-8. DOI: 10.1111/ene.2014.21.issue-11. |
| [4] | Laureys S, Schiff ND. Coma and consciousness:paradigms (re) framed by neuroimaging[J]. Neuroimage, 2012, 61 (2): 478-91. DOI: 10.1016/j.neuroimage.2011.12.041. |
| [5] | Stokes V, Gunn S, Schouwenaars K, et al. Neurobehavioural assessment and diagnosis in disorders of consciousness: a preliminary study of the sensory tool to assess responsiveness (STAR)[J]. Neuro Reh, 2016, 5 (9): 1-18. |
| [6] | Di Perri C, Heine L, Amico E, et al. Technology-based assessment in patients with disorders of consciousness[J]. Ann Ist Super Sanita, 2014, 50 (3): 209-20. |
| [7] | Gosseries O, Pistoia F, Charland-Verville V, et al. The role of neuroimaging techniques in establishing diagnosis, prognosis and therapy in disorders of consciousness[J]. Open Neuroimag J, 2016, 10 (3): 52-68. |
| [8] | Magee L, Siegert J, Taylor M, et al. Music therapy assessment Tool for awareness in disorders of consciousness (MATADOC): reliability and validity of a measure to assess awareness in patients with disorders of consciousness[J]. J Music Ther, 2016, 53 (1): 1-26. DOI: 10.1093/jmt/thv017. |
| [9] | Giacino JT, Kalmar K, Whyte J. The JFK coma recovery Scale- Revised: measurement characteristics and diagnostic utility[J]. Arch Phys Med Rehabil, 2004, 85 (12): 2020-9. DOI: 10.1016/j.apmr.2004.02.033. |
| [10] | Synek VM. Prognostically important eeg coma patterns in diffuse anoxic and traumatic encephalopathies in adults[J]. J Clin Neuro, 1988, 5 (2): 161-74. DOI: 10.1097/00004691-198804000-00003. |
| [11] | Lemeshow S, Hosmer J. Logistic regression analysis: applications to ophthalmic research[J]. Am J Ophthalmol, 2009, 147 (5): 766-7. DOI: 10.1016/j.ajo.2008.07.042. |
| [12] | Whyte J, Nordenbo AM, Kalmar K, et al. Medical complications during inpatient rehabilitation among patients with traumatic disorders of consciousness[J]. Arch Phys Med Rehabil, 2013, 94 (10): 1877-83. DOI: 10.1016/j.apmr.2012.12.027. |
| [13] | Ganesh S, Guernon A, Chalcraft L, et al. Medical comorbidities in disorders of consciousness patients and their association with functional outcomes[J]. Arch Phys Med Rehabil, 2013, 94 (10): 1899-907. DOI: 10.1016/j.apmr.2012.12.026. |
| [14] | Howell K, Grill E, Klein AM, et al. Rehabilitation outcome of anoxic-ischaemic encephalopathy survivors with prolonged disorders of consciousness[J]. Resuscitation, 2013, 84 (10): 1409-15. DOI: 10.1016/j.resuscitation.2013.05.015. |
| [15] | Dolce G, Lucca F, Riganello F, et al. Advances in the neurorehabilitation of severe disorder of consciousness[J]. Ann Ist Super Sanita, 2014, 50 (3): 234-40. |
| [16] | Baguley IJ, Perkes IE, Fernandez-Ortega JF, et al. Paroxysmal sympathetic hyperactivity after acquired brain injury: consensus on conceptual definition, nomenclature, and diagnostic criteria[J]. J Neurotrauma, 2014, 31 (17): 1515-20. DOI: 10.1089/neu.2013.3301. |
| [17] | Baguley IJ, Heriseanu RE, Nott MT, et al. Dysautonomia after Severe Traumatic Brain Injury Evidence of Persisting Overresponsiveness to Afferent Stimuli[J]. Am J Phys Med Rehabil, 2009, 88 (8): 615-22. DOI: 10.1097/PHM.0b013e3181aeab96. |
| [18] | Mathew MJ, Deepika A, Shukla D, et al. Paroxysmal sympathetic hyperactivity in severe traumatic brain injury[J]. Acta Neurochir (Wien), 2016, 158 (11): 2047-52. DOI: 10.1007/s00701-016-2934-x. |
| [19] | Lv LQ, Hou LJ, Yu MK, et al. Prognostic influence and magnetic resonance imaging findings in paroxysmal sympathetic hyperactivity after severe traumatic brain injury[J]. J Neurotrauma, 2010, 27 (11): 1945-50. DOI: 10.1089/neu.2010.1391. |
| [20] | Perkes I, Baguley IJ, Nott MT, et al. A review of paroxysmal sympathetic hyperactivity after acquired brain injury[J]. Ann Neurol, 2010, 68 (2): 126-35. DOI: 10.1002/ana.22066. |
| [21] | Baguley IJ, Slewa-Younan S, Heriseanu RE, et al. The incidence of dysautonomia and its relationship with autonomic arousal following traumatic brain injury[J]. Brain Inj, 2007, 21 (11): 1175-81. DOI: 10.1080/02699050701687375. |
| [22] | Mehta NM, Bechard LJ, Leavitt K, et al. Severe weight loss and hypermetabolic paroxysmal dysautonomia following hypoxic ischemic brain injury: The role of indirect calorimetry in the intensive care unit[J]. JPEN J Parenter Enteral Nutr, 2008, 32 (3): 281-4. DOI: 10.1177/0148607108316196. |
| [23] | Rossi S, Zanier ER, Mauri I, et al. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage[J]. J Neurol Neurosurg Psychiatry, 2001, 71 (4): 448-454. DOI: 10.1136/jnnp.71.4.448. |
| [24] | Greer DM, Funk SE, Reaven NL, et al. Impact of fever on outcome in patients with stroke and neurologic injury a comprehensive Meta-Analysis[J]. Stroke, 2008, 39 (11): 3029-35. DOI: 10.1161/STROKEAHA.108.521583. |
| [25] | Saxena M, Young P, Pilcher D, et al. Early temperature and mortality in critically ill patients with acute neurological diseases: trauma and stroke differ from infection[J]. Intensive Care Med, 2015, 41 (5): 823-32. DOI: 10.1007/s00134-015-3676-6. |
| [26] | Reith J, J?rgensen S, Pedersen M, et al. Body temperature in acute stroke: relation to stroke severity, infarct size, mortality, and outcome[J]. Lancet, 1996, 347 (8999): 422-5. DOI: 10.1016/S0140-6736(96)90008-2. |
| [27] | Rossi S, Zanier R, Mauri I, et al. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage[J]. J Neurol Neurosurg Psychiatry, 2001, 71 (4): 448-54. DOI: 10.1136/jnnp.71.4.448. |
| [28] | Badjatia N. Hyperthermia and fever control in brain injury[J]. Crit Care Med, 2009, 37 (7): S250-7. |
| [29] | Medical aspects of the persistent vegetative state (2). The Multi- Society Task Force on PVS[J]. N Engl J Med, 1994, 330 (22): 1572-9. DOI: 10.1056/NEJM199406023302206. |
| [30] | American Congress of Rehabilitation Medicine, Brain Injury-Interdisciplinary Special Interest Group, Disorders of Consciousness Task Force, Seel RT, Sherer M, et al. Assessment scales for disorders of consciousness: evidence-based recommendations for clinical practice and research[J]. Arch Phys Med Rehabil, 2010, 91 (12): 1795-813. DOI: 10.1016/j.apmr.2010.07.218. |
 2017, Vol. 37
2017, Vol. 37

