2. 广州医科大学附属第二医院 血液科,广东 广州 510260;
3. 南方医科大学公共卫生学院//广东省热带病研究重点实验室,微生物学系,广东 广州 510515
2. Department of Hematology, Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510260, China;
3. Department of Microbiology, Guangdong Provincial Key Laboratory of Tropical Disease Research/ School of Public Health, Southern Medical University, Guangzhou 510515, China
奇异变形杆菌为条件致病菌,可引起尿路感染、食物中毒、肺炎等多种疾病。其中以泌尿系统感染最常见,并可导致结石的出现。最近有调查表明,奇异变形杆菌检出率在尿路感染患者分离的革兰阴性杆菌中排在第4位[1] 。我们课题组则发现,奇异变形杆菌临床分离株超广谱β-内酰胺酶阳性率已达到28.95%[2] 。作为尿路感染中的重要病原菌之一,奇异变形杆菌耐药株的不断出现已引起研究者的高度重视,鉴定相关毒力因子、深入探索其致尿路感染机制,将为临床奇异变形杆菌尿路感染的预防和治疗提供重要的参考信息。
聚磷酸盐(Poly P)是一种广泛存在于从高等生物到低等生物体内的无机盐,由几个至数百个磷酸盐残基通过高能磷酸酐键结合在一起形成线形聚合体。在微生物体内,Poly P 甚至可以占到细胞干重的10%~20%[3] 。Poly P具有多种生物学功能,包括:参与能量代谢,维持细胞形态,调节胞内酸碱度和渗透压以及细胞磷脂膜通道的形成等[4-6] 。聚磷酸盐激酶(PPK)是催化合成Poly P关键激酶之一。多项研究证实,当某些微生物体内ppk基因缺失、Poly P合成受阻时,其对外界不利条件的抵抗力和毒力等会受到明显的影响[7-12] 。我们前期研究也发现PPK与奇异变形杆菌对尿路上皮细胞的侵袭能力以及群集运动能力有关[13] 。对于探索PPK的具体致病机制,获得PPK抗体是重要条件之一。然而目前还没有商品化的PPK抗体可购买,也未见有关奇异变形杆菌PPK抗体制备的任何报道。本文利用载体表达PPK重组蛋白,结合佐剂免疫兔子后进行ELISA效价及Western blotting验证,获得了效果较好的抗PPK多克隆抗体,为后续深入研究奇异变形杆菌PPK致病机制打下基础。
1 材料和方法 1.1 材料菌株BL21(DE3)、TOP10及质粒pET28b(+)(本室保存),弗氏完全佐剂、弗氏不完全佐剂购自Sigma,镍琼脂糖、TMB显色试剂盒、辣根酶标记山羊抗兔IgG(H+L)、蛋白定量试剂盒均购自上海生工生物工程有限公司。限制性内切酶购自Thermo Scientific。奇异变形杆菌野生株HI4320[14-15] 由密歇根大学医学院Harry L.T. Mobley教授惠赠,ppk基因敲除株由本室构建、保存。
1.2 抗原氨基酸序列的筛选及基因合成从GenBank中获得奇异变形杆菌HI4320 PPK氨基酸序列,采用ANTHEWIN、DNAstar 等分子生物学软件进行分析,筛选出N-端309个氨基酸做原核表达。利用DNAMAN软件将氨基酸序列翻译成相应的核苷酸序列,根据有利于原核表达的密码子进行基因序列优化,在5'和3'端分别引入NdeⅠ、XhoⅠ酶切位点。交由上海生工合成新的基因序列,大小共939 bp。
1.3 重组表达质粒的构建用NdeⅠ、XhoⅠ双酶切目的基因和质粒pET28b(+),回收片段连接反应1 h。将连接液42 ℃热激法转化宿主菌TOP10。挑取转化后平板上的单菌落于试管中37 ℃、220 r/min 培养过夜,抽提质粒,BamHⅠ、XhoⅠ双酶切鉴定,并将重组质粒送测序鉴定。
1.4 重组蛋白的表达与纯化 1.4.1 转化与诱导表达取1 μL重组质粒转化宿主菌BL21(DE3),37 ℃培养过夜。挑取单菌落于试管中(4 mL LB培养基,30 μg/mL卡那霉素)37 ℃,220 r/min过夜培养。将培养的菌液按1∶100比例转接。当A值达到0.6左右时,添加终浓度为0.5 mmol/Lol/L的IPTG,设15、22、30、37 ℃ 4种温度条件培养过夜,220 r/min诱导5 h,未加IPTG 诱导剂的作为阴性对照。SDS-PAGE电泳检测,选择最佳的蛋白表达诱导条件。
1.4.2 融合蛋白的纯化将菌液转接于含卡那霉素的LB 液体培养基中培养至A 值为0.6。添加终浓度为0.5 mmol/L的IPTG,于37 ℃、220 r/min,培养5 h,离心收集细胞菌体。将收集的菌体用裂解缓冲液(50 mmol/LTris,300 mmol/L NaCl,0.1%Triton X-100,pH=8.0)混匀,冰浴中超声破碎菌体。超声完毕,12 000 r/min,4 ℃ 离心20 min。沉淀用溶解缓冲液(7 mol/L 盐酸胍,50 mmol/L Tris,pH=8.0)溶解,重复上述超声、离心步骤,上清做下一步纯化。取5 mL Ni-IDA,用10倍柱床体积的结合缓冲液清洗平衡柱子,收集穿透液。10 倍柱床体积的结合缓冲液清洗柱子。洗脱缓冲液洗脱,收集洗脱液。注:结合缓冲液(8 mol/L 尿素,50 mmol/L Tris,300 mmol/L NaCl,pH8.0),清洗缓冲液(8 mol/L尿素,50 mmol/L Tris,300 mmol/L NaCl,10/20/50 mmol/L Imidazole,pH8.0),洗脱缓冲液(8 mol/L尿素,50 mmol/L Tris,300 mmol/L NaCl,500 mmol/LImidazole,pH8.0)。将50 mmol/L 咪唑洗脱液透析到25 mmol/L Tris,150 mmol/L NaCl,0.1%SKL,2 mmol/LDTT,pH8.0 的透析缓冲液中,收集样品SDS-PAGE检测。
1.5 动物免疫选用4只4月龄健康雌性新西兰大白兔,体质量约2.1 kg,分别命名为A、B、C、D兔。第1天,免疫用抗原为弗氏完全佐剂+蛋白抗原,背部多点注射(初免)。第21、35、42 天,均采用弗氏不完全佐剂+蛋白抗原进行背部多点注射(分别为二免、三免和四免)。接种蛋白总量约为5.2 mg,初次免疫剂量为0.3 mg/只,二免、三免、四免剂量为0.15 mg/只。于第42和56天,耳静脉采血1 mL,ELISA检测抗血清效价。第57天,ELISA检测抗血清效价达到要求,活体动物颈动脉采全血(终末采血)。亲和层析法纯化终末采血获得的抗血清[16] 。
1.6 间接ELISA检测血清效价将抗原用0.05 mol/L碳酸盐(pH=9.6)按0.2 μg/孔包板,4 ℃孵育过夜。PBST洗液洗涤3次。每孔加入5%脱脂奶粉100 μL封闭液,37 ℃封闭60 min。PBST洗涤3 次。加一抗:将兔子的血清分别按照1∶1000稀释,然后倍比稀释,37 ℃ 孵育1 h。PBST洗板3次。加二抗:辣根酶标记山羊抗兔IgG(H+L),1∶8000 稀释,37 ℃孵育45 min。PBST洗板5次。加入底物溶液100 μL/孔,反应15 min,最后加入100 μL 2 mol/L硫酸终止反应。用酶标仪在450 nm波长下测定A值。
1.7 Western blotting 检测抗体特异性提取PPK 重组蛋白以及奇异变形杆菌野生株HI4320、ppk敲除株的菌体蛋白。制备聚丙烯酰胺凝胶:浓缩胶5%、分离胶8%。蛋白上样量上样量为1 μg。垂直电泳条件为:浓缩胶90 V,30 min;分离胶120 V,1 h。300 mA湿转2 h。5%脱脂奶粉4度封闭过夜。一抗1∶500 TBST稀释,与PVF膜室温孵育3.5 h。二抗1∶5000稀释,室温缓慢振荡1 h。ECL曝光。
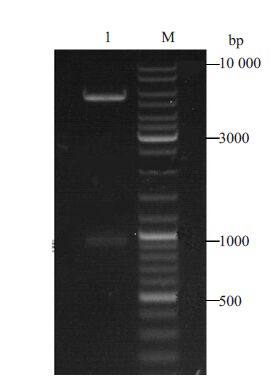
2 结果 2.1 重组表达质粒的双酶切鉴定挑取转化后平板上的单菌落于试管中37 ℃、220 r/min培养过夜,抽提质粒,采用BamHⅠ、XhoⅠ双酶切鉴定。结果如图 1,目的片段大小980 bp。
|
图 1 重组表达质粒的双酶切鉴定 Figure 1 Restriction enzyme identification of the recombinant plasmid. Lane 1: pET28b(+ ) recombinant plasmid; Lane M: DNAmarker. |
通过SDS-PAGE电泳和灰度分析,检测分析纯化后融合蛋白的纯度。用蛋白定量试剂盒测定蛋白浓度。通过1.4.1步骤小试样品进行SDS-PAGE分析,电泳显示在相应位置(~38 000)出现明显的新生条带(图 2)。

|
图 2 融合蛋白SDS-PAGE分析 Figure 2 SDS-PAGE analysis of the fusion protein. Lane M: Protein marker; Lane 1: Protein sample before induction; Lane 2: Bacterial protein sample after induction with 0.2 mmol/L IPTG at 20 ℃ for 16 h; Lane 3: Bacterial protein sample after induction with 0.2 mmol/L IPTG at 37 ℃ for 5 h. |
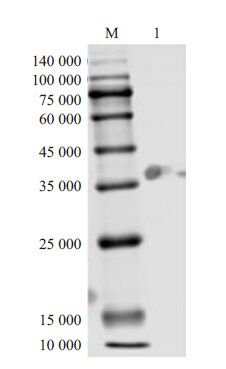
融合蛋白经过镍琼脂糖亲和层析法进行纯化,SDS-PAGE 电泳分析在相应位置(~38 000)下方出现明显条带,表明融合蛋白成功得到了纯化(图 3)。
|
图 3 融合蛋白纯化SDS-PAGE电泳图 Figure 3 SDS-PAGE analysis of fusion protein after purification. Lane M: Protein marker; Lane 1: Fusion protein after purification. |
纯化抗体ELISA检测结果见表 1。终放后抗血清纯化抗体效价:A≥512 K,B≥512 K,C≥512 K,D≥512 K。
| 表 1 纯化抗体ELISA检测结果 Table 1 ELISA test results of the purified anti-serum |
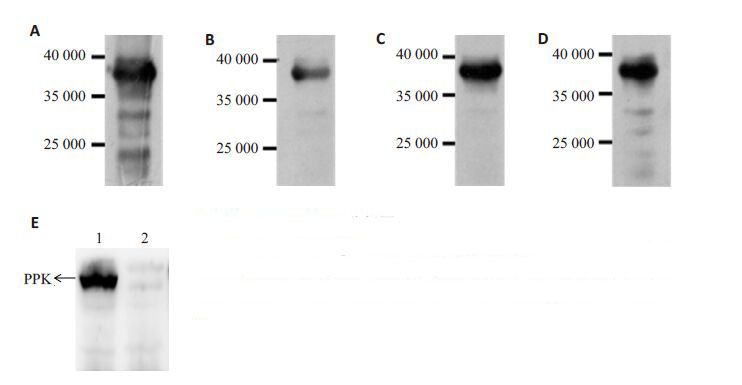
用兔抗血清对PPK重组蛋白进行western blotting分析,在相应位置出现明显条带,如图 4A~D(分别代表A、B、C、D兔所产生的抗体)所示,目的条带大小约为38 000。由图可见,B、C兔所产生的多克隆抗体特异性较好。选用C兔产生的抗体进一步对野生株HI4320和ppk敲除株菌体蛋白进行验证,显示野生株PPK所在位置可见明显条带,而ppk敲除株的相应位置则未见明显条带(图 4E)。
|
图 4 Western blottting分析图 Figure 4 Western blotting of PPK. A-B: Western blotting analysis of PPK fusion protein using the antibody produced by rabbits A, B, C and D, respectively; E: Western blotting of PPK from wild-type HI4320 (lane 1) and ppk mutant strain (lane 2) using the antibody produced by rabbit C. |
奇异变形杆菌是引发尿路感染的常见病原菌之一,且耐药株的出现呈上涨趋势。对于奇异变形杆菌的临床感染情况,我们应引起重视并开展更多的相关研究。PPK最初被发现时只有一种形式,后多项研究证实PPK可分为PPK1和PPK2[17-22] 。本文的研究目标PPK经序列比对为PPK1。近年来,研究者发现PPK参与了多种细菌的致病过程。PPK与绿脓杆菌的群集运动和泳动能力密切相关[23] 。类鼻疽伯克氏菌ppk基因被敲除后运动和菌膜形成能力均明显下降[24] 。PPK参与空肠弯曲菌对肠上皮细胞的侵袭过程[25] 。而我们在相关研究中也发现,ppk在大肠杆菌K1株致脑膜炎的过程中扮演了重要角色[12] 。但是PPK在奇异变形杆菌致病过程中所扮演的角色却并不清楚。
目前对于奇异变形杆菌研究较少,关于其抗体制备的报道则更为少见。PPK作为奇异变形杆菌重要毒力因子之一,没有相应的抗体成为了对其深入研究的障碍。单克隆抗体最大的优点是特异性强,然而其制备过程繁琐,成本和要求都较高。多克隆抗体虽然特异性不如单抗,但其生产操作过程相对简便、产量大,因此也是抗体制备的重要选择之一。由于种属间差异,利用大肠埃希菌表达系统表达奇异变形杆菌蛋白可能会受到影响。我们通过密码子优化为原核生物易于表达的碱基,另外,利用生物学软件预测、选取抗原性强的基因片段而非全长编码框,在保持抗原特异性的基础上有效提高了目的蛋白在大肠埃希菌中的表达。GST标签及His标签载体是两种常用的蛋白表达载体,前者有利于提高蛋白表达的可溶性及表达量。但GST标签较大,容易导致非特异免疫原性,通常蛋白表达后还需进行切除。后者His标签较小,对免疫时产生的非特异性干扰也较小[26] 。在本研究中,我们证实了利用携带His 标签的pET28b(+)表达质粒,可以在大肠埃希菌表达系统中高效表达奇异变形杆菌PPK片段。
本课题利用分子生物学软件对PPK序列进行分析,选取抗原性、亲水性强且保守性较高的的片段,并通过密码子优化、合成新的基因序列,插入到pET28b(+)表达质粒中,获得了可在大肠埃希菌中高效表达的重组质粒。表达的融合蛋白经过镍琼脂糖亲和层析法进行纯化,SDS-PAGE电泳分析证实所得到的蛋白具有较高纯度。将纯化蛋白与佐剂共同免疫新西兰大白兔后,获得了高效价的多抗血清,其效价达到1∶512 000。用最终纯化得到的多克隆抗体对PPK重组蛋白以及奇异变形杆菌野生株HI4320、ppk 敲除株的菌体蛋白进行Western blotting分析,结果显示多抗具有高效价以及较好的特异性。
综上所述,本文利用pET28b(+)质粒,通过原核表达奇异变形杆菌PPK融合蛋白,结合使用佐剂免疫兔子后可获得效价高、特异性良好的多克隆抗体。这为奇异变形杆菌抗体的制备提供了参考资料,也为进一步深入研究PPK在奇异变形杆菌致病机制中的作用奠定了重要基础。
| [1] | 李美红, 王峰, 李春仙. 尿路感染的主要病原菌及耐药性分析[J]. 中国消毒学杂志, 2016, 33 (11): 1122-4. |
| [2] | 彭亮, 黄瑞娇, 肖柯玲, 等. 2011-2013年奇异变形杆菌临床分离株的耐药性分析[J]. 热带医学杂志, 2014, 14 (7): 853-5. |
| [3] | Brown R, Kornberg A. Inorganic polyphosphate in the origin and survival of species[J]. Proc Natl Acad Sci USA, 2004, 101 (46): 16085-7. DOI: 10.1073/pnas.0406909101. |
| [4] | Seufferheld J, Alvarez M, Farias E. Role of polyphosphates in microbial adaptation to extreme environments[J]. Appl Environ Microbiol, 2008, 74 (19): 5867-74. DOI: 10.1128/AEM.00501-08. |
| [5] | 杨正慧, 彭亮, 黄慕芳, 等. 黄慕芳多聚磷酸盐在细菌和哺乳动物细胞中的作用[J]. 微生物学通报, 2015, 42 (11): 25. |
| [6] | 石廷玉, 王怀林, 谢建平. 多聚磷酸盐及其代谢酶的研究进展[J]. 生理科学进展, 2011, 42 (3): 181-7. |
| [7] | Silby W, Nicoll S, Levy B. Requirement of polyphosphate by Pseudomonas fluorescens Pf0-1 for competitive fitness and heat tolerance in laboratory media and sterile soil[J]. Appl Environ Microbiol, 2009, 75 (12): 3872-81. DOI: 10.1128/AEM.00017-09. |
| [8] | Chandrashekhar K, Kassem I, Nislow C, et al. Transcriptome analysis of Campylobacter jejuni polyphosphate kinase (ppk1 and ppk2) mutants[J]. Virulence, 2015, 6 (8): 814-8. DOI: 10.1080/21505594.2015.1104449. |
| [9] | Sarabhai S, Harjai K, Sharma P, et al. Ellagic acid derivatives from Terminalia chebula Retz. increase the susceptibility of Pseudomonas aeruginosa to stress by inhibiting polyphosphate kinase[J]. J Appl Microbiol, 2015, 118 (4): 817-25. DOI: 10.1111/jam.2015.118.issue-4. |
| [10] | 彭亮, 潘嘉韵, 罗苏., 等. [J]. 南方医科大学学报, 2014, 34 (7): 965-8. |
| [11] | Alcántara C, Blasco A, Zúñiga M, et al. Accumulation of polyphosphate in Lactobacillus spp. and its involvement in stress resistance[J]. Appl Environ Microbiol, 2014, 80 (5): 1650-9. DOI: 10.1128/AEM.03997-13. |
| [12] | Peng L, Luo WY, Zhao T, et al. Polyphosphate kinase 1 is required for the pathogenesis process of meningitic Escherichia coli K1 (RS218)[J]. Future Microbiol, 2012, 7 (3): 411-23. DOI: 10.2217/fmb.12.3. |
| [13] | Peng L, Jiang Q, Pan Y, et al. Involvement of polyphosphate kinase in virulence and stress tolerance of uropathogenic proteus mirabilis[J]. Med Microbiol Immunol, 2016, 205 (2): 97-109. DOI: 10.1007/s00430-015-0430-1. |
| [14] | Himpsl D, Lockatell V, Hebel R, et al. Identification of virulence determinants in uropathogenic Proteus mirabilis using signaturetagged mutagenesis[J]. J Med Microbiol, 2008, 57 (Pt 9): 1068-78. |
| [15] | O'may C, Amzallag O, Bechir K, et al. Cranberry derivatives enhance biofilm formation and transiently impair swarming motility of the uropathogen proteus mirabilis HI4320[J]. Can J Microbiol, 2016, 62 (6): 464-74. DOI: 10.1139/cjm-2015-0715. |
| [16] | 佟澄碧, 郝文波, 罗树红, 等. 兔抗弓形虫Ⅰ型液泡型质子焦磷酸酶多克隆抗体的制备及鉴定[J]. 南方医科大学学报, 2015, 35 (8): 1137-42. |
| [17] | Singh M, Tiwari P, Arora G, et al. Establishing virulence associated polyphosphate kinase 2 as a drug target for mycobacterium tuberculosis[J]. Sci Rep, 2016, 6 (3): 26900. |
| [18] | Chuang M, Dutta K, Hung F, et al. Stringent response factors PPX1 and PPK2 play an important role in Mycobacterium tuberculosis metabolism, biofilm formation, and sensitivity to isoniazid in vivo[J]. Antimicrob Agents Chemother, 2016, 60 (11): 6460-70. DOI: 10.1128/AAC.01139-16. |
| [19] | Batten E, Parnell E, Wells J, et al. Biochemical and structural characterization of polyphosphate kinase 2 from the intracellular pathogen Francisella tularensis[J]. Biosci Rep, 2015, 36 (1): e00294. |
| [20] | Ortiz-Severín J, Varas M, Bravo-Toncio C, et al. Multiple antibiotic susceptibility of polyphosphate kinase mutants (ppk1 and ppk2) from Pseudomonas aeruginosa PAO1 as revealed by global phenotypic analysis[J]. Biol Res, 2015, 48 (7): 22. |
| [21] | Chuang YM, Belchis DA, Karakousis PC. The polyphosphate kinase gene ppk2 is required for Mycobacterium tuberculosis inorganic polyphosphate regulation and virulence[J]. MBio, 2013, 4 (3): e00013-39. |
| [22] | Nocek B, Kochinyan S, Proudfoot M, et al. Polyphosphatedependent synthesis of ATP and ADP by the family-2 polyphosphate kinases in bacteria[J]. Proc Natl Acad Sci USA, 2008, 105 (46): 17730-5. DOI: 10.1073/pnas.0807563105. |
| [23] | Rashid H, Rumbaugh K, Passador L, et al. Polyphosphate kinase is essential for biofilm development, quorum sensing, and virulence of Pseudomonas aeruginosa[J]. Proc Natl Acad Sci USA, 2000, 97 (17): 9636-41. DOI: 10.1073/pnas.170283397. |
| [24] | Tunpiboonsak S, Mongkolrob R, Kitudomsub K, et al. Role of a burkholderia pseudomallei polyphosphate kinase in an oxidative stress response, motilities, and biofilm formation[J]. J Microbiol, 2010, 48 (1): 63-70. DOI: 10.1007/s12275-010-9138-5. |
| [25] | Pina-Mimbela R, Madrid A, Kumar A, et al. Polyphosphate kinases modulate Campylobacter jejuni outer membrane constituents and alter its capacity to invade and survive in intestinal epithelial cells in vitro[J]. Emerg Microbes Infect, 2015, 4 (12): e77. DOI: 10.1038/emi.2015.77. |
| [26] | 徐悦玥, 蔡冉, 马颖, 等. 肺炎链球菌表面蛋白A的原核表达、纯化及其多克隆抗体的制备[J]. 中国生物制品学杂志, 2015, 28 (4): 372-6. |
 2017, Vol. 37
2017, Vol. 37

