登革热是一种登革病毒引起的主要在热带和亚热带地区流行的重要虫媒传染病。目前登革热重要疫区涵盖了非洲、美洲、东地中海、东南亚以及西太平洋地区100多个国家,每年有超过4亿人感染登革病毒并造成2万人死亡[1-4] 。登革病毒感染机制研究在受体结合、细胞通路、病毒表面蛋白等方面已取得较大进展[5-12] 。与其他黄病毒相同,登革病毒通过网格蛋白介导的内吞作用进入细胞[5-6] ,单粒子跟踪实验显示登革病毒颗粒经受体介导形成病毒受体复合物实现与细胞表面结合及迁移过程[7] 。pH依赖性的膜融合过程是登革病毒进入细胞实现基因组释放的关键步骤,通过病毒表面融合蛋白发生构象变化触发了系列形态学改变,形成病毒-细胞膜融合过程,病毒进入细胞内复制[8-10] 。然而对内吞作用及膜融合过程中系列构象改变触发的细胞形态学变化研究较少。因此,深入研究登革病毒感染宿主细胞系列形态学变化过程,有助于更全面阐述病毒感染机制。
数字全息显微术是近年来开始应用于活细胞形态学研究的新技术。采用了数字全息技术与显微技术相结合方法,特异性测量细胞数目、细胞面积、厚度及体积等细胞形态学评估参数,提供空间、时间、高分辨率的三维形态学图像,经数据处理转化为细胞增殖、迁移、活性和细胞死亡等细胞变化过程[13-16] 。数字全息显微术已逐渐应用于细胞水平机制研究中,如通过实时成像技术从原理到应用全过程研究各个阶段细胞的病理生理学改变[17] 。目前登革病毒感染机制主要通过对相关蛋白、细胞通路、细胞因子等方面的表达与调控进行深入研究,然而对侵袭过程中病毒-细胞膜融合的构象改变形式和方向缺乏有效的研究方法。因此,本研究借助HoloMonitor M4全息细胞成像及分析系统,对登革病毒感染宿主细胞的形态学变化进行实时监控,定量分析病毒感染过程中细胞面积、厚度及体积等各项三维参数的变化,有助于阐明登革病毒感染细胞的细节。同时,此方法对于其他病毒感染机制研究同样适用,为研究病毒感染过程中的细胞形态学变化提供了新方向。
1 材料和方法 1.1 材料 1.1.1 试剂RPMI 1640、胎牛血清FBS 购自美国Gibco-BRL;75 cm2细胞培养瓶、6孔细胞培养培养板购自美国Corning。
1.1.2 病毒与细胞实验中病毒采用DENV-1,夏威夷株;DENV-2,NGC株;DENV-3,H87株;DENV-4,H241株。病毒和C6/36细胞为本实验室保存。
1.2 方法 1.2.1 细胞培养C6/36细胞于液氮中保存,常规复苏后用含10%FBS的RPMI 1640培养基于28 ℃、5%CO2培养箱中进行培养、经5次传代至细胞对数生长期。
1.2.2 确定C6/36细胞全息细胞成像仪下最佳成像密度(1)用RPMI 1640完全培养基(含有10%FBS)将C6/36细胞按105、2×105、4×105、8×105、106个分别接种于6孔细胞培养板,置于28 ℃、5% CO2的细胞培养箱过夜;(2)置于全息细胞成像仪下进行三维全息图记录,分析数据选取最佳成像密度;(3)转移此6孔细胞培养板置于37 ℃、5% CO2培养箱中培养24 h,记录其三维全息图及各项形态指数,分析培养环境改变对细胞状态的影响。
1.2.3 登革病毒感染C6/36细胞形态学变化检测(1)用RPMI-1640完全培养基将C6/36细胞以最佳成像密度接种至6孔细胞培养板,置于28 ℃、5% CO2的细胞培养箱过夜;(2)吸弃完全培养基,无血清1640清洗细胞两次后,将1~4型登革病毒以MOI=1分别加入6孔板,每种型别登革病毒设置3个复孔保证实验结果可靠性,另设添加无血清1640培养基为空白对照组,置于37 ℃、5% CO2孵育;(3)病毒孵育2 h期间,分别监控0、0.5、1、1.5、2 h共5个时间点病毒进入细胞内过程的形态学变化;(4)孵育2 h后吸弃病毒原液,添加含2%FBS的1640维持培养基,置于37 ℃、5% CO2培养;(5)培养期间,分别监控4、8、12、16、24 h共5个时间点病毒于细胞内复制并释放的形态学变化过程;(6)重复本实验2次以验证实验重复性,最后将数据统一进行相关分析。
1.3 仪器M4 激光全息细胞成像及分析系统(HoloMonitorM4),瑞典Phiab;CO2细胞培养箱,美国Thermo。
1.4 数据分析HoloMonitor M4对病毒感染过程进行全息成像及形态学参数分析,借助GraphPadPrism5.0 软件对所得数据进行统计学分析。实验中,多个实验组之间的数据分析采用SPSS13.0的单因素方差分析,多个实验组之间的两两比较采用SNK-Q检验的方法。
2 结果 2.1 C6/36细胞全息细胞成像仪下的最佳成像密度在接种细胞量方面设立105、2×105、4×105、8×105、106个/孔等5个不同条件,对各实验组过夜培养后进行细胞三维形态学观察及细胞参数分析,确定开展登革病毒感染C6/36细胞三维形态学实验最佳密度。如细胞全息图所示,实验组3即细胞接种量为4×105时C6/36细胞贴壁后单个细胞生存空间充足,呈良好的圆形三维形态,细胞间形态学表现一致,提示细胞三维成像具有较高统一性。相同的是,细胞厚度-面积散点图显示不同于其他接种量的带状分布,实验组3大部分细胞呈片状分布,离群细胞较少。以实验组3散点图作为标准区域进行对比,其他实验组细胞分布存在偏移,带状分布的尾端散在离群点较多(图 1A~E)。同时,在统计分析中无论是细胞面积、厚度还是体积,实验组3数据标准差均最小,表明该接种量下离散程度最小,各项指标具有更强的均一性,能准确判断后续实验干预细胞后的形态学变化方向(图 1F~G)。因此,后续试验均采取4×105接种量作为形态学研究最佳成像密度。
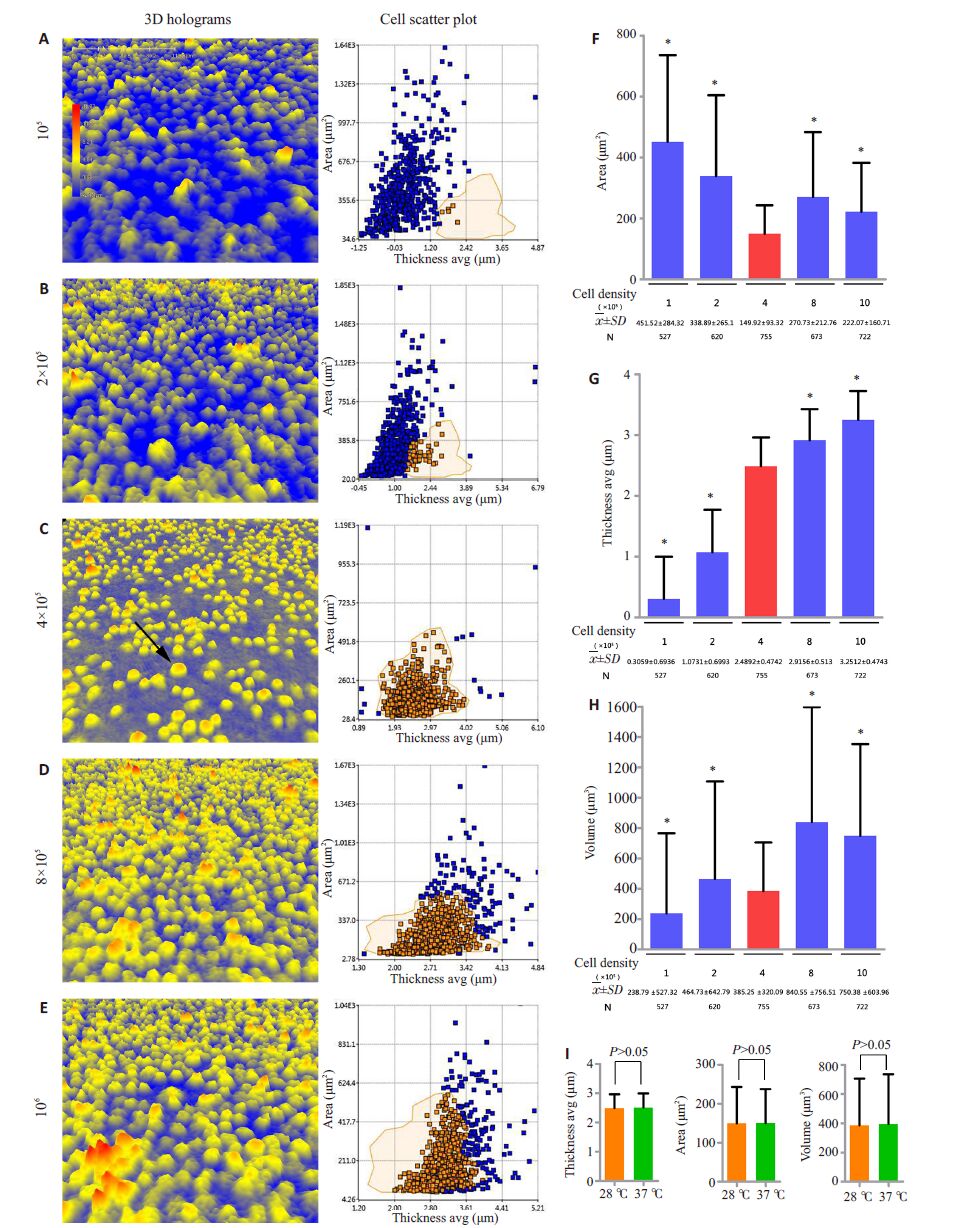
|
图 1 全息细胞成像仪下C6/36细胞最佳成像密度测定和培养条件改变对细胞状态的影响 Figure 1 Determination of the optimal cell density for HoloMonitor M4 imaging and cell status in different culture conditions. A-E: 3D holograms of cells in different inoculation conditions after adherence (left panel) and the cell scatter plot (right panel). The arrow indicates an individual C6/36 cell in good growth condition. Circles in the cell scatter plot shows the comparison result with the standard region where 4×105 cells were inoculated. Blue dots indicate cells out of the region while brown dots the cells within the region. F-H: Dispersion degree statistics for single cell area, thickness, and volume of cells in different inoculation conditions after adherence. Error bars show standard deviations (SD), and the red one is the smallest SD. *P<0.05 (two-sample t test, blue vs red; I: Comparison of single cell area, thickness, and volume of cells cultured at 28 ℃ and 37 ℃ condition. Error bars show standard deviations (SD). |
将常规28 ℃、5% CO2条件下培养的C6/36细胞转移至37 ℃、5% CO2细胞培养箱中培养24 h后,分析最佳成像密度(4×105/孔)下各形态学指标变化,培养前后细胞厚度、面积和体积的均数和标准差均不相同,但统计学分析显示无统计学意义(P>0.05),提示最佳成像密度下培养环境的改变在实验观察时间内对细胞形态无影响(图 1Ⅰ)。
2.2 登革病毒感染C6/36细胞的三维形态学变化为了从三维结构角度全面阐述感染过程中细胞的构象改变,本研究利用全息显微术在病毒进入细胞的孵育时期和病毒于细胞内释放至胞外的培养时期分别设计5个时间点进行实时监控,记录全息图。结果发现4个血清型登革病毒在孵育2 h和培养24 h期间均在特定时间点发生细胞构象改变,且不同血清型间存在差异。孵育2 h期间,经4个血清型登革病毒处理实验组表现一致,部分细胞失去圆形形状,出现不规则钉状突起,并伴随细胞面积增大、厚度减小(图 2A~D)。但其发生时间及细胞总体迁移率存在差异,单个细胞绘制散点图显示DENV-4于0.5 h最早出现,迁移率为24.67%,随后1 h出现的DENV-1和DENV-2呈现最小和最大的迁移率,分别为10.84%和55.88%。而在1.5 h最后出现的DENV-3迁移程度接近DENV-4(图 2E~H)。有趣的是,培养24 h 期间不同实验组细胞构象变化差异较大。DENV-1 和DENV-2 均在16 h 细胞面积增大、厚度减小,且迁移率达到74.49%和90.77%,提示细胞总体迁移程度较强。而DENV-3和DENV-4表现为细胞面积增大、厚度增大,细胞总体迁移率均较低,分别为10.35%和13.76%,发生时间也出现较早,分别为培养12 h 和8 h(图 2A~H)。
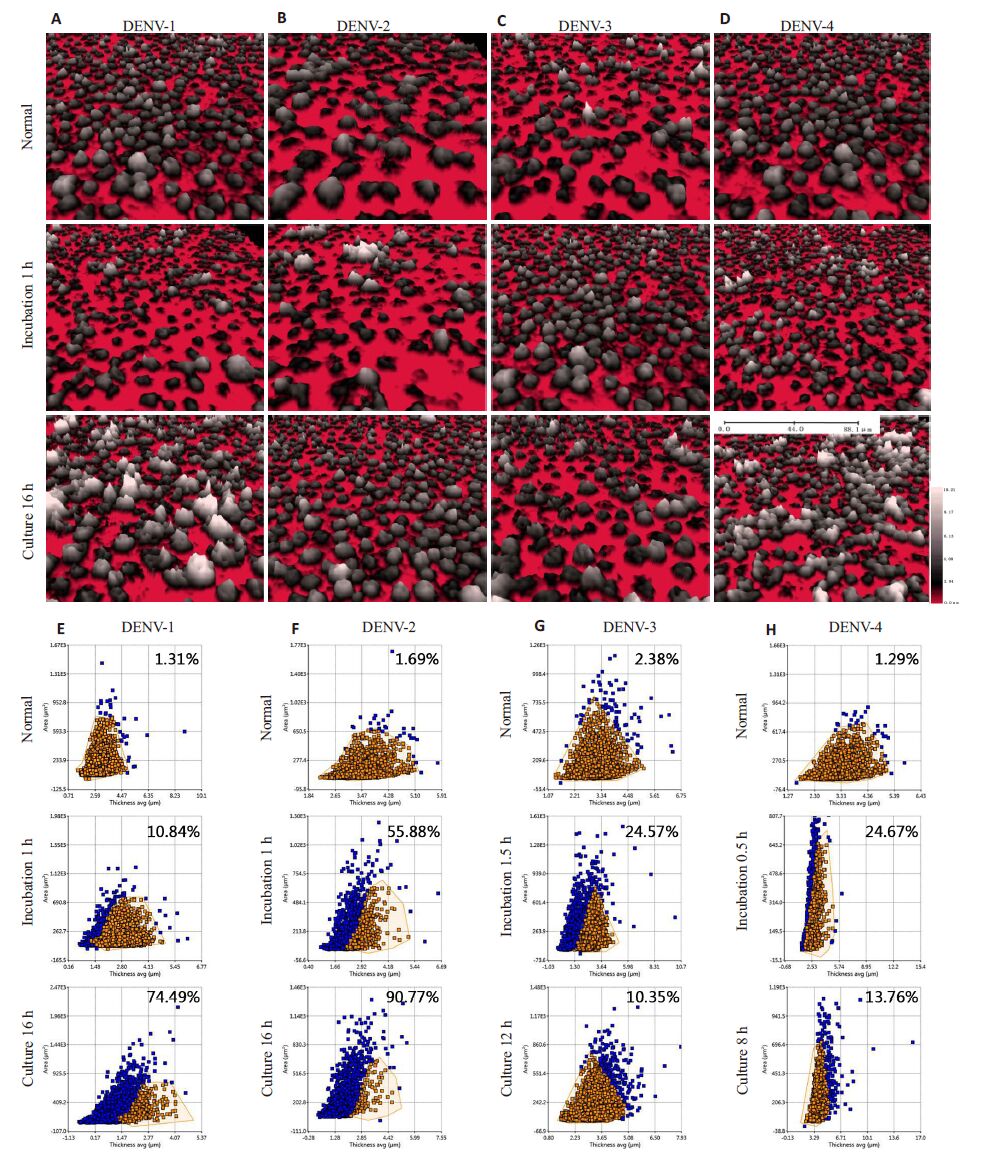
|
图 2 不同时期全息细胞成像仪下C6/36三维结构变化检测 Figure 2 Detection of 3-dimensional structural changes of C6/36 cells captured by HoloMonitor M4 at different time points following virus infection. A-D: 3D holograms of cells infected by 4 dengue virus with different serotypes. From top to down are normal cells before infection, abnormal cells during incubation and culture; B: Cell scatter plots corresponding to the holograms. Blue circles indicate cells out of the region and brown ones cells within the region. The percentage of cells out of the region in the total cell number is indicated in each scatter diagram. |
为了全面阐述不同血清型登革病毒在感染细胞过程中实时膜构象改变,本研究利用M4激光全息细胞成像及分析系统实时监控的数据对各时期细胞厚度、细胞面积、细胞体积进行统计学分析。结果发现细胞厚度和细胞面积的变化方向与三维全息图下细胞观察结果一致,但不同血清型间存在特异性(图 3)。孵育期间DENV-1、3、4在细胞厚度减小、面积增大后均表现出厚度增大、面积减小的恢复过程。但DENV-2在0.5 h后发生两次细胞厚度减小并伴随持续的面积增大膜构象改变。与DENV-1和DENV-4培养期间存在构象恢复不同,DENV-2培养16 h后呈现细胞厚度持续减小、面积持续增大,而DENV-3培养8 h后细胞厚度持续增大,但细胞面积仅在16 h有显著性差异(图 3A~D)。另外,各实验组无论是孵育还是培养期间细胞均表现体积增大过程。DENV-1孵育期间体积增大持续时间较长,且培养期间发生两次体积增大构象改变。DENV-2在不同时期有且仅有一次体积显著性增大过程。DENV-3在孵育期间体积增大后伴随构象恢复,培养期间呈现细胞体积持续性增大。而DENV-4在感染过程中无构象恢复且表现为体积持续性增大趋势(图 3E、F)
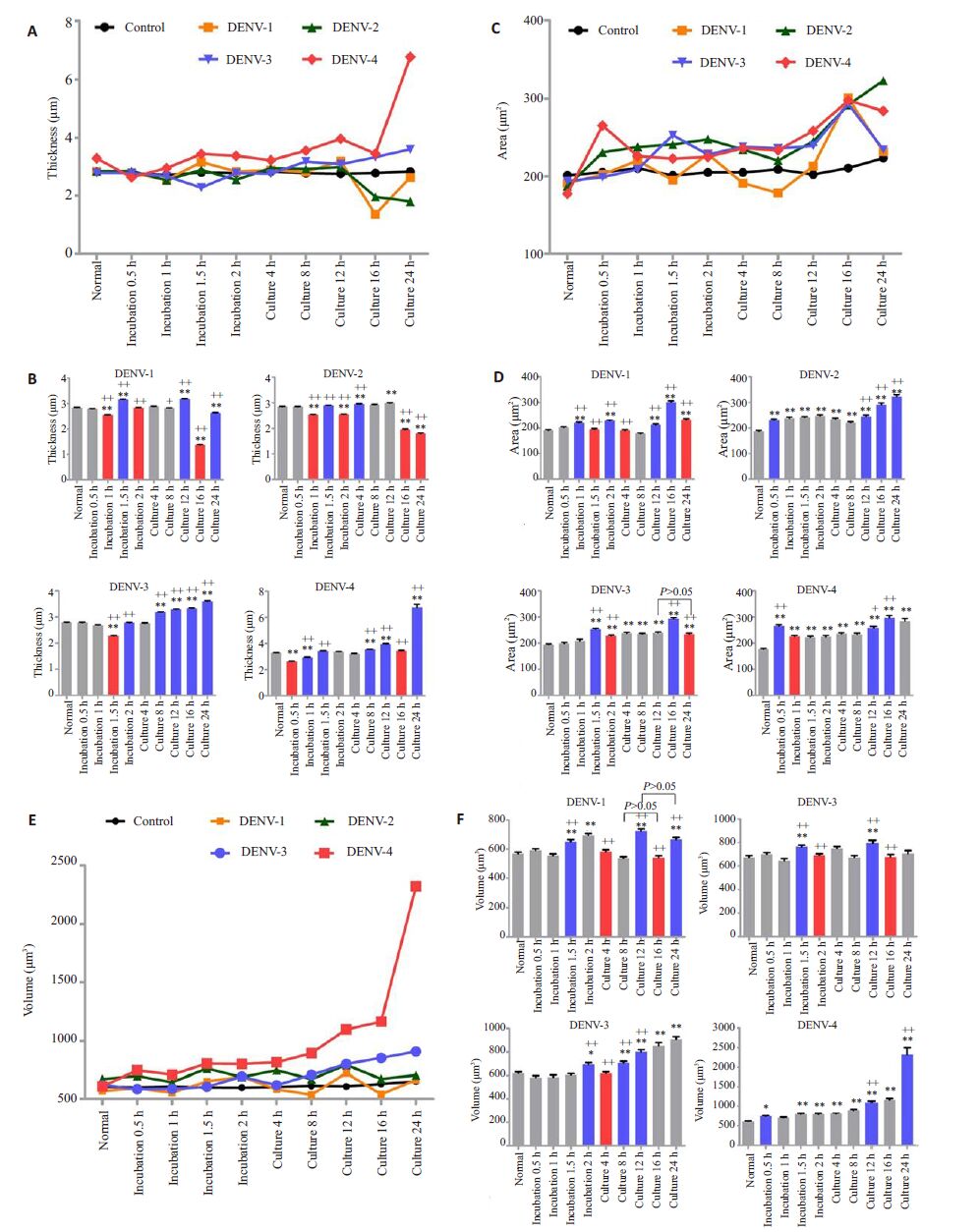
|
图 3 登革病毒感染细胞过程形态学参数变化趋势 Figure 3 Tendency of the changes in the cell morphological parameters during dengue virus infection. A-F: Dynamic analysis of changes in cell thickness, area, and volume during infection. The line chart of each parameter shows dynamics during infection (A, C and D). Statistical analysis of the matching histogram illustrates the direction of conformations changes. Grey, red and blue histogram indicate no changes, decreases and increases compared with the previous period, respectively. Error bars show standard error of mean (SEM). *P<0.05, **P<0.01 vs normal cell parameters; +P<0.05, ++P<0.01 vs the previous period. |
登革热是全球经蚊虫传播流行范围最广的病毒性疾病,目前几乎一半的世界人口生活在高登革流行风险地区[18] 。近年来,登革病毒(DENV)与靶细胞如巨噬细胞、树突细胞、干细胞和血管内皮细胞的相互作用研究已取得显著进展。细胞通过内吞作用和胞吐作用实现病毒侵入与释放,此过程经受体介导、细胞通路调节,并伴随细胞膜构象改变[19] 。这提示登革病毒感染细胞过程中病毒的侵入与释放与细胞形态学变化紧密相关,为应用数字全息显微新技术实时监测细胞三维结构动态变化过程提供了实验依据,有助于揭示登革病毒感染机制及不同血清型间特异性细胞感染差异提供可能。
全息显微技术利用干涉波朝向感应,在0.8 mWHeNe射线曝光下,经HoloMonitor M4数字全息显微镜记录细胞三维结构即为全息图。其成像效应与接种细胞密度息息相关,细胞密度过高时会导致细胞扩展受限,细胞密度过低时往往会集聚形成细胞群,在非实验干预情况下引起细胞形态的改变,不利于观察且影响获取数据的准确性[15-17] 。因此,细胞最佳成像密度的确定对于建立基于全息显微术研究活细胞三维形态学至关重要。本实验针对6孔细胞培养板,最终确立了C6/36细胞最佳接种量为4×105/孔,其具有更强、更可靠的成像效应。
由于E蛋白作为嵌入式糖蛋白暴露在登革病毒膜表面,其包含与宿主细胞受体相互作用的结构与功能元件,被称为病毒吸附的蛋白质[20] 。研究表明,登革病毒E蛋白包含3个三维结构域,且结构域Ⅲ是病毒特异性吸附相关受体进入宿主细胞的关键靶点[21-22] 。本研究应用全息显微新技术监测病毒进入宿主细胞过程的三维形态学变化,发现4 个血清型登革病毒均表现细胞厚度减小、面积增大过程,提示不同血清型的登革病毒可能存在相同的膜构象改变机制。Cao-Lormeau V M在埃及伊蚊唾液腺提取物中发现4个大小分别为37、54、58、77 000 的蛋白可以同时介导四个血清型病毒吸附过程[31] 。值得注意的是DENV-4吸附时间(0.5 h)明显早于其他3个血清型(1~1.5 h),DENV-2在0.5 h后发生两次细胞厚度减小并伴随持续的面积增大膜构象改变,这些现象可能与不同血清型特异性受体蛋白差异相关。Salas-Benito 等[23] 在C6/36 细胞表面发现大小分别为40 000、45 000 的DENV-4 特异性受体蛋白,随后Reyes-del 等[24-25] 证实其与登革E蛋白相互作用机制相关。同样,C6/36细胞表面两个80 000、67 000大小的蛋白、相关微管蛋白、热休克蛋白、抑制蛋白等与DENV-2感染机制特异性相关的受体蛋白相继被发现[26-30] 。另外,本实验细胞膜构象恢复现象的发现表明登革病毒吸附和释放的过程体现为间歇性而非持续性进出细胞的过程。
病毒培养24 h期间,DENV-4在8 h时发生膜构象改变,随后DENV-3在12 h,DENV-1和DENV-2在16 h出现。这一结果与Thepparit等[32] 通过4个血清型登革病毒感染人肝癌细胞HepG2时,细胞上清液中首先在12 h检测到DENV-4病毒出现,随后DENV-2、3和1在17~18 h产生的发现一致。随后研究中也获得验证[33-34] 。此外,本研究发现培养期间不同血清型膜构象改变存在显著差异,三维全息图显示DENV-1和DENV-2表现细胞厚度减小,而DENV-3 和DENV-4 则表现为厚度增大,且参数统计分析显示差异有统计学意义(P<0.01)。然而,目前宿主细胞中病毒释放机制尚未阐明,此发现提示DENV-1和DENV-2经胞吐方式释放成熟病毒的调控过程可能与DENV-3和DENV-4截然不同,且与细胞厚度改变相关。
综上,本研究建立了一种基于数字全息显微技术的活细胞形态学检测新方法,实验证实通过三维全息图、形态学参数统计等方式可以全面阐述细胞形态学变化的方向与强度。此方法应用于登革病毒感染C6/36细胞的膜构象改变的探索,有助于全面阐述感染过程中细胞系列膜构象变化趋势,为深入研究不同血清型登革病毒感染机制奠定基础。
| [1] | World Health Organization. Global strategy for dengue prevention and control, 2012-2020 [R] . http://www.who.int/denguecontrol/9789241504034/en/:2012. |
| [2] | Hidari KJ, Suzuki T. Dengue virus receptor[J]. Tropical Med Health, 2011, 39 (39): 37-43. |
| [3] | Chan CY, Ooi EE. Dengue: an update on treatment options[J]. Future Microbiol, 2015, 10 (12): 2017-31. DOI: 10.2217/fmb.15.105. |
| [4] | World Health Organization. WHO report on global surveillance of epidemic-prone infectious diseases-dengue and dengue haemorrhagic fever [C] . http://www.who.int/csr/resources/publications/dengue/CSR_ISR_2000_1/en/. |
| [5] | Maximova OA, Bernbaum JG, Pletnev AG. West Nile virus spreads transsynaptically within the pathways of motor control: anatomical and ultrastructural mapping of neuronal virus infection in the Primate central nervous system[J]. PLoS Negl Trop Dis, 2016, 10 (9): e0004980. DOI: 10.1371/journal.pntd.0004980. |
| [6] | Rodenhuis-Zybert IA, Wilschut J, Smit JM. Dengue virus life cycle: viral and host factors modulating infectivity[J]. Cell Mol Life Sci, 2010, 67 (16): 2773-86. DOI: 10.1007/s00018-010-0357-z. |
| [7] | Schaar HD, michael JR, Chen C, et al. Dissecting the cell entry pathway of dengue virus by Single-Particle tracking in living cells[J]. PLoS Pathog, 2008, 4 (12): e1000244. DOI: 10.1371/journal.ppat.1000244. |
| [8] | Midgey CM, Flanagan A, Hai BT, et al. Structural analysis of a dengue cross-reactive antibody complexed with envelope domain III reveals the molecular basis of cross-reactivity[J]. J Immun, 2012, 188 (10): 4971-9. DOI: 10.4049/jimmunol.1200227. |
| [9] | Costa RL, Voloch CM, Schrago CG. Comparative evolutionary epidemiology of dengue virus serotypes[J]. Infect Gene Evo, 2012, 12 (2): 309-14. DOI: 10.1016/j.meegid.2011.12.011. |
| [10] | Zhao DM, Huang XM, Liu YZ, et al. Domain I and II from newly emerging goose tembusu virus envelope protein functions as a dominant-negative inhibitor of virus infectivity[J]. Res Vet Sci, 2015, 98 (8): 121-6. |
| [11] | Moraes AH, Simonelli L, Pedotti M, et al. NMR investigation of domain III of Dengue virus E protein: antibody binding modulates conformational exchange in the antigen[J]. J Virol, 2015, 25 (7): 314-5. |
| [12] | Desai TM, Marin M, Chin CR, et al. IFITM3 restricts influenza a virus entry by blocking the formation of fusion pores following Virus-Endosome hemifusion[J]. PLoS Pathog, 2014, 10 (4): e1004048-50. DOI: 10.1371/journal.ppat.1004048. |
| [13] | Kemper B, von Bally G. Digital holographic microscopy for live cell applications and technical inspection[J]. Appl Opt, 2008, 47 (4): A52-61. DOI: 10.1364/AO.47.000A52. |
| [14] | Heimbeck MS, Kim MK, Gregory DA, et al. Terahertz digital holography using angular spectrum and dual wavelength Reconstruction methods[J]. Opt Express, 2011, 19 (10): 9192-200. DOI: 10.1364/OE.19.009192. |
| [15] | Gao P, Yao BL, Min JW, et al. Autofocusing of digital holographic microscopy based on off-axis illuminations[J]. Opt Lett, 2012, 37 (17): 3630-2. DOI: 10.1364/OL.37.003630. |
| [16] | Kim Y, Shim H, Kim K, et al. Profiling individual human red blood cells using common-path diffraction optical tomography[J]. Sci Rep, 2014, 34 (7): 6659. |
| [17] | Lee KR, Kim K, Jung J, et al. Quantitative phase imaging techniques for the study of cell pathophysiology: from principles to applications[J]. Sensors, 2013, 13 (4): 4170-91. DOI: 10.3390/s130404170. |
| [18] | Costin JM, Zaitseva E, Kahle KM, et al. Mechanistic study of broadly neutralizing human monoclonal antibodies against dengue virus that target the fusion loop[J]. J Virol, 2013, 87 (1): 52-66. DOI: 10.1128/JVI.02273-12. |
| [19] | Miller JL, Dewet BJ, Martinez-Pomares L, et al. The mannose receptor mediates dengue virus infection of macrophages[J]. PLoS Pathog, 2008, 4 (2): e17. DOI: 10.1371/journal.ppat.0040017. |
| [20] | Valdes I, Bernardo L, Gil L, et al. A novel fusion protein domain III-capsid from dengue-2, in a highly aggregated form, induces a functional immune response and protection in mice[J]. Virology, 2009, 394 (2): 249-58. DOI: 10.1016/j.virol.2009.08.029. |
| [21] | Modis Y, Ogata S, Clements D, et al. A ligand-binding pocket in the dengue virus envelope glycoprotein[J]. Proc Natl Acad Sci USA, 2003, 100 (12): 6986-91. DOI: 10.1073/pnas.0832193100. |
| [22] | Smit JM, Moesker B, Rodenhuis-Zybert IA. Flavivirus cell entry and membrane fusion[J]. Viruses, 2011, 3 (2): 160-71. |
| [23] | Salas-Benito S, del Angel M. Identification of two surface proteins from C6/36 cells that bind dengue type 4 virus[J]. J Virol, 1997, 71 (10): 7246-52. |
| [24] | Reyes-dal Valle J, del Angel RM. Isolation of putative dengue virus receptor molecules by affinity chromatography using a recombinant E protein ligand[J]. J Virol Methods, 2004, 116 (1): 95-102. DOI: 10.1016/j.jviromet.2003.10.014. |
| [25] | Mendoza MY, Salas-Benito JS, Lanz-Mendoza HA, et al. A putative receptor for dengue virus in mosquito tissues: Localization of a 45- kDa glycoprotein[J]. American J Trop Med Hyg, 2002, 67 (1): 76-84. |
| [26] | Chee HY, Abubakar S. Identification of a 48 kDa tubulin or tubulinlike C6/36 mosquito cells protein that binds dengue virus 2 using mass spectrometry[J]. Biochem Biophys Res Commun, 2004, 320 (1): 11-7. DOI: 10.1016/j.bbrc.2004.05.124. |
| [27] | Guether J, Martinez-Munoz JP, Perez-Ishiwara DG, et al. Evidence of vertical transmission of dengue virus in two endemic localities in the state of Oaxaca, Mexico[J]. Intervirology, 2007, 50 (5): 347-52. DOI: 10.1159/000107272. |
| [28] | Kuadkitkan A, Wikan N, Fongsaran C, et al. Identification and characterization of prohibitin as a receptor protein mediating DENV-2 entry into insect cells[J]. Virology, 2010, 406 (1): 149-61. DOI: 10.1016/j.virol.2010.07.015. |
| [29] | Yang J, Zou L, Hu Z, et al. Identification and characterization of a 43 kDa actin protein involved in the DENV-2 binding and infection of ECV304 cells[C] . 全国微生物遗传学学术研讨会, 2012: 310-8. |
| [30] | Piccini E, Castilla Viviana, Damonte B. Dengue-3 virus entry into Vero cells: role of Clathrin-mediated endocytosis in the outcome of infection[J]. PLoS One, 2015, 10 (10): e0140824. DOI: 10.1371/journal.pone.0140824. |
| [31] | Cao-Lormeau VM. Dengue viruses binding proteins from Aedes aegypti and Aedes polynesiensis salivary glands[J]. Virol J, 2009, 6 (1): 66. DOI: 10.1186/1743-422X-6-66. |
| [32] | Thepparit C, Phoolcharoen W, Suksanpaisan L, et al. Internalization and propagation of the dengue virus in human hepatoma (HepG2) cells[J]. Intervirology, 2004, 47 (2): 78-86. DOI: 10.1159/000077830. |
| [33] | Thepparit C, Khakpoor A, Khongwichit S, et al. Dengue 2 infection of HepG2 liver cells results in endoplasmic reticulum stress and induction of multiple pathways of cell death[J]. BMC Res Notes, 2013, 6 (1): 372. DOI: 10.1186/1756-0500-6-372. |
| [34] | Cruz-Oliveira C, Freire JM, Conceicao TM, et al. Receptors and routes of dengue virus entry into the host cells[J]. FEMS Microbiol Rev, 2015, 39 (2): 155-70. DOI: 10.1093/femsre/fuu004. |
 2017, Vol. 37
2017, Vol. 37

