2.南京医科大学附属妇产医院介入科,江苏 南京 210004
Department of Interventional Radiology, Obstetrics and Gynecology Hospital Affiliated to Nanjing Medical University, Nanjing 210004, China
外周动脉疾病(PAD)常表现为下和/或上肢动脉的狭窄、血流量减少[1] ,四肢的急性动脉缺血会导致危及生命的并发症,如肢体的不可逆损伤或缺失[2] ,严重威胁患者的健康和生命,而股腘动脉硬化闭塞为常见的PAD。PAD治疗的重点是针对可导致生活质量降低的间歇性跛行和严重肢体缺血的管理[3] 。介入腔内手术被推荐用于存在严重肢体缺血的PAD患者的治疗[4] 。目前药物涂层球囊(DCB)相关机制研究日趋成熟,且已被广泛应用于冠状动脉的介入治疗中[5-7] 。但对外周血管DCB的研究远远没有冠脉DCB充分,国外有DCB用于外周血管狭窄治疗的动物模型的文献报道[8] ,欧洲有部分产品用于临床[9-10] ,美国FDA已批准DCB应用于下肢缺血性疾病,近年来DCB体现了其在介入治疗阻塞性病变中的优越性,即有效改善血运并降低再狭窄发生的同时克服了药物涂层支架的某些缺陷[11] 。但应用时间不长、积累病例数不多,临床疗效有待进一步评估。在国内外周血管DCB尚处于临床试验阶段,缺乏其用于我国人群治疗的疗效及并发症等临床数据,因而目前对外周血管DCB的研究是十分必要的。
1 对象和方法 1.1 研究对象收集2015年9月~2016年12月收治于南京医科大学附属南京医院介入血管科符合入组标准且完成随访的46例患者的临床资料。入组患者由计算机随机分入药物涂层球囊(DCB)组(n=23)和普通球囊(CB)组(n=23)。本研究入组患者进行的临床评估包括:踝臂指数、超声、CT血管造影(CTA),以评价病灶的形态解剖特征。入组标准:同侧单个或多个股浅动脉(SFA)和/或腘动脉(PA)病变(3~15 cm的狭窄或闭塞)、Rutherford分级2~5级、伴有或不伴有其他伴随疾病。排除标准:支架内再狭窄,动脉瘤,急性血栓形成,妊娠,预期寿命不满1年,以及膝下(BTK)动脉闭塞。
1.2 研究设计本研究为一项前瞻性、独立性研究,其设计主要用来比较DCB与普通球囊血管成形术,对于股腘动脉闭塞性疾病治疗后6个月的晚期管腔丢失的差异。由于管腔晚期丢失这一指标足够灵敏,故被选择用来监测2组间发生再狭窄的差异性[12] 。本试验设计已获当地伦理委员会批准,且所有患者均被告知治疗相关风险并签署知情同意书。该试验针对患者单盲。将符合入组条件的46例患者,以电脑随机化的方式按1∶1的比例分别纳入DCB组或CB组,每组各23例。比较两组间晚期管腔丢失的差异性(P<0.05)。
所有手术操作均在同一台数字血管造影设备(Siemens, Artis zee ceiling)上进行。根据试验设计,以DCB和CB扩张不同程度的SFA和/或PA原发狭窄(扩张后由于残余狭窄>50%而行支架植入术的患者不纳入本研究),见图 1。在球囊扩张血管成形术前,入组患者经阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)口服抗血小板治疗3 d,术前未经抗血小板治疗的患者,则给予300 mg负荷剂量的氯吡格雷。根据解剖特点和病变部位,选择常规股动脉逆行或顺行的穿刺方式。DCB球囊经6F Terumo动脉鞘送入目标血管,以最大限度的减少DCB表面药物在输送过程中的损失,虽然DCB球囊在输送过程中是否存在药物损失目前仍然存在争议[13-15] 。动脉鞘置入后立即经鞘推注5000 U 肝素。DCB组患者,在对病变段血管进行DCB扩张前,需经普通球囊预扩,预扩球囊直径较治疗用球囊小1 mm[16] 。DCB组所使用药物球囊均为FREEWAY紫杉醇药物洗脱球囊。DCB直径与病变血管直径之比为1∶1[17] 。本研究所选病变范围为股腘动脉,不包括BTK 动脉。DCB在病变段血管内扩张时间为60 s。长段病变中需使用两枚DCB,两者间重叠段不小于1 cm[18] 。CB组球囊使用要求同DCB组。球囊扩张后残余狭窄<50%则判定为技术成功。治疗后,所有入组患者均长期给予阿司匹林(100 mg/d)以及4周的氯吡格雷(75 mg/d)的药物辅助治疗。而狭窄段支架植入患者需延长氯吡格雷治疗至术后3月[19] 。
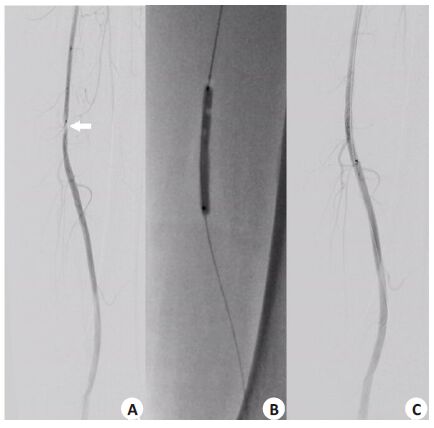
|
图 1 球囊扩张血管成形术 Figure 1 Balloon dilation angioplasty. A: Short segment stenosis of the inferior segment of the superficial femoral artery before balloon dilation; B: Filling the balloon in full contact with the lesion for 60 s; C: The stenosis segment was recovered after balloon dilatation. |
收集两组患者治疗后6个月,管腔晚期丢失、踝臂指数、Rutherford分级、再狭窄发生率、血栓形成率以及截肢率的数据。其中管腔晚期丢失为本研究主要观测指标。在本研究中定义为,治疗后即刻病变血管段最小直径与6月后随访截止时该段血管最小直径的差值,测量精度为1 mm。如随访过程中发现再狭窄已≥50%或发生急性下肢缺血症状,且经超声、血管造影等证实的48 h 内动脉的急性血栓闭塞,则结束随访,同时积极采取相应治疗,如再次球囊扩张、支架成形术或外科手术等。
本研究过程中的不良事件主要有靶血管血运重建、截肢、血栓形成及钙化等。
1.3 统计学方法用PASW Statistics 18软件统计分析数据,计量资料用均数±标准差表示,组间均数比较采用方差分析,多重比较采用LSD-t检验,计数资料用率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果两组患者一般情况及危险因素比较见表 1,差别无统计学意义(P>0.05)。两组患者病变血管特征情况(病变部位、累计病变长度和钙化程度)比较见表 2,差别亦无统计学差异(P>0.05)。本研究钙化程度由CTA及腔内超声轴位图像评估后得出,分为1 级(钙化范围≤45°)、2级(钙化范围≤90°)、3级(钙化范围≤135°)和4级(>135°)。
| 表 1 入组患者一般情况及危险因素 Table 1 General conditions and risk factors of the enrolled patients |
| 表 2 病变血管特征 Table 2 Characteristics of vascular lesions in the two groups [n(%)] |
46例患者中采取顺行穿刺者35例,逆行穿刺者11例,全部46例患者取得技术成功。术后平均残余狭窄(17.4±4.9)%(12.5%~22.3%)。至随访结束时,所有46例患者均存活。管腔晚期丢失在DCB组显著低于CB组(0.46±0.7 vs 1.60±1.5 mm,P<0.01)。在DCB组与CB组中不同病变部位的亚组分析显示:SFA(0.42±0.5 vs1.51±1.2 mm,P<0.05)、PA(0.53±0.8 vs 1.67±1.4 mm,P<0.05)。
经临床及影像学证实的6 个月后再狭窄发生率,DCB 组为13.0%(3/23),CB 组为30.4%(7/23),P<0.05。血栓形成发生率,DCB组为8.7%(2/23),CB组为21.7%(5/23),两组比较,P<0.05。截肢率,DCB组为8.7%(2/23),Rutherford 6级大截肢及Rutherford 5级小截肢患者各1 例;CB组为13.0%(3/23),3 例截肢患者中,1例为Rutherford 6级大截肢,2例为Rutherford 5级小截肢,两组相比,P>0.05。
DCB 组与CB 组踝臂指数改善情况对比如下。DCB组治疗前/后踝臂指数为0.51±0.02/0.86±0.04,CB组治疗前/后踝臂指数为0.55±0.05/0.71±0.09,两组间差别有统计学意义(P<0.05)。治疗后Rutherford 分级评估较治疗前均有改善,DCB组更为显著(P<0.05)。
本研究入组患者,疗效与动脉壁钙化程度相关。动脉壁钙化程度在CTA轴位图像上分为1~4 级,4 级为钙负荷最高。1级治疗后6个月管腔晚期丢失为0.48±0.2 mm,2级为0.65±0.3 mm,3级为0.73±0.2 mm,4级为0.77±0.2 mm。再狭窄发生率和截肢率在3级(3例)和4级(4例)患者中更为常见。前文提及的2例发生血栓栓塞事件的大截肢患者,均存在严重的钙化(4级)。两组患者治疗后6个月随访指标见表 3。
| 表 3 治疗后6个月随访指标 Table 3 Follow-up data of the patients at 6 months after the treatment |
前期动物实验已证实DCB在SFA及BTK动脉病变的治疗中有确切疗效。在此基础上进行了DCB治疗SFA的早期临床研究[16, 20-22] 。本研究的目的是探讨DCB是否可降低单纯间歇性跛行及严重下肢缺血患者治疗后病变血管再狭窄的发生。与以往研究有所不同,本研究主要关注采取DCB在内的,针对SFA和/或PA病变的综合治疗后,下肢微循环的改善情况。
本研究结果显示,无论在SFA、PA还是混合病变的治疗中,DCB组管腔晚期丢失均低于CB组。此外,在治疗股腘动脉病变中DCB组治疗后6个月造影复查结局及血流动力学指标改善情况均优于CB组。
已有一些临床试验,对比了紫杉醇DCB与普通球囊,在降低外周血管病变治疗后再狭窄的疗效差异。154 例SFA或PA狭窄或闭塞患者,其中接受紫杉醇DCB治疗、普通球囊治疗及造影剂混合紫杉醇治疗的患者各1/3[20] 。治疗后6个月的随访结果显示,紫杉醇BCB组的管腔晚期丢失明显低于其余2组。治疗后6、12、24个月靶病变血运重建率紫杉醇DCB组也明显优于其余2组。
87例患者被随机分入DCB组和CB组[16] 。6个月随访结果表明,DCB组管腔晚期丢失明显低于CB组。靶病变血运重建数BCB组明显低于CB组,且在介入治疗后18~24 个月均保持差异。另外,该试验还提示了DCB组患者Rutherford分级的改善,但ABI指标未观察到明显改变。
一项对比MoxyDCB球囊(涂层药物为紫杉醇)与普通球囊治疗101例髂股动脉狭窄患者的随机对照研究[23] 。该研究观测到MoxyDCB组6个月管腔晚期丢失指标从1.09 mm降到0.46 mm。105例间歇性跛行及静息痛患者治疗1年后通畅率为83.7%,仅12.3%的患者需植入支架[22] 。该项研究结果显示,12个月随访期内,患者踝臂指数、行走能力及生活质量均显著提高。本研究所报道的DCB组患者治疗后6个月管腔晚期丢失为0.46 mm,与文献报道的总体上比较接近[17, 20, 23] 。此外,几乎所有文献都证实了紫杉醇可减轻病变血管再狭窄程度[24] 。
初步研究表明DCB 治疗BTK 动脉病变同样有效[21] 。该研究回顾性分析了30例长段BTK动脉狭窄或闭塞患者(其中DCB组13例,CB组17例)治疗后3个月再狭窄发生的差异性,DCB组为27%,CB组为69%,两者有统计学差异(P<0.05),且前者管腔晚期丢失也显著低于后者(P<0.01)。在6个月的随访期内,该研究观察到CB组截肢率为11.76%(2/17),而DCB组截肢率仅为7.69%(1/13)。
本研究结果显示,DCB用于治疗股腘动脉硬化闭塞患者,与常规球囊相比可有效降低股腘动脉6个月管腔晚期丢失、再狭窄发生率和血栓形成率,并可获得更优的踝臂指数、Rutherford分级改善。同时,本研究对钙化病变的亚组分析表明,钙化3级和4级的靶血管管腔晚期丢失普遍较高,这也验证了重度钙化可影响药物吸收这一假说。鉴于此种情况,DCB术前应评估病变钙化情况,并通过进一步实验研究寻求适当解决方案。不足之处:本研究涉及样本量较小,虽足以检测到管腔晚期丢失这一主要观测指标的差异性,但数据对其他相关临床指标的支撑不足。在后续研究中我们需进一步扩大样本数量,并延长随访时间,以对研究的结论做出更有力的支持。
综上所述,DCB治疗下肢动脉疾病的优势主要是减轻术后再狭窄程度并降低支架植入率。近关节部位的支架由于机械应力作用易发生断裂,而BTK动脉支架可明显影响远端血流速度。显然不植入支架的DCB治疗对于提高术后靶血管通畅率有潜在优势,故非支架治疗策略对预期寿命较长的间歇性跛行患者更为适合。如果DCB的长期疗效得到肯定,其有望成为取代血管内支架的理想选择。
| [1] | Ouma GO, Jonas RA, Usman MH, et al. Targets and delivery methods for therapeutic angiogenesis in peripheral artery disease[J]. Vasc Med, 2012, 17 (3): 174-92. DOI: 10.1177/1358863X12438270. |
| [2] | Lichtenberg M, Stahlhoff FW, Boese D. Endovascular treatment of acute limb ischemia and proximal deep vein thrombosis using rotational thrombectomy: A review of published literature[J]. Cardio Rev Med, 2013, 14 (6): 343-8. DOI: 10.1016/j.carrev.2013.08.005. |
| [3] | Mcdermott MM, Kibbe M, Guralnik JM, et al. Comparative effectiveness study of self-directed walking exercise, lower extremity revascularization, and functional decline in peripheral artery disease[J]. J Vasc Surg, 2013, 57 (4): 990-6. DOI: 10.1016/j.jvs.2012.09.068. |
| [4] | Rooke TW, Hirsch AT, Misra S, et al. 2011 ACCF/AHA focused update of the guideline for the management of patients with peripheral artery disease (updating the 2005 guideline): a report of the American college of cardiology foundation/American heart association task force on practice guidelines[J]. Catheter Cardio Int, 2011, 58 (19): 2020-45. |
| [5] | Schnorr B, Speck U, Scheller B. Review of clinical data with Paccocath-coated balloon catheters[J]. Minerva Cardioangiol, 2011, 59 (5): 431-45. |
| [6] | Sgueglia GA. Innovative approaches to percutaneous bifurcation interventions using drug-eluting balloons[J]. Minerva Cardioangiol, 2012, 60 (5): 531-7. |
| [7] | Briguori C, Virmani R, Kolodgie F, et al. From bench to bedside: initial experience with the Primus drug-coated balloon catheter[J]. Minerva Cardioangiol, 2012, 60 (5): 507-15. |
| [8] | Milewski K, Afari ME, Tellez A, et al. Evaluation of efficacy and dose response of different paclitaxel-coated balloon formulations in a novel swine model of iliofemoral in-stent restenosis[J]. JACC Cardiovasc Interv, 2012, 5 (10): 1081-8. DOI: 10.1016/j.jcin.2012.06.012. |
| [9] | Tepe G, Laird J, Schneider P, et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized tria[J]. Circulation, 2015, 13 (15): 495-502. |
| [10] | Scheinert D, Schulte KL, Zeller T, et al. Paclitaxel-Releasing balloon in femoropopliteal lesions using a BTHC excipient: Twelve-Month results from the BIOLUX P-I randomized trial[J]. J Endovasc Ther, 2015, 22 (1): 14-21. DOI: 10.1177/1526602814564383. |
| [11] | Pache J, Dibra A, Mehilli J, et al. Drug-eluting stents compared with thin-strut bare stents for the reduction of restenosis: a prospective, randomized trial[J]. Eur Heart J, 2005, 26 (13): 1262-8. DOI: 10.1093/eurheartj/ehi098. |
| [12] | Mauri L, Orav EJ, Candia SC, et al. Robustness of late lumen loss in discriminating drug-eluting stents across variable observational and randomized trials[J]. Circulation, 2005, 112 (18): 2833-9. DOI: 10.1161/CIRCULATIONAHA105.570093. |
| [13] | Baumann F, Willenberg T, Do DD, et al. Endovascular revascularization of below-the-knee arteries: prospective short-term angiographic and clinical follow-up[J]. J Vasc Interv Radiol, 2011, 22 (12): 1665-73. DOI: 10.1016/j.jvir.2011.08.028. |
| [14] | Sharma S, Kukreja N, Christopoulos C, et al. Drug-eluting balloon: new tool in the box[J]. Expert Rev Med Devices, 2010, 7 (3): 381-8. DOI: 10.1586/erd.10.5. |
| [15] | Cremers B, Speck U, Kaufels N, et al. Drug-eluting balloon: very short-term exposure and overlapping[J]. Thromb Haemost, 2009, 101 (1): 201-6. |
| [16] | Werk M, Langner S, Reinkensmeier B, et al. Inhibition of restenosis in femoropopliteal arteries: paclitaxel-coated versus uncoated balloon: femoral paclitaxel randomized pilot trial[J]. Circulation, 2008, 118 (13): 1358-65. DOI: 10.1161/CIRCULATIONAHA.107.735985. |
| [17] | Scheinert D, Scheinert D, Duda S, et al. The Levant I (lutonix Paclitaxel-Coated balloon for the prevention of femoropopliteal restenosis) trial for femoropopliteal revascularization First-in- Human randomized trial of Low-Dose Drug-Coated balloon versus uncoated balloon angioplasty[J]. JACC Cardiovasc Interv, 2014, 7 (1): 11-9. DOI: 10.1161/CIRCINTERVENTIONS.113.000679. |
| [18] | Fanelli F, Cannavale A, Boatta E, et al. Lower limb multilevel treatment with drug-eluting balloons: 6-month results from the DEBELLUM randomized trial[J]. J Endovasc Ther, 2012, 19 (5): 571-80. DOI: 10.1583/JEVT-12-3926MR.1. |
| [19] | Liistro F, Grotti S, Porto I, et al. Drug-eluting balloon in peripheral intervention for the superficial femoral artery: the DEBATE-SFA randomized trial (drug eluting balloon in peripheral intervention for the superficial femoral artery)[J]. JACC Cardiovasc Interv, 2013, 6 (12): 1295-302. DOI: 10.1016/j.jcin.2013.07.010. |
| [20] | Tepe G, Zeller T, Albrecht T, et al. Local delivery of paclitaxel to inhibit restenosis during angioplasty of the leg[J]. N Engl J Med, 2008, 358 (7): 689-99. DOI: 10.1056/NEJMoa0706356. |
| [21] | Schmidt A, Piorkowski M, Werner M, et al. First experience with drug-eluting balloons in infrapopliteal arteries: restenosis rate and clinical outcome[J]. J Am Coll Cardiol, 2011, 58 (11): 1105-9. DOI: 10.1016/j.jacc.2011.05.034. |
| [22] | Micari A, Cioppa A, Vadalà G, et al. Clinical evaluation of a paclitaxel-eluting balloon for treatment of femoropopliteal arterial disease: 12-month results from a multicenter Italian registry[J]. JACC Cardiovasc Interv, 2012, 5 (3): 331-8. DOI: 10.1016/j.jcin.2011.11.010. |
| [23] | Zeller T, Schmitmeier S, Tepe G, et al. Drug-coated balloons in the lower limb[J]. J Cardiovasc Surg (Torino), 2011, 52 (2): 235-43. |
| [24] | Diehm N, Hoppe H, Do DD. Drug eluting balloons[J]. Tech Vasc Interv Radiol, 2010, 13 (1): 59-63. DOI: 10.1053/j.tvir.2009.10.008. |
 2017, Vol. 37
2017, Vol. 37

