2. 公共卫生与热带医学学院,广东 广州 510515
2. Southern Medical University, Guangzhou 510515, China
食管癌是全球肿瘤中最常见的恶性肿瘤之一,病死率高[1]。患者平均生存期不到2 年[2],5 年生存率低于15%[3]。虽然手术治疗、(新)辅助治疗对食管癌预后有所改善,但食管癌患者的整体存活率还是比其他实体肿瘤差[4]。尽管临床上采用了完整的原发肿瘤切除术和其他治疗方法,但仍有超过2/3的食管癌患者出现局部复发或远处转移,最终死亡[2]。目前认为复发或转移可能与进入外周血和骨髓中的肿瘤细胞(CTCs)和/或播散肿瘤细胞(DTCs)有关,然而,食管癌患者CTCs/DTCs的意义尚存争议,有待进一步明确[5-6],已成为食管癌循证医学研究中需要解决的重要问题。为此,本文基于循证医学理论,采用文献系统评价和Meta分析,探讨食管癌CTCs/DTCs与患者临床病理特征、预后和生存状况的关系,以评价、回答食管癌患者CTCs/DTCs是否可作为其临床预测指标。
1 资料和方法 1.1 检索策略对文献进行独立的系统回顾,通过PubMed、Webof Science、Embase 及Cochrane 数据库检索可能的食管癌与CTCs/DTCs方面的相关研究(1986年~至2016年1 月)。使用的主要关键词是:"circulating tumorcells"、"micrometastasis"、"disseminated tumor cells"、"isolated tumor cells"、"occult tumor cells"、"esophagealcancer"、"esophageal carcinoma"、"esophagus cancer"、"esophagus carcinoma" and "prognos*"。纳入研究的选择过程见图 1,搜索策略和结果见补充材料。
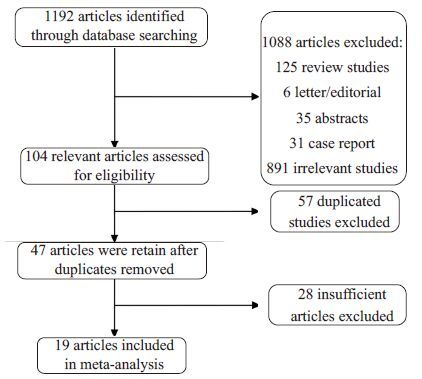
|
图 1 研究选择的流程图 Figure 1 Flowchart of studies screening process. |
为保证分析的准确性,我们严格按照以下标准纳入文献:(1)研究提供了进行CTCs/DTCs检测的食管癌患者的临床病理特征、预后、生存状况,从该研究或已发布数据可计算出至少一项结果;(2)使用反转录酶-聚合酶链锁反应、免疫组织化学、免疫细胞化学、免疫磁珠分离和CellSearch系统检测CTCs/DTCs;(3)样本来源于外周血或骨髓。上述纳入标准(1)、(2)和(3)需同时具备。当同一样本人群被多个已发表的研究纳入时,本研究只纳入最新发表或最完整的研究。
文献排除标准:(1)食管癌患者的样本量小于20例;(2)样本来源于淋巴结、胸腔或腹腔;(3)文献中未提及或从发表的原始数据中不能计算出患者的临床病理特征、预后和生存状况;(4)同一样本的重复文献。我们通过检查所有研究的作者及其机构,分析每一项研究数据收集时间及患者的地址以排除重复研究的纳入。
1.3 数据提取由两名具有医学专业的研究人员作为评价员独立阅读文献并提取数据,意见不一致时由两名评价员讨论,达成一致时方采纳相应数据。收集的信息包括以下几个方面:第一作者、发表年份、研究人群的特点(例如:样本量、性别和年龄)、取样前治疗(有/未知、无)、抽样时间、检测方法、CTCs/DTCs、CTCs/DTCs阳性率、结局指标:[OS、DFS、PFS、远期无病生存率(DDFS)和累积生存率(CS)]以及多因素分析结果。
1.4 文献质量评估由两名评价员根据NOS量表独立地对纳入的非随机对照实验文献进行质量评价[7],当质量评价结果意见不一致时由两名评价员讨论解决。该量表主要包括3个部分:研究人群的选择、研究人群的比较和研究结果的评价。
1.5 统计学分析用Review Manager 5.3 软件(Copenhagen: TheNordic Cochrane Centre,The Cochrane Collaboration,2014)、Stata12.0(Stata Corp,College Station,TX,USA)进行统计学分析。用OR 值评价食管癌患者CTCs/DTCs检测结果与其临床病理特征(分期、T、N、M、分化程度、淋巴脉管转移)之间的关联,RR值评价预后(复发、转移),HR值评价生存结局(OS、DFS/PFS)。用相对危险度的自然对数(lnHR)和标准误(SE)进行生存分析。如果原始文献中未明确提到相对危险度和其标准误,以及95%可信区间和P值,则据现有数据和生存曲线运用Tierney 等人设计的软件计算出自然对数相对危险度、标准误和P值的近似值[8]。根据约定,OR、RR 或HR>1 表明CTCs/DTCs 检测阳性组的结局差于阴性组。采用固定或随机效应模型计算生存分析中总的相对危险度和95%可信区间。用Cochran Q检验评价研究之间的异质性差异,异质性的大小用I2定量衡量。当Q检验的P<0.05和/或I2>50%时,尚不能认为各研究存在同质性,此时用随机效应模型进行分析。反之则用固定效应模型进行分析。用森林图分析meta分析中的异质性来源。用漏斗图评价发表偏倚。所有的统计结果均用95%可信区间表示,双侧检验P<0.05认定为差异具有显著性。
为避免相同的人群被重复分析,保证合并分析的准确性,对于重复研究从CTCs、DTCs中选择一项进行分析,从术前/中、术后中选择一个项进行分析。综合不同研究的临床病理特征、预后和生存状况进行总体分析。同时,在取样前治疗(有/未知、无)、检测方法(CellSearch/IHC/ICC、RT-PCR)和取样部位(CTCs/DTCs)的基础上进行生存亚组分析。采用敏感性分析(逐一去除某篇文献后观察余下研究合并效应是否变化,以分析单篇文献研究的影响)来测试结果的可靠性和一致性。
2 结果 2.1 检索结果利用关键词对上述数据库文献进行检索得到1192项研究。选择过程总结在图 1中。文献审查后1088项研究被排除,包括评论(125项)、信/社评(6项)、摘要(35项)、病例报告(31项)、无关紧要的或缺乏收集的信息(891项)。剩下的104项相关研究中,57项重复研究和28项不充分的研究被排除在外。最后,19项研究符合数据提取的入选标准,纳入研究的基本信息总结在表 1中。
| 表 1 纳入研究的基本信息 Table 1 Characteristics of the included studies |
1996~2015 年刊出的纳入研究(样本含量范围从33~370)包含1766例食管癌患者。其中1项研究包括用RT-PCR方法检测85名患者的CTCs/DTCs,12项研究共1005名患者记录有外周血中CTCs,6项研究共676例患者骨髓中记录有DTCs。12 项研究提供了OS或DFS/PFS/DDFS数据,其中9项提供了OS的HRs,6项研究提供了DFS/PFS 的HRs,1 项研究提供DDFS 的HRs。收集的数据总结于表 1。根据NOS量表,19项研究的质量评价见表 2。
| 表 2 根据NOS量表研究偏倚的风险评估 Table 2 The assessment of the risk of bias in each study using the Newcastle-Ottawa scale |
通过15项研究[2, 4-6, 9-11, 14, 18-20, 22-23],对比分期Ⅲ/Ⅳ组与Ⅰ/Ⅱ组,显示食管癌患者肿瘤分期与CTCs/DTCs有显著关联(OR=1.95,95% CI:1.48~2.56,P<0.01),表明CTCs/DTCs 与食管癌患者肿瘤分期有关。不同研究之间的异质性不显著(I2=30%,P=0.13)。
通过15项研究[2, 4-6, 9, 10, 12, 14-19, 21, 23],对比pT3/T4组与pT1/T2 组,显示肿瘤pT 与CTCs/DTCs 有显著关联(OR=1.99,95% CI:1.53~2.60,P<0.01),表明CTCs/DTCs与食管癌患者肿瘤侵犯深度有关。不同研究之间的异质性不显著(I2=46%,P=0.02)。
13项研究[2,5-6,9-10,12,14,16-19,21- 22]评价淋巴结转移N与CTCs/DTCs 的关系,表明食管癌患者淋巴结转移与CTCs/DTCs 有关联(OR=2.09,95% CI:1.62~2.70,P<0.01)。不同研究之间的异质性差异显著(I2=60%,P<0.01)。去除异质性差异最显著的研究(Tanaka et al.2010)后,敏感性分析显示不同研究之间的异质性不显著(最低效应,敏感性分析[SEN]:OR=2.44,95% CI:1.58~3.75,P<0.01;I2=45%,P=0.05)。因此,CTCs/DTCs与食管癌患者淋巴结转移的风险增加有关。
4项研究[2, 9, 14, 16]评价治疗前远处转移M与CTCs/DTCs 的关系,显示食管癌患者治疗前远处转移与CTCs/DTCs 有关联(OR=2.99,95% CI:1.51~5.89,P<0.01)。不同研究之间的异质性差异非常显著(I2=76%,P<0.01),去除异质性差异最显著的研究(Bobek et al.2014)后,敏感性分析显示不同研究之间的异质性不显著(最低效应,敏感性分析[SEN]:OR=5.98,95% CI:2.59~13.81,P<0.01;I2=0%,P=0.48)。因此,CTCs/DTCs与食管癌患者治疗前远处转移的风险增加有关。
2.3.1.2 分化10项研究[2, 6, 12, 14, 17-19, 21-23]通过对比中/低分化组与高分化组,显示食管癌分化程度与CTCs/DTCs有关联(OR=1.67,95% CI:1.07~2.61,P=0.02),表明CTCs/DTCs与食管癌患者肿瘤呈低分化的风险增加有关。不同研究之间的异质性不显著(I2=30%,P=0.13)。
2.3.1.3 淋巴脉管转移4项研究[6, 12, 14, 17]评价淋巴脉管转移与CTCs/DTCs的关系,显示食管癌患者脉管和/或淋巴转移与CTCs/DTCs有明显的关联(OR=4.48,95%CI:2.20~9.14,P<0.01),表明CTCs/DTCs与食管癌患者淋巴脉管转移的风险增加有关。不同研究之间的异质性不显著(I2=33%,P=0.21)。
2.3.2 CTCs/DTCs与预后的关联 2.3.2.1 复发5项研究[10, 17, 19-21]评价复发与CTCs/DTCs的关系,显示食管癌患者肿瘤复发与CTCs/DTCs有明显的关联(RR=4.75,95% CI:3.33~6.79,P<0.01)。不同研究之间的异质性差异显著(I2=70%,P=0.01)。去除异质性差异最显著的研究(Tanaka et al. 2010)后,敏感性分析显示不同研究之间的异质性不显著(最低效应,敏感性分析[SEN]:RR=6.86,95% CI:4.42~10.66,P<0.01;I2=0%,P=0.39)。因此,CTCs/DTCs能明显增加食管癌患者肿瘤复发的风险。
2.3.2.2 转移4项研究[4, 10, 20, 23]评估转移与CTCs/DTCs的关系,显示食管癌患者肿瘤转移与CTCs/DTCs有明显的关联(RR=3.22,95% CI:1.48~6.97,P<0.01),表明CTCs/DTCs能明显增加食管癌患者肿瘤转移的风险。不同研究之间的异质性不显著(I2=58%,P=0.07)。
2.3.3 CTCs/DTCs与生存状况的关联 2.3.3.1 OS9项研究[2, 4, 5, 10-13, 16, 21]食管癌患者OS的HR值及其95%可信区间显示食管癌患者OS与CTCs/DTCs有明显的关联(HR=3.06,95% CI:2.50~3.73,P<0.01),提示CTCs/DTCs意味着食管癌患者OS预后不良。不同研究之间的异质性差异显著(I2=66%,P<0.01)。去除异质性差异最显著的研究[12]后,敏感性分析显示不同研究之间的异质性不显著(最低效应,敏感性分析[SEN]:HR=3.46,95%CI:2.81~4.26,P<0.01;I2=0%,P=0.75,图 2)。通过绘制漏斗图评价发表偏倚,显示漏斗图对称、点分布均匀(图 3),Egger检验结果(P=0.525)也表明没有发表偏倚,研究结果可信。
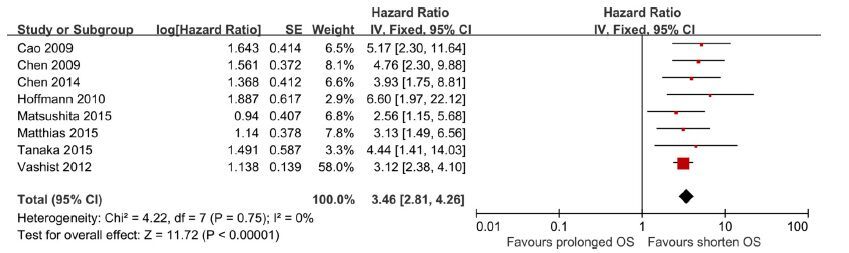
|
图 2 CTCs/DTCs阳性组对比阴性组OS森林图 Figure 2 Forest plot association of OS and CTCs/DTCs positive group compared to negative group. (Sensitivity analysis). |
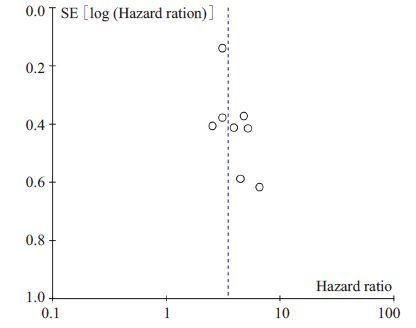
|
图 3 CTCs/DTCs阳性组对比阴性组OS漏斗图(敏感性分析) Figure 3 Funnel plot (sensitivity analysis) for overall survival in patients positive or negative for CTCs and DTCs. |
将研究分为有/未知取样前治疗、无取样前治疗两个亚组以探究食管癌患者取样前治疗对OS的影响。3项研究[4, 11, 13]中患者有/未知取样前治疗,6项研究[2, 5, 10, 12, 16, 21]中患者无取样前治疗。不论患者有无取样前治疗,食管癌患者OS 均与CTCs/DTCs 有关(HRYES/NR=5.01,95%CI:2.90~8.68,P<0.01,I2=0% ;HRNO=2.83,95% CI:2.28~3.51,P<0.01,I2=75%)。对无取样前治疗亚组去除异质性差异最显著的研究[12]后,敏感性分析显示不同研究之间的异质性不显著(最低效应,敏感性分析[SEN]:HRNO=3.25,95% CI:2.60~4.07,P<0.01;I2=0%,P=0.75)。因此,不论患者有无取样前治疗,CTCs/DTCs 均可预测食管癌患者OS。
将研究分为肿瘤细胞蛋白水平检测、基因水平检测两个亚组以探究食管癌患者肿瘤细胞蛋白水平和基因水平检测对OS 的影响。6 项研究[2, 4, 11-12, 16, 21]通过CellSearch/IHC/ICC检测肿瘤细胞,3项研究[5, 10, 13]通过RT-PCR检测肿瘤细胞,结果表明不论是蛋白水平还是基因水平检测,食管癌患者OS均与CTCs/DTCs有关(HRCellSearch/IHC/ICC=2.82,95% CI:2.27~3.50,P<0.01,I2=75%;HRRT-PCR=4.83,95% CI:2.88~8.10,P<0.01,I2=0%)。对蛋白水平检测亚组去除异质性差异最显著的研究(Gray et al. 2012)后,敏感性分析显示不同研究之间的异质性不显著(最低效应,敏感性分析[SEN]:HRCellSearch/IHC/ICC=3.24,95% CI:2.59~4.07,P<0.01;I2=0%,P=0.78)。因此,肿瘤细胞蛋白水平检测、基因水平检测均可用来检测CTCs/DTCs以预测EC患者OS。
将研究分为CTCs、DTCs 检测两个亚组以探究食管癌患者CTCs和DTCs检测对OS的影响。6 项研究[2, 4, 10, 11, 13, 16]检测患者CTCs,3 项研究[5, 12, 21]检测患者DTCs,结果表明不论检测CTCs还是DTCs,食管癌患者OS均与CTCs/DTCs有密切关系(HRCTCs=4.00,95%CI:2.82~5.66,P<0.01,I2=0%;HRDTCs=2.68,95% CI:2.10~3.42,P<0.01,I2=89%)。对DTCs检测亚组去除异质性差异最显著的研究[12]后,敏感性分析显示不同研究之间的异质性不显著(最低效应,敏感性分析[SEN]:HRDTCs=3.19,95% CI:2.47~4.26,P<0.01;I2=0%,P=0.60)。因此,食管癌患者CTCs 和DTCs 均可用来检测以预测OS。
2.3.3.2 DFS/PFS6项研究[2, 5, 11, 18-19, 22]食管癌患者DFS/PFS的HR值及其95%可信区间显示患者DFS/PFS与CTCs/DTCs有明显关联(HR=3.00,95% CI:2.27~3.97,P<0.01),表明CTCs/DTCs意味着食管癌患者DFS/PFS预后不良。不同研究之间的异质性不显著(I2=56%,P=0.05)。合并分析结果见图 4。通过绘制漏斗图评估发表偏倚,显示漏斗图对称、点分布均匀(图 5),Egger检验结果(P=0.409)也表明没有发表偏倚,研究结果可信。
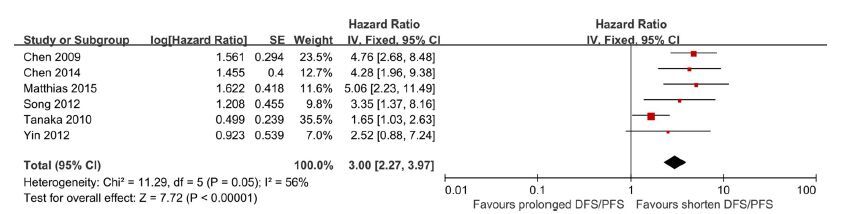
|
图 4 CTCs/DTCs阳性组对比阴性组DFS/PFS森林图 Figure 4 Forest plot for disease-free and progression-free survival of the patients positive or negative for CTCs and DTCs. |
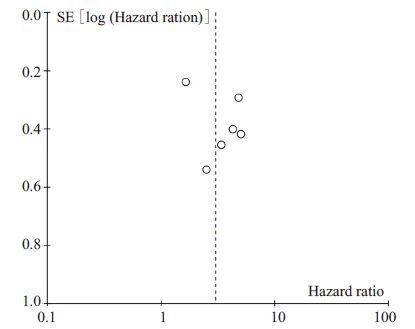
|
图 5 CTCs/DTCs阳性组对比阴性组DFS/PFS漏斗图 Figure 5 Funnel plot for disease-free and progression-freesurvival of the patients positive or negative for CTCsand DTCs. |
将研究分为有/未知取样前治疗、无取样前治疗两个亚组以探讨食管癌患者取样前治疗对DFS/PFS的影响。4项研究[11, 18-19, 22]患者有/未知取样前治疗,2项研究[2, 5]患者无取样前治疗。结果表明,不论患者有无取样前治疗,食管癌患者DFS/PFS均与CTCs/DTCs有关(HRYES/NR=2.61,95% CI:1.89~3.59,P<0.01,I2=63%;HRNO=4.64,95% CI:2.63~8.18,P<0.01,I2=0%)。对有/未知取样前治疗亚组去除异质性差异最显著的研究[19]后,敏感性分析显示不同研究之间的异质性不显著(最低效应,敏感性分析[SEN]:HRYES/NR=3.91,95% CI:2.52~6.08,P<0.01;I2=0%,P=0.54)。因此,不论患者有无取样前治疗,CTCs/DTCs均可预测食管癌患者DFS/PFS。
将研究分为肿瘤细胞蛋白水平检测、基因水平检测两个亚组以探讨食管癌患者肿瘤细胞蛋白水平和基因水平检测方法对DFS/PFS 的影响。2 项研究[2, 11]通过CellSearch/IHC/ICC检测肿瘤细胞,4项研究[5, 18-19, 22]通过RT-PCR检测肿瘤细胞。结果表明,不论是蛋白水平还是基因水平检测,食管癌患者DFS/PFS 均与CTCs/DTCs 有关(HRCellSearch/IHC/ICC=4.86,95% CI:3.03~7.79,P<0.01,I2=0%;HRRT-PCR=2.31,95% CI:1.64~3.27,P<0.01,I2=41%),表明肿瘤细胞蛋白水平检测、基因水平检测均可用来检测CTCs/DTCs以预测食管癌患者DFS/PFS。
3 讨论对于某些恶性肿瘤,如肺癌、乳腺癌、大肠癌等,CTCs/DTCs检测是预测肿瘤进展和预后的有效方法。然而,食管癌患者CTCs/DTCs检测的预后价值仍有争议,其CTCs/DTCs的检测能否预示不良的预后乃是问题的焦点。这些争议基于各自的研究结果,如何客观地评价这些已有的研究结果,回答CTCs/DTCs在食管癌预后分析中的价值是本文的核心目的。为此本文通过文献系统评价,采用meta分析方法对食管癌患者CTCs/DTCs检测的临床意义进行了评价性研究,结果表明食管癌患者CTCs/DTCs的存在不仅对临床病理特征和预后有预测价值,而且对生存状况有预测价值。
本文分析显示食管癌患者CTCs/DTCs可以作为复发(RR=6.88SEN)和转移(RR=3.22)的危险因素。CTCs/DTCs是前景很好的预测肿瘤进展的指标,有助于识别复发和转移高风险的患者。不难理解,CTCs/DTCs通过血行转移入脉管系统或器官(如肝、肺和骨),然后不断增殖形成微转移灶,继而逐渐发展成转移癌。此外,患者术后CTCs/DTCs有可能源自已存在的微转移灶或微小残留灶的脱落而不是原发肿瘤脱落(因为原发肿瘤已经被切除),这些微转移灶或微小残留灶可引起复发/转移[24]。
总体分析和亚组分析均显示,OS 和DFS/PFS 与CTCs/DTCs密切相关。CTCs/DTCs合并的HRs在OS和DFS/PFS 方面都超过3.0,表明CTCs/DTCs 检测对OS和DFS/PFS有很大的预测价值。在亚组分析中,在OS方面,对比CTCs和DTCs的HRs后可以看出CTCs比DTCs更敏感(HR 4.00 vs 3.19SEN)。此外,CTCs的检测没有时间限制,易被患者接受。因此,通过检测CTCs比DTCs 来预测食管癌患者的生存更为实用。对于CTCs/DTCs的检测方法,在OS方面蛋白水平检测比基因水平检测(HR 4.83 vs 3.24SEN)更敏感,但在DFS/PFS(HR 2.31 vs 4.86)方面基因水平检测比蛋白水平检测更敏感,目前还无法说明哪种方法检测CTCs/DTCs 更好。已有研究[24]比较了这些检测方法,也没有得出明确的结论。因此,还需要进一步的研究来评价哪种方法检测食管癌患者CTCs/DTCs 更好。对于取样前治疗亚组,在OS方面取样前有/未知治疗比取样前无治疗(HR5.01 vs 3.25SEN)检测CTCs/DTCs更敏感,但在DFS/PFS(HR 3.91 vs 4.64)方面取样前无治疗比取样前有/未知治疗检测CTCs/DTCs更敏感,尚不能说明取样前治疗对检测CTCs/DTCs的影响。
本文Meta分析存在一定程度的异质性,表现在淋巴结转移分析[19],治疗前远处转移分析,复发分析[19],OS分析和DFS/PFS取样前治疗亚组分析。异质性可能来自于不同的人群特点(例如:样本量、性别、年龄)和不同的临床病理特征(例如:抽样前治疗、抽样时间、检测方法、CTCs/DTCs)。此外,不同研究之间的异质性也可能是由实验设计的差异造成的。虽然异质性不可能完全消除,但本文还是按照文献系统评价和Meta分析的基本要求,对异质性进行了最大限度的控制。
综上所述,食管癌患者CTCs/DTCs与其临床病理参数(肿瘤分期、T、N、M、分化程度、淋巴脉管转移)和预后(复发、转移)有明显的相关性,CTCs/DTCs也与OS、DFS/PFS有明显的相关性。因此,CTCs/DTCs可作为食管癌患者非侵入性的可靠临床预测指标。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in Globocan 2012[J]. Int J Cancer, 2015, 136 (5): E359-86. DOI: 10.1002/ijc.29210. |
| [2] | Reeh M, Effenberger KE, Koenig AM, et al. Circulating tumor cells as a biomarker for preoperative prognostic staging in patients with EC[J]. Ann Surg, 2015, 261 (6): 1124-30. DOI: 10.1097/SLA.0000000000001130. |
| [3] | Tong YS, Wang XW, Zhou XL, et al. Identification of the long non-coding RNA POU3F3 in plasma as a novel biomarker for diagnosis of esophageal squamous cell carcinoma[J]. Mol Cancer, 2015, 14 : 3. |
| [4] | Tanaka M, Takeuchi H, Osaki Y, et al. Prognostic significance of circulating tumor cells in patients with advanced esophageal Cancer[J]. Esophagus, 2015, 12 (4): 352-9. DOI: 10.1007/s10388-014-0482-0. |
| [5] | Chen SB, Su XD, Ma GW, et al. Prognostic value of bone marrow micrometastasis in patients with operable esophageal squamous cell carcinoma: a long-term follow-up study[J]. J Thorac Oncol, 2014, 9 (8): 1207-13. DOI: 10.1097/JTO.0000000000000233. |
| [6] | Li H, Song P, Zou B, et al. Circulating tumor cell analyses in patients with esophageal squamous cell carcinoma using epithelial Marker-Dependent and -Independent approaches[J]. Medicine (Baltimore), 2015, 94 (38): e1565. DOI: 10.1097/MD.0000000000001565. |
| [7] | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in metaanalyses[J]. Eur J Epidemiol, 2010, 25 (9): 603-5. DOI: 10.1007/s10654-010-9491-z. |
| [8] | Panic N, Leoncini E, de BG, et al. Evaluation of the endorsement of the preferred reporting items for systematic reviews and meta-analysis(PRISMA) statement on the quality of published systematic review and meta-analyses[J]. PLoS One, 2013, 8 (12): e83138. DOI: 10.1371/journal.pone.0083138. |
| [9] | Bobek V, Matkowski R, Guerlich R, et al. Cultivation of circulating tumor cells in esophageal Cancer[J]. Folia Histochem Cytobiol, 2014, 52 (3): 171-7. DOI: 10.5603/FHC.2014.0020. |
| [10] | Cao M, Yie SM, Wu SM, et al. Detection of survivin-expressing circulating cancer cells in the peripheral blood of patients with esophageal squamous cell carcinoma and its clinical significance[J]. Clin Exp Metastasis, 2009, 26 (7): 751-8. DOI: 10.1007/s10585-009-9274-7. |
| [11] | Chen MF, Lee KD, Lu MS, et al. The predictive role of E2-EPF ubiquitin carrier protein in esophageal squamous cell carcinoma[J]. J Mol Med (Berl), 2009, 87 (3): 307-20. DOI: 10.1007/s00109-008-0430-3. |
| [12] | Gray RT, O'donnell ME, Verghis RM, et al. Bone marrow micrometastases in esophageal carcinoma: a 10-year follow-up study[J]. Dis Esophagus, 2012, 25 (8): 709-15. DOI: 10.1111/dote.2012.25.issue-8. |
| [13] | Hoffmann AC, Vallboehmer D, Grimminger P, et al. Preoperative survivin mRNA detection in peripheral blood is an Independent predictor of outcome in esophageal carcinoma[J]. Pharmacogenomics, 2010, 11 (3): 341-7. DOI: 10.2217/pgs.09.164. |
| [14] | Kaganoi J, Shimada Y, Kano M, et al. Detection of circulating oesophageal squamous Cancer cells in peripheral blood and its impact on prognosis[J]. Br J Surg, 2004, 91 (8): 1055-60. DOI: 10.1002/(ISSN)1365-2168. |
| [15] | Koike M, Hibi K, Kasai Y, et al. Molecular detection of circulating esophageal squamous cell cancer cells in the peripheral blood[J]. Clin Cancer Res, 2002, 8 (9): 2879-82. |
| [16] | Matsushita D, Uenosono Y, Arigami TA, et al. Clinical significance of circulating tumor cells in peripheral blood of patients with esophageal squamous cell carcinoma[J]. Ann Surg Oncol, 2015, 22 (11): 3674-80. DOI: 10.1245/s10434-015-4392-8. |
| [17] | Nakamura T, Matsunami K, Hayashi K, et al. Detection of bone marrow micrometastasis in esophageal cancer patients by immunomagnetic separation[J]. Oncol Rep, 2004, 11 (5): 999-1003. |
| [18] | Song H, Xu B, Yi J. Clinical significance of stanniocalcin-1 detected in peripheral blood and bone marrow of esophageal squamous cell carcinoma patients[J]. J Exp Clin Cancer Res, 2012, 31 : 35. DOI: 10.1186/1756-9966-31-35. |
| [19] | Tanaka K, Yano M, Motoori M, et al. CEA-antigen and SCCantigen mRNA expression in peripheral blood predict hematogenous recurrence after resection in patients with esophageal cancer[J]. Ann Surg Oncol, 2010, 17 (10): 2779-86. DOI: 10.1245/s10434-010-1075-3. |
| [20] | Thorban S, Roder JD, Nekarda H, et al. Immunocytochemical detection of disseminated tumor cells in the bone marrow of patients with esophageal carcinoma[J]. J Natl Cancer Inst, 1996, 88 (17): 1222-7. DOI: 10.1093/jnci/88.17.1222. |
| [21] | Vashist YK, Effenberger KE, Vettorazzi EA, et al. Disseminated tumor cells in bone marrow and the natural course of resected esophageal cancer[J]. Ann Surg, 2012, 255 (6): 1105-12. DOI: 10.1097/SLA.0b013e3182565b0b. |
| [22] | Yin XD, Yuan X, Xue JJ, et al. Clinical significance of carcinoembryonic antigen-, cytokeratin 19-, or survivin-positive circulating tumor cells in the peripheral blood of esophageal squamous cell carcinoma patients treated with radiotherapy[J]. Dis Esophagus, 2012, 25 (8): 750-6. DOI: 10.1111/dote.2012.25.issue-8. |
| [23] | Zhang X, Chen SB, Chen JX, et al. CK19 mRNA expression in the bone marrow of patients with esophageal squamous cell carcinoma and its clinical significance[J]. Dis Esophagus, 2010, 23 (5): 437-43. |
| [24] | Huang XZ, Gao P, Sun JX, et al. Clinicopathological and prognostic significance of circulating tumor cells in patients with gastric cancer: A meta-analysis[J]. Int J Cancer, 2015, 136 (1): 21-33. DOI: 10.1002/ijc.v136.1. |
 2017, Vol. 37
2017, Vol. 37

