2. 广州军区总医院妇产科,广东广州510010;
3. 妇女保健科,广东 深圳 518067;
4. 南方医科大学基础医学院基因工程研究所,广东 广州510515
2. Department of Obstetrics and Gynecology, General Hospital of Guangzhou Military Command, Guangzhou 510010, China;
3. Department of Women's Healthcare, Nanshan Maternity & Child Healthcare Hospital, Shenzhen 518067, China;
4. Institute of Genetic Engineering, School of Basic Medical Science, Southern Medical University, Guangzhou 510515, China
在世界范围内,宫颈癌为女性第3大恶性肿瘤,且85%的新发及死亡病例均出现在发展中国家[1]。近20年来,我国宫颈癌发病率和死亡率均明显上升,且发病呈年轻化趋势[2]。预测宫颈癌的增殖、迁移能力,对了解病变的生物学特点、选择正确的治疗方案及预后判断有着重要的意义。
宫颈癌的发生是遗传和环境因素长期相互作用的结果,是涉及多基因改变和多阶段致癌的复杂过程,国内外已有包括HPV癌蛋白E6、E7,染色体微结构稳定蛋白MCM-5、细胞周期蛋白CDC6、p16INK4A、鳞状细胞癌抗原SCC、细胞增殖相关标志物如PCNA 以及Ki-67等宫颈癌肿瘤标志物[3-4]用于科研及临床领域,对于提高疾病筛查率及临床早期诊断具有非常重要的意义。
目前,研究发现泛素-蛋白酶体系统(ubiquitinproteasome system,UPS)在肿瘤的发生、发展中发挥重要作用[5-6]。E3泛素连接酶通过参与底物识别和底物与泛素连接的作用,在蛋白酶体降解蛋白的底物特异性中起到决定性的作用。HERC4是近年来发现的E3泛素连接酶[7],有研究报道其在乳腺癌组织中的表达水平显著高于对应的癌旁正常乳腺组织,且降低HERC4表达可对乳腺癌MCF-7细胞系的增殖产生抑制作用,将细胞阻滞在G1期[8]。肺癌组织中HERC4的表达与乳腺癌的研究结果相同[9],而HERC4在宫颈癌中的表达情况及其功能研究在国内外尚无公开报道。本研究通过沉默宫颈癌Hela 细胞中HERC4 的表达,进一步检测Hela细胞的增殖、凋亡和迁移能力的变化,从细胞水平阐明HERC4对宫颈癌细胞生物学行为的影响。
1 材料和方法 1.1 主要试剂胎牛血清、DMEM 培养液、Opti-MEM 培养液均购自美国Gibco 公司,LipofectamineTM 2000 购自美国Invitrogen公司,RIPA裂解液、BCA(Bicinchoninic Acid)蛋白定量试剂盒、ECL(Electro-Chemi-Luminescence)化学发光液均购自碧云天生物有限公司,兔抗人HERC4,Cyclin D1,Bcl-2 多克隆抗体购自PLlaboratories,鼠抗人β-actin单克隆抗体购自欣博盛生物科技有限公司,si-RNA 由锐博生物有限公司合成,CCK-8 试剂,Annexin Ⅴ-FITC/碘化丙啶(propidiumiodide,PI)细胞凋亡检测试剂盒均购自江苏凯基生物技术股份有限公司,PVDF(polyvinylidene fluoride)膜购自美国Millipore 公司。
1.2 细胞及细胞培养宫颈癌Hela 细胞由南方医科大学基因工程研究所惠赠。Hela细胞用含10%胎牛血清的DMEM 高糖培养液,置于37 ℃、5% CO2的培养箱中恒温恒湿培养,取对数生长期的细胞进行实验。
1.3 HERC4 RNA干扰序列的设计根据NCBI 提供的序列(Genebank: XM_011539593)设计RNA干扰序列,经过BLAST分析,排除与其他基因同源的靶序列,共得到3条靶序列(表 1),阴性对照siRNA 序列为锐博公司专有。
| 表 1 针对HERC4基因的特异siRNA序列 Table 1 Specific siRNA sequences targeting HERC4 |
取对数生长期的Hela细胞接种于6孔板中,细胞浓度为5×105个/孔。每个孔加入约500 μL无抗生素的培养基,当细胞融合度达到70%~80%时,参照Lipofectamine2000说明书的方法将各组siRNA分别转染至Hela细胞中,终浓度达到100 nmol,同时以未转染的Hela细胞作为空白对照组(未加siRNA 及转染试剂),非特异性siRNA作为阴性对照组(NC组),每组设3 个复孔。
1.5 Western blotting 检测转染siRNA 后Hela 细胞HERC4,Cyclin D1和Bcl-2蛋白的表达收集转染72 h 后的各组Hela 细胞,用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白质浓度;取蛋白质40 μg/孔进行10% SDS-PAGE电泳,将电泳分离后的蛋白转移至PVDF膜上,用含5%脱脂奶粉的封闭液室温下封闭反应2 h,分别加入抗人HERC4,Cyclin D1 和Bcl-2 的兔源多克隆抗体(1∶1000,3% BSA)或抗人β-actin的鼠源单克隆抗体(1∶2000,3% BSA)于4 ℃孵育过夜;次日,TBST洗膜3次,每次5 min后,加入辣根过氧化物酶标记的山羊抗兔IgG(二抗,体积稀释比例为1∶5000),室温反应1 h ;TBST洗膜后,用ECL试剂进行显影。使用CareStream Health公司的Image Station4000R PRO成像仪检测发光信号。
1.6 CCK-8法检测转染siRNA后Hela细胞的增殖能力将转染24 h后的各组Hela细胞按照5×103个/孔分别接种于96 孔板中,每组设置5个复孔。将培养板置于细胞培养箱中,分别在细胞培养0,24,48和72 h后加入CCK-8(10 μL/孔),继续培养1 h,用酶联免疫检测仪检测450 nm波长处各孔的吸光度(A)值。以时间(T)为横轴,以光吸收值(A)为纵坐标绘制细胞生长曲线。
1.7 AnnexinⅤ-FITC/PI双染法检测转染siRNA后Hela细胞凋亡的变化将转染72 h后的各组Hela细胞以0.25%的胰蛋白酶(不含EDTA)消化收集,用PBS洗涤细胞2次后,加入500 μL Binding Buffer悬浮细胞,再加入5 μL AnnexinⅤ-FITC 混匀,最后加入5 μL PI 混匀;室温避光反应10 min后,用流式细胞仪检测各组细胞的凋亡情况。
1.8 细胞划痕实验取处于对数生长期的细胞,消化后在6孔板中接种1×105个细胞,待细胞汇合度达到80%进行转染。在单层细胞上,用10 μL的枪头沿培养板底部呈“一”字形划痕,用PBS清洗掉悬浮的细胞,用不含血清的DMEM培养基继续培养;分别在划痕的0、12、24、48 h给细胞更换新鲜的不含血清的DMEM 培养基,显微镜下观察细胞从划痕处向中央爬行的面积,其面积大小表示细胞迁移能力强弱,拍摄后应用图像分析软件Image-J软件计算细胞迁移面积,迁移面积(48 h)=空白面积(0 h)-空白面积(48 h)。Migration index=迁移面积(48 h)/空白面积(0 h)。3次独立实验计算平均值[10]。
1.9 统计分析以SPSS 13.0软件进行统计学分析,所得数据以均数±标准差表示,组间比较采用配对t检验,P<0.05时认为差异有统计学意义。
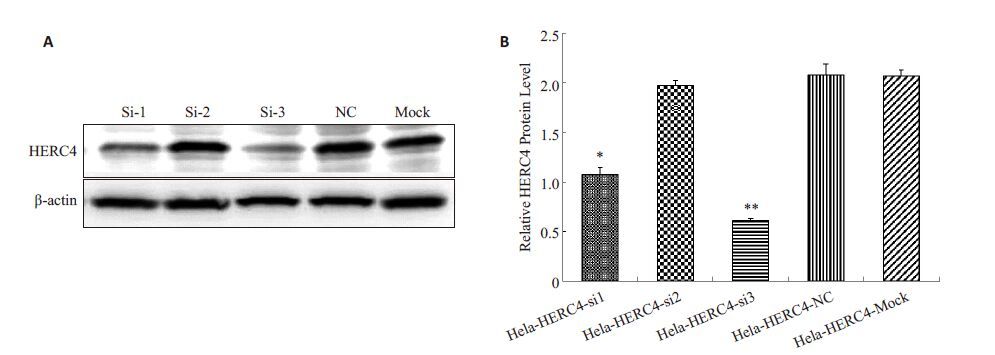
2 结果 2.1 HERC4-si-3 转染可显著下调Hela 细胞中HERC4蛋白的表达应用Western blotting 分别检测转染HERC4-si-1、HERC4-si-2、HERC4-si-3组、阴性对照组和未转染的空白对照组Hela细胞HERC4蛋白的表达。结果显示(图 1),转染HERC4-si-3组细胞HERC4蛋白表达显著低于阴性对照组和空白对照组(P<0.01)。这一结果表明,HERC4-si-3转染可显著下调Hela细胞中HERC4蛋白的表达水平。
|
图 1 转染siRNA对Hela细胞中HERC4蛋白表达的影响 Figure 1 Expression of HERC4 protein in Hela cells transfected with siRNA. A: Expression of HERC4 protein detected byWestern blotting; B: Relative HERC4 protein level in Hela cells transfected with siRNA. *P<0.05 vs non-transfected or NCsiRNA groups,**P<0.01 vs non-transfected or NC siRNA groups. si-1: HERC4-si-1; si-2: HERC4-si-2; si-3HERC4-si-3; NC:Negative control; Mock: Non-transfected. |
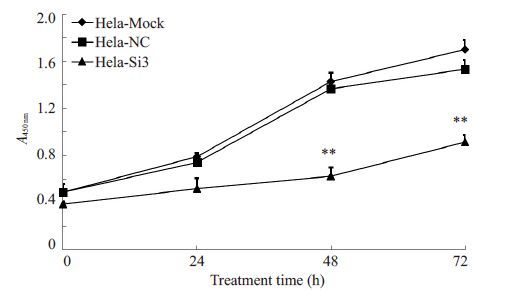
采用CCK-8法检测HERC4-si-3转染组、阴性对照组和空白对照组Hela细胞的增殖情况。结果显示(图 2),HERC4-si-3转染组细胞的A值显著低于阴性对照组和空白对照组细胞(P<0.01)。这一结果表明,下调HERC4的表达水平可显著抑制Hela细胞的增殖。
|
图 2 HERC4表达对Hela细胞增殖能力的影响 Figure 2 Effect of HERC4 expression on the cell proliferation ofHela cells. **P<0.01 vs non-transfected or NC siRNA groups. |
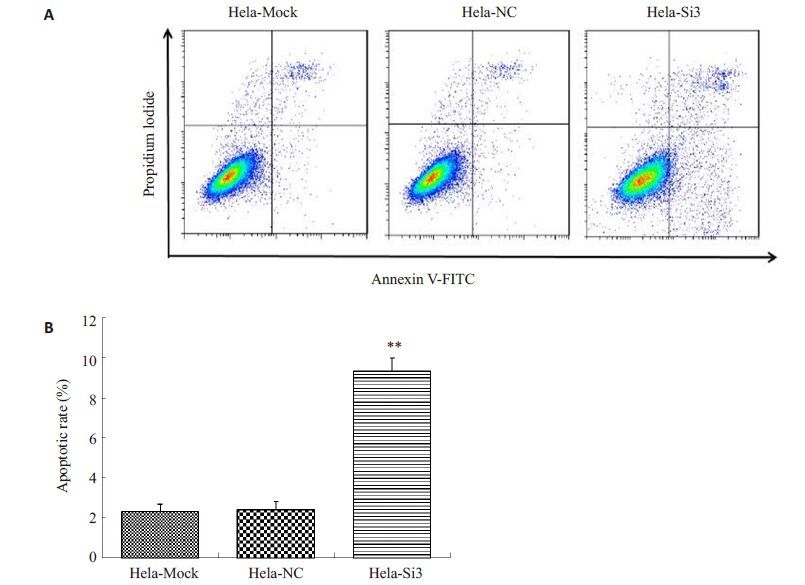
采用AnnexinⅤ-FITC/PI双染法检测HERC4-si-3转染组、阴性对照组和空白对照组Hela细胞的凋亡率。结果显示(图 3),HERC4-si-3转染组Hela细胞的早期凋亡率、晚期凋亡率和总凋亡率均高于阴性对照组和空白对照组细胞(P<0.01)。这一结果表明,下调HERC4的表达水平可促进Hela细胞的凋亡。
|
图 3 HERC4表达对Hela细胞凋亡率的影响 Figure 3 Effect of HERC4 knockdown on apoptosisrates of Hela cells. A: Apoptosis detection of Helacells transfected with siRNA by Annexin V-FITC/PI; B: Apoptosis rate of Hela cells transfectedwith siRNA. **P<0.01 vs non-transfected or NCsiRNA groups. |
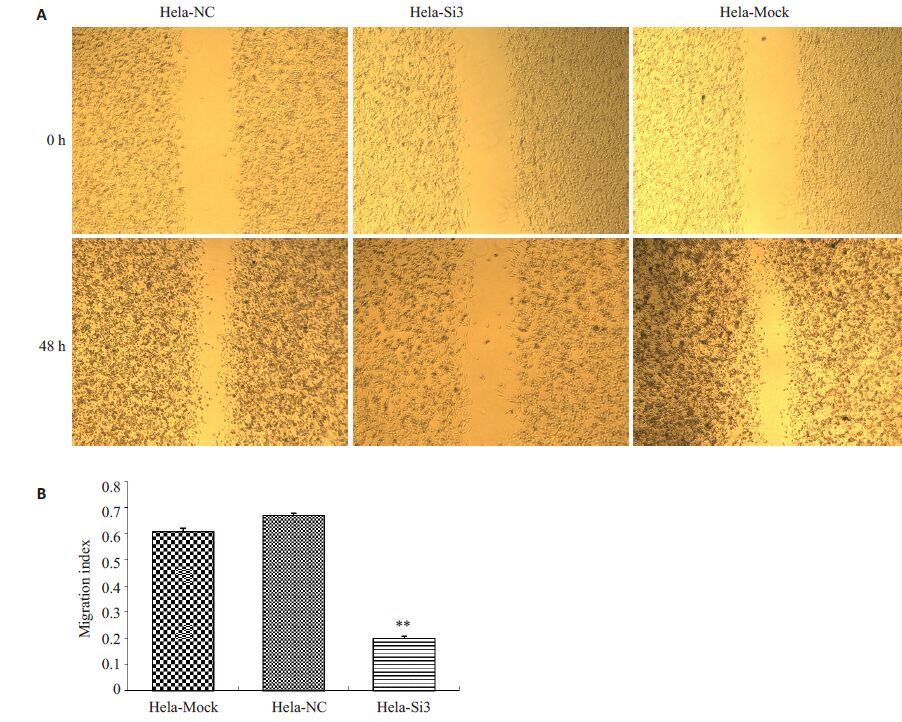
对转染24 h后的各实验组及对照组细胞进行“一”划痕,划痕后的0 h和48 h在显微镜下拍照,划痕区域的愈合情况可反映细胞的相对迁移能力。图 4显示相较于阴性对照组和空白对照组,抑制HERC4表达后,Hela细胞的迁移能力明显降低(P<0.01);NC组与Mock组相比无统计学差异(P>0.05)。
|
图 4 HERC4表达对Hela细胞迁移能力的影响 Figure 4 Effect of HERC4 expression on the cell migration ofHela cells (Original magnification: × 100). A: Effect ofHERC4 knockdown on migration of Hela cells; B:Migration index of Hela cells transfected with siRNA. **P<0.01 vs non-transfected or NC siRNA groups. |
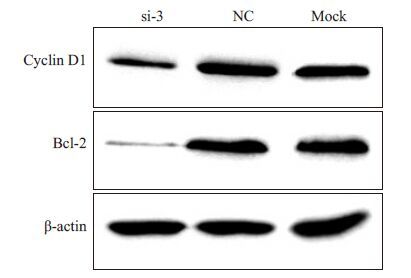
应用Western blot分别检测转染HERC4-si-3组、阴性对照组和未转染的空白对照组Hela 细胞Cyclin D1和Bcl-2蛋白的表达。结果显示(图 5),下调HERC4后细胞Cyclin D1和Bcl-2蛋白的表达显著降低。
|
图 5 敲低HERC4对Hela细胞Cyclin D1和Bcl-2蛋白表达的影响 Figure 5 Effect of HERC4 knockdown on the expression ofCyclin D1 and Bcl-2 proteins in Hela cells. |
宫颈癌是女性最常见的恶性肿瘤之一,在其癌变、增殖、转移、复发等一系列过程中伴随着癌基因或抑癌基因变异,引起相关因子表达的紊乱,针对这些生物学特性,RNA 干扰技术已成功应用于宫颈癌的基因治疗与研究。通过载体携带化学合成的siRNAs,可通过细胞内RNAi 体系使靶mRNA(如Bcl-2,cdk-2,mdm-2,pkc-α,tgf-β,H-ras,vegf和GFP的mRNA)沉默,组合不同的siRNAs可有效抑制癌细胞的增殖和生长[11]。在宫颈癌中最新的研究发现针对HPV E6/E7 癌基因的siRNA可显著增加小鼠宫颈癌放疗的效果[12];体内外研究表明通过全身给药的方式静脉输入siRNA 可抑制HPV相关宫颈癌细胞E6/E7癌基因的表达,并激活抑癌蛋白P53从而抑制肿瘤生长速度[13]。
现有的研究证实UPS系统在肿瘤的发生中可起到关键作用,其成员不仅可以作为潜在的癌症诊断标志物或者预后指标[14-15],而且可以作为潜在的分子治疗靶标[16-17]。该系统中的E3泛素连接酶因具有特异性而受到广泛关注。HERC4是近年来才被鉴定出的一种E3泛素连接酶,其特点是具有HECT结构域和至少一个RCC1 样结构域[6]。免疫荧光结果显示HERC4 定位于细胞的核内体和溶酶体中[18]。HERC4在各种组织中广泛表达,尤其在睾丸组织中大量表达,研究表明其在小鼠精子成熟过程中发挥重要作用[19]。HERC4在不同乳腺肿瘤组织中(良性纤维瘤、导管内癌、浸润性导管癌)的表达水平显著高于对应的癌旁正常乳腺组织,且HERC4的表达水平越高,乳腺癌的恶性程度越高[7]。在肺癌中的研究结果表明HERC4在肺神经内分泌癌、肺鳞状上皮癌、肺腺癌中的表达水平均高于对应的癌旁正常肺组织,并且HERC4蛋白的表达情况与肺癌TNM分期、病理组织学分级相关[8]。
但HERC4宫颈癌中的表达情况及其功能研究在国内外尚无研究报道,本研究通过转染针对HERC4设计的特异siRNA,发现转染HERC4-si-3后,Hela细胞中HERC4蛋白的表达水平显著低于对照组。随后,通过CCK-8法、细胞划痕实验和AnnexinⅤ-FITC/PI双染法发现,下调HERC4的表达水平可显著抑制Hela细胞的增殖、迁移并促进Hela细胞的凋亡,差异具有统计学意义。以上研究表明HERC4在宫颈癌细胞的增殖、凋亡和迁移中起着重要作用。
为了初步探讨干扰HERC4表达对Hela细胞增殖和凋亡能力的影响机制,siRNA干扰下调HERC4水平后细胞周期蛋白D1(Cyclin D1)和Bcl-2的表达具有重要意义。Cyclin D1作用于细胞周期的G1期,可与多种蛋白相互作用促进细胞进入S期,从而促进细胞的分裂与增殖。Cyclin D1的过度表达与恶性肿瘤的发生、组织学类型、分化程度、侵袭性及患者预后存在密切关系[20-21]。而定位于线粒体膜上的Bcl-2为公认的Bcl-2家族蛋白成员中主要抗凋亡分子。Bcl-2通过干扰细胞色素C及钙离子的释放,降低核酸内切酶活性,导致细胞色素C无法达到激活下游胱冬肽酶的阈值,从而保护细胞器功能,抑制细胞凋亡[22-23]。本研究发现在Hela细胞中下调HERC4的表达,细胞周期素Cyclin D1和细胞凋亡抑制蛋白Bcl-2的表达均明显下降,进一步说明HERC4在宫颈癌的发生发展中可能通过促进Cyclin D1和Bcl-2的表达促进细胞增殖和抑制细胞凋亡。
综上所述,本研究通过对HERC4在宫颈癌细胞中生物功能的研究,为HERC4参与宫颈癌发生的分子机制的研究以及宫颈癌靶向治疗的研究提供了新的思路。通过进一步大量收集临床资料齐全的样本,分析HERC4作为宫颈癌分子诊断标志物以及治疗靶标的可能,结合快速发展的RNAi技术治疗肿瘤,将为宫颈癌的基因治疗开辟更广阔的前景。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90. DOI: 10.3322/caac.v61:2. |
| [2] | Zhang Q, Xie W, Wang F, et al. Epidemiological investigation and risk factors for cervical lesions: cervical cancer screening among women in rural areas of Henan province China[J]. Med Sci Monit, 2016, 22 (22): 1858-65. |
| [3] | Arbyn M, Castellsagué X, De Sanjosé S, et al. Worldwide burden of cervical cancer in 2008[J]. Ann Oncol, 2011, 22 (12): 2675-86. DOI: 10.1093/annonc/mdr015. |
| [4] | Yim EK, Park JS. Biomarkers in cervical cancer[J]. Biomark Insights, 2007, 1 : 215-25. |
| [5] | Orlowski RZ, Dees EC. The role of the ubiquitination-proteasome pathway in breast cancer: applying drugs that affect the ubiquitin-proteasome pathway to the therapy of breast cancer[J]. Breast Cancer Res, 2003, 5 (1): 1-7. |
| [6] | Wang S, Huang X, Li Y, et al. RN181 suppresses hepatocellular carcinoma growth by inhibition of the ERK/MAPK pathway[J]. Hepatology, 2011, 53 (6): 1932-42. DOI: 10.1002/hep.24291. |
| [7] | Hochrainer K, Mayer H, Baranyi U, et al. The human HERC family of ubiquitin ligases: novel members, genomic organization, expression profiling, and evolutionary aspects[J]. Genomics, 2005, 85 (2): 153-64. DOI: 10.1016/j.ygeno.2004.10.006. |
| [8] | Zhou H, Shi R, Wei M, et al. The expression and clinical significance of HERC4 in breast cancer[J]. Cancer Cell Int, 2013, 13 (1): 113. DOI: 10.1186/1475-2867-13-113. |
| [9] | Zeng L, Chen W, Zhou H, et al. Expression of HERC4 in lung cancer and its correlation with clinicopathological parameters[J]. Asian Pac J Cancer Prev, 2015, 16 (2): 513-7. DOI: 10.7314/APJCP.2015.16.2.513. |
| [10] | 张俊霞, 张腾腾, 张利军, 等. 肺炎衣原体感染通过PI3K激活Rac1而诱导血管平滑肌细胞迁移[J]. 中国病理生理杂志, 2013, 29 (2): 236-41. |
| [11] | Yin Q, Gao J, Shao R, et al. siRNA agents inhibit oncogene expression and attenuate human tumor cell growth[J]. J Exp Ther Oncol, 2003, 3 (4): 194-204. DOI: 10.1046/j.1359-4117.2003.01092.x. |
| [12] | Nishida H, Matsumoto Y, Kawana K, et al. Systemic delivery of siRNA by actively targeted polyion complex micelles for silencing the E6 and E7 human papillomavirus oncogenes[J]. J Control Release, 2016, 231 (231): 29-37. |
| [13] | Jung S, Rajasekaran N, Song Y, et al. Human papillomavirus E6/ E7-Specific siRNA potentiates the effect of radiotherapy for cervical cancer in vitro and in vivo[J]. Int J Mol Sci, 2015, 16 (6): 12243-60. DOI: 10.3390/ijms160612243. |
| [14] | Hsieh SC, Kuo SN, Zheng YH, et al. The E3 ubiquitin ligase SIAH2 is a prosurvival factor overexpressed in oral cancer[J]. Anticancer Res, 2013, 33 (11): 4965-73. |
| [15] | Xie C, Powell C, Yao M, et al. Ubiquitin-conjugating enzyme E2C: a potential cancer biomarker[J]. Int J Biochem Cell Biol, 2014, 47 : 113-7. DOI: 10.1016/j.biocel.2013.11.023. |
| [16] | Micel LN, Tentler JJ, Smith PG, et al. Role of ubiquitin ligases and the proteasome in oncogenesis: novel targets for anticancer therapies[J]. J Clin Oncol, 2013, 31 (9): 1231-8. DOI: 10.1200/JCO.2012.44.0958. |
| [17] | Weathington NM, Mallampalli RK. Emerging therapies targeting the ubiquitin proteasome system in cancer[J]. J Clin Invest, 2014, 124 (1): 6-12. DOI: 10.1172/JCI71602. |
| [18] | Hochrainer K, Kroismayr R, Baranyi U, et al. Highly homologous HERC proteins localize to endosomes and exhibit specific interactions with hPLIC and Nm23B[J]. Cell Mol Life Sci, 2008, 65 (13): 2105-17. DOI: 10.1007/s00018-008-8148-5. |
| [19] | Rodriguez CI, Stewart CL. Disruption of the ubiquitin ligase HERC4 causes defects in spermatozoon maturation and impaired fertility[J]. Dev Biol, 2007, 312 (2): 501-8. DOI: 10.1016/j.ydbio.2007.09.053. |
| [20] | Feng X, Hao J, Liu Q, et al. HMGB1 mediates IFN-γ-induced cell proliferation in MMC cells through regulation of cyclin D1/CDK4/ p16 pathway[J]. J Cell Biochem, 2012, 113 (6): 2009-19. DOI: 10.1002/jcb.v113.6. |
| [21] | Li J, Hu L, Tian C, et al. microRNA-150 promotes cervical cancer cell growth and survival by targeting FOXO4[J]. BMC Mol Biol, 2015, 16 (1): 24. DOI: 10.1186/s12867-015-0052-6. |
| [22] | 杨翠, 张广平, 陈咏宁, 等. DHA对宫颈癌细胞株凋亡、侵袭和转移的影响[J]. 南方医科大学学报, 2016, 36 (6): 848-56. |
| [23] | Zhang Y, Lin S, Zhang Y, et al. Effect of beclin 1 expression on the biological behavior and chemotherapy sensitivity of cervical cancer cells[J]. Oncol Lett, 2016, 11 (6): 4089-94. |
 2017, Vol. 37
2017, Vol. 37

