2. 附属第一医院血液科,重庆 400016
2. Department of Hematology, First Affiliated Hospital of Chongqing Medical University, Chongqing 400016,China
慢性粒细胞白血病(CML)是起源于造血干细胞的恶性增生性疾病,它以BCR/ABL融合基因为遗传学特征,其编码的BCR/ABL融合蛋白发挥异常增高的酪氨酸激酶活性,激活下游信号通路从而导致疾病的发生发展[1]。目前,BCR/ABL酪氨酸激酶抑制剂(TKIs)作为治疗CML的一线临床用药,已取得了较好的治疗效果。但是,由于TKIs具有一定的副作用,且CML慢性期患者因多种原因易发生耐药,复发以及急变[2-4],因此,对于CML病人而言,寻找一种新的治疗药物至关重要。
桃儿七(Sinopodophyllum hexundrum),又名鬼臼,是我国珍稀草本药用植物,为我国三级濒危保护物种,已被2005 版药典收载[5-6]。桃儿七作为我国传统藏药之一,因其具有祛痰止咳、抗炎,抗肿瘤等多种作用而成为藏族人民常用药[7-8]。逐年来,国内外研究者证实桃儿七中主要成分鬼臼毒素及其衍生物对多种肿瘤具有良好的抑制作用[9-10]。其部分化学单体衍生物,如VP16-213,VM-26等,也已应用于临床肿瘤治疗[11]。以往有研究表明鬼臼酰肼对白血病K562细胞具有显著促凋亡作用[12],但由于该类化学单体衍生物具有极大的毒副作用,临床疗效并不佳。然而,有学者研究发现桃儿七天然提取物对小鼠移植性肝癌的抑制作用明显优于单体化合物(鬼臼毒素)[13],桃儿七根醇提取物可显著抑制人乳腺癌MCF-7细胞的生长并促进凋亡[14],但是该天然提取物对于急变期CML细胞生长的影响尚不清楚。由此我们推测,桃儿七天然提取物对急变期CML细胞的抑制作用可能优于单体化合物,其具体效应及机制还有待研究。因此,本实验以CML急变期细胞株K562为研究对象,初步探讨桃儿七天然提取物对K562细胞凋亡的效应及作用机制,为CML的治疗提供中医治疗的新思路,同时进一步深化藏药的开发利用。
1 材料和方法 1.1 主要材料及试剂 1.1.1 桃儿七药物桃儿七由西藏昌都地区藏医院提供并鉴定其品质,使用前粉碎并筛分,取粒径250~850 μm作为实验原料。准确称取10.0 g(绝干计)桃儿七原料,用200 mL 体积分数55%的乙醇溶解;以200 w功率超声提取3 次,每次提取时间为50 min且需更换乙醇并取出样品过滤,滤渣用乙醇洗涤浸提至无色,回收乙醇,减压蒸馏获得浸膏,真空低温干燥,制得样品。样品先以少量DMSO 溶解,然后用双蒸馏水稀释配制为20 mg/mL的原液,用0.22 m孔径滤膜过滤除菌后-20 ℃避光保存,使用前根据实验需要用RPMI 1640培养基稀释配成不同药物浓度,DMSO在溶液中浓度小于0.05%。应用HPLC 法测定样品中鬼臼毒素的含量,以此作为质量控制[15]。
1.1.2 主要试剂及仪器RBMI 1640培养基、小牛血清(FBS)购于Gibco,CCK8 试剂购于博培生物技术有限公司,DAPI试剂购于碧云天生物技术有限公司,伊马替尼(Imatinib)购于诺华制药,p-BCR/ABL、BCR/ABl抗体、p-STAT5、STAT5 抗体购于Cell signaling technology,IgG-HRP标记的二抗、β-actin 抗体购自Santa Cruz 公司,实验主要仪器为酶标仪,相差倒置显微镜,荧光显微镜,流式细胞仪,化学发光仪。
1.1.3 细胞株慢性粒细胞白血病急变期细胞K562为本实验室保存,培养于含10%小牛血清的RPMI 1640培养基中。置37 ℃饱和湿度的5% CO2孵箱中培养,2~3 d换液传代1次,取对数生长期的细胞进行实验,实验细胞起始接种浓度为1×105/mL。
1.2 CCK8实验检测桃儿七对K562细胞生长的影响取对数生长期细胞,将K562细胞按1×103/孔加入96孔培养板中,设置空白对照组(C)、DMSO溶剂对照组(D)、及桃儿七处理组(T)、Imatinib处理组,每组5个复孔。桃儿七处理组分别给予1、2、3 μg/mL的桃儿七药物,分别培养12、24、36、48、72、96 h后,每孔加入10 μLCCK8 试剂培养4 h,于酶标仪上测定450 nm 吸光度(A值)。
1.3 流式细胞术检测细胞凋亡收集对数期生长的K562 细胞,按1×106/孔加入6孔培养板中,用2 μg/mL桃儿七处理12、24、36、48 h后收集细胞沉淀,PBS 洗2 次,用1 mL PBS 重悬,采用Annexin-PI 双染法流式细胞术检测细胞凋亡数量。
1.4 Western blotting检测蛋白的表达水平收集用2 μg/mL 桃儿七处理12、24、36、48 h 后的K562细胞,按照操作说明提取细胞蛋白,用BCA(碧云天)法测定蛋白浓度,配制10% SDS-PAGE分离胶,上样进行电泳分离;切取需要目的条带胶进行转膜,转膜完成后,将膜收入封闭液中,4 ℃封闭4 h;分别孵一抗,4 ℃过夜;用TBST洗涤膜3 次,孵IgG-HRP 羊抗兔二抗,用TBST洗涤膜2次,TBS洗膜1次,采用ECL化学发光法检测目的蛋白表达情况。
1.5 瑞氏染色观察细胞凋亡形态学变化收集已传代培养的K562 细胞,按1×106/孔加入6孔培养板中,设置空白对照组(C)、DMSO溶剂对照组(D)及桃儿七处理组(T)。用2 μg/mL桃儿七处理48 h后收集细胞,用PBS洗涤细胞2次后离心弃上清液,残留少许上清液轻轻吹打混匀沉淀再涂片染色。采用刘氏快速染液进行染色,每张涂片滴加刘氏A液7~8滴,染色35 s后加刘氏B液4~5滴染色1 min,冲洗干净后晾干,显微镜观察并拍照。
1.6 DAPI染色观察细胞核形态变化收集2 μg/mL桃儿七处理48 h后的K562细胞,用PBS洗涤两次后离心弃上清液,残留少许上清液轻轻吹打混匀沉淀,涂片干燥,于4%多聚甲醛中室温固定15 min,PBS洗3 次后干燥,Trtion x-100 透化15 min,PBS洗3次后干燥,加DAPI试剂于37 ℃染色15 min,PBS洗3次后干燥,甘油封片后于荧光显微镜下观察。
1.7 数据统计学分析实验数据采用SPSS 17.0分析软件进行分析,实验结果的计量数据用均数±标准差表示,组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较用SNK法。以P<0.05为差异具有统计学意义。
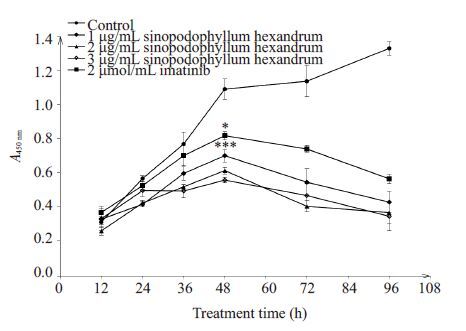
2 结果 2.1 CCK8实验筛选桃儿七对K562细胞最佳作用浓度及时间分别给予1、2、3 μg/mL的桃儿药物及2 μmol/mL伊马替尼处理K562 细胞12、24、36、48、72、96 h,利用CCK8实验检测桃儿七对K562细胞生长的影响。检测结果显示:与对照组比较,桃儿七在2、3 μg/mL浓度下均可抑制K562细胞生长并呈时间和浓度依赖性(P<0.001)。由于考虑到试剂本身对细胞的毒性作用,最终筛选2 μg/mL桃儿七处理细胞48 h作为最佳的作用浓度及作用时间。此外,结果中可以发现,桃儿七对K562细胞增殖的抑制程度明显高于伊马替尼,差异具有统计学意义(P<0.05,图 1)。
|
图 1 CCK8实验筛选桃儿七对K562细胞的最佳作用浓度及时间 Figure 1 Optimal concentration and time of Sinopodophyllumhexandrum treatment of K562 cells determined with CCK8assay. ***P<0.001 vs control groups; *P<0.05 Imatinib groupvs three Sinopodophyllum hexandrum treatment groups. |
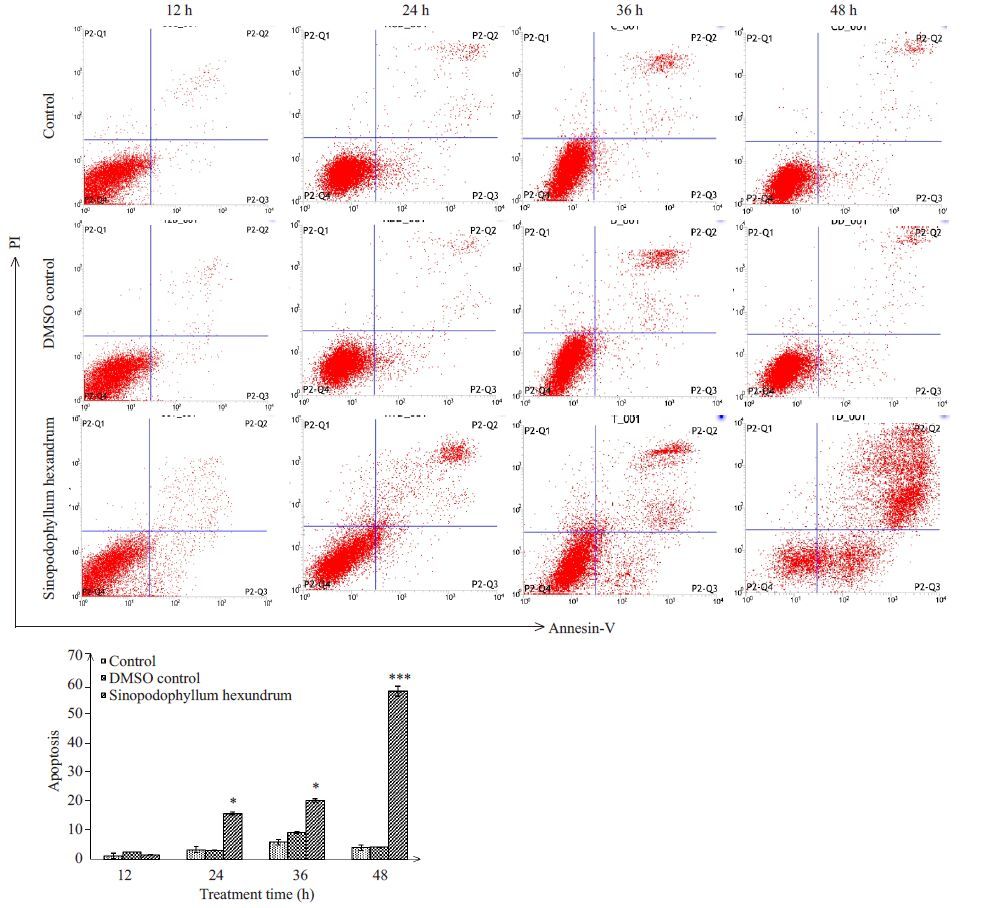
2μg/mL桃儿七分别处理K562细胞12、24、36、48 h后,使用流式细胞术进行细胞存活及凋亡分析。结果显示,与两组对照组比较,在处理24 h后细胞凋亡开始显著增加并呈时间依赖性(P<0.05),48 h细胞凋亡效应最为显著,差异具有统计学意义(P<0.001)。该结果说明桃儿七对K562细胞具有促凋亡效应,并呈时间依赖性,在48 h促凋亡效应最明显。此结果与CCK8实验结果相符合(图 2)。
|
图 2 流式细胞术检测桃儿七对K562细胞凋亡的影响 Figure 2 Effects of Sinopodophyllum hexandrumon onapoptosis of K562 cells detected by flow cytometry.***P<0.001,*P<0.05 vs two control groups. |
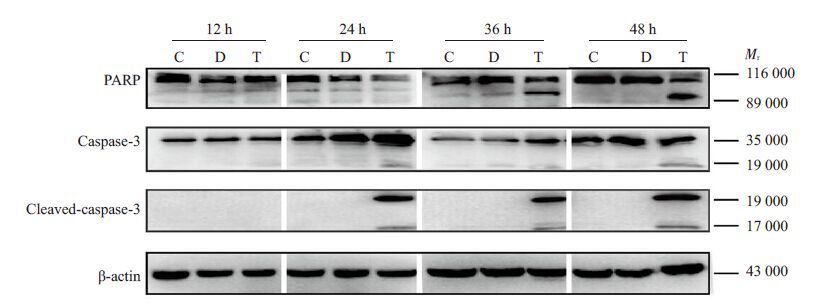
K562细胞经2 μg/mL桃儿七分别处理12、24、36、48 h后,Western blotting结果显示,凋亡相关蛋白PARP及caspase-3分别在36 h,24 h开始发生活化,出现活化剪切条带,两者均呈时间依赖性,在48 h 活化最为明显。此外,Cleaved-caspase-3蛋白也在24 h出现并呈时间依赖性增加(图 3)。
|
图 3 桃儿七对K562细胞凋亡相关蛋白活化的影响 Figure 3 Effect of Sinopodophyllum hexundrum on expressions of apoptosis-relatedproteins in K562 cells. C: Control group; D: DMSO control group; T: Sinopodophyllumhexundrum treatment group. |
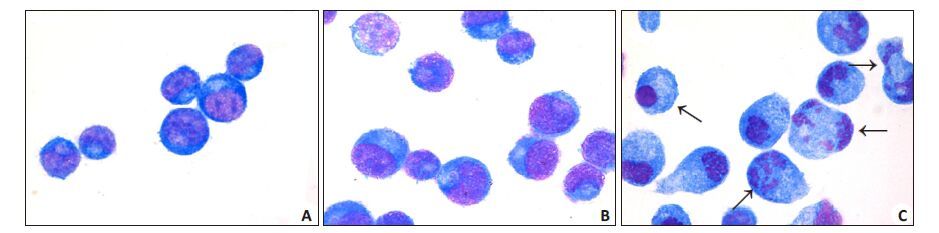
用2 μg/mL桃儿七处理K562细胞48 h后进行瑞氏染色。结果显示,与对照组相比,K562细胞经桃儿七处理48 h后细胞形态发生不规则改变,出现明显的核碎裂,胞膜肿胀,染色质聚集,凋亡小体形成等典型特征。此实验表明,桃儿七对K562细胞具有促进其凋亡的效应(图 4)。
|
图 4 瑞氏染色观察桃儿七处理K562 细胞后形态学变化 Figure 4 Effects of Sinopodophyllum hexandrum on morphology of K562 cells (Wright staining). Arrows indicate typical apoptoticchanges in K562 cell morphology such as nuclear fragmentation and dissolution. A: Control; B: DMSO control; C:Sinopodophyllum hexundrum. |
与对照组相比,K562细胞经2 μg/mL桃儿七处理48 h后,DAPI染色结果显示桃儿七处理组细胞核形态发生染色质聚集固缩,核碎裂,核膜肿胀等显著变化。此结果进一步说明桃儿七对K562细胞具有明显促凋亡的效应(图 5)。
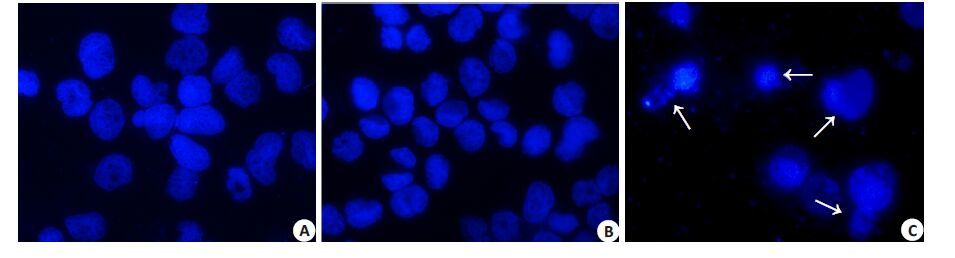
|
图 5 DAPI染色观察桃儿七对K562 细胞核形态学的影响 Figure 5 Effects of Sinopodophyllum hexandrum on nuclear morphology of K562 cells (Wright staining). Arrows indicate cell nuclearmorphology of apoptotic K562 cells. A: Control; B: DMSO control; C: Sinopodophyllum hexundrum. |
应用2 μg/mL 桃儿七处理K562 细胞48 h,通过Western blotting实验检测蛋白水平的改变。实验结果显示,与两组对照组相比,K562细胞在桃儿七处理48 h后,BCR/ABL,p-BCR/ABL及其下游的STAT5,p-STAT5蛋白表达量均显著减少。以上实验结果表明,2 μg/mL桃儿七可下调BCR/ABL及下游的信号通路蛋白STAT5的表达并降低其磷酸化表达水平(图 6)。
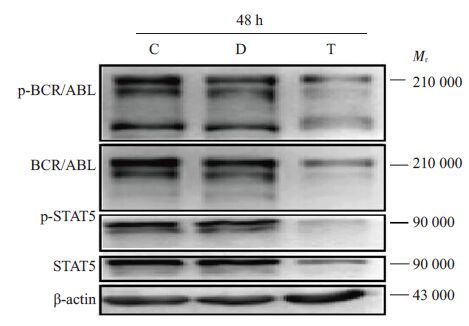
|
图 6 桃儿七对BCR/ABL、p-BCR/ABL、STAT5、p-STAT5蛋白表达的影响 Figure 6 Protein expressions of p-BCR/ABL,BCR/ABL,p-STAT5 and STAT5 in K562 cells treatedwith Sinopodophyllum hexandrum. C: Controlgroup; D: DMSO control group; T:Sinopodophyllum hexundrum treatment group. |
慢性粒细胞白血病(CML)是恶性血液肿瘤中比较常见的一种白血病类型,占成人白血病总数的40%,该病在亚洲发病率最高,且90%以上患者白血病细胞中含有特征性的BCR/ABL融合基因,该基因编码的高酪氨酸激酶活性的BCR/ABL 融合蛋白可通过Ras-Raf-MAPK、STAT-Bcl-XL、PI3K-AKT、NFκB等多条信号转导通路参与调控白血病细胞的恶性增殖,在CML发生发展中起到关键作用[1, 16-17]。临床上CML急变期患者易向急淋或急粒转变,并且对放化疗敏感性降低[18]。K562 细胞是从急变期病人腹水中分离而来的含有BCR/ABL融合蛋白的细胞,可通过多种途径抵制药物引起的细胞凋亡[19]。因此,促进细胞凋亡对于急变期CML 的治疗尤为重要。目前,TKIs在临床上应用取得了较好的疗效,但是仍然有近30%~40%的患者由于对伊马替尼等药物的不耐受性或者耐药性的逐渐增加而需要联合其他药物治疗[20]。也有文献报道BCR/ABL依赖的JAK-STAT5细胞生存信号通路也是CML患者对TKIs耐药的原因之一[21]。
桃儿七作为我国传统的藏医药,其木脂素类活性成分具有良好的抗肿瘤药效。有研究显示,桃儿七天然乙醇提取物对体外培养的小鼠白血病细胞L1210 及L7712有促凋亡作用,且效应呈浓度时间依赖性[22]。那么,在本实验中,我们以K562 细胞为研究模型展开研究,实验结果显示,分别给予1、2、3 μg/mL的桃儿药物处理K562细胞12、24、36、48、72、96 h,K562细胞生长被抑制并呈时间浓度依赖性,与伊马替尼处理组比较,桃儿七对K562细胞生长抑制作用明显优于伊马替尼。同时,流式细胞术检测结果也表明桃儿七对K562细胞促凋亡效应呈时间依赖性,在48 h效应最为显著。瑞氏染色及DAPI染色发现细胞形态出现明显的核碎裂,胞膜肿胀,染色质聚集,凋亡小体形成等典型凋亡特征。
此外,以往有学者研究发现桃儿七单体衍生物4-邻氨基酚-4’去甲表鬼臼酯(ODE)能促进K562细胞凋亡,但并未探讨相关作用机制[23]。我们在实验中通过应用Western blotting 检测蛋白表达情况发现,与两组对照组相比,K562 细胞经桃儿七处理后,凋亡相关蛋白PARP、caspase-3以及Cleaved-caspase-3蛋白在桃儿七药物作用下呈时间依赖性显著活化;BCR/ABL、p-BCR/ABL及其下游信号分子STAT5、p-STAT5 蛋白表达量均减少。因此,从Western blot实验结果中可知,桃儿七诱导K562 细胞凋亡的机制可能是通过下调BCR/ABL及下游STAT5 的蛋白表达并降低其磷酸化表达水平,通过抑制BCR/ABL-JAK/STAT5 信号通路最终促进细胞凋亡。此外凋亡相关蛋白PARP 和caspase-3以及Cleaved-caspase-3蛋白的活化也显示该作用效应也可能与线粒体凋亡途径有关,但其具体的分子生物学机制仍有待深入探讨。
综上所述,本实验证实了桃儿七药物对CML急变期K562细胞具有显著促凋亡效应,并呈时间依赖性,其机制可能与BCR/ABL-JAK/STAT5信号通路及线粒体凋亡途径相关,该研究结果为进一步明确藏药桃儿七在CML治疗中的意义奠定了基础。
| [1] | McCubrey JA, Steelman LS, Abrams SL, et al. Targeting survival cascades induced by activation of Ras/Raf/MEK/ERK, PI3K/PTEN/ Akt/mTOR and Jak/STAT pathways for effective leukemia therapy[J]. Leukemia, 2008, 22 (4): 708-22. DOI: 10.1038/leu.2008.27. |
| [2] | Weisberg E, Manley PW, Cowan-Jacob SW, et al. Second generation inhibitors of BCR-ABL for the treatment of imatinib-resistant chronic myeloid leukaemia[J]. Nat Rev Cancer, 2007, 7 (5): 345-56. DOI: 10.1038/nrc2126. |
| [3] | Cortes J, Hochhaus A, Hughes T, et al. Front-line and salvage therapies with tyrosine kinase inhibitors and other treatments in chronic myeloid leukemia[J]. J Clin Oncol, 2011, 29 (5): 524-31. DOI: 10.1200/JCO.2010.31.3619. |
| [4] | Kuroda J, Shimura Y, Yamamoto-Sugitani M, et al. Multifaceted mechanisms for cell survival an drug targeting in chronic myelogenous leukemia[J]. Curr Cancer Drug Targets, 2013, 13 (1): 69-79. DOI: 10.2174/156800913804486638. |
| [5] | 国家药典委员会, 中国药典(I部)[S]. 北京化工工业出版社, 2005: 31. |
| [6] | 赵纪峰, 刘翔, 王昌华, 等. 珍稀濒危药用植物桃儿七的资源调查[J]. 中国中药杂志, 2011, 36 (10): 1255-60. |
| [7] | 宗玉英, 党合群, 骆桂法, 等. 110种藏药抗肿瘤体外筛选实验研究[J]. 药学实践杂志, 2000, 18 (5): 290-1. |
| [8] | 黄坤, 蒋伟, 赵纪峰, 等. 桃儿七中木脂素类化学成分及其活性研究进展[J]. 中药新药与临床药理, 2012, 23 (2): 232-8. |
| [9] | 吴志豪, 赵玉敏, 李成檀, 等. 鬼臼毒酮对人白血病细胞株HL-60 的增殖凋亡及端粒酶活性的影响[J]. 中华实用中西医杂志, 2002, 2 (15): 568-9. |
| [10] | Yong Y, Shin SY, Lee YH, et al. Antitumor activity of deoxypodophyllotoxin isolated from Anthriscus sylvestris: Induction of G2/M cell cycle arrest and caspase-dependent apoptosis[J]. Bioorg Med Chem Lett, 2009, 19 (15): 4367-71. DOI: 10.1016/j.bmcl.2009.05.093. |
| [11] | Zheng Y, Sun YG, Zhang Y, et al. Synthesis and cytotoxicity of novel podophyllotoxin derivatives[J]. 中国化学快报: 英文版, 2009, 20 (12): 1431-4. |
| [12] | 俞建, 陈彻, 高培龙, 等. 鬼臼酰肼对白血病K562细胞株作用的实验研究[J]. 中药材, 2005, 28 (2): 111-3. |
| [13] | 尚明英, 徐珞珊, 李萍, 等. 鬼臼类中药及其木脂素类成分的药效学研究[J]. 中草药, 2002, 33 (8): 722-4. |
| [14] | 李国元. 桃儿七根醇提物对人乳腺癌MCF-7细胞增殖和凋亡的影响[J]. 中国新药杂志, 2006, 15 (13): 1064-7. |
| [15] | 杨磊, 唐晓溪, 赵春建, 等. 响应全面法优选桃儿七中的鬼臼毒素的超声提取工艺[J]. 化工进展, 2009, 28 (2): 297-304. |
| [16] | Quintás-Cardama A, Cortes J. Molecular biology of bcr-abl1- positive chronic myeloid leukemia[J]. Blood, 2009, 113 (8): 1619-30. DOI: 10.1182/blood-2008-03-144790. |
| [17] | Benjamini O, Kantarjian HM, O'brien S, et al. Combination chemotherapy with tyrosine kinase inhibitors can overcome Bcr-Abl mutations in acute lymphoblastic leukemia or blast crisis CML[J]. Blood, 2013, 122 (21): 2734-9. |
| [18] | Fernandes RS, Gorman AM, McGahon A, et al. The repression of apoptosis by activated abl oncogenes in chronic myelogenous[J]. Leukemia, 1996, 10 : S17-21. |
| [19] | Kang CD, Yoo SD, Hwang BW, et al. The inhibition of ERK/MAPK not the activation of JNK/SAPK is primarily required to induce apoptosis in chronic myelogenous leukemic K562 cells[J]. Leuk Res, 2000, 24 (6): 527-34. DOI: 10.1016/S0145-2126(00)00010-2. |
| [20] | Santos FP, Kantarjian H, Quintas-Cardama A, et al. Evolution of therapies for chronic myelogenous leukemia[J]. Cancer J, 2011, 17 (6): 465-76. DOI: 10.1097/PPO.0b013e31823dec8d. |
| [21] | Xu X. Zhang X, Liu Y, et al. BM microenvironmental protection of CML cells from imatinib through Stat5/NF-κB signaling and reversal by wogonin[J]. Oncotarget, 2016, 7 (17): 24436-54. |
| [22] | Shareef MA, Duscharla D, Ramasatyaveni G, et al. Investigation of podophyllotoxin esters as potential anticancer agents: Synthesis, biological studies and tubulin inhibition properties[J]. Eur J Med Chem, 2015, 89 : 128-37. DOI: 10.1016/j.ejmech.2014.10.050. |
| [23] | 赵俊. 4-邻氨基酚-4'去甲表鬼臼酯(ODE)在K562肿瘤细胞凋亡中的作用[J]. 青海医药杂志, 2010, 40 (8): 2-5. |
 2017, Vol. 37
2017, Vol. 37

