2. 广东省人民医院//广东省医学科学院妇产科, 广东 广州 510080;
3. 南方医科大学珠江医院 检验医学部,广东 广州 510280
2. Department of Obstetrics and Gynecology, Guangdong General Hospital/Guangdong Academy of Medical Sciences, Guangzhou 510080, China;
3. Department of Laboratory Medicine, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China
复发性外阴阴道假丝酵母菌病(Recurrentvulvovaginal candidiasis,RVVC),是指经过治疗,临床症状消失且真菌学检查阴性后复发,且在1年内发作4次或以上[1],临床表现为反复外阴阴道瘙痒、灼痛、豆渣样阴道分泌物增多,常伴有尿痛及性交痛。2013年有一项来自西方6个国家6010名女性的在线调查结果显示:总人群RVVC发生率为9%,25 岁女性RVVC发生率为10%,而50岁女性RVVC发生率高达25%[2]。2015年也有学者估计全世界每年约1.38亿女性患有RVVC,以及约4.92亿女性在其一生中会罹患RVVC[1]。目前局部抗真菌治疗是RVVC的主要治疗方案,但反复复发成为疾病治疗的瓶颈,因此积极寻求针对其发病机制的靶向治疗,成为临床上亟待解决的问题。
然而RVVC的发病机制目前尚未明了,研究证实RVVC发病可能与机体免疫因素[3]、基因多态性[4]和治疗耐药性[5]有关,近年来更强调阴道微生态环境的变化在RVVC的发生发展中也起重要作用[1]。目前关于RVVC阴道微生态的研究结果存在争议。有研究发现,RVVC患者发作期阴道乳酸杆菌比例显著下降,抗真菌治疗的同时补充阴道益生菌能显著减轻症状[6];亦有研究表明,RVVC患者乳酸杆菌丰度高,其与健康对照女性阴道菌群的结构无明显差异。上述研究为横断面研究,考虑存在采集样本时间点的差异[7]。目前国内关于RVVC患者阴道菌群的动态研究鲜有报道。本研究拟利用基于荧光测序平台的双末端测序(BarcodedPaired-End Illumina Sequencing,BIPES)[8],在不同时间点采集RVVC患者及正常对照女性阴道分泌物,比较两者菌群结构及在月经周期中的变化,以及比较RVVC发作期和间歇期阴道菌群结构的变化,可以更加全面地了解RVVC患者的阴道微生态,有望为RVVC复发的机制研究及指导临床治疗提供有价值的理论基础。
1 资料和方法 1.1 材料和研究对象 1.1.1 主要试剂阴道拭子基因组DNA提取试剂盒(北京百泰克,中国)、蛋白酶K(Sigma公司)、Ex-taq PCR试剂盒(TaKaRa,日本)。盐酸特比萘芬阴道泡腾片(齐鲁天和惠世制药有限公司,50 mg/片,7片/盒,中国)。
1.1.2 研究对象选取2015年12月~2016年6月在南方医科大学珠江医院妇产科就诊的RVVC患者6名,并同期招募了5名健康育龄期女性作为正常对照组纳入研究,年龄分别是35.2±6.8 岁和30.5±9.1 岁,具有可比性。患者均签署知情同意书。
RVVC组纳入标准:(1)症状:外阴瘙痒、灼痛、性交痛及尿痛,可伴有阴道分泌物增多;(2)体征:外阴红斑、水肿,多伴抓痕或皮肤皲裂、表皮脱落,阴道黏膜潮红、小阴唇内侧及阴道黏膜附着白色膜状物,阴道内可见白色黏稠呈乳胶或豆渣样分泌物;(3)实验室检查:湿涂片(以生理盐水和10% KOH制备)证实存在假丝酵母菌的芽生孢子或假菌丝;或真菌培养有白假丝酵母菌、近平滑假丝酵母菌、热带假丝酵母菌等生长;(4)1年内有症状并经真菌学证实的发作4次或以上。
正常对照组纳入标准为同时满足以下4项:(1)无临床症状;(2)阴道清洁度分级为Ⅰ~Ⅱ级;(3)实验室检查:阴道分泌物镜检未找到假丝酵母菌的芽孢或菌丝;(4)月经正常。
排除标准:妊娠期及哺乳期妇女;全身系统性疾病(如糖尿病)、激素治疗性疾病(如急慢性肾炎)等;其他阴道炎如滴虫性、细菌性阴道病;1个月内有全身应用抗生素、免疫抑制剂、阴道用药史,3 d内有性生活或阴道灌洗。
RVVC患者每次复发后均予盐酸特比萘芬阴道泡腾片治疗(阴道内用药,50 mg/d,共7 d)。
1.2 方法 1.2.1 标本采集RVVC组患者首次就诊即为发作期。正常对照组为同期本院健康门诊体检的健康育龄期妇女。告知研究对象该实验研究方案及意义并签署知情同意书后,嘱其至少每隔3 d使用一次性棉签拭子在阴道下1/3处轻轻旋转至少10次,然后转移至-80 ℃低温冰箱保存。在所有样品收集完成后转移至南方医科大学珠江医院检验医学部实验室进行细菌总DNA提取。正常对照组个体编号为H1、H2、⋯⋯H5;RVVC组患者个体编号为RV1、RV2、⋯⋯RV6。
1.2.2 细菌总DNA提取与检测以细菌基因组DNA提取试剂盒提取样本中总DNA,具体操作步骤参照说明书。提取的总DNA经紫外分光光度计(波长为570)测定纯度和浓度,PCR产物经1%琼脂糖凝胶电泳检测后放置4 ℃冰箱中保存备用。
1.2.3 16s rRNA V4 区基因片段的扩增及Illumina测序以样本总DNA为模版,采用引物514F和805R,合成单位:上海生工生物工程股份有限公司。514F:GTGCCAGCMGCCGCGGTAA、805R:GGACTACHVGGGTWTCTAAT,扩增其中的16s rRNA V4 区基因。PCR反应体系(25 μL):10×buffer(2.5 μL),dNTP(2 μL),Mg2+(1.5 μL),P1(0.5 μL),P2(0.5 μL),Ex-taq(0.25 μL)模板DNA(1 μL),H2O(16.75 μL)。PCR扩增条件:94 ℃预变性2 min,然后94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,共30个循环,72 ℃最终延伸5 min。PCR产物用1.0%琼脂糖凝胶电泳(电压:180 V,电泳时间:20 min)检测产量和特性。最终产物使用QiagenQIAquick Gel Extraction Kit 切胶回收纯化后,送深圳华大基因公司通过Illmnina HiSeq2000 平台进行双末端100 bp测序。
1.3 生物信息学分析所测得的序列经过BIPES操作进行初步处理,保留有效测序数据进行修剪;反向互补组装V4序列;釆用二阶段聚类算法(Two-Stage-Clustering,TSC)[9]进行聚类,提取出每个操作分类单元(Operational taxonomyunit,OTU)的代表序列后,采用全局比对序列分类(Global Alignment for Sequence Taxonomy,GAST)[10]算法对OTU进行分类。利用GAST进行物种的分类,其中属于乳酸菌属的OTU利用Blast程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进一步分到细菌种级别,再进行菌群结构分析、A1pha 多样性以及Beta 多样性分析。基于Unifrac距离[11],采用QIIME[12]进行主成分分析。
1.4 统计学处理应用SPSS 20.0统计软件进行统计分析,两组计量资料间的比较采用两独立样本的t检验,对多样性指数应用Mann-Whitney U检验。P<0.05 认为差异具有统计学意义。
2 结果 2.1 样本信息本实验样品采集信息如表 1所示。
| 表 1 实验样品信息表 Table 1 Sample information in the present study |
本实验测序样品数293个,共获得10 869 883条高质量16S rRNA基因序列数。序列数最低为5880条,最高为73 766条,将测序深度标化到5880条,所有的样品均可纳入分析。平均每个样品37 099条序列。
2.3 菌群结构比较选取丰度最高的前20位细菌属,计算这20种细菌属占总细菌属的百分比。对每个个体所有时间点的阴道菌群结构进行构成比分析(图 1),结果显示,正常对照组H1、H3的阴道菌群主要由惰性乳酸杆菌(L.iners)、卷曲乳酸杆菌(L.crispatus)为优势菌,H2、H4、H5则主要以惰性乳酸杆菌(L.iners)、加德纳式菌属(Gardnerella)、普氏菌属(Prevotella)、奇异菌属(Atopobium),纤毛菌属(Sneathia)等为主要菌属。少部分人还存在少量的詹氏乳酸杆菌(L.jensenii)、嗜酸乳杆菌(L.acidophilus)、约氏乳酸杆菌(L.johnsonii),后面3种在所有检测对象中,均未占据主要地位,而是和前两种乳酸杆菌共存。相比之下,RVVC组的阴道菌群多样性明显降低,L.iners菌丰度异常增高,呈绝对优势,其他菌属如Prevotella、链球菌属(Streptococcus)、Gardnerella、Sneathia则相对减少,并且L.crispatus明显减少。
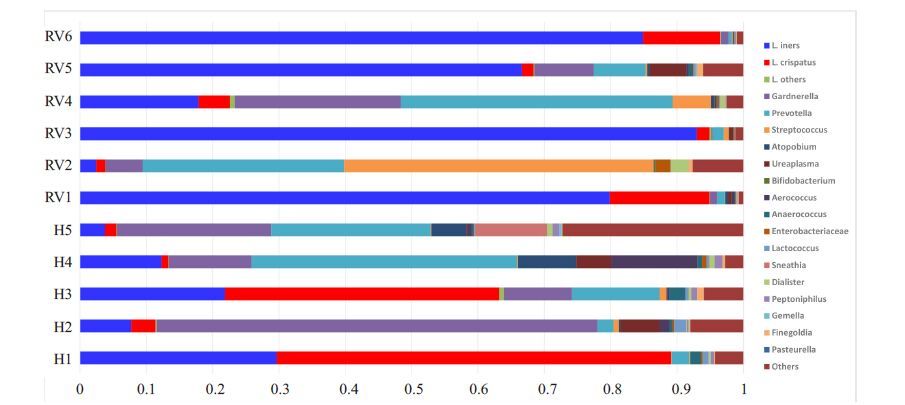
|
图 1 两组阴道微生物群落整体结构比较 Figure 1 Composition of the vaginal flora in each individual in RVVC and control group. |
Shannon指数同时受到物种丰富度和均匀度两者的影响。我们用Shannon指数来比较两组间的差异,结果提示(图 2A)两组间阴道菌群的α-多样性有显著的统计学差异(P<0.01,Mann-Whitney U Test)。并且我们发现,RVVC组的Shannon指数低于正常对照组。对两组每个个体分别比较,差异均具有统计学差异(P<0.01,Mann-Whitney U Test)(图 2B、C)。
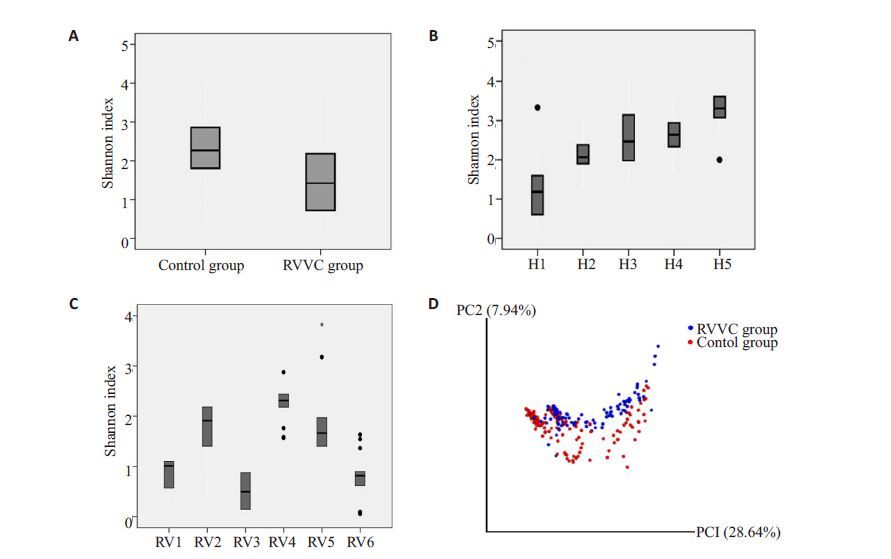
|
图 2 两组间及各组内α-多样性分析及组间β-多样性分析 Figure 2 Comparison of Alpha diversity between and within groups and comparison of beta diversity between groups. A: Comparison of the Shannon index between RVVC group and control group (P<0.01); B: Comparison of the Shannon index of each individual in control group (P<0.01); C: Comparison of the Shannon index of each individual in RVVC group (P<0.01); D: Comparison of the beta diversity between RVVC group and control group. |
根据QIIME 分析流程进行β- 多样性分析,用UniFrac距离进行的PCoA分析来展示两组菌群之间的相似度。每个点代表 1个样品,而点与点之间的距离通过两个菌群之间的序列相似度比较获得。如图 2D所示RVVC组(蓝色)和正常对照组(红色)能大致分开,表明二者的菌群结构有所区别。
2.6 菌群动态分析 2.6.1 正常对照组菌群动态分析如图 3所示,阴道菌群波动的大小因人而异,有些女性阴道菌群随着月经周期发生周期性变化,而有些女性阴道菌群却非常稳定。如H1、H3,月经周期期间阴道菌群以乳酸杆菌为主,只是在L.iners与L.crispatus之间相互交替变化,其他种属变化不大。H2、H4 的阴道菌群却分别以Gardnerella、Prevotella为绝对优势菌属,并且菌群相对稳定,波动性减弱。而有些则在物种组成和稳定性方面相差很大,如H5,随着时间的推移,占优势地位的菌属不断在Gardnerella、Prevotella、梭菌属(Clostridiales)之间变换。而且阴道菌群在经期波动较明显。
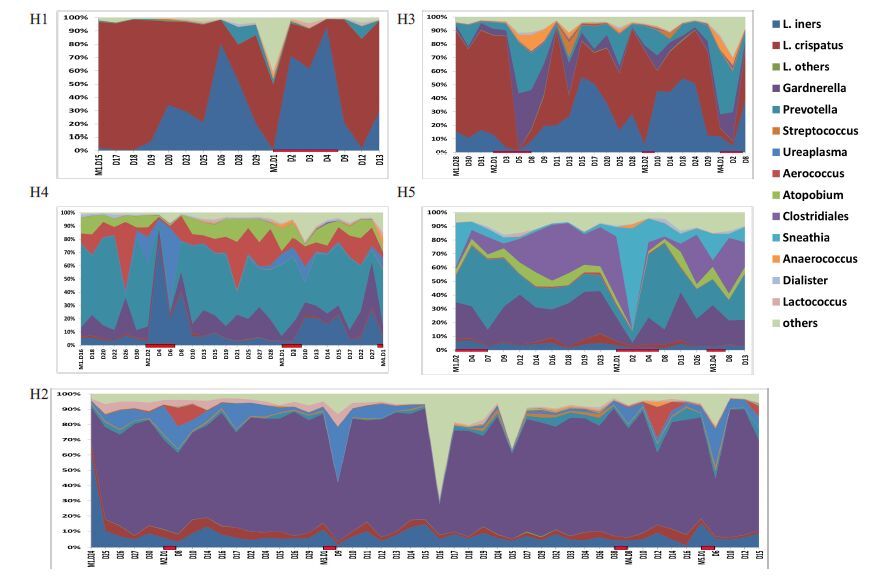
|
图 3 正常对照组阴道菌群动态变化图 Figure 3 Dynamic variation of vaginal flora in the control group. Notes: Red bar means menses; H1-H5 means the serial number of each individual in control group. |
如图 4所示,RVVC患者阴道菌群的波动性明显减弱,RV1、RV3、RV5、RV6菌群波动性几乎消失,并且在月经期、发作期和间歇期均无明显波动。RV2 的阴道菌群在Prevotella 与Streptococcus之间出现动态波动,此起彼伏,但在发作期并未见明显波动。RV4的菌群丰富度稍高,以L.iners、Gardnerella、Prevotella为优势菌属,但波动性亦不显著。
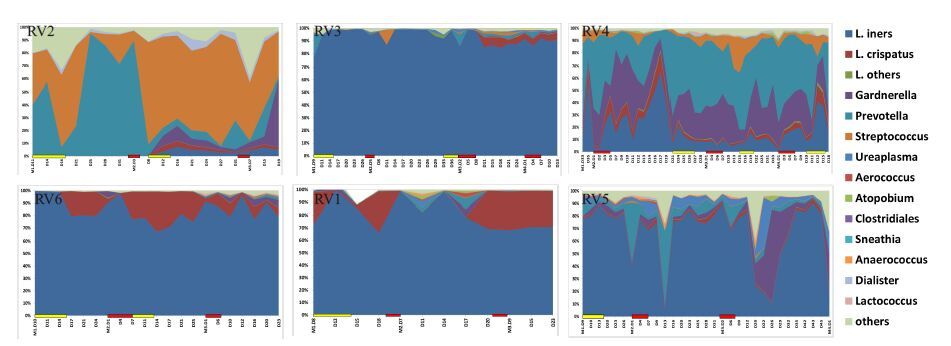
|
图 4 RVVC组阴道菌群动态变化图 Figure 4 Dynamic variation of vaginal flora in RVVC group. Notes: Red bar means menses; Yellow bar means recurrence; RV1-RV6 means the serial number of each individual in RVVC group. RV2、RV3、RV4、RV6: Recurrence occurred during the follow-up period; RV1、RV5: No recurrence during the follow-up period. |
根据QIIME分析流程进行β-多样性分析,来展示RVVC组复发前后菌群之间的相似度(图 5),分析RVVC组4个随访到复发的研究对象在复发前后阴道菌群随着时间的变化,图中每一个点代表一个样品。可以看出RVVC患者在其复发前后的菌群分布相似,未能有显著区分,即表示它们间的菌群差异不大,提示我们RVVC患者在其复发前后阴道菌群的构成无明显变化,维持在一个相对稳定的状态。另外两个RVVC患者没有随访到复发,遂以其月经周期为观察单位,可以看出其3个月经周期的菌群分布相似,都未能有显著区分。
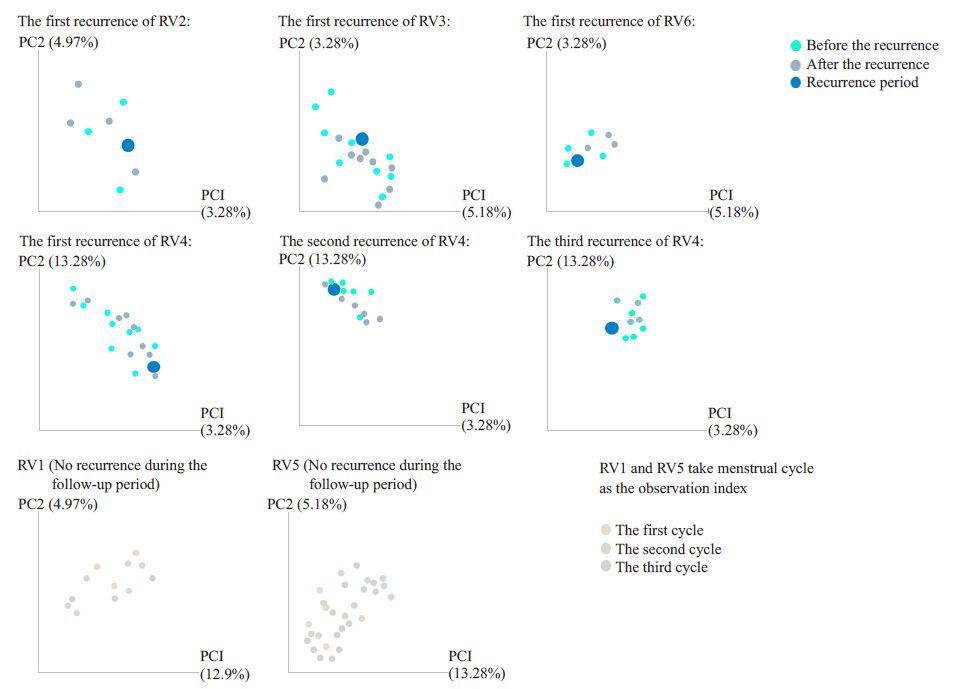
|
图 5 RVVC患者复发前后阴道菌群β-多样性分析 Figure 5 Comparison of Beta diversity in patients with RVVC before and after recurrence. |
本研究展示了5 例正常育龄女性及6 例RVVC患者阴道菌群的动态变化。对于正常育龄女性,有些女性阴道菌群随着月经周期发生周期性波动,而有些女性阴道菌群却相对稳定,提示阴道菌群对内在因素月经周期的干扰反应因人而异。多数研究亦表明阴道菌群在月经周期大多保持相对稳定,但在月经期变化较大[13-14]。Pawel等[15]对32名正常育龄妇女阴道菌群进行为期16周的研究,发现部分妇女阴道菌群相对稳定,部分妇女阴道菌群变化多异,而且菌群的变化与月经时间、菌群结构以及性生活有关,这与我们的结论相类似。本研究亦发现正常女性阴道优势菌属除了以乳酸杆菌属为优势菌属外,其他多种微生物,如Gardnerella、Prevotella、Atopobium、Sneathia等均可以为优势菌属。已有学者针对健康育龄期女性阴道微生物的优势菌属提出了“菌型”(community state type,CST)的概念[16],并且划分为5 种:CSTⅠ,CSTⅡ,CSTⅢ,CSTⅣ和CSTⅤ,其中CSTⅠ,CSTⅡ,CSTⅢ,CSTⅤ均以乳酸杆菌属为优势菌,将乳酸杆菌属细分到种,则分别以L.crispatus、格式乳酸杆菌(L.gasseri)、L.iners、L.jensenii 为优势菌种。而CSTⅣ则是以多样性菌属为主,并可分为两种亚类:CST Ⅳ-A 和CST Ⅳ-B,其中CST Ⅳ-A 菌属主要是Gardnerella,Streptococcus,Atopobium,Prevotella,Sneathia,而CSTⅣ-B是以Atopobium 为优势菌。因此,本研究中观察到的健康女性的多样化的优势菌属也是正常的。
阴道微生态平衡的破坏可能引起阴道局部免疫抑制和阴道菌群失调。本研究发现RVVC患者阴道菌群多样性降低,多数RVVC患者仍是以乳酸杆菌属为优势菌属。Jakobsson等[17]研究表明并非所有乳酸杆菌均为益生菌,如L.crispatus多为益生菌,而L.iners则多与疾病相关。本研究进一步将RVVC患者阴道乳酸杆菌细分到菌种水平,发现RVVC中占优势的乳酸酐菌是L.iners,而L.crispatus明显减少甚至缺如。有研究证实,L.crispatus、L.jensenii 等菌种可产生大量H2O2,而L.iners仅有9%菌株产生H2O2[18],而且L.iners抵抗病原体在阴道内定植的能力明显低于L.crispatus[19]。也有研究发现,L.iners可以同时存在于健康状态及菌群失调状态,但在不同状态时L.iners 会有超过10%的基因表达差异,表现为溶细胞素,粘蛋白,甘油运输及相关代谢酶的表达增加[20]。据此,我们认为RVVC患者阴道内定植的致病菌假丝酵母菌抑制阴道内其他菌群生长,而产H2O2能力较弱的L.iners更容易在此环境生长繁殖,并且在抗生素治疗后经常持续存在;大量繁殖的L.iners引起代谢终产物如短链脂肪酸的堆积,对抗乳酸作用,从而提高阴道pH 值,增加RVVC的发病风险。有学者持相同意见,认为L.iners与假丝酵母菌之间是共生关系,而不是抑制关系[21]。相反,L.crispatus有利于维持正常阴道微生物群的稳定性[19, 22]。Kwok等[23]在101例健康女性的研究中亦发现L.crispatus对阴道上皮细胞具有较强的粘附性。提示我们L.iners增多、L.crispatus减少引起乳杆菌菌种比例失调可能是参与RVVC发病的重要因素之一。
本研究还揭示了育龄女性RVVC复发前后阴道微生物的动态变化过程,提示RVVC患者的阴道菌群对内外因素(月经周期以及药物治疗)的干扰反应甚微,菌群波动性明显减弱。并且在RVVC复发前后菌群变化不大,并持续到下一次复发,提示阴道微生物系统失衡可能存在于整个RVVC发生发展阶段。Yue等[24]对400例RVVC患者和400例健康女性的阴道微生态进行了为期2年的回顾性研究,发现与健康女性相比,RVVC首次发作时的阴道菌群结构复杂;随着RVVC发展,其菌群结构逐渐趋于稳定,与本研究结果类似。另外,本研究患者复发后均予以治疗,但发作前后菌群结构变化不大,该结果与叶桂娥等[25]的研究结果一致,认为VVC患者需规范足量治疗,一旦发展成为RVVC则治愈难度增加。
本研究的不足之处是样本数较少,观察时间偏短,难以代表所有RVVC患者宏基因组特征。后续可以针对RVVC患者稳定的阴道菌群进行组学研究,寻找差异基因或蛋白,进一步研究其发病机制,实现靶向治疗。
综上所述,本研究表明RVVC患者阴道菌群结构不随月经周期发生变化,在疾病发作期和间歇期相似,并且表现为乳杆菌菌种比例失调,尤其是L.iners增多、L.crispatus减少。补充相关益生菌诱导L.crispatus产生或抑制L.iners定植,从而恢复阴道菌群比例,可能可以治愈RVVC。
| [1] | Sobel JD. Recurrent vulvovaginal candidiasis[J]. Am J Obstet Gynecol, 2016, 214 (1): 15-21. DOI: 10.1016/j.ajog.2015.06.067. |
| [2] | Foxman B, Muraglia R, Dietz JP, et al. Prevalence of recurrent vulvovaginal candidiasis in 5 European countries and the United States: results from an internet panel survey[J]. J Low Genit Tract Dis, 2013, 17 (3): 340-5. DOI: 10.1097/LGT.0b013e318273e8cf. |
| [3] | Gladiator A, Wangler N, Trautwein-Weidner K, et al. Cutting edge: IL-17-secreting innate lymphoid cells are essential for host defense against fungal infection[J]. J Immunol, 2013, 190 (2): 521-5. DOI: 10.4049/jimmunol.1202924. |
| [4] | Wojitani MD, de Aguiar LM, Baracat EC, et al. Association between mannose-binding lectin and interleukin-1 receptor antagonist gene polymorphisms and recurrent vulvovaginal candidiasis[J]. Arch Gynecol Obstet, 2012, 285 (1): 149-53. DOI: 10.1007/s00404-011-1920-z. |
| [5] | Rosa MI, Silva BR, Pires PS, et al. Weekly fluconazole therapy for recurrent vulvovaginal candidiasis: a systematic review and metaanalysis[J]. Eur J Obstet Gynecol Reprod Biol, 2013, 167 (2): 132-6. DOI: 10.1016/j.ejogrb.2012.12.001. |
| [6] | Martinez RC, Franceschini SA, Patta MC, et al. Improved treatment of vulvovaginal candidiasis with fluconazole plus probiotic Lactobacillus rhamnosus GR-1 and Lactobacillus reuteri RC-14[J]. Lett Appl Microbiol, 2009, 48 (3): 269-74. DOI: 10.1111/lam.2009.48.issue-3. |
| [7] | Zhou X, Westman R, Hickey R, et al. Vaginal microbiota of women with frequent vulvovaginal candidiasis[J]. Infect Immun, 2009, 77 (9): 4130-5. DOI: 10.1128/IAI.00436-09. |
| [8] | Zhou HW, Li DF, Tam NF, et al. BIPES, a cost-effective highthroughput method for assessing microbial diversity[J]. ISME J, 2011, 5 (4): 741-9. DOI: 10.1038/ismej.2010.160. |
| [9] | Jiang XT, Zhang H, Sheng HF, et al. Two-stage clustering (TSC): a pipeline for selecting operational taxonomic units for the highthroughput sequencing of PCR amplicons[J]. PLoS One, 2012, 7 (1): e30230. DOI: 10.1371/journal.pone.0030230. |
| [10] | Huse SM, Dethlefsen L, Huber JA, et al. Exploring microbial diversity and taxonomy using SSU rRNA hypervariable tag sequencing[J]. PLoS Genet, 2008, 4 (11): e1000255. DOI: 10.1371/journal.pgen.1000255. |
| [11] | Hamady M, Lozupone C, Knight R. Fast UniFrac: facilitating highthroughput phylogenetic analyses of microbial communities including analysis of pyrosequencing and PhyloChip data[J]. ISME J, 2010, 4 (1): 17-27. DOI: 10.1038/ismej.2009.97. |
| [12] | Caporaso JG, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nat Methods, 2010, 7 (5): 335-6. DOI: 10.1038/nmeth.f.303. |
| [13] | Brown WJ. Variations in the vaginal bacterial flora: a preliminary report[J]. Ann Intern Med, 1982, 96 (6 Pt 2): 931-4. |
| [14] | Larsen B, Galask RP. Vaginal microbial flora: composition and influences of host physiology[J]. Ann Intern Med, 1982, 96 (6 Pt 2): 926-30. |
| [15] | Gajer P, Brotman RM, Bai G, et al. Temporal dynamics of the human vaginal microbiota[J]. Sci Transl Med, 2012, 4 (132): 132ra52. |
| [16] | Ravel J, Gajer P, Abdo Z, et al. Vaginal microbiome of reproductiveage women[J]. Proc Natl Acad Sci USA, 2011, 108 (Suppl 1): 4680-7. |
| [17] | Jakobsson T, Forsum U. Lactobacillus iners: a marker of changes in the vaginal flora[J]. ? J Clin Microbiol, 2007, 45 (9): 3145. DOI: 10.1128/JCM.00558-07. |
| [18] | Antonio MA, Hawes SE, Hillier SL. The identification of vaginal Lactobacillus species and the demographic and microbiologic characteristics of women colonized by these species[J]. J Infect Dis, 1999, 180 (6): 1950-6. DOI: 10.1086/jid.1999.180.issue-6. |
| [19] | Verstraelen H, Verhelst R, Claeys G, et al. Longitudinal analysis of the vaginal microflora in pregnancy suggests that L. gasseri and/or L. iners are more conducive to the occurrence of abnormal vaginal microflora[J]. BMC Microbiol, 2009, 9 : 116. DOI: 10.1186/1471-2180-9-116. |
| [20] | Macklaim JM, Fernandes AD, Di BJM, et al. Comparative meta- RNA-seq of the vaginal microbiota and differential expression by Lactobacillus iners in health and dysbiosis[J]. Microbiome, 2013, 1 (1): 12. DOI: 10.1186/2049-2618-1-12. |
| [21] | 欧阳才颜, 刘木彪, 黄宜娥, 等. 外阴阴道假丝酵母菌病的阴道菌群结构分析[J]. 热带医学杂志, 2014, 14 (11): 1434-7. |
| [22] | Petrova MI, Lievens E, Malik S, et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health[J]. Front Physiol, 2015, 6 : 81. |
| [23] | Kwok L, Stapleton AE, Stamm WE, et al. Adherence of Lactobacillus crispatus to vaginal epithelial cells from women with or without a history of recurrent urinary tract infection[J]. J Urol, 2006, 176 (5): 2050-4. DOI: 10.1016/j.juro.2006.07.014. |
| [24] | Yue XA, Chen P, Tang Y, et al. The dynamic changes of vaginal microecosystem in patients with recurrent vulvovaginal candidiasis: a retrospective study of 800 patients[J]. Arch Gynecol Obstet, 2015, 292 (6): 1285-94. DOI: 10.1007/s00404-015-3774-2. |
| [25] | 叶桂娥, 刘木彪, 黄宜娥, 等. VVC与RVVC患者治疗前后阴道菌群的对比研究[J]. 东南国防医药, 2014, 16 (06): 600-4. |
 2017, Vol. 37
2017, Vol. 37

