2. 成都市双流区妇幼保健院, 四川 成都 610200;
3. 宁夏医科大学护理学院社区护理系, 宁夏 银川 750004
2. Chengdu Shuangliu District Maternal and Children's Healthcare Hospital, Chengdu 610200, China;
3. Department of Community Nursing, School of Nursing, Ningxia Medical University, Yinchuan 750004, China
类风湿关节炎(Rheumatoid arthritis,RA)是一种以关节滑膜炎性病变为主要特征的慢性自身免疫性疾病,主要表现为滑膜炎症及增生、自身抗体的产生、软骨及骨的破坏,严重者关节功能丧失,甚至畸形、伤残[1-2]。1977年,Trentham[3]在50%的RA患者血清中发现了抗Ⅱ型胶原(CⅡ)的自身抗体,随后成功建立了Ⅱ型胶原诱导的类风湿关节炎模型(CIA),其临床症状和病理变化与人类RA相似。虽然RA的发病机制尚未明确,但有研究表明CD4+T细胞参与RA的发生及发展[4],主要表现为Th1/Th2 平衡向Th1 倾斜,Th17/Treg 平衡向Th17 倾斜[5-6]。近年来,有学者报道视黄酸可以通过激活视黄酸受体和类视黄醇X受体,调节T细胞的分化,减少促炎因子的释放,发挥免疫调节的作用[7-9]。本课题组前期研究结果也证实,全反式视黄酸(ATRA)对CIA大鼠的炎性症状具有一定的缓解作用[10]。但是,预防性给药对RA的预防及缓解作用尚不清楚。对此,本实验于CIA诱导开始时预防性给予大鼠不同剂量的ATRA,探讨ATRA对RA的预防作用及其机制。
1 材料和方法 1.1 实验动物60只SPF级健康Wistar雌性大鼠,6~8周龄,体质量200±20 g,由成都达硕实验动物中心提供,动物合格证号为SCXK(川)2013-24 0017735。四川大学华西公共卫生学院实验动物中心SPF动物房饲养,5只/笼,饲料和饮水由实验动物中心供给,实验动物使用许可证号为SYXK(川)2011-011。
1.2 主要试剂牛CⅡ和不完全弗氏佐剂(美国Chondrex);ATRA(美国Sigma);Aladdin玉米油(上海晶纯);TNF-α、IL-10、IL-17A的ELISA试剂盒(均购于美国eBiosicence);抗解整链蛋白金属蛋白酶(ADAMTS-4)抗体(武汉博士德);抗基质金属蛋白酶(MMP-1)抗体(Abnova);抗基质金属蛋白酶(MMP-3)抗体(Abcam);抗金属蛋白酶组织抑制因子(TIMP-1)抗体(Biorbyt);超敏二步法免疫组化检测试剂盒、生物素-链霉卵白素免疫组化试剂盒和浓缩型DAB试剂盒(均购于北京中杉金桥);其它化学试剂均为国产分析纯。
1.3 主要仪器高压蒸汽灭菌器(上海申安);超净工作台(苏州安泰);手持匀浆器(德国IKA);低温冷冻离心机(美国ThermoFisher);酶标仪(美国BIO-RAD);电子天平(德国Sartorius);显微镜(德国Leica)。
1.4 实验方法 1.4.1 实验分组将Wistar大鼠随机分成空白对照组、溶剂对照组、ATRA低剂量组、ATRA中剂量组、ATRA高剂量组,每组12只。
1.4.2 关节炎模型诱导溶剂对照组和ATRA各剂量组给予胶原诱导关节炎模型,方法同前期研究报道[10]。空白对照组给予等量生理盐水,给药方式与诱导关节炎模型相同。
1.4.3 干预处理自初次免疫后第1天起,ATRA低、中、高剂量组大鼠腹腔注射给予0.05、0.5、5 mg/kg的ATRA玉米油溶液,空白对照组和溶剂对照组分别腹腔注射等体积的生理盐水和玉米油,每周3次,连续3周。
1.4.4 关节炎指数AI评分加强免疫后,采用AI评分标准进行评分,1次/3 d。实验员经统一培训后,采用双人同时独立评分,以二者均值进行统计分析。
1.4.5 组织形态学观察初次免疫后第24天,以40 mg/kg的戊巴比妥钠对大鼠进行腹麻醉,取血后处死,分离出双侧膝踝关节,甲醛固定、脱钙后石蜡包埋、切片,HE染色显微镜下观察关节的组织形态学变化。
按照Masakazu分级法(5级)[11]对关节病理损伤进行总体半定量评分,并单独对关节滑膜炎进行半定量评分[12]。评分采用双人单独评分,取均值进行统计分析。
1.4.6 ELISA法测定相关炎性因子水平按ELISA试剂盒操作说明书,测定大鼠血清中相关炎性细胞因子IL-10、IL-17A、TNF-α的表达水平。
1.4.7 炎性相关蛋白的免疫组化法检测采用SP二步法测定ADAMTS-4,PV二步法测定MMP-1、MMP-3、TIMP-1,方法同前期研究[10]。4 个指标一抗稀释倍数依次为:ADAMTS-4,1∶400;MMP-1,1∶100;MMP-3,1∶200;TIMP-1,1∶200。用Image-Pro Plus6.0图像处理软件进行染色区域光密度分析,测量平均光密度值(A)。
1.4.8 数据统计分析实验结果采用SPSS 17.0进行统计分析,统计结果均以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法,方差不齐时用Games-Howell校正,重复测量的数据采用重复测量资料的方差分析,当P<0.05认为差异有统计学意义。
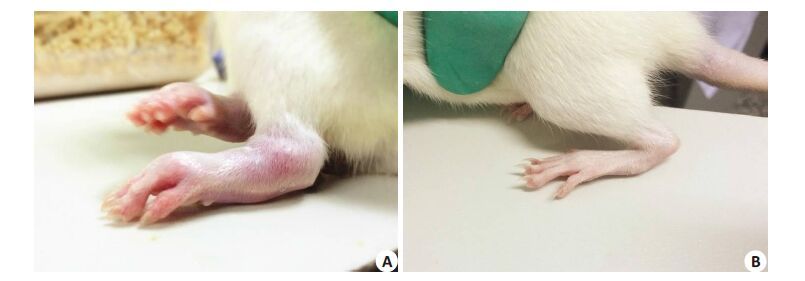
2 结果 2.1 一般情况初次免疫后第13天,大鼠开始出现关节红肿,表皮温度升高。第15天开始进入出模高峰期。与空白对照组大鼠相比,CIA大鼠体质量增长缓慢,毛发无光泽且轻微脱毛,后足体积和形态上出现明显变化(图 1),可见暴躁、攻击等行为表现。实验后期,CIA大鼠出模率为67%。
|
图 1 正常大鼠和CIA造模大鼠 Figure 1 Hindlimb joints of a normal rat (A) and a CIA rat (B). |
重复测量资料的方差分析发现:ATRA各剂量组大鼠AI值差异有统计学意义(P<0.05),且时间和剂量间存在交互作用(P<0.05)。从第15天开始,溶剂对照组的AI评分趋于平稳,ATRA各剂量组的AI评分呈上升趋势,但ATRA各剂量组出模大鼠的AI评分显著低于溶剂对照组;ATRA低、高剂量组与溶剂对照组差异有统计学意义(P<0.05,表 1)。
| 表 1 不同时间点上大鼠的关节炎指数 Table 1 Changes of arthritis index over time in different groups(n=8) |
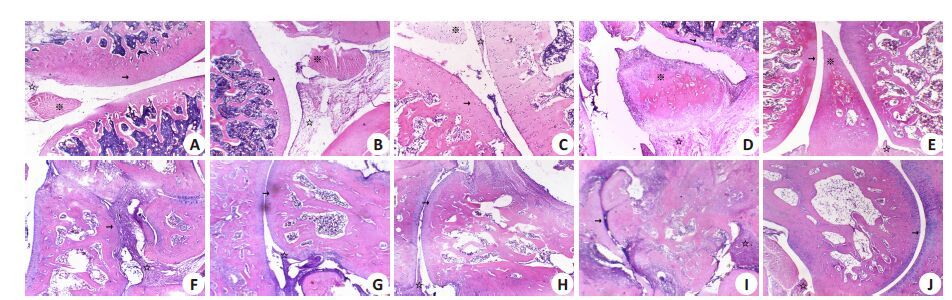
HE染色结果示空白对照组膝、踝关节结构完整,关节软骨面及关节腔间隙正常;相较于空白对照组,溶剂对照组可见纤维组织增生,滑膜组织向软骨面爬行形成血管翳,踝关节结构可见明显改变,关节软骨面大量脱落,可见骨侵蚀,大量新生骨组织形成严重的软骨破坏,关节腔间隙明显缩小;ATRA各剂量组膝关节损伤较溶剂对照组轻,关节软骨面结构正常或可见脱落,有少量血管翳,少量滑膜组织爬行形成血管翳,踝关节较膝关节受累严重,关节软骨面脱落,新生骨组织形成软骨破坏,关节腔间隙相对缩小(图 2)。
|
图 2 大鼠膝关节和踝关节HE染色 Figure 2 HE staining of the knee joints (upper panel) and ankle joints (lower panel) of the rats (Original magnification: × 40). A, F: Normal control group; B, G: Solvent control group; C, H: ATRA low-dose group; D, I: ATRA middle-dose group; E, J: ATRA high-dose group. |
与空白对照组相比,其余各组关节病理损伤评分差异有统计学意义(P<0.05);ATRA各剂量组评分低于溶剂对照组,但仅高剂量组的踝关节评分差异有统计学意义(P<0.05);其余各组评分两两比较无统计学意义(P>0.05)。与空白对照组相比,其余各组滑膜炎评分均有差异(P<0.05),但两两比较差异无统计学意义(P>0.05,表 2)。
| 表 2 对关节病理损伤的影响 Table 2 Effect of ATRA on joint pathological damage scores (n=8) |
| 表 3 对细胞因子水平的影响 Table 3 Effect of ATRA on cytokine levels (n=8) |
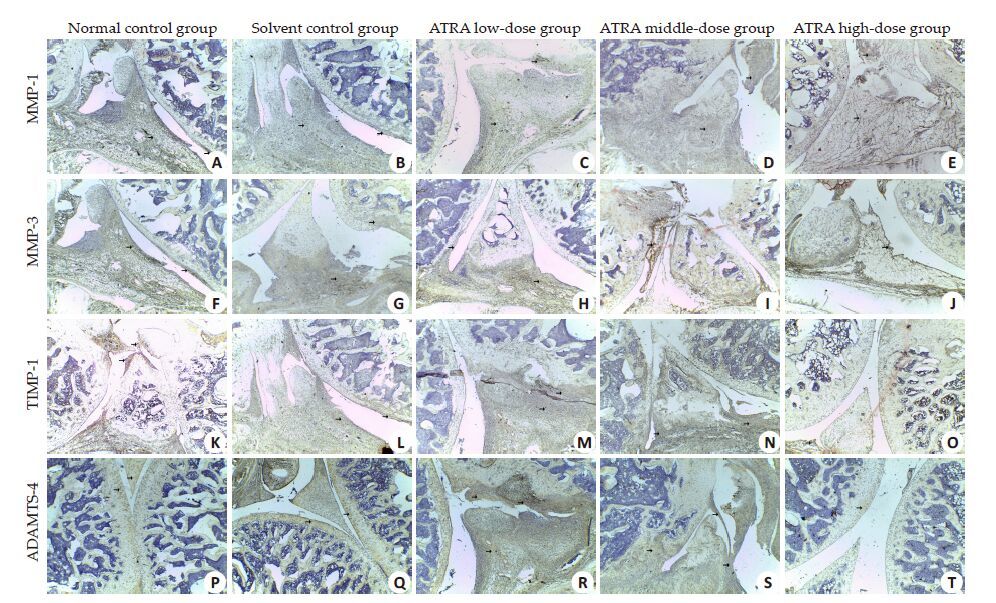
ADAMT-4、MMP-1、MMP-3和TIMP-1的免疫组化阳性反应定位在软骨细胞及滑膜组织,呈棕红色(图 3)。在膝关节上,与溶剂对照组相比,ATRA低剂量组的ADAMT-4 和ATRA中剂量组的MMP-3 表达下调(P<0.05),ATRA高剂量组的MMP-1 表达上调(P<0.05),其余各组差异无统计学意义(P>0.05);在踝关节上,仅ATRA高剂量组的MMP-3高于溶剂对照组,其余各组蛋白表达与溶剂对照组差异无统计学意义(P>0.05,表 4、5)。
|
图 3 ATRA对大鼠蛋白表达的影响 Figure 3 Effect of ATRA on protein expression in the rats (×40). |
| 表 4 对大鼠膝关节相关蛋白AOD值的影响 Table 4 Effects of ATRA on protein expressions (absorbance) of the rats' knee joint (n=8) |
| 表 5 对大鼠踝关节相关蛋白AOD值的影响 Table 5 Effects of ATRA on protein expressions (absorbance) of the rats' ankle joint (n=8) |
CIA大鼠模型是应用最为广泛的一种RA动物模型,因为它具有很多人类RA的细胞和体液免疫特征[13-14]。CIA大鼠模型通过软骨蛋白产生自身免疫反应,从而诱导关节炎的发生,产生抗CⅡ抗体。本实验通过CⅡ诱导成功建立了CIA 大鼠模型,通过在RA形成期使用ATRA对造模大鼠进行干预,探究ATRA对RA形成的预防作用及其机制。实验过程中,造模大鼠RA症状明显,多为后足,踝严重受累,前爪发病率较低,与Zhang等[15]研究结果一致。虽各组出模率相同,但ATRA各剂量组大鼠各时点的AI值均低于溶剂对照组,出模较晚,提示出模前给予ATRA对RA症状有预防性的缓解作用。
CIA模型最初的病理变化依赖于特异性T细胞的CD4+表面抗原,T细胞活化及相关细胞因子的产生是RA的重要发病机制之一[4]。研究表明,各种免疫细胞分泌的细胞因子如IL-17、IL-10、TNF-α等在RA形成过程中发挥着重要作用[16]。IL-10 是公认的免疫抑制因子,在体内的来源主要是单核巨噬细胞、Th2 细胞和Foxp3+Treg 细胞,可以抑制巨噬细胞分泌IL-23,而IL-23在Th17介导的细胞免疫中起重要作用[17]。IL-17是主要促炎效应因子,可以激活免疫淋巴T细胞和相关细胞。在动物实验中,IL-17 的相关抗体可明显缓解CIA鼠的关节炎症状,同时减轻骨组织的破坏,并且下调某些炎症因子的表达[18]。TNF-α是RA发病机制中关键的促炎因子之一,主要由Th1细胞分泌,在RA滑膜增生、软骨/骨破坏和全身炎症反应中发挥重要作用[19]。在本研究中,我们发现ATRA各剂量组IL-10的表达水平增加,IL-17A和TNF-α的表达水平减少,与溶剂对照组相比差异有统计学意义,表明预防性给予ATRA对CIA大鼠炎性症状的缓解作用可能与纠正CIA 大鼠血清Th1/Th2和Th17/Treg失衡有关。该结果与Kowk、Yuji等[20-21]的研究结果基本一致,但有效剂量不同。我们发现,不同剂量对不同炎性因子的影响是有区别的,如ATRA低、高剂量组对IL-10、TNF-α的调节作用与溶剂对照组相比差异有统计学意义,而中剂量组差异无统计学意义,对IL-17A中、高剂量组却有明显下调作用。可能是因为ATRA对某些相关炎性因子具有双向性U形作用,而非常规线性量效关系,具体原因及机制尚不明确,还需进一步研究探讨。
在类风湿关节炎中,血管翳爬行、覆盖于关节软骨面,对软骨及骨造成进行性破坏[22]。大量研究表明,ADAMTS和MMPs在RA的软骨基质降解导致骨质破坏过程中起着主要作用[23-24]。ADAMTS-4在骨关节炎中的作用已被证实[25]。在本研究中,由病理评分可以发现,在RA骨质破坏发展中,踝关节首先受累,且骨质破坏较膝关节严重。ATRA各剂量组ADAMT-4 的蛋白表达水平和溶剂对照组均明显上调,但在膝关节上,ATRA低剂量组较溶剂对照组有所下调,提示在RA骨质破坏早期,低剂量ATRA 可在一定程度上抑制ADAMTS-4 对蛋白聚糖的酶解作用。本研究结果显示,CIA大鼠MMP-3 的蛋白表达明显上调,但在膝关节,ATRA中剂量组MMP-3的蛋白表达较溶剂对照组有所下调,与前期研究结果一致[10],表明ATRA 对MMPs/TIMPs失衡有潜在的纠正作用倾向,但效果不明显。
综上所述,在胶原诱导关节炎形成期,ATRA促进IL-10 的分泌,并抑制TNF-α、IL-17A等促炎因子的分泌,可能在一定程度上纠正了Th1/Th2及Th17/Treg失衡,从而减轻CIA大鼠关节炎早期的炎症反应。
| [1] | 曾小峰, 谭爱春, 谢小平, 等. 我国类风湿关节炎疾病负担和生存质量研究的系统评价[J]. 中国循证医学杂志, 2013, 13 (3): 300-7. |
| [2] | McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis[J]. N Engl J Med, 2011, 365 (23): 2205-19. DOI: 10.1056/NEJMra1004965. |
| [3] | Trentham DE, Townes AS, Kang AH. Autoimmunity to type II collagen: an experimental model of arthritis[J]. J Exp, 1977, 146 (3): 857-66. DOI: 10.1084/jem.146.3.857. |
| [4] | Falgarone G, Semerano L, Rulle S, et al. Targeting lymphocyte activation to treat rheumatoid arthritis[J]. Joint Bone Spine, 2009, 76 (4): 327-32. DOI: 10.1016/j.jbspin.2008.12.007. |
| [5] | Zhou X, Hua X, Ding X, et al. Trichostatin differentially regulates Th1 and Th2 responses and alleviates rheumatoid arthritis in mice[J]. J Clin Immunol, 2011, 31 (3): 395-405. DOI: 10.1007/s10875-011-9508-8. |
| [6] | Mucida D, Pino-Lagos K, Kim G, et al. Retinoic acid can directly promote TGF-beta-mediated Foxp3(+ ) Treg cell conversion of naive T cells[J]. Immunity, 2009, 30 (4): 471-2. DOI: 10.1016/j.immuni.2009.03.008. |
| [7] | Pino-Lagos K, Guo Y, Noelle RJ. Retinoic acid: a key player in immunity[J]. Biofactors, 2010, 36 (6): 430-6. DOI: 10.1002/biof.v36.6. |
| [8] | Boissier MC. Cell and cytokine imbalances in rheumatoid synovitis[J]. Joint Bone Spine, 2011, 78 (3): 230-4. DOI: 10.1016/j.jbspin.2010.08.017. |
| [9] | Miyabe Y, Miyabe C, Nanki T. Could retinoids be a potential treatment for rheumatic diseases[J]. ? Rheumatol Int, 2015, 35 (1): 35-41. DOI: 10.1007/s00296-014-3067-2. |
| [10] | 谢雪健, 申雨燕, 宋杰, 等. 全反式视黄酸对CIA大鼠血清炎性细胞因子及软骨损伤相关蛋白表达的影响[J]. 四川大学学报: 医学版, 2016, 47 (4): 479-84. |
| [11] | 王岩艳. Ⅱ型胶原诱导的大鼠关节炎动物模型的研究[D] . 四川大学, 2006. |
| [12] | Roth A, Mollenhauer J, Wagner A, et al. Intra-articular injections ofhigh-molecular-weight hyaluronic acid have biphasic effects on joint inflammation and destruction in rat antigen-induced arthritis[J]. Arthritis Res Ther, 2005, 7 (3): R677-86. DOI: 10.1186/ar1725. |
| [13] | Holmdahl R, Andersson M, Goldschmidt TJ, et al. Type II Collagen Autoimmunity in Animals and Provocations Leading to Arthritis[J]. Immunol Rev, 1990, 118 : 193-232. DOI: 10.1111/imr.1990.118.issue-1. |
| [14] | 张敏娜. 类风湿关节炎的实验动物模型及其评价[J]. 实验动物科学, 2011, 28 (4): 57-9. |
| [15] | Zhang P, Han D, Tang T, et al. The destruction evaluation in different foot joints: new ideas in collagen-induced arthritis rat model[J]. Rheumatol Int, 2009, 29 (6): 607-13. DOI: 10.1007/s00296-008-0731-4. |
| [16] | Feldmann M, Brennan FM, Maini RN. Rheumatoid arthritis[J]. Cell, 1996, 85 (3): 307-10. DOI: 10.1016/S0092-8674(00)81109-5. |
| [17] | Raychaudhuri B, Fisher CJ, Farver CF, et al. Interleukin 10 (IL-10)-mediated inhibition of inflammatory cytokine production by human alveolar macrophages[J]. Cytokine, 2000, 12 (9): 1348-55. DOI: 10.1006/cyto.2000.0721. |
| [18] | Kimura A, Kishimoto T. IL-6: Regulator of Treg/Th17 balance[J]. Eur J Immunol, 2010, 40 (7): 1830-5. DOI: 10.1002/eji.201040391. |
| [19] | Yoshimatsu H, Okazaki F, Ieiri I, et al. Mechaism of the 24 hour rhythm of tumor necrosis factor-alpha formed by onset of rheumatoid arthritis[J]. Chronobiol Int, 2014, 31 (4): 564-71. DOI: 10.3109/07420528.2013.878350. |
| [20] | Kwok SK, Park MK, Cho ML, et al. Retinoic acid attenuates rheumatoid inflammation in mice[J]. J Immunol, 2012, 189 (2): 1062-71. DOI: 10.4049/jimmunol.1102706. |
| [21] | Nozaki YJ, Yamagata T, Sugiyama M, et al. Anti-inflammatory effect of all-trans-retinoic acid in inflammatory arthritis[J]. Clin Immunol, 2006, 119 (3): 272-9. DOI: 10.1016/j.clim.2005.11.012. |
| [22] | 苏金. DDR2调控MMP-13表达的分子机制及其与类风湿性关节炎关节软骨破坏关系的研究[D] . 第四军医大学, 2008. |
| [23] | Glasson SS, Askew R, Sheppard B, et al. Deletion of active ADAMTS5 prevents cartilage degradation in a murine model of osteoarthritis[J]. Nature, 2005, 434 (7033): 644-8. DOI: 10.1038/nature03369. |
| [24] | 杨文芳, 周惠琼. 蛋白聚糖异常代谢与类风湿关节炎相关性研究进展[J]. 中华临床医师杂志: 电子版, 2013, 7 (10): 4485-8. |
| [25] | Yamamoto K, Murphy G, Troeberg L. Extracellular regulation of metalloproteinases[J]. Matrix Biol, 2015, 44-46 : 255-63. DOI: 10.1016/j.matbio.2015.02.007. |
 2017, Vol. 37
2017, Vol. 37

