2. 广州医科大学第三附属医院病理科, 广东 广州 510150
2. Department of Pathology, Third Affiliated Hospital of Guangzhou Medical College, Guangzhou 510150, China
子宫内膜癌是原发于子宫内膜的上皮性恶性肿瘤,是女性生殖器3大恶性肿瘤之一。有研究表明子宫内膜癌是西方国家中最常见的妇科恶性肿瘤,每年全球每10万个女性中就有287例新病例和74例死于子宫内膜癌[1]。近年来子宫内膜癌的发病率有逐年上升并年轻化的趋势,约占女性癌症总数7%,占女性生殖道恶性肿瘤的20%~30%,已经接近甚至超过宫颈癌的发病率,据美国癌症协会报道,在美国子宫内膜癌已经成为发病率最高的女性生殖道恶性肿瘤,2011年美国新增加子宫内膜癌病例有46470例,远远高于宫颈癌和卵巢癌,其中有8120例患者死于本病[2]。由于该疾病在早期阶段会出现典型症状如绝经后异常阴道出血或伴有子宫积脓,因此子宫内膜癌经常在FIGOⅠ期就可以被诊断出来[3]。丝裂原活化蛋白激酶4(MAP2K4)是编码MAP激酶信号家族基因的成员[4-5]。丝裂原活化蛋白激酶(MAPK)通路是介导细胞反应的重要信号系统,存在于多种细胞中,该通路参与细胞生长、发育、分化、凋亡、存活等多种生理过程,其中许多激酶组分的异常活化与多种疾病密切相关[6]。MAP2K4在其激活状态下具有双重特异性,可磷酸化JNK 或p38 从而导致应激活化蛋白激酶(SAPK)途径的活化,进而发生细胞凋亡和细胞恶性转化[7-8]。MAPK信号通路是细胞外信号刺激引起细胞核反应的共同通路,是介导上皮细胞-间充质转化(EMT)的细胞内信号分子[9]。EMT是指上皮细胞在特定的情况下向间质细胞转分化的现象,其主要的特征为上皮细胞粘附分子(如E-cadherin)表达的下调,并获得间质细胞的特性(成纤维细胞样的外形、波形蛋白的重新表达)[10]。EMT在胚胎发育、慢性炎症、组织重建、癌症转移和多种纤维化疾病中发挥了重要作用,是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。目前,国内外尚无关于MAP2K4与波形蛋白的共同表达与子宫内膜癌临床病例特征的相关研究。本研究主要通过免疫组化方法检测128 例子宫内膜癌组织中MAP2K4和波形蛋白表达水平,分析它们之间的相互关系,探讨二者与子宫内膜癌侵袭、转移及临床病理特征之间的关系。
1 资料和方法 1.1 临床资料收集广州医科大学第三附属医院2003~2007年子宫内膜癌组织128例(其中FIGOⅠ期100例、FIGO Ⅱ+Ⅲ期28例),所有患者手术范围由FIGO分期决定,术后病理确诊为子宫内膜癌,术前均未行放疗或化疗。所有病例均有完整的临床、病理及随访资料,随访时间为89~108个月。128例患者中年龄<50岁者42例,≥50岁86例,年龄为51.2±9.7岁;绝经前者69例,绝经后者59例;组织学分型高分化者69例,中分化者46例,低分化者13例;无转移者111例,有淋巴结转移者17例;肌层浸润深度<1/2者91例,≥1/2者37例。
1.2 主要试剂兔抗人MAP2K4单克隆抗体购自Proteintech,兔抗人波形蛋白单克隆抗体购自Cell Signaling Technology;SP试剂盒及DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 试验方法所有标本均经4%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,烤干。采用链霉亲合素-生物素酶复合物(SP)法,所有免疫组化操作步骤严格按照试剂盒说明书进行,一抗均按1∶100稀释。利用已知阳性片作为对照,以PBS液代替一抗作为空白对照。
1.4 结果判定MAP2K4蛋白表达和波形蛋白表达均主要定位于胞浆,有时也会出现胞核着色,阳性表现为细胞浆或者核内出现棕黄色颗粒。400倍显微镜下随机观察10个视野,参考相关文献[11],按阳性细胞个数所占比例及着色强度评分,然后将所得分数相乘计算综合得分。阳性细胞比例:无阳性细胞为0 分,<0%为1 分,10%~50%为2分,>50%为3分,>75%为4分;着色强度:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。免疫组化染色结果由两位高年资病理医师通过独立双盲法读片评定。
1.5 统计分析实验数据采用SPSS 20.0软件进行分析,对免疫组化评分结果作图绘制ROC 曲线,计算曲线下面积(AUC)。MAP2K4和波形蛋白在子宫内膜癌组织中的表达、蛋白表达情况与各临床病理因素之间的关系、二者之间的相互关系均采用χ2检验、Spearman等级相关检验,MAP2K4和波形蛋白表达阳性组与阴性组生存分析采用Kaplan-Meier法,组间比较采用Log-rank检验,多因素分析采用Cox回归多因素模型,P<0.05为差异有统计学意义。
2 结果 2.1 子宫额内膜癌中MAP2K4蛋白的表达及其与临床病理参数的关系MAP2K4蛋白在子宫内膜癌组织中阳性表达率为38.3%(图 1A、图 2A)。MAP2K4蛋白的表达与子宫额内膜癌患者FIGO分期呈负相关(P=0.010),FIGOⅠ期阳性表达率为45%,Ⅱ+Ⅲ期阳性表达率为14.3%;且与淋巴结转移呈负相关(P=0.016),无淋巴结转移者阳性表达率为42.3%,有淋巴结转移者阳性表达率为11.8%;而与患者的年龄、月经情况、组织学分型、肌层浸润无明显相关关系(P>0.05,表 1)。
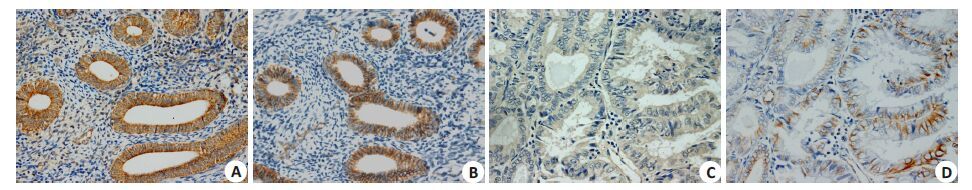
|
图 1 MAP2K4和波形蛋白在子宫内膜癌中同时阳性表达或同时阴性表达 Figure 1 Endometrial carcinoma tissues positive for both MAP2K4 and vimentin (A, B) and tissues negative for both (C, D) (Immunohistochemistry, original magnification: ×200) |
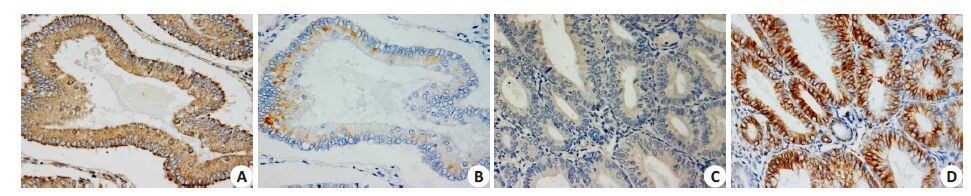
|
图 2 MAP2K4和波形蛋白在子宫内膜癌中的不同表达 Figure 2 Endometrial carcinoma tissues positive for MAP2K4 (A), negative for vimentin (B), negative for MAP2K4 (C), and positive for Vimentin (D) (Immunohistochemistry, ×200) |
| 表 1 子宫内膜癌中MAP2K4和波形蛋白的表达及其与临床病理因素的关系 Table 1 Correlation of MAP2K4 and vimentin expressions with the clinicopathological characteristics of the EC patients |
波形蛋白在子宫内膜癌组织中阳性表达率为64.8%(图 1B、图 2D)。波形蛋白的表达与子宫内膜癌患者FIGO分期呈正相关(P=0.025),FIGOⅠ期阳性表达率为59%,Ⅱ+Ⅲ期阳性表达率为85.7%;与患者组织学分型呈正相关(P=0.017),G1期阳性表达率为55.1%,G2期阳性表达率为71.7%,G3期阳性表达率为92.3%;与患者淋巴结转移呈正相关(P=0.032),无淋巴结转移者阳性表达率为61.3%,有淋巴结转移者阳性表达率为88.2%;且与患者肌层浸润深度呈正相关(P=0.044),肌层浸润深度<50%者阳性表达率为59.3%,≥50%者阳性表达率为78.4%;而与患者的年龄、月经情况无明显相关关系(P>0.05,表 1)。
2.3 子宫内膜癌中MAP2K4和波形蛋白之间的关系Spearman相关分析显示,MAP2K4和波形蛋白在子宫内膜癌中的表达呈负相关关系(r=-0.598,P<0.001,表 2)。MAP2K4和波形蛋白的共同表达与肿瘤的FIGO 分期(P=0.026)及淋巴结是否转移相关(P=0.021,表 3)。
| 表 2 子宫内膜癌中MAP2K4和波形蛋白的关系 Table 2 Correlation between MAP2K4 and vimentin expressions in EC |
| 表 3 子宫内膜癌中MAP2K4和波形蛋白的共同表达之间的关系 Table 3 Co-expression of MAP2K4 and vimentin in EC |
将子宫内膜癌患者的年龄(分为<50岁和≥50岁)、肿瘤家族史(分为无肿瘤家族史和有肿瘤家族史)、教育背景(分为大学以上和大学以下)、是否有医保(分为无和有)、职业(分为政府雇员、事业单位部队以及从这些地方退休人员和工农及无职业者)、月经史(分为绝经前和绝经后)、是否有合并症(分为无和有)、FIGO分期(分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期)、组织学分级(分为高分化、中分化、低分化)、淋巴结转移(分为无转移和有转移)、肌层浸润(分为<1/2和≥1/2)、MAP2K4蛋白表达(分为阳性表达和阴性表达)、波形蛋白表达(分为阳性表达和阴性表达)、术后放疗(分为无和有)、术后化疗(分为无和有)、术后激素治疗(分为无和有)先进行单因素分析,其中P<0.05的分别是:FIGO分期、组织学分级、淋巴结转移、肌层浸润、MAP2K4蛋白表达、波形蛋白表达和术后化疗(表 4)。然后将这些P<0.05临床病理因素带入Cox模型进行多因素分析发现:肌层浸润是影响子宫内膜癌患者预后的独立危险因素(表 4)。
| 表 4 总体生存率的单因素与多因素Cox分析 Table 4 Univariate and multivariate Cox regression analysis of the overall survival of the patients |
Kaplan-Meier生存分析显示MAP2K4蛋白阳性表达组患者的生存时间明显长于其阴性表达组患者(Log-rank=9.337,P=0.002,图 3A);波形蛋白阳性表达组患者生存时间明显短于其阴性表达组患者(Log-rank=7.243,P=0.007,图 3B)。并且,MAP2K4阳性表达/波形蛋白阴性表达患者的无病生存时间最长,而MAP2K4阴性表达/波形蛋白阳性表达患者的无病生存时间短(Log-rank=13.578,P=0.004,图 3C)。
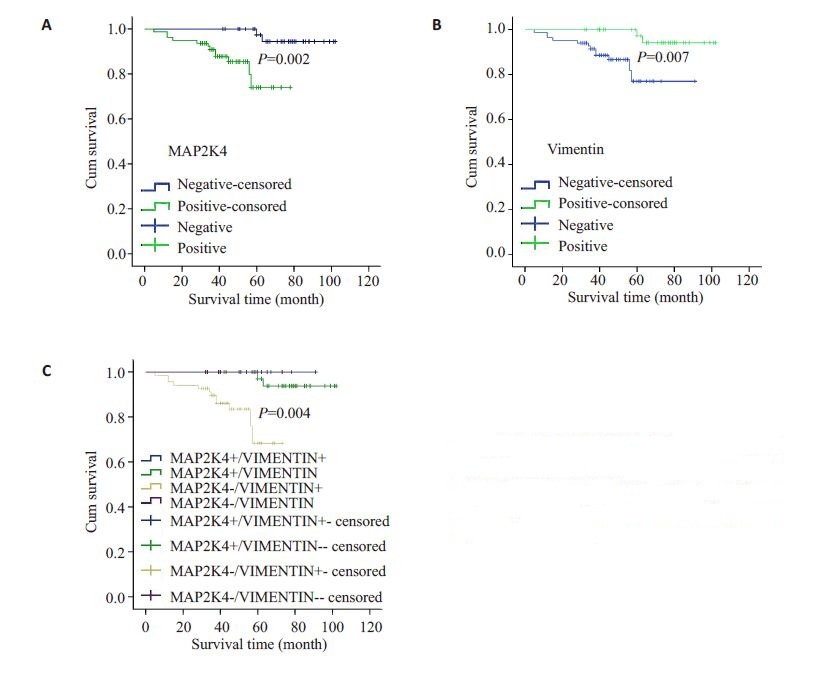
|
图 3 MAP2K4和波形蛋白不同表达组间子宫内膜癌患者的生存曲线 Figure 3 Survival curves of EC patients positive or negative for MAP2K4 (A), vimentin (B) and positive for both (C) |
MAP2K4和波形蛋白的阳性表达的敏感性和特异性经ROC曲线分析后的AUC值见表 5。MAP2K4 的AUC 值为0.913,波形蛋白的AUC 值为0.895。根据Swets[12]标准评估各个指标的诊断价值,AUC<0.5时,说明没有诊断价值,AUC 在0.5~0.7 时有较低准确性,AUC在0.7~0.9时有较高准确性,AUC在0.9以上时有准确性最高。
| 表 5 MAP2K4 和波形蛋白阳性表达的敏感性、特异性及AUC值 Table 5 Sensitivity, specificity and AUC of positive MAP2K4 and vimentin expression in EC diagnosis |
MAP2K4是MAPK信号传导途径的一员,并且通常激活两个下游目标,p38 丝裂原活化蛋白激酶(p38MAPK)和c-Jun N末端激酶(JNK)[13]。MAP2K4 位于染色体片段17p11.2,在人上皮性肿瘤中,特别是卵巢癌和乳腺癌,它能够以7%~10%的速率丢失[14-15]。因此,它最初被认为是一种肿瘤抑制基因,关于MAP2K4的抑癌作用的报道见于卵巢癌[16]、乳腺癌[14]、前列腺癌[17]、胃癌[18]、胰腺癌[19]、肺癌[20]等。但是,目前有研究表明MAP2K4对某些肿瘤也有促进作用,如皮肤癌[21]、乳腺癌[22]、前列腺癌[17]、胃癌[23]、胰腺癌[23]、喉鳞状细胞癌[24]等。本研究结果显示:MAP2K4蛋白主要定位于细胞浆,在子宫内膜癌组织中的阳性表达率为38.3%。且子宫内膜癌患者的MAP2K4蛋白的阳性表达与FIGO分期呈负相关,FIGOⅠ期、Ⅱ+Ⅲ期阳性表达率分别为45%,14.3%,差异有统计学意义(P=0.010);子宫内膜癌组织中无淋巴结转移者(42.3%)的MAP2K4蛋白阳性率远高于有淋巴结转移者(11.8%),差异有统计学意义(P=0.016);MAP2K4阳性表达的患者总体生存时间较阴性表达的患者长,差异有统计学意义(P=0.002)。表明MAP2K4对子宫内膜癌的侵袭转移起着抑制作用,MAP2K4 蛋白阳性表达对子宫内膜癌患者的预后较好,这与Xin 等[20]报道MAP2K4 在胰腺癌中的作用一致。由此来看,MAP2K4在子宫内膜癌中发挥抑癌作用,它可能成为评价子宫内膜癌发展、转移的有用指标。
波形蛋白是中间丝蛋白家族的主要成分,在正常间质细胞广泛表达并且能够维持细胞完整性并提供抵抗应力。波形蛋白在各种上皮癌中过表达,包括前列腺癌、胃肠道肿瘤、中枢神经系统肿瘤、乳腺癌、恶性黑色素瘤和肺癌等,其在癌症中过表达与加速肿瘤生长、促进侵袭和预后不良有关[25]。EMT与胚胎发育有关,在肿瘤浸润和转移过程中的作用也日益突出[26]。EMT可以使上皮细胞失去极性,使得细胞-细胞和细胞-细胞外基质的粘附减少,细胞变形并且活性提升,获得间质细胞的特性,从而加强肿瘤细胞的攻击性,以便获得远处转移的能力[26]。有研究表明,波形蛋白启动子是β链蛋白(β-catenin)/T细胞因子途径的一个靶点[28],波形蛋白还参与细胞的粘附、迁移和细胞信号传导等关键功能[29-31],波形蛋白在EMT过程中表达升高,与肿瘤的侵袭和转移的能力密切相关[32]。本研究结果显示:波形蛋白主要在细胞质中表达,呈棕褐色颗粒,阳性表达率为64.8%。子宫内膜癌组织中波形蛋白在肿瘤FIGOⅠ期、Ⅱ+Ⅲ期阳性表达率分别为59%,85.7%,差异有统计学意义(P=0.025);在患者的组织学分型G1期、G2期、G3期阳性表达率分别为55.1%、71.7%、92.3%,差异有统计学意义(P=0.017);子宫内膜癌组织中无淋巴结转移者(61.3%)的波形蛋白阳性率远低于有淋巴结转移者(88.2%),差异有统计学意义(P=0.032);肌层浸润深度<50%者阳性表达率(59.3%)远低于≥50%者阳性表达率(78.4%),差异有统计学意义(P=0.044);波形蛋白阳性表达的患者总体生存时间显著短于阴性表达的患者,差异有统计学意义(P=0.007)。这一结果与Shi等[33]在肾透明细胞癌中关于波形蛋白的表达情况的研究结果类似。本研究表明波形蛋白基因对子宫内膜癌的发展、分化、淋巴结转移、肌层浸润均起着促进作用,波形蛋白的检测有望成为评价子宫内膜癌的分期、转移及评估预后的一个有价值的指标。
目前,对MAP2K4和波形蛋白二者在子宫内膜癌中的共同表达、生存分析及与各临床病理因素之间的相互关系的研究国内外尚未见文献报道。现有的研究表明,MAP2K4对某些肿瘤既有抑制的一面,又存在促进的一面,其具体的机制还有待进一步研究。波形蛋白表达的上调作为EMT过程的一个特征表现,使得肿瘤细胞更易于侵袭和转移,然而,波形蛋白在癌症发展中的作用仍不完全清楚[25]。本研究对于128例子宫内膜癌组织中MAP2K4 和波形蛋白的表达进行了检测,Spearman 相关分析发现在子宫内膜癌组织中随着MAP2K4蛋白阳性表达率的降低,波形蛋白的阳性表达率明显升高,呈负相关(r=-0.598,P<0.001),提示MAP2K4蛋白的表达的降低或者缺失与波形蛋白的表达增高可能存在某种联系。MAP2K4和波形蛋白的共同表达与肿瘤的FIGO分期(P=0.026)及淋巴结是否转移(P=0.021)相关,而与患者的年龄、月经情况、组织学分型、肌层浸润无明显相关关系(P>0.05),表明二者的联合表达对于子宫内膜癌的侵袭转移作用比较明显。
以上研究显示,波形蛋白表达的升高作为EMT过程的一个特征性改变,可能参与了子宫内膜癌的发生、发展及侵袭转移过程,而MAP2K4蛋白表达的降低或缺失可能进一步促进了子宫内膜癌的浸润和转移。并且二者的共同表达均与肿瘤的FIGO和淋巴结转移相关,影响患者的预后。因此,早期联合检测MAP2K4和波形蛋白有助于预测子宫内膜癌患者的分期和转移,有望成为评估患者预后的重要指标。
| [1] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127 (12): 2893-917. DOI: 10.1002/ijc.v127:12. |
| [2] | Siegel R, Ward E, Brawley O, et al. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J]. CA Cancer J Clin, 2011, 61 (4): 212-36. DOI: 10.3322/caac.v61:4. |
| [3] | Morice P, Leary A, Creutzberg C, et al. Endometrial cancer[J]. Lancet, 2016, 387 (123): 1094-108. |
| [4] | Chang LF, Karin M. Mammalian MAP kinase signalling cascades[J]. Nature, 2001, 410 (6824): 37-40. DOI: 10.1038/35065000. |
| [5] | Derijard B, Raingeaud J, Barrett T, et al. Independent human MAP-kinase signal transduction pathways defined by MEK and MKK isoforms[J]. Science, 1995, 267 (5198): 682-5. DOI: 10.1126/science.7839144. |
| [6] | Qi M, Elion EA. MAP kinase pathways[J]. J Cell Sci, 2005, 18 (Pt 16): 3569-72. |
| [7] | Davis RJ. Signal transduction by the JNK group of MAP kinases[J]. Cell, 2000, 103 (2): 239-52. DOI: 10.1016/S0092-8674(00)00116-1. |
| [8] | Ip YT, Davis RJ. Signal transduction by the c-Jun N-terminal kinase (JNK) - from inflammation to development[J]. Curr Opin Cell Biol, 1998, 10 (2): 205-19. DOI: 10.1016/S0955-0674(98)80143-9. |
| [9] | 高振芹, 胡永斌, 周建华. MAPK信号通路与上皮间质转型[J]. 国际病理科学与临床杂志, 2009, 29 (4): 303-6. |
| [10] | Thiery JP, Sleeman JP. Complex networks orchestrate epithelialmesenchymal transitions[J]. Nat Rev Mol Cell Biol, 2006, 7 (2): 131-42. DOI: 10.1038/nrm1835. |
| [11] | Pecina-Slaus N. Tumor suppressor gene E-cadherin and its role in normal and malignant cells[J]. Cancer Cell Int, 2003, 3 (1): 17. DOI: 10.1186/1475-2867-3-17. |
| [12] | Swets JA. Measuring the accuracy of diagnostic system[J]. Science, 1988, 240 (4855): 1285-93. |
| [13] | Whitmarsh AJ, Davis RJ. Role of mitogen-activated protein kinase kinase 4 in cancer[J]. Oncogene, 2007, 26 (22): 3172-84. DOI: 10.1038/sj.onc.1210410. |
| [14] | Su GH, Hilgers W, Shekher MC, et al. Alterations in pancreatic, biliary, and breast carcinomas support MKK4 as a genetically targeted tumor suppressor gene[J]. Cancer Res, 1998, 58 (11): 2339-42. |
| [15] | Nakayama K, Nakayama N, Davidson B, et al. Homozygous deletion of MKK4 in ovarian serous carcinoma[J]. Cancer Biol Ther, 2006, 5 (6): 630-4. DOI: 10.4161/cbt.5.6.2675. |
| [16] | Yamada SD, Hickson JA, Hrobowski Y, et al. Mitogen-activated protein kinase 4(MKK4)Acts as a metastasis suppressor gene in human ovarian carcinoma[J]. Cancer Res, 2002, 62 (22): 6717-23. |
| [17] | Pavese JM, Ogden IM, Voll EA, et al. Mitogen-Activated protein kinase kinase 4 (MAP2K4) promotes human prostate cancer metastasis[J]. PLoS One, 2014, 9 (7): e102289. DOI: 10.1371/journal.pone.0102289. |
| [18] | Cunningham SC, Kamangar F, Kim MP, et al. Claudin-4, mitogenactivated protein kinase kinase 4, and stratifin are markers of gastric adenocarcinoma precursor lesions[J]. Cancer Epidemiol Biomarkers Prev, 2006, 15 (2): 281-7. DOI: 10.1158/1055-9965.EPI-05-0539. |
| [19] | Xin W, Yun KJ, Ricci F, et al. MAP2K4/MKK4 expression in pancreatic cancer: Genetic validation of immunohistochemistry and relationship to disease course[J]. Clin Cancer Res, 2004, 10 (24): 8516-20. DOI: 10.1158/1078-0432.CCR-04-0885. |
| [20] | Liu B, Chen D, Yang L, et al. A functional variant(-1304T>G)in the MKK4 promoter contributes to a decreased risk of lung cancer by increasing the promoter activity[J]. Carcinogenesis, 2010, 31 (8): 1405-11. DOI: 10.1093/carcin/bgq126. |
| [21] | Finegan KG, Tournier C. The Mitogen-Activated protein kinase kinase 4 has a pro-oncogenic role in skin cancer[J]. Cancer Res, 2010, 70 (14): 5797-806. DOI: 10.1158/0008-5472.CAN-09-3669. |
| [22] | Wang L, Pan Y, Dai JL. Evidence of MKK4 pro-oncogenic activity in breast and pancreatic tumors[J]. Oncogene, 2004, 23 (35): 5978-85. DOI: 10.1038/sj.onc.1207802. |
| [23] | Wu CW, Li AF, Chi CW, et al. Human gastric cancer kinaseprofile and prognostic significance of MKK4kinase[J]. Am J Pathol, 2000, 156 (6): 2007-15. DOI: 10.1016/S0002-9440(10)65073-0. |
| [24] | Huang C, Huang K, Wang C, et al. Overexpression of mitogenactivated protein kinase kinase 4 and nuclear factor-kappa B in laryngeal squamous cell carcinoma: A potential indicator for poor prognosis[J]. Oncol Rep, 2009, 22 (1): 89-95. |
| [25] | Satelli A, Li S. Vimentin in Cancer and its potential as a molecular target for cancer therapy[J]. Cell Mol Life Sci, 2011, 68 (18): 3033-46. DOI: 10.1007/s00018-011-0735-1. |
| [26] | Meng FY, Wu GJ. The rejuvenated scenario of epithelialmesenchymal transition (EMT) and cancer metastasis[J]. Cancer Metastasis Rev, 2012, 31 (3/4, SI): 455-67. |
| [27] | Moustakas A, Heldin CH. Signaling networks guiding epithelialmesenchymal transitions during embryogenesis and cancer progression[J]. Cancer Sci, 2007, 98 (10): 1512-20. DOI: 10.1111/cas.2007.98.issue-10. |
| [28] | Gilles C, Polette M, Mestdagt M, et al. Transactivation of vimentin by beta-catenin in human breast cancer cells[J]. Cancer Res, 2003, 63 (10): 2658-64. |
| [29] | Ivaska J, Pallari HM, Nevo J, et al. Novel functions of vimentin in cell adhesion, migration, and signaling[J]. Exp Cell Res, 2007, 313 (10): 2050-62. DOI: 10.1016/j.yexcr.2007.03.040. |
| [30] | Gotz M, Hartfuss E, Malatesta P. Radial glial cells asneuronal precursors: a new perspective on the correlation ofmorphology and lineage restriction in the developing cerebralcortex of mice[J]. Brain Res Bull, 2002, 57 (6): 777-88. DOI: 10.1016/S0361-9230(01)00777-8. |
| [31] | Lopez-Egido J, Cunningham J, Berg M, et al. Menin'sinteraction with glial fibrillary acidic protein and vimentin suggests a role for the intermediate filament network in regulatingmenin activity[J]. Exp Cell Res, 2002, 278 (2): 175-83. DOI: 10.1006/excr.2002.5575. |
| [32] | Perlson E, Michaelevski I, Kowalsman N, et al. Vimentin binding to phosphorylated Erk sterically hinders enzymatic dephosphorylation of the kinase[J]. J Mol Biol, 2006, 364 (5): 938-44. DOI: 10.1016/j.jmb.2006.09.056. |
| [33] | Shi ZG, Li SQ, Li ZJ, et al. Expression of vimentin and survivin in clear cell renal cell carcinoma and correlation with p53[J]. Clin Transl Oncol, 2015, 17 (1): 65-73. DOI: 10.1007/s12094-014-1199-1. |
 2017, Vol. 37
2017, Vol. 37

