2. 南方医科大学法医学院,广东 广州 510515
2. College of Forensic Science, Southern Medical University, Guangzhou 510515, China
甲基苯丙胺(Methamphetamine, METH),又称去氧麻黄碱,是一种苯丙胺类中枢兴奋剂,可导致大脑出现与阿尔茨海默病(AD)、帕金森病(PD)及肌萎缩侧索硬化(ALS)等神经退行性疾病相类似的改变[1-2],并且METH使用者患帕金森病的比率明显升高。近期研究还显示METH可以导致小鼠黑质纹状体区产生类似与Lewy小体的包涵体[3-4],METH还常被用于制作PD动物模型[5-6]。二硫键异构酶(PDI)是一种与PD发病密切相关的蛋白,也是一种具有多种功能的内质网蛋白酶,并具有分子伴侣活性,在正常、无应激或一些温和的应激的神经元中,PDI可提供防御机制,有效抑制错误折叠蛋白的聚集,稳定蛋白质的正确结构[7-8];当过度的应激,诱导生成大量的NO时,NO则可使PDI发生S亚硝基化,而失去原有的正常功能,最终导致异常蛋白聚集和神经细胞损伤或死亡[9-11]。因此,在散在的PD与AD患者的脑组织样本中,大量的NO导致PDI明显被S-亚硝基化,细胞内Lewy小体大量聚集,最终多巴胺能神经元减少或死亡。在前期实验中,我们已经证明METH可使神经元内氧化应激作用显著增强,NO的表达显著升高,而METH诱导升高的NO是否也和退行性疾病诱导升高的NO一样,导致细胞内PDI发生S-亚硝基化而其失去其保护的功能,这还不得而知,因此为了证明METH所致的氧化应激与PDI的关系,我们利用METH处理PC12细胞,并且检测PC12细胞中PDI的S亚硝基化的情况,从而为治疗METH导致的神经毒性提供重要靶点。
1 材料和方法 1.1 材料和试剂高分化的PC12细胞购自中科院上海细胞库,盐酸甲基苯丙胺购自中国药品生物制品鉴定所,DEME培养基、胎牛血清购自Gibco公司,CCK-8试剂盒购自日本同仁公司,N-硝基-L-精氨酸(L-NNA)、streptavidinagarose、购自Sigma公司,Biotion-HPDP购自pierce公司,兔抗鼠PDI多克隆抗体购自Cell signaling technology公司,PVDF膜购自Millopore公司,其余试剂为国产分析纯试剂。
1.2 实验方法 1.2.1 细胞培养及药物处理高分化的PC12细胞培养于含有10%FBS的高糖DMEM培养基中,37 ℃、5% CO2培养箱中培养,隔天换液,每2~3 d传代1次。根据实验需求将细胞种植于96孔板、6孔板、小皿爬片中,当PC12细胞培养至对数生长期,达约70%汇合时进行实验。将细胞分为2大组,每1大组中又各分为5小组。第1大组为METH组,分别用0、0.5、1、2、3 mmol/L 5种不同浓度的METH处理细胞;第2大组为METH+ L-NNA组,预先用0.1 mmol/L的L-NNA处理各组细胞30 min,再分别用0、0.5、1、2、3 mmol/L 5种不同浓度的METH处理细胞。药物处理24 h后,收集细胞,检测指标。
1.2.2 指标检测CCK-8法检测METH组细胞的存活率;Western Blotting法检测METH组和METH + L-NNA组中细胞内PDI总蛋白的表达变化,生物素转化法检测METH组和METH + L-NNA组细胞内PDI-SNO的表达变化[9],并根据PDI-SNO表达率变化情况,找出最适METH浓度,CCK-8法和HE染色法比较在此最适浓度下,对应的METH组细胞与METH+ L-NNA组细胞存活率和细胞形态学变化情况,并且以METH浓度为0时所对应的METH组和METH + L-NNA组为对照。
1.3 统计方法采用SPSS 19.0软件进行数据统计分析,实验数据以均数±标准差表示;多组数据间的比较采用单因素方差分析,两两比较采用独立样本t检验,以P < 0.05为差异有统计学意义。
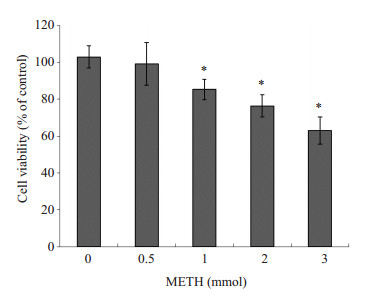
2 结果 2.1 METH组细胞存活率变化CCK-8法测得PC12细胞存活率随METH浓度升高而逐渐降低,除0.5 mmol/L METH组外(P>0.05),其他各浓度组与浓度为0的METH组相比均有统计学差异(P < 0.05),且各两组间比较,差异均有统计学意义(P < 0.05)。表明METH具有神经毒性,可使神经元细胞存活率显著降低,且降低程度与METH浓度成正相关(图 1)。
|
图 1 METH对PC12细胞存活率的影响 Figure 1 Effect of METH on the viability of PC12 cells. *P < 0.05 vs 0 mmol METH group. |
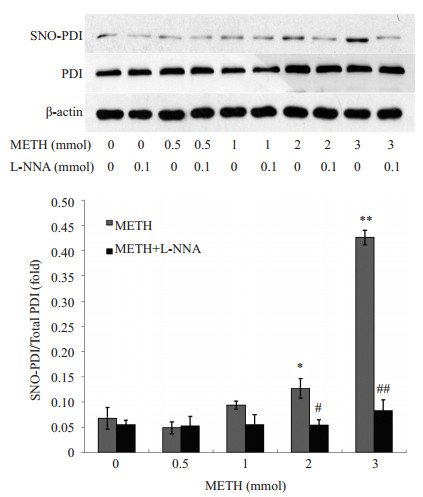
生物素转化法测得METH可导致PC12细胞内PDI发生显著S亚硝基化,且随着METH的浓度升高,PDI的S亚硝基化程度越大,当METH浓度大于2 mmol/L时,PDI的S亚硝基化,较浓度为0的METH组具有统计学差异(P < 0.05)。0.1 mmol/L的一氧化氮合酶(NOS)抑制剂L-NNA可有效抑制PDI的S亚硝基化,当METH浓度大于2 mmol/L时,L-NNA抑制PDI的S亚硝基化具有统计学意义(P < 0.05),且当METH的浓度在3 mmol/L时,L-NNA抑制PDI的S亚硝基化效果最为最显著(P < 0.01),因此在下一步的实验中,我们选用3 mmol/L的METH浓度(图 2)。
|
图 2 METH组和METH+L-NNA组细胞内PDI-SNO表达率情况 Figure 2 S-nitrosylation of PDI levels in METH and METH + L-NNA groups. *P < 0.05, **P < 0.01 vs 0 mmol METH group; #P < 0.05, ##P < 0.01 vs METH group of the same concentration. |
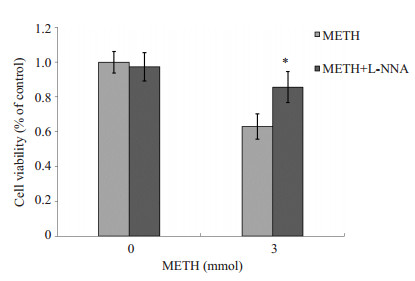
CCK-8法测得0 mmol/L的METH组与0 mmol/L的METH+L-NNA组细胞存活率没有统计学差异(P> 0.05),说明L-NNA本身对细胞无毒性作用;而3 mmol/L的METH+L-NNA组细胞存活率较3 mmol/L的METH组显著升高(P < 0.05),说明NOS抑制剂L-NNA在一定程度上可有效的抑制METH所致的细胞存活率的下降(图 3)。
|
图 3 L-NNA对METH所致的细胞存活率的影响 Figure 3 Effect of L-NNA on METH-induced reduction in cell viability (*P < 0.05 vs 3 mmol METH group). |
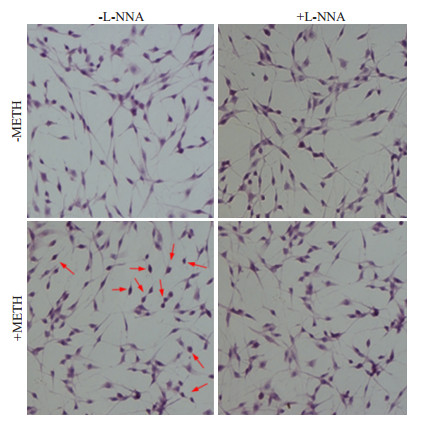
将细胞经过HE染色后,显微镜下观察各组细胞均表现为核嗜碱性、胞质嗜酸性,核蓝浆红的状态。其中0 mmol/L的METH组PC12细胞胞膜光滑边界清晰,胞体呈长梭形,有多条细长突起伸出,并相互延伸连接形成类似神经元的网状结构;0 mmol/L的METH+L-NNA组细胞形态与0 mmol/L的METH组相类似,细胞生长良好,无异常;3 mmol/L的METH组PC12细胞胞体萎缩变圆,细胞体积缩小,胞质致密、嗜酸性染色增强,胞核聚集成团。3 mmol/L的METH+L-NNA组细胞形态损伤较METH组降低,可见胞体皱缩、胞质嗜酸性、胞核聚集成团等异常变化都有所缓解。说明NOS抑制剂L-NNA可在一定程度上抑制METH所致的细胞形态的改变(图 4)。
|
图 4 L-NNA对METH所致的细胞形态学的影响 Figure 4 Effect of L-NNA on METH-induced changes in cell morphology. |
目前,国内外关于METH的神经毒性机制的研究仍处于探索阶段,其中氧化应激一直是METH所致神经毒性机制重点研究对象之一[12]。在前期实验中,我们已经发现METH可通过诱导大鼠脑组织中的氧化应激作用,使大鼠脑组织中的NO表达显著升高,且神经毒性也随之增强[13]。但诱导产生的NO所致的神经毒性机制仍不明确。为进一步对METH诱导的氧化应激作用所致的神经毒性进行深入研究,我们对神经元中与氧化应激相关的重要蛋白进行分析,通过查找文献发现,PDI不仅是内质网中含量非常高的一种蛋白,同时也是生物功能非常重要的一种蛋白,它不仅具有氧化、还原和异构等多种功能,同时还具有分子伴侣活性,能抑制错误折叠蛋白的聚集,稳定蛋白质的正确结构,在一些神经退行性疾病中起到非常重要的作用[14-17]。然而在一些神经退行性疾病中,PDI易受氧化应激作用的影响,与氧化应激产生的NO结合,形成S亚硝基化PDI,从而导致PDI的构象发生改变,其原有的氧化、还原、异构以及分子伴侣等功能受损[18-20]。早在2006年,Uehara等[21]研究发现PDI及PDI-SNO在蛋白质异常聚集相关神经系统变性疾病中具有重要地位,与AD和PD等退行性疾病的发病机制密不可分,在这些退行性疾病的脑组织样本中,PDI明显被S-亚硝基化。有文献研究表明当用小剂量的METH处理多巴胺能神经元时,PDI家族成员中的PDIA3未发生显著的S亚硝基化,且细胞也没有出现明显的毒性损伤,当抑制细胞内PDIA3的表达之后,再用小剂量的METH处理时,细胞出现明显的损伤作用,说明PDIA3在METH导致的神经毒性中确实起到一定的保护作用[22],同时也预示着PDI家族与METH所致的神经毒性密切相关。
我们利用较高剂量的METH处理PC12细胞,使得PC12细胞中的PDI与METH诱导的氧化应激产生的NO结合,形成PDI-SNO,失去其正常功能,而不再具有抵抗METH所致的神经毒性作用。细胞内NO的生物合成是通过酶促反应进行的。L-精氨酸在NOS的催化下,以及一系列的辅助因子的作用下,先生成左旋羟基精氨酸,再最后生成NO。其中NOS是NO生成的关键因素。神经系统中的NOS主要存在于神经元中,而神经元中的NOS根据其酶的来源不同、对钙离子依赖性的不同以及是否受内毒素诱导等特点分为神经元型(nNOS)、内皮型(iNOS)和诱导型(eNOS)3种不同的NOS。L-NNA是一种经典的NOS抑制剂,它是L-精氨酸的类似物,可与L-精氨酸发生竞争性抑制,是非选择性NOS抑制剂,可有效抑制神经元中这3种不同类型NOS。因此在我们实验中,当用NOS抑制剂L-NNA预处理细胞时,L-NNA可通过抑制METH所致的NOS表达,从而降低细胞内NO的表达,进而显著降低METH所致的PDI-SNO程度,那么正常功能的PDI则可保护神经元,改善METH所致的神经毒性,提高细胞的存活率。这些结果证明METH所致的神经毒性确实与PDI功能异常有关。PDI是一种抑制错误折叠蛋白聚集、稳定蛋白质正确结构的重要的酶,因此有可能METH所致的PDI的S亚硝基化,导致PDI失去原有功能,致使细胞内某些蛋白结构异常,或异常聚集,而产生神经毒性;当抑制PDI的亚硝基化时,PDI的功能未受到影响,从而可保证神经元内某些蛋白的正常结构和活性,抑制METH所致的神经毒性。而该蛋白是什么蛋白,如何发生聚集还不得而知。因此,研究工作是找出PDI所保护的蛋白,重点研究该蛋白通过何种机制保护神经元、抑制METH的神经毒性,并以此蛋白作为研究靶点,为治疗METH神经毒性提供新的理论依据。
| [1] | Garwood ER, Bekele W, McCulloch CE, et al. Amphetamine exposure is elevated in Parkinson's disease[J]. Neurotoxicology, 2006, 27 (6): 1003-6. DOI: 10.1016/j.neuro.2006.03.015. |
| [2] | Perri E, Parakh S, Atkin J. Protein DisulphideIsomerases: Emerging roles of PDI and ERp57 in the nervous system and as therapeutic targets for ALS[J]. Expert Opin Ther Targets, 2017, 21 (1): 37-49. DOI: 10.1080/14728222.2016.1254197. |
| [3] | Lazzeri G, Lenzi P, Busceti CL, et al. Mechanisms involved in the formation of dopamine-induced intracellular bodies within striatal neurons[J]. J Neurochem, 2007, 101 (5): 1414-27. DOI: 10.1111/jnc.2007.101.issue-5. |
| [4] | Fornai F, Lenzi P, Gesi M, et al. Similarities between methamphetamine toxicity and proteasome inhibition[J]. Ann N Y Acad Sci, 2004, 1025 : 162-70. DOI: 10.1196/annals.1316.021. |
| [5] | 陈欢意, 牛平. 帕金森病动物模型的研究进展[J]. 解剖科学进展, 2005, 11 (4): 362-6. |
| [6] | 陈丽, 梁思泉, 张志明. 帕金森病动物模型的研究进展[J]. 医学综述, 2011, 17 (24): 3740-2. |
| [7] | Irvine AG, Wallis AK, Sanghera N, et al. Protein disulfideisomerase interacts with a substrate protein at all stages along its folding pathway[J]. PLoS One, 2014, 9 (1): e82511. DOI: 10.1371/journal.pone.0082511. |
| [8] | Lu J, Holmgren A. The thioredoxin superfamily in oxidative protein folding[J]. Antioxid Redox Signal, 2014, 21 (3): 457-70. DOI: 10.1089/ars.2014.5849. |
| [9] | Halloran M, Parakh S, Atkin JD. The role of S-Nitrosylation and S-Glutathionylation of protein disulphideIsomerase in protein misfolding and neurodegeneration[J]. Int J Cell Biol, 2013, 2013 : 797914. |
| [10] | 钱健, 郭军. 二硫键异构酶在神经变性疾病中的调控机制[J]. 国际病理科学与临床杂志, 2009, 29 (3): 216-9. |
| [11] | Ohkubo Y, Nakato R, Uehara T. Regulation of unfolded protein response via protein S-nitrosylation[J]. Yakugaku Zasshi, 2016, 136 (6): 801-4. DOI: 10.1248/yakushi.15-00292-1. |
| [12] | 郝柳, 罗涛, 唐爱国, 等. 甲基苯丙胺滥用的研究进展[J]. 中国药物滥用防治杂志, 2015, 21 (5): 302-6. |
| [13] | 陈汉, 王慧君, 李学锋, 等. 甲基苯丙胺对大鼠脑组织中NO, SOD和MDA的影响[J]. 中国药物依赖性杂志, 2007, 16 (2): 102-4. |
| [14] | Lyles MM, Gilbert HF. Catalysis of the oxidative folding of ribonuclease A by protein disulfide isomerase: dependence of the rate on the composition of the redox buffer[J]. Biochemistry, 1991, 30 (3): 613-9. DOI: 10.1021/bi00217a004. |
| [15] | Perri ER, Thomas CJ, Parakh S, et al. The unfolded protein response and the role of protein disulfide isomerase in neurodegeneration[J]. Front Cell Dev Biol, 2016, 3 : 80. |
| [16] | SoaresMoretti AI, Martins Laurindo FR. Protein disulfide isomerases: Redox connections in and out of the endoplasmic reticulum[J]. Arch Biochem Biophys, 2016, pii : 30521-5. |
| [17] | Appenzeller-Herzog C, Ellgaard L. The human PDI family: versatility packed into a single fold[J]. Biochim Biophys Acta, 2008, 1783 (4): 535-48. DOI: 10.1016/j.bbamcr.2007.11.010. |
| [18] | Conway ME, Harris M. S-nitrosylation of the thioredoxin-like domains of protein disulfide isomerase and its role in neurodegenerative conditions[J]. Front Chem, 2015, 3 : 27. |
| [19] | 黄子芮, 潘黎明, 盛梦婷, 等. 人类蛋白质二硫键异构酶家族研究进展[J]. 现代医药卫生, 2016, 32 (2): 206-8. |
| [20] | Okada K, Fukui M, Zhu BT. Protein disulfide isomerase mediates glutathione depletion-induced cytotoxicity[J]. Biochem Biophys Res Commun, 2016, 477 (3): 495-502. DOI: 10.1016/j.bbrc.2016.06.066. |
| [21] | Uehara T, Nakamura T, Yao D, et al. S-nitrosylated proteindisulphideisomerase links protein misfolding to neurodegeneration[J]. Nature, 2006, 441 (7092): 513-7. DOI: 10.1038/nature04782. |
| [22] | Pendyala G, Ninemire C, Fox HS. Protective role for the disulfide isomerase PDIA3 in methamphetamine neurotoxicity[J]. PLoS One, 2012, 7 (6): e38909. DOI: 10.1371/journal.pone.0038909. |
 2017, Vol. 37
2017, Vol. 37

