2. 江西省妇幼保健院,江西 南昌 330006;
3. 江西省药物研究所,江西 南昌330012
2. Maternal and Children's Health Hospital of Jiangxi Province, Nanchang 330006, China;
3. Drug Research Institute of Jiangxi Province, Nanchang 330012, China
随着气候的变暖,高温天气变得越来越常见。高温可引起人体生理和心理上的不适,甚至引发中暑。高温对胚胎生长发育的影响也逐步引起了人们的重视[1-2]。我们在前期的研究中发现炎热季节胎儿宫内生长受限及围生儿并发症的发病率明显高于寒冷季节和过渡季节[3]。但孕期高温暴露对子代宫内生长发育的确切影响及机制目前尚不明确。
胎盘作为孕期母体与胎儿物质交换的桥梁,其结构、功能的变化与胚胎发育密切相关。HSP70是一种非特异性细胞保护蛋白,可以在许多不利的情况下被刺激,其生理作用就是保护细胞[4]。有研究发现,在子痫前期患者胎盘组织细胞内HSP70及相应抗体的表达明显升高[5]。研究者认为:在上述情况中,HSP70通过抑制细胞凋亡从而使细胞避免或减轻伤害性刺激对其造成的损伤。但该推论目前还存在一定的争议[6]。本研究通过观察孕中期热暴露对大鼠胎盘和子代宫内生长发育、胎盘组织热休克蛋白70(heat shock protein 70, HSP70)及Bax、Bcl-2等凋亡相关蛋白表达的变化,探索孕中期热暴露对胚胎生长发育的影响,并摸索HSP70在其中可能的参与机制。
1 材料和方法 1.1 材料SPF级SD大鼠36只,其中雌性24只,雄性12只,体质量200~250 g,购于湖南斯莱克景达实验动物有限公司,置于室内温度23±1 ℃、相对湿度55%~70%的环境中饲养,适应性饲养7 d;人工气候培养箱,购于上海慧泰仪器制造有限公司;兔抗大鼠HSP70、Bax、Bcl-2抗体、鼠抗大鼠HSP70、Bax、Bcl-2抗体、兔抗大鼠β-actin抗体均购于美国Proteintech公司。
1.2 方法将36只大鼠随机分为2组,每组18只,其中雌性12只,雄性6只,雌:雄2:1合笼饲养。按照SD大鼠孕期为3周的推算,发现阴栓当日为妊娠第1天,观察期设定为妊娠第21天。对照组:孕期全程在23±1 ℃、相对湿度55%~70%的环境中饲养;热暴露组:大鼠受孕后继续在23±1 ℃的环境中正常饲养,受孕第8天上午移置35±1 ℃的人工气候箱中饲养,妊娠第14天上午移回至23±1 ℃的环境中饲养,孕期全程相对湿度保持在55%~70%。在妊娠第1、14、21天测量并记录孕鼠的体质量。在妊娠第21天,两组所有孕鼠用0.3%戊巴比妥麻醉后行剖腹取胎,检测存活仔鼠的数量、体质量、身长、尾长、外观有无畸形、胎盘质量及死胎数。胎盘组织称重后立即放置液氮保存。
采用Western blotting方法检测24只母鼠胎盘组织(取胎盘与子宫剥离面滋养细胞丰富组织)中HSP70、Bax、Bcl-2的蛋白表达量。经过蛋白提取、浓度测定、蛋白变性、蛋白电泳分离及转膜后进行免疫印迹,经过封闭、加抗体、洗膜后,用增强化学发光剂(ECL)进行发光,然后曝光显影,将显影所示条带放入Alpha ImagerTM2200图像分析处理系统,利用Alpha Ease4.0软件,电脑直接扫描测定显影条带积分光密度值(350 nm),条带的积分光密度值(IDV)即表示蛋白的表达量,并计算每份样本中目的蛋白的相对表达量(目的蛋白/β-actin)及Bax蛋白与Bcl-2蛋白的比值(Bax/Bcl-2)。
1.3 统计学方法采用SPSS13.0软件进行统计学分析,计量资料采用均数±标准差表示,组间比较采用成组设计t检验;死胎/总胎数的计较采用四格表资料的χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 母鼠一般情况及体质量变化两组均有11只雌鼠参与交配且发现阴栓,但对照组有3只雌鼠剖腹未发现胎鼠,目前尚不能确定这些大鼠是由于受孕未成功还是怀孕后流产导致。两组大鼠妊娠第1天与第14天体质量的组间比较差异均无统计学意义(P>0.05);但妊娠第21天体质量及孕期体质量增加值的组间比较,对照组均大于热暴露组,且差异均有统计学意义(均P < 0.05);两组大鼠胎死率(死胎数/总胎数)的比较差异无统计学意义(均P>0.05,表 1)。
| 表 1 两组孕鼠体质量变化及怀孕状况的比较 Table 1 Changes of body weight and pregnancy outcomes in the two groups of rats |
两组孕鼠孕21 d时活胎数的比较差异无统计学意义(P>0.05);对照组仔鼠的体质量、身长、尾长均大于热暴露组仔鼠,且差异均有统计学意义(均P < 0.05);对照组的胎盘质量稍大于热暴露组,但比较差异无统计学意义(P>0.05);两组所有活胎仔鼠外观均未见明显的器官残缺或畸形(表 2)。
| 表 2 两组仔鼠生长发育与胎盘质量的比较 Table 2 Comparison of fetal development and placental weight between the two groups |
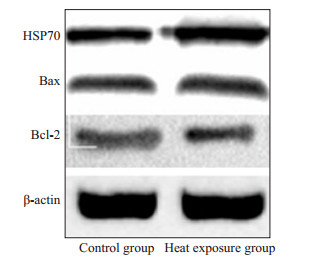
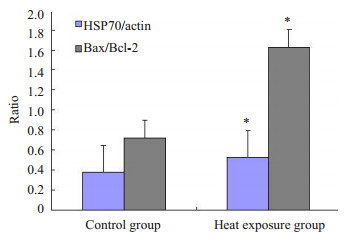
与对照组比较,热暴露组的HSP70和Bax蛋白表达水平(HSP70/actin)明显升高,且差异均有统计学意义(P < 0.05);热暴露组胎盘Bcl-2蛋白表达低于对照组,差异有统计学意义(P < 0.05);热暴露组Bax/Bcl-2比值明显高于对照组,差异有统计学意义(P < 0.05,表 3、图 1、2)。
| 表 3 两组胎盘组织HSP70、Bax、Bcl-2蛋白表达的比较 Table 3 Comparison of expressions of HSP70, Bax and Bcl-2 in placental tissues |
|
图 1 Western blotting检测胎盘组织HSP70、Bax、Bcl-2表达 Figure 1 HSP70, Bax and Bcl-2 expression in the placental tissues detected by Western blotting. |
|
图 2 胎盘组织HSP70、Bax、Bcl-2表达的t检验分析 Figure 2 Quantitative analysis of HSP70, Bax and Bcl-2 expressions in the placental tissues. *P < 0.05 vs control group by t-test. |
近年来,高温对胚胎宫内生长发育的影响越来越引起人们的重视。在前期的研究中我们发现:炎热季节胎儿宫内生长受限及围生儿并发症的发病率明显高于寒冷季节和过渡季节。一些研究也证实,孕早期胚胎遭遇母体高热或高温环境可引起胚胎发育畸形的发生,甚至可以使胚胎死亡率明显增加[7-8]。但胚胎对热应激的敏感性具有发育阶段性差异[9]。此前,大多数研究都是选择孕早期作为热暴露的时间窗口[10, 12]。
孕中期(大鼠妊娠8.5~13 d)是胚胎器官形成的关键时期[13]。因此,本实验选择以妊娠第8~13天对孕鼠进行热暴露。结果显示,与对照组相比较,实验组孕鼠热暴露后体质量增加明显放缓,仔鼠在宫内的生长发育也受到明显影响(仔鼠的体质量、身长、尾长均小于对照组,且差异均有统计学意义)。这可能与高温引起孕鼠食欲减退、进食减少、精神萎靡有关。另外,高温环境可以引起外周血管张力下降,进而引起子宫血流减少,也是其导致胎儿生长发育障碍的重要原因[8]。本研究中两组孕鼠的胎死率并无明显差异,且所有仔鼠并未发现有明显的肢体残缺或外观畸形。这与Chen等[13]的研究结果并不完全一致,这可能与本研究的热暴露温度(35±1 ℃)相对他们的(39 ℃)较低有关。
胎盘是孕期母体与胎儿物质与气体交换的桥梁,其结构、功能变化与胚胎发育乃至远期预后密切相关。Iyengar等[14]认为孕期胎盘结构的变化是分析环境污染对胚胎毒性的良好评价指标。有研究表明,孕鼠暴露于高温环境时,胎盘会出现基膜增厚,淋巴细胞浸润,肥大细胞增多,糖原细胞退化[15]。本研究中,虽然两组仔鼠的胎盘质量没有显著差异,但热暴露组胎盘组织Bax/Bcl-2比值明显升高。热暴露组仔鼠胎盘质量的相对增加可能是机体为应对高温环境下母体营养摄入下降、代谢率升高,维持母体-胎儿营养物质交换最大化的代偿性增生所致[16]。陈慧萍等[17]通过观察比较100例FGR胎儿和30例正常胎儿胎盘组织细胞的凋亡与增殖,发现FGR患者胎盘合体滋养细胞及蜕膜细胞凋亡较正常晚孕明显增多,提示胎盘组织细胞凋亡活跃可能是引起FGR发生、发展的重要病理过程。细胞凋亡是由基因控制的序化的主动死亡过程。Bcl-2是一种抑制细胞凋亡的基因,Bax则促进细胞凋亡,细胞内Bax和Bcl-2的比值是反应组织细胞凋亡的敏感指标[18]。本研究中,热暴露组胎盘组织Bax/Bcl-2比值明显升高,这说明热暴露组胎盘组织细胞凋亡更为活跃。这也提示我们,热暴露诱发胎盘组织细胞凋亡增加可能是孕中期热暴露影响子代宫内生长发育的机制之一。
HSP70是一种非特异性细胞保护蛋白,可以在许多不利的情况下被刺激,其生理作用就是保护细胞。研究证明,HSP70可以在一定程度上保护外界不良刺激引起的细胞损伤[19]。胎盘又是母体与胎儿进行物质与气体交换的场所。因此,观察胎盘组织HSP70表达的变化,可能对研究孕期不良应激对胚胎发育的影响有重要意义。本研究中,热暴露组孕鼠胎盘组织的HSP70表达明显高于对照组。Mishra等[20]在研究中证实,高温环境可以诱导细胞内热休克蛋白的表达,热休克蛋白家族作为主要的耐热介质,能阻止高温引起的细胞破坏并有助于损伤的修复。Chaiworapongsa等[21]则认为妊娠晚期细胞内HSP70的表达升高可能与随后的分娩过程的开始密切相关。本研究中热暴露组大鼠胎盘组织细胞内HSP70的高表达是否参与了高温环境下细胞应激损伤的保护,还是单纯只是为了应对妊娠足月时的分娩过程?还有待进一步的探索。
本研究的不足之处:(1)本研究只是选择了模拟夏季高温气候的35 ℃进行热暴露,缺乏对热暴露的温度的详细划分,因此缺乏对热暴露引发胚胎发育严重受损或畸形的温度阈值的探索;(2)本研究只是对仔鼠的体质量、身长、尾长等发育状况进行了初步检测,没有对仔鼠主要器官的发育状况进行解剖和分析。孕中期35 ℃热暴露是否会对子代大鼠的大脑、肝脏、肾脏、肺等主要器官的发育产生不利影响?还有待我们进一步的研究。
| [1] | Chambers D. Risks of hyperthermia associated with hot tub or spa use by pregnant women[J]. Birth Defects Res A Clin Mol Teratol, 2006, 76 (8): 569-73. DOI: 10.1002/(ISSN)1542-0760. |
| [2] | Aroyo A, Yavin S, Arav A, et al. Maternal hyperthermia disrupts developmental competence of follicle-enclosed oocytes: In vivo and ex vivo studies in mice[J]. Theriogenology, 2007, 67 (5): 1013-21. DOI: 10.1016/j.theriogenology.2006.12.001. |
| [3] | 黄淑晖, 刘淮, 戴龙芳, 等. 江西南昌地区季节性气候变化与妊娠期高血压疾病发病规律相关性研究[J]. 中国妇幼保健, 2014, 29 (9): 1324-7. |
| [4] | Tanaka KI, Mizushima T. Protective role of HSF1 and Hsp70 against gastrointestinal diseases[J]. Int J Hyperthermia, 2009, 25 (8): 668-76. DOI: 10.3109/02656730903213366. |
| [5] | Prasad P, Djanaguiraman M, Perumal R, et al. Impact of high temperature stress on floret fertility and individual grain weight of grain sorghum: sensitive stages and thresholds for temperature and duration[J]. Front Plant Sci, 2015, 6 : 820. |
| [6] | Molvarec A, Tamasi L, Losonczy G, et al. Circulating heat shock protein 70(HSPA1A) in normal and pathological pregnancies[J]. Cell Stress Chaperones, 2010, 15 (3): 237-47. DOI: 10.1007/s12192-009-0146-5. |
| [7] | Aoyama K, Seaward PG, Lapinsky SE. Fetal outcome in the critically ill pregnant Woman[J]. Crit Care, 2014, 18 (3): 307. DOI: 10.1186/cc13895. |
| [8] | 唱斗, 刘莉扬, 王淑玲, 等. 器官形成期高温暴露对大鼠胚胎生长发育的影响[J]. 环境与健康杂志, 2010, 27 (10): 883-5. |
| [9] | Rivera M, Hansen J. Development of cultured bovine embryos after exposure to high temperatures in the physiological range[J]. Reproduction, 2001, 121 (1): 107-15. DOI: 10.1530/rep.0.1210107. |
| [10] | Pei LJ, Zhu HP, Ye RW, et al. Interaction between the SLC19A1 Gene and Maternal First Trimester Fever on Offspring Neural Tube Defects[J]. Birth Defects Res A Clin Mol Teratol, 2015, 103 (1): 3-11. DOI: 10.1002/bdra.v103.1. |
| [11] | Dreier JW, Andersen AM, Berg-Beckhoff G. Systematic review and meta-analyses: fever in pregnancy and health impacts in the offspring[J]. Pediatrics, 2014, 133 (3): e674-88. DOI: 10.1542/peds.2013-3205. |
| [12] | Eroglu B, Min JN, Zhang Y, et al. An essential role for heat shock transcription factor binding protein 1(HSBP1) during early embryonic development[J]. Dev Biol, 2014, 386 (2): 448-60. DOI: 10.1016/j.ydbio.2013.12.038. |
| [13] | Chen H, Liu Z, Zhou Z, et al. The regulatory effect of memantine on expression and synthesis of heat shock protein 70 gene in neonatal rat models with cerebral hypoxic ischemia[J]. Chin Med J (Engl), 2003, 116 (4): 558-64. |
| [14] | Iyengar V, Rapp A. Human placenta as a 'dual' biomarker for monitoring fetal and maternal environment with special reference to potentially toxic trace elements.Part 3: toxic trace elements in placenta and placenta as a biomarker for these elements[J]. Sci Total Environ, 2001, 280 (1/3): 221-38. |
| [15] | Padmanabhan R, Al-Menhali NM, Ahmed I, et al. Histological, histochemical and electron microscopic changes of the placenta induced by maternal exposure to hyperthermia in the rat[J]. Int J Hyperthermia, 2005, 21 (1): 29-44. DOI: 10.1080/02656730410001716614. |
| [16] | Saito FH, Damasceno DC, Dallaqua B, et al. Heat shock protein production and immunity and altered fetal development in diabetic pregnant rats[J]. Cell Stress Chaperones, 2013, 18 (1): 25-33. DOI: 10.1007/s12192-012-0353-3. |
| [17] | 陈慧萍, 张茂娜, 李新敏, 等. 胎儿生长受限胎盘绒毛的凋亡与增殖及微血管密度的相关性[J]. 中国妇幼保健, 2015, 30 (36): 6596-8. |
| [18] | Mo J, Marshall B, Covar J, et al. Role of Bax in death of uninfected retinal cells during murine cytomegalovirus retinitis[J]. Invest Ophthalmol Vis Sci, 2014, 55 (11): 7137-46. DOI: 10.1167/iovs.14-15404. |
| [19] | Chauhan SS, Celi P, Fahri FT, et al. Dietary antioxidants at supranutritional doses modulate skeletal muscle heat shock protein and inflammatory gene expression in sheep exposed to heat stress[J]. J Anim Sci, 2014, 92 (11): 4897-908. DOI: 10.2527/jas.2014-8047. |
| [20] | Mishra A, Hooda OK, Singh G, et al. Influence of induced heat stress on HSP70 in Buffalo lymphocytes[J]. J Anim Physiol Anim Nutr (Berl), 2011, 95 (4): 540-4. DOI: 10.1111/jpn.2011.95.issue-4. |
| [21] | Chaiworapongsa T, Erez O, Kusanovic JP, et al. Amniotic fluid heat shock protein 70 concentration in histologic chorioamnionitis, term and preterm parturition[J]. J Matern Fetal Neonatal Med, 2008, 21 (7): 449-61. DOI: 10.1080/14767050802054550. |
 2017, Vol. 37
2017, Vol. 37

