骨组织工程的目标是找一个更好的方案解决大段骨缺损、骨延迟愈合或不愈合的难题。从骨膜组织中可提取到的细胞并被广大学者习惯称之为骨膜来源干细胞(periosteum derived stem cell, PDSC),已经被证实表达间充质干细胞标记,并具有向成骨、成软骨、成脂分化的潜能[1-3]。种子细胞、支架材料、细胞因子是骨组织工程的三要素。自1991年Nakahara首次将PDSC应用于骨组织工程[4],引起了广大学者的关注。自此有很多研究小组采用各种生物材料搭载PDSC进行动物体内骨缺损修复实验[5-8]。Van等[3]发现PDSC能通过旁分泌VEGF促进内皮细胞增殖与存活并引导血管浸润。Eyckmans发现骨形态发生蛋白-2(BMP)和Wnt信号在PDSC搭载CaP支架进行动物异位成骨起着至关重要的作用[9]。然而基于种子细胞的组织工程中仍然面临一个关键问题,即在体外扩增过程中种子细胞的成骨能力逐步下降,这可能与成骨祖细胞干性下降有关[10],而在细胞移植过程中通过模拟内环境提供关键性因子有望解决这个难题[11]。骨折的自然愈合早期,成纤维细胞生长因子-2(FGF-2)显著增加,但在随后的骨生成阶段低表达[12]。而BMP-2则在成骨分化阶段大量表达。另外,有研究发现利用FGF-2体外预刺激后的PDSC,可提高其在体内外的成骨分化能力,并且促进随后的BMP-2表达[13-14]。故我们认为,FGF-2/BMP-2序贯释放的支架材料搭载PDSC有望成为骨损伤修复的新策略。本研究制备内包BMP-2且外粘附FGF-2的聚乳酸-聚乙二醇-聚乳酸(PELA)微囊支架使其达到序贯释放的目的,并观察该材料对SD大鼠PDSC的成骨分化能力影响。
1 材料和方法 1.1 PDSC的分离、培养取约4周龄的SD雄性大鼠,由南方医科大学动物实验中心提供(合格证号: 44002100009903),腹腔过量注射戊巴比妥钠麻醉致死。消毒双下肢皮肤,无菌条件下小心剔除肌肉、筋膜等结缔组织,暴露骨膜并用手术刀、眼科镊分离得到骨膜。按以往的方法[15],用含1%青链霉素双抗的PBS浸泡冲洗,眼科剪剪碎至约2 mm,在0.2% Ⅱ型胶原酶中消化4 h,离心重悬细胞,加入适量10% FBS完全培养基,置于5% CO2孵箱内培养。每隔2 d进行换液。原代培养当细胞达到约80%融合时进行1:2传代。
1.2 PDSC的流式细胞学检测取P3代的PDSC用PBS重悬,调整密度约为1×106/mL后,取200 μL细胞悬液分装各管,加入抗大鼠CD29-FITC,CD44-FITC,CD45-FITC,CD90-PE(BD Pharmingen)混匀,避光孵育30 min。以小鼠IgG1-PE和IgG1-FITC(BD Pharmingen)做为同型对照。孵育完成后,用PBS清洗2次,1000 r/min离心5 min,弃上清,加200 μL PBS重悬,用流式细胞仪进行检测(BD FACSVerse),并用BD FACSuit软件进行数据分析。
1.3 PDSC细胞骨架免疫荧光及成骨、成软骨、成脂诱导分化实验取P3代细胞,用FITC-鬼笔环肽(上海翊圣)按照说明书进行细胞骨架免疫荧光实验。
用含10-8 mol/L地塞米松,10 mmol/L β-甘油磷酸钠,50 μmol/L抗坏血酸,10% FBS的L-DMEM进行成骨诱导,3周后进行茜素红染色。并做细胞爬片进行骨钙蛋白(OCN)免疫荧光染色。
用含10-7 mol/L地塞米松,50 μmol/L抗坏血酸,10 ng/ml TGF-β,5 mmol/L丙酮酸钠,40 μg/mL脯氨酸,1%胰岛素,10% FBS的L-DMEM进行成软骨诱导,3周后进行甲苯胺蓝染色。并在15 mL离心管中进行三维模式软骨球的诱导,3周后脱水、包埋,切片进行阿利新蓝染色。
用含0.5 mmol/L异丁基甲基黄嘌呤,10 μg/mL胰岛素,1 μmol/L地塞米松,2 mmol/L谷氨酰胺,100 μmol/L吲哚美辛,10% FBS的L-DMEM进行成脂诱导,3周后进行油红O染色。
1.4 PELA微囊支架制备通过复乳溶剂挥发法(W/O/W)制备内包封BMP-2且外粘附FGF-2的PELA微囊。根据本课题组以往研究结果选用优化的参数[16]。简述如下:取3 μg BMP-2溶于200 μL蒸馏水,将其与溶有280 mg PELA的4 mL二氯甲烷混合,震荡混匀5 min制成初乳液。加到40 mL 0.8%的聚乙烯醇(PVA)溶液制成复乳,再以800 r/min室温搅拌40 min,充分挥发有机溶剂,再离心洗涤3次后收集微囊,将溶有3 μg FGF-2的2 mL PBS与收集到的微囊混合并搅拌10 min,放入-80℃急冻成冰,负压冷冻干燥24 h。取50 mg干燥微囊用二氯甲烷熏蒸法熏蒸10 min,空气中干燥10 min。进行扫描电镜观察(HITACHI S-3000N)。
用TRITC和FITC标记的鬼笔环肽(上海翊圣)分别代替BMP-2及FGF-2,制备内包封TRITC-鬼笔环肽且外粘附FITC-鬼笔环肽的进行模拟实验,并在荧光显微镜下观察。
1.5 FGF-2/PELA/BMP-2微囊支架体外释放检测将FGF-2/PELA/BMP-2支架材料进行体外缓释的研究。按我们以往方法,将10 mg支架材料放入盛有1 mL PBS的EP管中,置于37 ℃恒温箱内。在固定的时间点(1、2、4、8、12、16、21 d)取出样品,先将EP管在800 r/min下离心30 min,吸出缓释液,并储存于-20 ℃冰箱,至检测时解冻测其因子的浓度。加入1 mL新的PBS至EP管中放回恒温箱,待下1次测量。缓释液中BMP-2和FGF-2的浓度通过BMP-2和FGF-2 ELISA试剂盒测定(根据说明书操作)。每个样本设六个重复样以减少误差,每组结果用均数±标准差表示。
1.6 支架浸提液促进PDSC成骨分化实验提前制作FGF-2/PELA/BMP-2、PELA/BMP-2、FGF-2/PELA、PELA 4组材料。将每组30 mg材料浸泡在装有1 mL 10% FBS的EP管中,放置在37 ℃的恒温箱中。每2 d取出EP管,200 r/min离心5 min,收集上清液并储存在-20 ℃冰箱中直到实验时解冻。再加入1 mL新鲜10% FBS继续放入恒温箱。将PDC以5×104/cm2密度接种于48孔板中,每2 d换液,并同时加入对应的支架材料浸泡液100 μL。分别于培养1周和2周后检测各实验组细胞的碱性磷酸酶(AKP)活性。具体按照试剂盒说明书(南京建成碱性磷酸酶试剂盒)操作,用酶标仪检测样品520 nm波长处吸光度值以确定AKP的活性。每个样品设6个重复样以减少误差。
将PDSC以5×104/cm2密度接种于6孔板中,按上述制作四组材料浸提液,分别于培养7 d、14 d和21 d后进行qRT-PCR,检测RunX-2,OCN等成骨基因表达。每组3个样,设3个复孔。以管家基因GAPDH对比得出ΔCt值,采用2-ΔΔCt进行数据分析。
1.7 统计学分析应用SPSS 20.0统计软件进行数据分析,各组数值以均数±标准差表示,组间比较用单因素方差分析(one-way ANOVA),若方差齐用LSD检验、方差不齐则用Dunnett T3检验作两两比较。设P值 < 0.05为差异具有统计学意义。
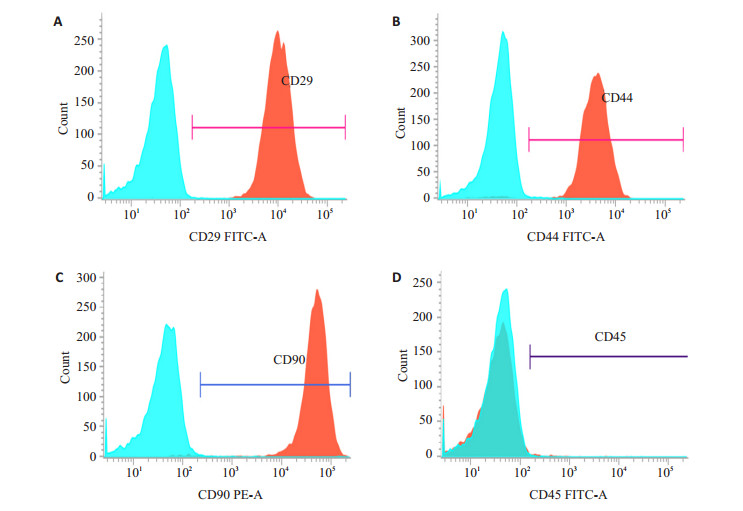
2 结果 2.1 PDSC原代培养及流式鉴定结果:取P3代细胞流式结果如(图 1)显示:阳性标记物CD29、CD44、CD90阳性率分别为99.89%、98.07%、99.07%,阴性标记物CD45阳性率为0.91%,故可认为本实验方法所提取的为骨膜来源干细胞且纯度较高。
|
图 1 流式细胞学检测结果 Figure 1 Results of flow cytometry. Positive markers: CD29 (A), CD44 (B), CD90 (C); Negative marker: CD45 (D). |
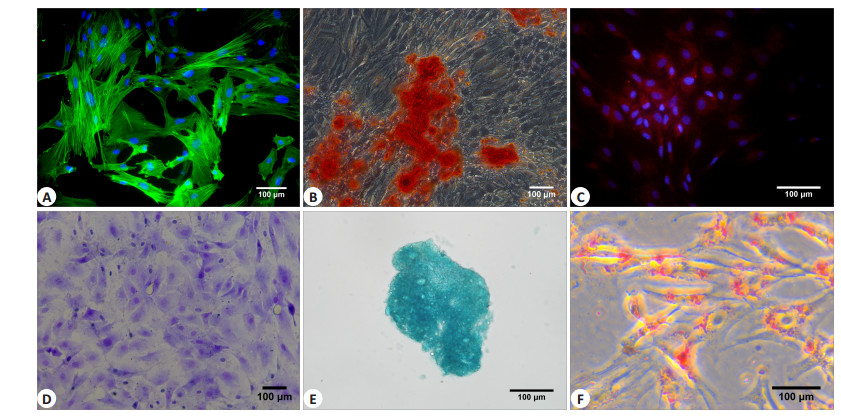
细胞骨架免疫荧光结果可见大量绿色丝状肌动蛋白F-actin(图 2A)。PDSC成骨诱导分化结果,钙茜素红染色结果见大量钙结节着红色(图 2B),细胞爬片OCN免疫荧光实验结果显示,经过诱导后的大部分细胞骨钙蛋白阳性(图 2C)。PDSC成软骨诱导后的甲苯胺蓝染色后,胞质中聚蛋白多糖着蓝紫色(图 2D),软骨球切片的阿利新蓝染色后,软骨球组织中内酸性粘多糖呈蓝色(图 2E)。PDSC成脂诱导后油红O染色见细胞质中有大量圆形脂肪滴着红色(图 2F)。上述实验证明,此方法获取并培养的PDSC细胞具有成骨、成软骨、成脂等多能分化的潜能。
|
图 2 丝状肌动蛋白F-actin免疫荧光及三系诱导结果 Figure 2 F-actin immunofluorescence assay (A), Alizarin red staining (B), OCN immunofluorescence assay (C), Toluidine blue staining (D), Alcian blue staining (E), and Oil red O staining (F) of the cells. |
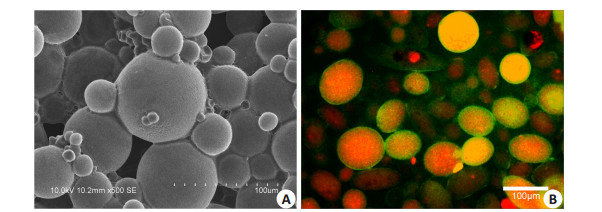
扫面电镜下PELA微囊支架的表面形态见(图 3A),经过10 min熏蒸融合的微囊,其球形结构依然清晰可见,微囊平均直径在50 μm左右,此次制备与我们前期研制的材料粒径相似。内包封TRITC-鬼笔环肽及外粘附FITC-鬼笔环肽的微球的荧光显微镜图片结果见(图 3B),可见微囊中心散发红光,而外周粘附黄绿色光晕,证明球形微囊材料已制备成功。
|
图 3 扫描电镜及荧光显微镜下PELA支架材料 Figure 3 Scanning electron microscopy of PELA scaffold (A) and fluorescence microscopy of the microcapsules (B; Red represents TRITC-phalloidin, and green represents FITCphalloidin). |
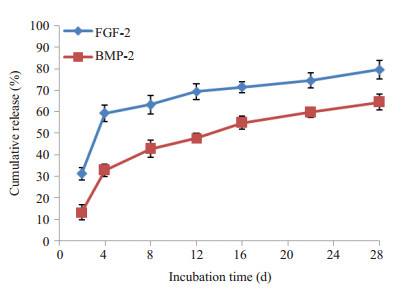
内包BMP-2外粘附FGF-2的PELA微囊支架体外释放结果见(图 4)。由于粘附于微囊表面,FGF-2呈现初始突释现象,第4天就有将近60%的累积释放量,此后就进入一个缓释阶段,到第28天总累积释放量接近80%。而同一材料的内包的BMP-2释放曲线明显不同,虽然存在突释现象,但在第4天总累积释放量仅接近30%,随后持续释放,到第28天累积释放量达60%。该材料可简单模拟自然骨折修复过程中早期FGF-2升高,随后BMP-2再升高的特点,且控释时间长于28 d。
|
图 4 FGF-2/PELA/BMP-2支架材料在PBS缓冲液中FGF-2及BMP-2的累积释放率曲线 Figure 4 Cumulative release profile of FGF-2 and BMP-2 from FGF-2/PELA/BMP-2 scaffold in PBS solution. |
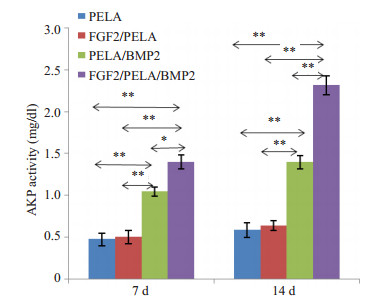
FGF-2/PELA/BMP-2、PELA/BMP-2、FGF-2/PELA、PELA等四组材料(A、B、C、D)浸提液培养PDSC7 d、14 d后,碱性磷酸酶活性检测结果见(图 5)。结果显示,在培养的第7天,各组AKP表达量有统计学差异(F=215.5,P < 0.0001),A组的AKP最高,差异有统计学意义(P值均 < 0.01),A、B组AKP值均高于C、D组,差异有统计学意义(P值均 < 0.01),而C、D组之间AKP值无统计学差异。到第14天结果与第7天相似,各组AKP值的总体差异也具有统计学意义(F=527.1,P < 0.001)。A组的AKP仍然为4组中最高(P=0.007),A、B组AKP值均高于C、D组,差异有统计学意义(P值均 < 0.01),C、D组间AKP差异无统计学意义。结果表明FGF-2/PELA/BMP-2材料组中的细胞因子活性得以保留,并且该组相对其他实验组有更高的促进PDSC成骨分化能力。
|
图 5 四个不同组的AKP活性 Figure 5 AKP activity in the culture media of PDSCs cultured with the extracts of different materials. *P < 0.05, **P < 0.01. |
|
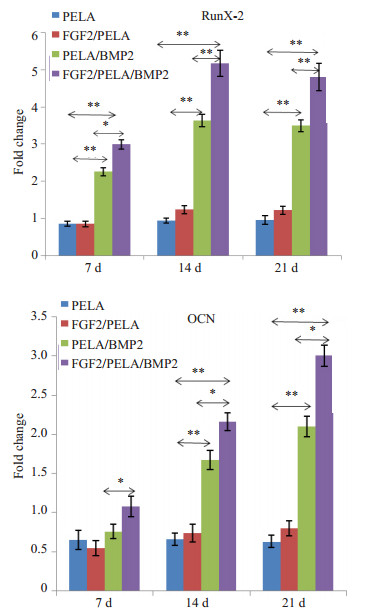
图 6 四个不同组的qRT-PCR检测成骨基因表达结果 Figure 6 Results of qRT-PCR for detecting mRNA expressions of osteogenic genes in PDSCs cultured with the extracts of different materials. *P < 0.05, **P < 0.01. |
按上述FGF-2/PELA/BMP-2、PELA/BMP-2、FGF-2/PELA、PELA材料浸提液培养PDSC,进行qRT-PCR检测RunX-2,OCN(A、B、C、D)。结果显示在7、14、21 d三个时间点,A组的成骨基因表达均高于其他组(P < 0.01),而A、B组则高于C、D组(P < 0.01)。C,D两组均无明显差异。RunX-2在14d左右达到高峰,而OCN表达呈持续升高趋势。根据结果显示,我们认为FGF-2/PELA/BMP-2组促进PDSC的成骨分化能力最强,提示FGF-2与BMP-2对于促进PDSC成骨方面可能存在协同作用。
3 讨论骨膜来源干细胞具有多向分化能力且容易提取而被广大研究者青睐,而较高的增殖能力通常是组织工程种子细胞的先决条件。有人发现在体外培养过程中,PDSC增殖速度比目前较常用的骨髓间充质干细胞(BMSC)更快[3, 13],因此使用PDSC可缩短细胞培养周期,从而降低细胞培养的成本和污染的风险。Yoshimura [17]等甚至认为PDSC比BMSC具有更强的成骨分化能力。而且骨折创伤后PDSC能旁分泌大量的VEGF、BMP-2等重要的细胞因子[18]。本实验方法提取的PDSC经过流式鉴定,其表面表达间充质干细胞标记物,并经过诱导可向成骨、成软骨、成脂等多向分化,我们认为骨膜来源干细胞会是骨组织工程中优秀的种子细胞。但不同种属、不同年龄层、不同提取方法及不同部位来源的PDSC的成骨能力及增殖能力差异如何,仍然需要进一步探究。
在骨组织工程中,仍然存在着种子细胞在体外扩增中伴随着成骨能力逐步下降的问题,我们期望通过在种子细胞移植过程中模拟内环境给予PDSC关键性因子提高其成骨能力。在骨折愈合的最早期FGF-2高表达[19],FGF-2能促进细胞的有丝分裂,调节细胞的生长分裂,其在骨量生成调节中起重要作用[20],并且能维持干细胞在体外自我更新的能力[21]。另外,单一剂量的FGF-2能够在骨折区促进PDSC增殖并促进新生骨痂形成[22]。然而BMP-2则是在成骨分化阶段大量表达,尽管BMP-2对PDSC增殖无影响,但是对于PDSC的成骨、成软骨则起到关键性作用[23-24]。并且Van[14]认为PDSC经过FGF-2的体外预刺激,可提高其对BMP-2的敏感性,保持PDSC软骨内成骨的性能,并促进其增殖及后续BMP-2的产生。鉴于FGF-2、BMP-2两种因子对于骨折修复的重要性及其在自然骨修复过程中体内先后高表达的特点,本实验成功制备了外粘附FGF-2内包含BMP-2的微囊支架,并且通过检测得出的细胞因子体外释放曲线可大致模拟出骨折发生后FGF-2先增高,BMP-2后增高的特点。而且AKP活性及RunX-2、OCN成骨基因检测结果均提示FGF-2/PELA/BMP-2实验组具有较优的促进PDSC成骨能力。众所周知RunX-2是成骨早期表达的基因[25],而OCN是成骨的晚期指标[26],与本实验中FGF-2/PELA/BMP-2组2周时RunX-2表达量达到顶峰,OCN表达量逐渐升高基本相吻合。故我们认为该支架材料对于PDSC初期及后期的成骨能力均有较好的促进作用。我们期望FGF-2/PELA/BMP-2搭载PDSC会是动物极量骨缺损修复的一个新的选择。
仿生控释细胞因子协调行动来刺激新的骨骼组织形成能够更有助于骨损伤修复。本课题组在前期研究中,研制了外粘附BMP-2内包含BMP-7的PELA微囊支架,达到仿生控释的目的,且体内外实验证明该材料具备良好的成骨活性,可塑型为骨填充材料,并且能修复大鼠股骨大块骨缺损,无免疫原性及其他明显不良反应[27]。本实验首次将FGF-2/BMP-2仿生控释系统与PDSC相结合,仿生控释并进行体外实验,结果证明可以有效促进PDSC的成骨分化。而Van等人采用的是体外FGF-2预刺激,再进行PDSC的体内外实验,但研究结果基本相一致。
本研究表明PDSC搭载FGF-2/PELA/BMP-2仿生控释支架,是骨组织工程中优秀的种子细胞-细胞因子-支架三合一模型,我们认为该模型会是骨组织工程中一种优秀的骨修复策略。本次实验为将来进行动物极量骨缺损修复实验及进一步探究PDSC与FGF-2等因子之间的内在关系提供理论基础和宝贵的数据。本课题组将进一步运用PDSC搭载FGF-2/PELA/BMP-2仿生控释支架进行动物体内极量骨缺损修复实验,希望能拓展骨组织工程领域,为生物材料促进骨损伤修复的研究提供新的思路。
| [1] | Wang Q, Huang C, Zeng F, et al. Activation of the Hh pathway in Periosteum-Derived mesenchymal stem cells induces bone formation in vivo[J]. Am J Pathol, 2010, 177 (6): 3100-11. DOI: 10.2353/ajpath.2010.100060. |
| [2] | De Bari C, Dell'accio F, Vanlauwe J, et al. Mesenchymal multipotency of adult human periosteal cells demonstrated by single-cell lineage analysis[J]. Arthritis Rheum, 2006, 54 (4): 1209-21. DOI: 10.1002/(ISSN)1529-0131. |
| [3] | van Gastel N, Torrekens S, Roberts SJ, et al. Engineering vascularized bone: osteogenic and proangiogenic potential of murine periosteal cells[J]. Stem Cells, 2012, 30 (11): 2460-71. DOI: 10.1002/stem.v30.11. |
| [4] | Nakahara H, Goldberg VM, Caplan AI. Culture-expanded human periosteal-derived cells exhibit osteochondral potential in vivo[J]. J Orthop Res, 1991, 9 (4): 465-76. DOI: 10.1002/(ISSN)1554-527X. |
| [5] | Breitbart AS, Grande DA, Kessler R, et al. Tissue engineered bone repair of calvarial defects using cultured periosteal cells[J]. Plast Reconstr Surg, 1998, 101 (3): 567-74; discussion 575-6.. DOI: 10.1097/00006534-199803000-00001. |
| [6] | Perka C, Schultz O, Spitzer RS, et al. Segmental bone repair by tissue-engineered periosteal cell transplants with bioresorbable fleece and fibrin scaffolds in rabbits[J]. Biomaterials, 2000, 21 (11): 1145-53. DOI: 10.1016/S0142-9612(99)00280-X. |
| [7] | Kawase T, Okuda K, Kogami H, et al. Human periosteum-derived cells combined with superporous hydroxyapatite blocks used as an osteogenic bone substitute for periodontal regenerative therapy: an animal implantation study using nude mice[J]. J Periodontol, 2010, 81 (3): 420-7. DOI: 10.1902/jop.2009.090523. |
| [8] | Roberts SJ, Owen HC, Tam WL, et al. Humanized culture of periosteal progenitors in allogeneic serum enhances osteogenic differentiation and in vivo bone formation[J]. Stem Cells Transl Med, 2014, 3 (2): 218-28. DOI: 10.5966/sctm.2012-0137. |
| [9] | Eyckmans J, Roberts SJ, Schrooten J, et al. A clinically relevant model of osteoinduction: a process requiring calcium phosphate and BMP/Wnt signalling[J]. J Cell Mol Med, 2010, 14 (6b): 1845-56. |
| [10] | Siddappa R, Licht R, van Blitterswijk C, et al. Donor variation and loss of multipotency during in vitro expansion of human mesenchymal stem cells for bone tissue engineering[J]. J Orthop Res, 2007, 25 (8): 1029-41. DOI: 10.1002/(ISSN)1554-527X. |
| [11] | Wagers AJ. The stem cell niche in regenerative medicine[J]. Cell Stem Cell, 2012, 10 (4): 362-9. DOI: 10.1016/j.stem.2012.02.018. |
| [12] | Lei L, Wang S, Wu H, et al. Optimization of release pattern of FGF-2 and BMP-2 for osteogenic differentiation of low-population density hMSCs[J]. J Biomed Mater Res A, 2015, 103 (1): 252-61. DOI: 10.1002/jbm.a.v103.1. |
| [13] | Agata H, Asahina I, Yamazaki Y, et al. Effective bone engineering with periosteum-derived cells[J]. J Dent Res, 2007, 86 (1): 79-83. DOI: 10.1177/154405910708600113. |
| [14] | van Gastel N, Stegen S, Stockmans I, et al. Expansion of murine periosteal progenitor cells with fibroblast growth factor 2 reveals an intrinsic endochondral ossification program mediated by bone morphogenetic protein 2[J]. Stem Cells, 2014, 32 (9): 2407-18. DOI: 10.1002/stem.1783. |
| [15] | Chen D, Zhang X, He Y, et al. Co-culturing mesenchymal stem cells from bone marrow and periosteum enhances osteogenesis and neovascularization of tissue-engineered bone[J]. J Tissue Eng Regen Med, 2012, 6 (10): 822-32. DOI: 10.1002/term.v6.10. |
| [16] | Li X, Min S, Zhao X, et al. Optimization of entrapping conditions to improve the release of BMP-2 from PELA carriers by response surface methodology[J]. Biomed Mater, 2015, 10 (1): 015002. |
| [17] | Yoshimura H, Muneta T, Nimura A, et al. Comparison of rat mesenchymal stem cells derived from bone marrow, synovium, periosteum, adipose tissue, and muscle[J]. Cell Tissue Res, 2007, 327 (3): 449-62. DOI: 10.1007/s00441-006-0308-z. |
| [18] | Hoffman D, Benoit S. Emulating native periosteum cell population and subsequent paracrine factor production to promote tissue engineered periosteum-mediated allograft healing[J]. Biomaterials, 2015, 52 : 426-40. DOI: 10.1016/j.biomaterials.2015.02.064. |
| [19] | Schmid J, Kobayashi C, Sandell J, et al. Fibroblast growth factor expression during skeletal fracture healing in mice[J]. Dev Dyn, 2009, 238 (3): 766-74. DOI: 10.1002/dvdy.v238:3. |
| [20] | Xiao L, Liu P, Li X, et al. Exported 18-kDa isoform of fibroblast growth factor-2 is a critical determinant of bone mass in mice[J]. J Biol Chem, 2009, 284 (5): 3170-82. DOI: 10.1074/jbc.M804900200. |
| [21] | Coutu DL, Galipeau J. Roles of FGF signaling in stem cell selfrenewal, senescence and aging[J]. Aging (Albany NY), 2011, 3 (10): 920-33. |
| [22] | Du X, Xie Y, Xian CJ, et al. Role of FGFs/FGFRs in skeletal development and bone regeneration[J]. J Cell Physiol, 2012, 227 (12): 3731-43. DOI: 10.1002/jcp.v227.12. |
| [23] | Chappuis V, Gamer L, Cox K, et al. Periosteal BMP2 activity drives bone graft healing[J]. Bone, 2012, 51 (4): 800-9. DOI: 10.1016/j.bone.2012.07.017. |
| [24] | Wang Q, Huang C, Xue M, et al. Expression of endogenous BMP-2 in periosteal progenitor cells is essential for bone healing[J]. Bone, 2011, 48 (3): 524-32. DOI: 10.1016/j.bone.2010.10.178. |
| [25] | Pramanik S, Pingguan-Murphy B, Cho J, et al. Design and development of potential tissue engineering scaffolds from structurally different longitudinal parts of a bovine-femur[J]. Sci Rep, 2014, 4 : 5843. |
| [26] | Marycz K, Śmieszek A, Grzesiak J, et al. The osteogenic properties of multipotent mesenchymal stromal cells in cultures on TiO2 solgel-derived biomaterial[J]. Biomed Res Int, 2015 : 651097. |
| [27] | Li X, Yi W, Jin A, et al. Effects of sequentially released BMP-2 and BMP-7 from PELA microcapsule-based scaffolds on the bone regeneration[J]. Am J Transl Res, 2015, 7 (8): 1417-28. |
 2017, Vol. 37
2017, Vol. 37

