2. 上海交通大学附属第一人民医院, 国际医疗保健中心, 上海 200080;
3. 上海交通大学附属第一人民医院, 消化科, 上海 200080;
4. 上海市胰腺疾病重点实验室, 上海 200080
2. International Medical Care Center, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080;
3. Department of Gastroenterology, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080;
4. Shanghai Key Laboratory of Pancreatic Diseases, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080, China
肠道上皮具有不断自我更新的能力,这个过程是通过肠道干细胞(intestinal stem cells, ISCs)和它的衍生细胞--祖细胞增殖后,再逐步分化成。肠道类器官培养系统是目前体外研究肠道上皮最好的工具[1],其中细胞类型包括了Lgr5+肠道干细胞以及由其分化的所有类型细胞:肠上皮细胞,潘氏细胞,杯状细胞和内分泌细胞,并且这些细胞的位置和功能也与活体组织一致[2]。肠道类器官研究在遗传性疾病、肿瘤、感染性疾病、多因性疾病和组织再生性研究中有着广阔的前景[3],然而国内鲜有相关报道。
高脂肪低纤维的饮食结构能引起肠道慢性低度炎症,肠道通透性的破坏[4-5],高脂饮食可使进入肠道的胆汁酸增多,不同的胆汁酸所起的生理作用不尽相同,疏水性胆酸被认为有细胞毒性作用,高脂饮食引起的肠道胆汁酸增多以疏水的次级胆酸--脱氧胆酸(DCA)在肠道内的浓度和比例增高为主[6]。DCA对于肠道上皮细胞的影响已经有研究报道,DCA可以增加肠道的通透性[7],可诱导线粒体氧化应激,通过活化NF-κB途径,诱导DNA结构破坏[8-9],100 µmol/L以上浓度的DCA可以非线性剂量反应性造成细胞DNA的损伤。然而对于DCA对于肠道类器官的生长的影响国内外尚无相关报道。
本研究旨在建立小鼠小肠类器官培养技术,并探讨DCA在不同浓度和干预时间下对小肠类器官生长的影响,以期为高脂饮食对肠道危害的基础研究提供平台。
1 材料和方法 1.1 实验动物及试剂C57BL/6小鼠,8周龄,雌雄不限,购自上海斯莱克实验动物有限责任公司。Advanced DMEM/F12(ADF)培养基、100×青/链霉素、100×Glutamax、100×HEPES缓冲液、PBS缓冲液、100×N-2 Supplement、100×无维生素A B27 Supplement、EDTA和Synth-aFreeze培养基购自Gibco;Matrigel Matrix基质胶购自Corning;70 μm细胞过滤器和程序降温冻存盒购自BD,表皮生长因子(EGF)、R-Spondin-1和Noggin购自PeproTech;Jagged-1购自AnaSpec;Y-27632购自Cayman Chemical;脱氧胆酸(DCA)购自Sigma。
1.2 研究方法 1.2.1 小肠隐窝分离和培养[1]腹腔麻醉后颈椎脱臼法处死小鼠,开腹取末段回肠10 cm左右,用冰的PBS清洗,分离去除肠道上的脂肪组织,沿长轴剪开小肠,冰PBS中洗去粪便。用刀片切成1~2 mm小块,将组织块转入20 mL含冰PBS的50 mL离心管中,用力震荡摇匀后静置,待组织块沉降后吸除上层液体,转入超净台重复上述过程清洗组织块直至上清液清亮。组织块重悬在25 mL 2.5 mmol/L EDTA-PBS中,4 ℃摇床30 min,弃上清液。组织块移入10 mL ADF培养基,使用移液管用力上下反复吹打后得到云雾状液体,用70 µm的细胞过滤器过滤掉组织和碎片,重复上述过程3~5次,收集液体,4°C 300×g离心5 min,除去上清液。加入ADF培养基重新吹打重悬沉淀。4 ℃ 150×g离心5 min,去除上清,并重复2到3次。加入适当体积ADF培养基重悬隐窝沉淀,以1:2比例与Matrigel基质胶混匀,按每孔50 µL的体积种植到37 ℃预热的12孔板中,放入培养箱中1 h,待基质胶固化后,加入完整培养基:包括1×Glutamax、1×HEPES buffer、1×青/链霉素、1×N2 supplement、1×无维生素A B-27 Supplement、50 ng/mL EGF、100 ng/mL Noggin、500 ng/mL Rspondin-1、1 µmol/L Jagged-1和10 µmol/L Y-27632的ADF培养基1 mL。放入培养箱5% CO2 37 ℃培养,隔天加入生长因子(EGF、Noggin、R-spondin-1、Jagged-1和Y-27632),每5~7 d更换完整培养基。
1.2.2 小肠类器官传代和冻存复苏类器官每隔1到2周传代1次,吸除全部培养基,使用冰ADF培养基吹打固化的含有类器官的Matrigel胶,将类器官悬浮液经过25到30 G的注射器针头抽吸一次将长大的类器官物理性分离成小的隐窝结构,离心,冰ADF培养基洗涤和与Matrigel胶混匀并铺板,具体过程同分离过程。
类器官生长到一定密度后可以冻存,过程同传代过程但无需注射器针头物理分离,以1×105/mL的细胞加入冰Synth-a-Freeze培养基1.5 mL,混匀后转移至2 mL冻存管中,放入程序降温冻存盒中-80 ℃冻存,1 d后移入液氮中保存。复苏时37 ℃水浴使冻存培养基溶解后,立即移入ADF培养基中,离心、洗涤、铺板、培养和传代同前。
1.2.3 短期和长期脱氧胆酸干预小鼠小肠类器官以无水酒精为溶剂溶解DCA,在传代后即刻和传代后正常培养3 d后(此时类器官已经形成肠道类器官结构)2个时间点,分别以无水酒精(溶剂)和正常类器官作为对照,加入高浓度DCA(100 µmol/L)短期干预48 h,每日观察类器官的生长情况和形态特点;干预48 h后Split传代,再恢复正常完整培养基培养10 d,期间在第6天时进行1次传代,观察类器官的生长情况和形态特点,每组均重复3孔。
在类器官传代后立即分为低浓度DCA组(10µmol/L)、无水酒精组(溶剂)和正常类器官组长期干预10 d,期间隔天换液,第6天时进行1次传代,每日观察类器官的生长情况和形态特点;10 d后传代并恢复正常完整培养基培养10 d,在第6天时进行1次传代,观察类器官的生长情况和形态特点,每组均重复3孔。
培养过程中,在显微镜下观察类器官形态改变,观察根据肠道干细胞学会定义的肠道类器官球形结构和典型的肠道类器官结构[10]。传代后立即计算每孔中铺板时的隐窝数量,在高浓度和低浓度DCA干预,去除DCA影响组,无水酒精对照和正常类器官组1和7 d(第6天传代后的次日)计算每孔中肠道类器官球形结构数量,2和10 d(第6天传代)时,记录每孔中肠道类器官结构数量,计算肠道类器官球形结构形成率,肠道类器官结构形成率和类器官演化率,即肠道类器官球形结构继续生长成为肠道类器官结构的比率。肠道类器官球形结构形成率(%)=肠道类器官球形结构数量/铺板时隐窝数量×100%;肠道类器官结构形成率(%)=肠道类器官结构数量/铺板时隐窝数量×100%;类器官演化率(%)=肠道类器官结构数量/肠道类器官球形结构数量×100%。2 d和10 d时在显微镜×400视野下每组各取两孔,每孔随机选取10个类器官记录每个类器官的出芽数量,如肠道类器官球形结构没有进一步生长成为肠道类器官结构则认为出芽数量为0 [11]。
1.3 统计学方法采用SPSS 19.0统计软件分析,计量资料采用均数±标准差表示,先进行K-S正态性检验,多组比较使用单因素方差分析方法,P < 0.05表示具有统计学意义。
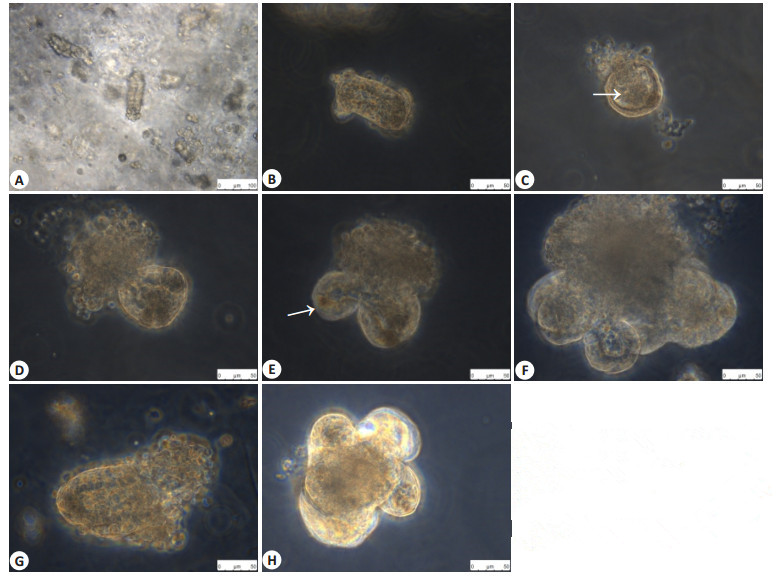
2 结果 2.1 小鼠小肠类器官培养体系建立新分离出的小鼠隐窝呈现发夹结构(图 1A),数小时至1 d内自动闭合构成球形结构,镜下观察似囊样的隐窝(图 1B,C),其中心具有单个的内腔(白色箭头),随着小肠干细胞自我更新复制,2~3 d左右肠道类器官球形结构形成出芽结构(白色箭头)向外突出生长(图 1E),类器官最后可形成多个出芽结构,演化成为典型的隐窝状类器官(图 1F)。传代时通过针头物理分离,单个隐窝被分离后再进行上述生长过程(图 1G,H)。
|
图 1 小鼠小肠类器官生长和传代后生长的变化 Figure 1 Growth of the organoids in culture. A: Crypts on initial plating; B: Crypts after plating 3 hours; C-F: Organoids after plating 1, 2, 3 d and 6 d; G and H Organoids after split 0 d and 4 d. |
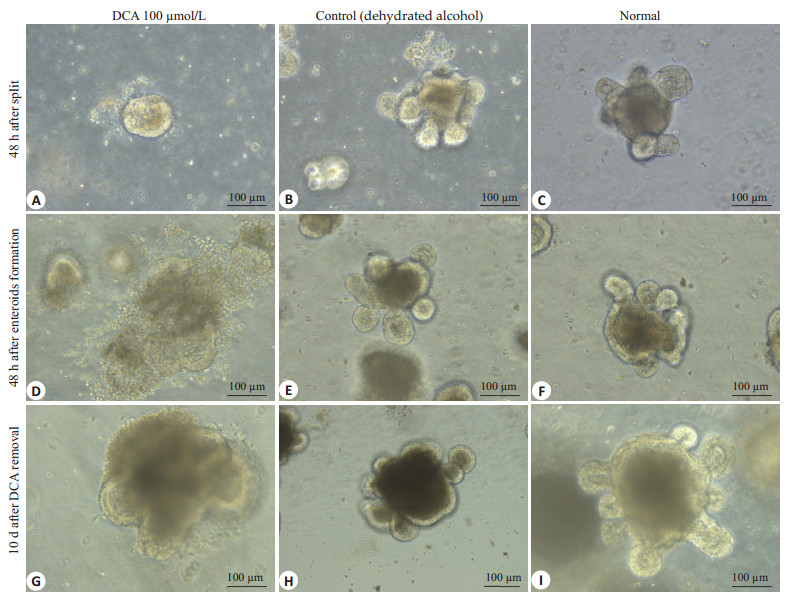
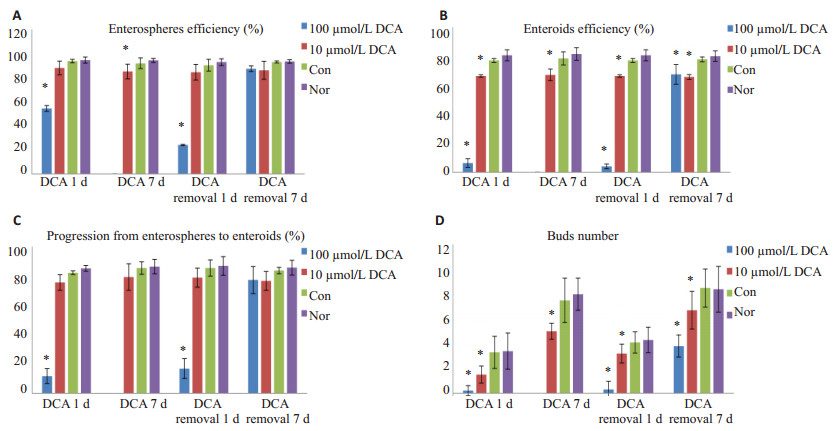
小鼠小肠类器官传代后立即给予100 µmol/LDCA干预,1 d时肠道类器官球形结构形成率([54.38±2.33)% vs(93.84±1.47)%和(94.67±2.57%)],2 d时肠道类器官结构形成率([6.39±2.95)% vs(77.16±1.30)%和(80.69±3.78)%]和类器官演化率([11.69±5.07)% vs(82.23±1.26)%和(85.21±1.94)%]明显较无水酒精和正常类器官对照组减少(图 3A~C,P < 0.05),说明高浓度短期干预类器官明显影响了类器官肠道类器官球形结构的形成和肠道类器官结构的形成。2 d时的类器官出芽数量也明显少于无水酒精和正常类器官对照组(0.20±0.41 vs 3.30±1.30和3.40±1.47,P < 0.05)(图 2A,图 3D)。在类器官生长到一定程度,已经形成典型隐窝状类器官结构肠道类器官结构后再给予100 µmol/L DCA干预2 d,发现有较多的坏死细胞,类器官部分结构受损(图 2D),而无水酒精和正常类器官对照组继续生长(图 2E,F)。
|
图 2 短期较高浓度DCA对小肠类器官生长的影响 Figure 2 Short-term treatment with high-concentration DCA adversely affects intestinal organoids growth (Original magnification: ×200). |
|
图 3 短期和长期DCA对小肠类器官生长的影响 Figure 3 Effect of short-and long-term DCA treatment on intestinal organoids growth. *P < 0.05, DCA vs dehydrated alcohol (control) and normal groups. |
高浓度DCA干预2 d后去除DCA,1 d时肠道类器官球形结构形成率([23.98±0.51)% vs(90.42±4.85)%和(92.96±2.75)%],2 d时肠道类器官结构形成率([4.06±1.68)% vs(77.16±1.30)%和(80.69±3.78)%]和类器官演化率([16.84±6.75)% vs(85.53±5.53)%和(86.92±6.38)%]也明显低于无水酒精和正常类器官对照组(P < 0.05),2 d时出芽数量也少于无水酒精和正常类器官对照组(0.30±0.66 vs 4.10±0.85和4.30±1.03,P < 0.05);去除DCA培养6 d时传代,7 d时肠道类器官球形结构形成率([87.52±2.29)% vs(93.05±0.86)%和(93.52±1.42)%]以及10 d时类器官演化率([77.31±9.25)% vs(83.71±2.13)%和(85.68±5.05)%)]基本和无水酒精、正常类器官无差异(P > 0.05),10 d时肠道类器官结构形成率仍低于无水酒精和正常类器官对照组([67.56±6.75)% vs(77.89±1.65)%和(80.08±3.66)%,P < 0.05],10 d时类器官结构有所恢复,但仍有较多坏死细胞(图 2G),出芽数量仍少于无水酒精和正常类器官对照组(3.80±0.89 vs 8.50±0.1.53和8.40±1.85,P < 0.05)(图 3)。
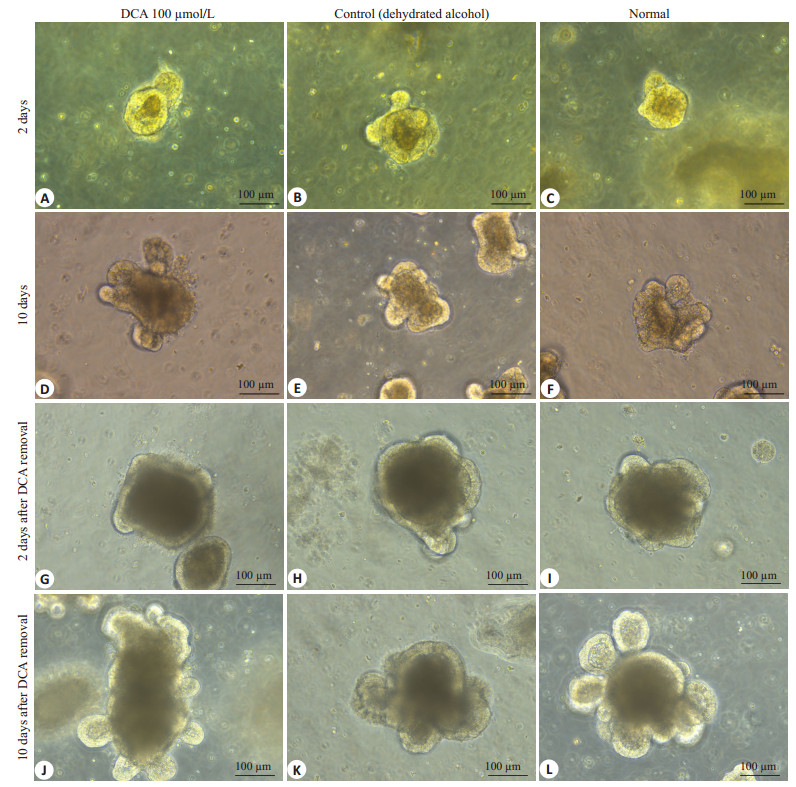
2.3 长期低浓度DCA干预对小鼠小肠类器官生长的影响小鼠小肠类器官传代后给予10 µmol/L DCA干预,1 d时肠道类器官球形结构形成率([84.56±6.55)% vs(90.42±4.85)%和(92.96±2.75)%]和2 d时类器官演化率([75.57±5.37)% vs(82.23±1.26)%和(85.21±1.94)%]与无水酒精组和正常类器官无明显差异(P > 0.05),但是2 d时肠道类器官结构形成率([66.41±2.95)% vs(77.16±1.30)%和(80.69±3.78)%]低于无水酒精和正常类器官对照组(P < 0.05)。2 d时的类器官出芽数量也明显少于无水酒精和正常类器官对照组(1.5±0.69 vs 3.30±1.30和3.40±1.47,P < 0.05)(图 4A)。DCA干预6 d后传代,7 d时肠道类器官球形结构形成率([85.19±6.13)% vs(92.01±4.47)%和(94.47±1.68)%],10 d时肠道类器官结构形成率([67.23±3.99)% vs(78.56±4.51)%和(81.64±4.27)%]低于无水酒精和正常类器官对照组(P < 0.05),但类器官演化率([79.30±9.05)% vs(85.43±4.25)%和(86.45±4.90)%]与无水酒精组和正常类器官无明显差异(P > 0.05)。10 d时出芽数量明显少于无水酒精和正常类器官对照组(0.50±0.65 vs 7.50±1.79和8.00±1.30,P < 0.05),虽然形态仍维持典型的类器官结构,但出现少量坏死细胞(图 4D)。
|
图 4 长期较低浓度DCA对小肠类器官生长的影响 Figure 4 Effect of long-term treatment with low-concentration DCA on intestinal organoids growth (×200). |
去除DCA干预1 d时肠道类器官球形结构形成率([88.14±5.71)% vs(93.84±1.47)%和(94.67±2.57)%]和2 d时类器官演化率([78.87±6.55)% vs(85.53±5.53)%和(86.92±6.38)%]与无水酒精组和正常类器官无明显差异(P > 0.05),但是2 d时肠道类器官结构形成率([66.42±0.86)% vs(77.16±1.30)%和(80.69±3.78)%]低于无水酒精和正常类器官对照组(P < 0.05)。2 d时的类器官出芽数量也明显少于无水酒精和正常类器官对照组(3.20±0.77 vs 4.10±0.85和4.30±1.03,P < 0.05)。此时类器官周围坏死细胞有所减少但仍存在(图 4G)。去除DCA培养6 d时传代,7 d时肠道类器官球形结构形成率([86.16±7.47)% vs(93.05±0.86)%和(93.52±1.42)%]以及10 d时类器官演化率([76.70±6.41)% vs(83.71±2.13)%和(85.68±5.05)%]基本和无水酒精、正常类器官无差异(P > 0.05),10 d时肠道类器官结构形成率仍低于无水酒精和正常类器官对照组([65.78±1.62)% vs(77.89±1.65)%]和([80.08±3.66)%,P < 0.05],10 d后类器官基本恢复到正常状态(图 4J),但出芽数量仍少于无水酒精和正常类器官对照组(6.70±1.53 vs 8.50±1.53和8.40±1.85,P < 0.05)(图 3)。
3 讨论Fuller等[11]在2012年提出利用肠道类器官球形结构形成率、肠道类器官结构形成率、类器官演化率和每个类器官出芽个数来评判类器官的生长情况。肠道类器官球形结构形成率和肠道类器官结构形成率可代表类器官的存活情况,从肠道类器官球形结构到肠道类器官结构的演化率可以明确ISCs的分化能力。由于每个出芽都有能力单独生长形成新的肠道类器官结构,出芽个数可以代表类器官的生长能力和分化能力。故而,本研究拟以此建立高脂饮食对肠道类器官损伤的模型,应用肠道类器官球形结构形成率、肠道类器官结构形成率、类器官演化率和出芽数来评估DCA对于小鼠回肠末端类器官的生长的影响。
近数十年来随着我国经济的发展,人群饮食结构西方化,肥胖、炎症性肠病、糖尿病等在我国发病率越来越高。高脂饮食可诱导肠腔内具有细胞毒性的次级胆汁酸--脱氧胆酸(DCA)和石胆酸的增加[12]。以往研究仅针对100 µmol/L以上高浓度的DCA对于肠道上皮细胞和潘氏细胞的损伤作用进行研究,本研究首先采用高浓度100 µmol/L DCA 2 d短期和低浓度10 µmol/LDCA 10 d长期干预小肠类器官,并去除DCA影响长期培养10 d后观察DCA对小肠类器官的影响。
本研究首先成功构建了小鼠回肠末端类器官培养系统,类器官的形态和生长特点与Sato的文献描述相吻合[1, 13-14],类器官的培养在国内尚在起步阶段,目前仅有极少的成功案例。本研究发现,高浓度100 µmol/LDCA 2 d的短期干预就能影响类器官的出芽,不利于肠道上皮的生长,同时对于肠道上皮有明显的细胞毒性。近期研究显示高脂饮食引起肠道中疏水胆汁酸DCA升高[5],DCA可以增加肠道的通透性引起细菌的侵入[7, 15],可诱导线粒体氧化应激,通过活化NF-κB途径,诱导DNA结构破坏[8-9]。100 µmol/L以上浓度的DCA可以非线性剂量反应性造成细胞DNA的损伤,高浓度DCA是潘氏细胞的内质网应激反应的重要诱因。而类器官中具有ISCs和所有种类的肠道上皮细胞,我们发现高浓度DCA影响类器官的生长,可能也是由于DCA对于肠上皮细胞DNA的破坏导致,同时氧化应激引起潘氏细胞内质网应激反应。维持干细胞所需的微环境是潘氏细胞的功能之一[16],潘氏细胞的内质网应激反应导致其功能异常,从而影响ISCs的自我复制和细胞的分化。本研究结果显示,去除DCA后肠道类器官结构有所恢复,但仍有较多的坏死细胞,无法恢复如初,肠道上皮生长仍受到损伤。10 µmol/L低浓度DCA 2 d短期干预对类器官生长影响尚不明显,但10 d的长期干预仍有一定的细胞毒性,明显影响类器官生长,去除DCA 2 d后肠道上皮生长可有所恢复,但仍有较严重损伤,去除DCA 10 d后肠道上皮生长进一步恢复但无法恢复正常状态。文献对于DCA和肠道上皮细胞的研究多集中在100 µmol/L及以上浓度,对于低浓度长期干预尚缺乏研究。近期研究显示高脂饮食可以导致潘氏细胞功能障碍[17],潘氏细胞在肠道炎症反应中起到了举足轻重的作用[18],潘氏细胞分泌大量的抗菌肽和炎症因子[19],维持肠道菌群的平衡,同时为肠道干细胞提供稳定的内环境[20]。而短期暴饮暴食对应我们研究中的高浓度DCA短期干预类器官模型,长期高脂饮食对应我们研究中低浓度长期DCA干预模型,我们推测短期大量的高脂饮食对于肠道损伤严重,即使恢复低脂饮食一段时间其损伤也无法恢复,而长期少量的高脂饮食也会导致肠道损伤,需要较长时间的低脂饮食才能部分恢复,其具体机制可能与DCA影响肠道潘氏细胞功能有关。
小肠类器官在高脂饮食方面的研究刚刚起步,本研究成功构建了DCA对于小肠类器官影响的模型,是相关领域研究工作的开端,后续将对于其机制进行深入探索。
| [1] | Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature, 2009, 459 (7244): 262-5. DOI: 10.1038/nature07935. |
| [2] | Middendorp S, Schneeberger K, Wiegerinck CL, et al. Adult stem cells in the small intestine are intrinsically programmed with their location-specific function[J]. Stem Cells, 2014, 32 (5): 1083-91. DOI: 10.1002/stem.1655. |
| [3] | Spence JR, Mayhew CN, Rankin SA, et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro[J]. Nature, 2011, 470 (7332): 105-U120. DOI: 10.1038/nature09691. |
| [4] | Moreira AP, Texeira TF, Ferreira AB, et al. Influence of a high-fat diet on gut microbiota, intestinal permeability and metabolic endotoxaemia[J]. Br J Nutr, 2012, 108 (5): 801-9. DOI: 10.1017/S0007114512001213. |
| [5] | Stenman LK, Holma R, Eggert A, et al. A novel mechanism for gut barrier dysfunction by dietary fat: epithelial disruption by hydrophobic bile acids[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 304 (3): G227-34. DOI: 10.1152/ajpgi.00267.2012. |
| [6] | Keating N, Keely SJ. Bile acids in regulation of intestinal physiology[J]. Curr Gastroenterol Rep, 2009, 11 (5): 375-82. DOI: 10.1007/s11894-009-0057-8. |
| [7] | Forsgård RA, Korpela R, Stenman LK, et al. Deoxycholic acid induced changes in electrophysiological parameters and macromolecular permeability in murine small intestine with and without functional enteric nervous system plexuses[J]. Neurogastroenterol Motil, 2014, 26 (8): 1179-87. DOI: 10.1111/nmo.2014.26.issue-8. |
| [8] | Glinghammar B, Inoue H, Rafter JJ. Deoxycholic acid causes DNA damage in colonic cells with subsequent induction of caspases, COX-2 promoter activity and the transcription factors NF-kB and AP-1[J]. Carcinogenesis, 2002, 23 (5): 839-45. DOI: 10.1093/carcin/23.5.839. |
| [9] | Huo X, Juergens S, Zhang X, et al. Deoxycholic acid causes DNA damage while inducing apoptotic resistance through NF-κB activation in benign Barrett's epithelial cells[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301 (2): G278-86. DOI: 10.1152/ajpgi.00092.2011. |
| [10] | Stelzner M, Helmrath M, Dunn JC, et al. NIH intestinal stem cell consortium.a nomenclature for intestinal in vitro cultures[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302 (12): G1359-63. DOI: 10.1152/ajpgi.00493.2011. |
| [11] | Fuller MK, Faulk DM, Sundaram N, et al. Intestinal crypts reproducibly expand in culture[J]. J Surg Res, 2012, 178 (1): 48-54. DOI: 10.1016/j.jss.2012.03.037. |
| [12] | Ajouz H, Mukherji D, Shamseddine A. Secondary bile acids: an underrecognized cause of colon cancer[J]. World J Surg Oncol, 2014, 12 : 164. DOI: 10.1186/1477-7819-12-164. |
| [13] | Van Lidth de Jeude JF, Vermeulen JL, Montenegro-Miranda PS, et al. A protocol for lentiviral transduction and downstream analysis of intestinal organoids[J]. J Vis Exp, 2015, 20 (98). DOI: 10.3791/52531. |
| [14] | Date S, Sato T. Mini-gut organoids: reconstitution of the stem cell niche[J]. Annu Rev Cell Dev Biol, 2015, 31 : 269-89. DOI: 10.1146/annurev-cellbio-100814-125218. |
| [15] | Münch A, Ström M, Söderholm D. Dihydroxy bile acids increase mucosal permeability and bacterial uptake in human colon biopsies[J]. Scand J Gastroenterol, 2007, 42 (10): 1167-74. DOI: 10.1080/00365520701320463. |
| [16] | van der Flier LG, Clevers H. Stem cells, self-renewal, and differentiation in the intestinal epithelium[J]. Annu Rev Physiol, 2009, 71 : 241-60. DOI: 10.1146/annurev.physiol.010908.163145. |
| [17] | Andres SF, Santoro MA, Mah AT, et al. Deletion of intestinal epithelial insulin receptor attenuates high-fat diet-induced elevations in cholesterol and stem, enteroendocrine, and Paneth cell mRNAs[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308 (2): G100-11. DOI: 10.1152/ajpgi.00287.2014. |
| [18] | Adolph TE, Tomczak MF, Niederreiter L, et al. Paneth cells as a site of origin for intestinal inflammation[J]. Nature, 2013, 503 (7475): 272-6. |
| [19] | Ouellette AJ. Paneth cells and innate mucosal immunity[J]. Curr Opin Gastroenterol, 2010, 26 (6): 547-53. DOI: 10.1097/MOG.0b013e32833dccde. |
| [20] | Sinagoga KL, Wells JM. Generating human intestinal tissues from pluripotent stem cells to study development and disease[J]. EMBO J, 2015, 34 (9): 1149-63. DOI: 10.15252/embj.201490686. |
 2017, Vol. 37
2017, Vol. 37

