非酒精性脂肪肝病(Non-alcoholic fatty liver disease, NAFLD)是一种无过量饮酒史,以肝实质细胞脂质贮积和脂肪变性为特征的临床病理综合征,包括单纯性脂肪肝、脂肪性肝炎(NASH)、肝硬化及肝癌[1-2]。目前NAFLD的发病机制尚不明确,有研究表明肝脂质代谢紊乱和炎症反应可能在NAFLD的发生发展中发挥重要作用[3-5]。腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)在肝脏脂质稳态调节中发挥重要作用,活化的AMPK可通过调节脂肪代谢相关靶蛋白活性从而影响肝脏脂质代谢[6-8]。此外,有研究发现AMPK可通过调节核因子-κB(nuclear factor NF-κB, NF-κB)活性间接抑制肝脏炎症反应[9],减轻肝损伤[10]。已有研究指出,高脂饮食诱导的NAFLD大鼠肝脏中p-AMPK蛋白表达减少、NF-κB蛋白表达增强[3, 11-12],表明AMPK及NF-κB参与了NAFLD的病理过程。因此,AMPK及NF-κB有望成为防治非酒精性脂肪肝的治疗靶点。护肝清脂片为我院用于NAFLD治疗的医院制剂,由泽泻、山楂、蒲黄、荷叶、三七等中药组成,经多年临床实践证明其疗效确切。本课题组前期研究结果表明,护肝清脂片对NAFLD脂质代谢异常及炎症反应有较好的调节作用[13],但其在体内的作用机制尚不明确。本研究利用高脂饮食建立NAFLD大鼠模型,通过观察护肝清脂片干预后大鼠肝组织p-AMPK、NF-κB及相关蛋白的表达水平,探讨其防治NAFLD的可能作用机制。
1 材料和方法 1.1 材料 1.1.1 实验动物SPF级雄性SD大鼠60只,体质量180~220 g,购自南方医科大学动物实验中心,合格证号:SCXK(粤)2011-0015。实验动物饲养于南方医院药学部动物室,室内保持12 h昼夜节律,温度25±2 ℃,自由饮食饮水。
1.1.2 实验药物护肝清脂片由南方医科大学珠江医院制剂室提供(批号:20150412),每片0.6 g。非诺贝特片(规格0.1g*20片/盒),杭州民生药业有限公司生产(批号:H33022462)。
1.1.3 试剂高脂饲料,由广东省医学实验动物中心提供(蔗糖20%、猪油15%、胆固醇1.2%、胆酸钠0.2%、酪蛋白10%、磷酸氢钙0.6%、石粉0.4%、预混料0.4%、基础饲料52.2%);Trizol试剂盒,美国Invitrogen公司;SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)荧光定量试剂盒、PrimeScript®RT Master Mix Perfect Real Time逆转录试剂盒,日本TAKARA Bio.株式会社;抗体p-AMPKα,美国Cell Signaling公司;抗体NF-κB p65,美国Abcam公司;抗体SREBP-1c、FAS、GAPDH、Histone H3,美国Santa Cruz公司。
1.1.4 仪器SL-502N电子天平(百分之一),上海民桥公司;BSA224S电子天平(万分之一),德国赛多利斯公司;AU2700全自动生化分析仪,日本Olympus公司;ABI-7500荧光定量PCR仪,美国ABI公司;ABI-9700普通PCR仪,美国ABI公司;BX51正置荧光显微镜,日本Olympus公司;FJ-200高速分散均质机,上海标本模型厂;Legend Mach 1.6R低温高速离心机,美国Thermo公司;BG-verMINI迷你垂直电泳仪,北京百晶公司。
1.2 方法 1.2.1 动物造模及给药将60只雄性SD大鼠适应性喂养1周后,按体质量随机分为6组:正常组(Con),模型组(HFD),非诺贝特组(FF),护肝清脂片低、中、高剂量组(HL/HM/HH)。正常组给予正常饲料,其余各组给予高脂饲料造模,在造模的同时持续给予相应的药物干预12周,其中正常组及模型组按10 mL/kg给予蒸馏水灌胃;护肝清脂片低、中、高剂量组分别以0.54、1.08、2.16 g/kg的护肝清脂片混悬液灌胃给药;非诺贝特组以0.1 g/kg的非诺贝特混悬液灌胃给药。1次/d,直至12周结束。
1.2.2 血脂及肝功能检测12周结束后,各组大鼠以水合氯醛麻醉,腹主动脉采血5 mL,3000 r/min,4 ℃离心15 min分离血清,采用全自动生化分析仪检测血清甘油三酯(TG)、胆固醇(CHOL)、谷丙转氨酶(ALT)和谷草转氨酶(AST)水平。
1.2.3 肝脏脂质含量检测取各组大鼠肝组织200 mg,制成组织匀浆,3000 r/min,4 ℃离心15 min后取上清,采用全自动生化分析仪检测肝组织甘油三酯(TG)、胆固醇(CHOL)水平。采用酶联免疫吸附测定(ELISA)试剂盒测定游离脂肪酸(FFA)含量。
1.2.4 炎症因子检测制备肝组织匀浆,按ELISA试剂盒说明书操作测定肝组织匀浆中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)及C反应蛋白(CRP)含量。
1.2.5 肝组织HE染色及病理学评价取各组大鼠适量肝组织以4%多聚甲醛液固定,经石蜡包埋后HE染色,于正置显微镜下观察肝组织形态学变化,并依据《非酒精性脂肪性肝病诊疗指南》(2010年修订版)中《美国国立卫生研究院NASH临床研究网病例工作组指南》的内容,对肝组织切片进行形态学与病理学分析,并对NAFLD活动度积分进行统计学评价,NAFLD活动度积分评价体系如表 1。
| 表 1 NAFLD活动度积分评价体系 Table 1 Evaluation system of NAFLD activity score |
取各组大鼠肝组织60 mg,于液氮中迅速研磨后加入Trizol试剂提取总RNA,测定浓度后进行逆转录反应合成cDNA,反应条件:37 ℃ 15 min,85 ℃ 5 s。按SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)荧光定量试剂盒说明分配各反应液,以cDNA为模版进行扩增,RT-qPCR上机条件:预变性(95 ℃、30 s,1cycle);扩增(95 ℃、5 s,60 ℃、34 s、40cycles);溶解曲线(95 ℃、5 s,60 ℃、1 min、1cycle),引物序列见表 2。
| 表 2 引物序列 Table 2 Primer sequence of qRT-PCR |
取适量肝组织加入冷裂解液后匀浆、离心提取总蛋白,胞核蛋白采用核蛋白提取试剂盒分离提取。BCA(bicinchoninic acid)法测定蛋白浓度,SDS-PAGE电泳分离蛋白,电泳结束后取出分离胶,转移至PVDF膜上,后加5%脱脂奶粉封闭液,室温下平摇1 h;洗膜,加一抗稀释液(p-AMPKα,1:1000;SREBP-1c,1:1000;FAS,1:1000;NF-κB-p65,1:500;GAPDH,1:1000;Histone H3,1:3000)4 ℃过夜孵育;洗膜,加二抗稀释液室温孵育1 h后,TBBS洗膜10 min×3次,均匀滴加ECL化学发光液后进行曝光显影。
1.2.8 统计学处理实验数据采用软件SPSS 19.0处理,数据以均数±标准差表示,多组间均数比较采用单因素方差分析(One-way ANOVA),并用LSD检验或Dunnett T3检验作两两比较。认为P < 0.05为差异有统计学意义。
2 结果 2.1 血清ALT、AST、TG及CHOL水平与正常组相比,模型组血清ALT、AST、TG、CHOL水平显著升高(P < 0.01);与模型组相比,护肝清脂片低、中、高剂量组及非诺贝特组血清ALT、AST、TG、CHOL水平显著下降(P < 0.01),且护肝清脂片中、高剂量组下降水平尤为突出(表 3)。
| 表 3 各组大鼠血清ALT、AST、TG、CHOL水平比较 Table 3 Serum ALT, AST, TG and CHOL levels indifferent groups (Mean±SD) |
与正常组相比,模型组肝组织TG、CHOL、FFA水平显著升高(P < 0.01);与模型组相比,护肝清脂片中、高剂量组及非诺贝特组肝组织TG、CHOL、FFA水平显著降低(P < 0.01,表 4)。
| 表 4 各组大鼠肝组织TG、CHOL、FFA水平比较 Table 4 TG, CHOL and FFA levels in liver homogenates indifferent groups (Mean±SD) |
与正常组相比,模型组肝组织TNF-α、IL-6、CRP水平显著升高(P < 0.01);与模型相比,护肝清脂片各组及非诺贝特组肝组织TNF-α、IL-6水平显著降低(P < 0.01),同时,护肝清脂片中、高剂量组及非诺贝特组肝组织CRP水平较模型组显著降低(P < 0.01,表 5)。
| 表 5 各组大鼠肝组织TNF-α、IL-6、CRP水平比较 Table 5 TNF-α, IL-6 and CRP levels in liver homogenates in different groups (Mean±SD) |
正常组肝细胞排列整齐,肝小叶结构清晰,细胞无脂变,汇管区无炎细胞浸润;模型组肝细胞肿胀,细胞内有大小不一的脂滴空泡,细胞核边缘化,汇管区有炎细胞浸润;护肝清脂片低剂量组较模型组有改善但不明显,护肝清脂片中、高剂量组及非诺贝特组较模型组脂肪变显著减轻,炎症细胞减少或消失(图 1a)。此外,依据各组NAS评分结果发现(图 1b),与正常组相比,模型组的NAS积分显著升高(P < 0.01);与模型组相比,护肝清脂片中、高剂量组及非诺贝特组的NAS积分显著降低(P < 0.01)。
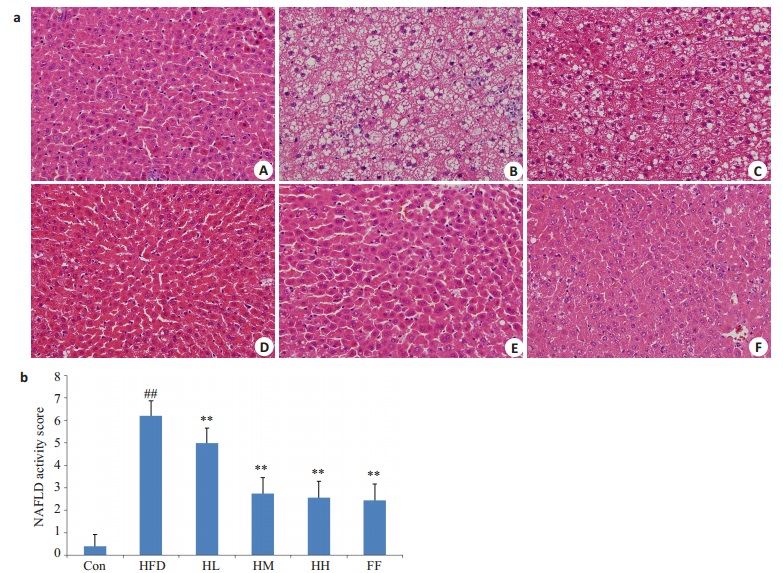
|
图 1 各组大鼠肝组织HE染色切片图 Figure 1 Liver pathologies in the 6 groups (HE staining, magnification ×400). ##P < 0.01 versus Con group. **P < 0.01 versus HFD group. A: control group; B: high-fat diet group; C: HFD+Hugan Qingzhi low dosegroup; D: HFD + Hugan Qingzhi moderate dosegroup; E: HFD + Hugan Qingzhi high dosegroup; F: HFD + fenofibrate group. |
由于AMPK的活性与其α亚基Thr-172位点的磷酸化(pAMPKα)密切相关,所以通过检测p-AMPKα的蛋白表达量评估AMPK的活性。如图 2A、B所示,与正常组相比,模型组中p-AMPKα的蛋白表达水平显著降低(P < 0.01);与模型相比,护肝清脂片中、高剂量组及非诺贝特组中p-AMPKα的蛋白表达水平显著升高(P < 0.01)。
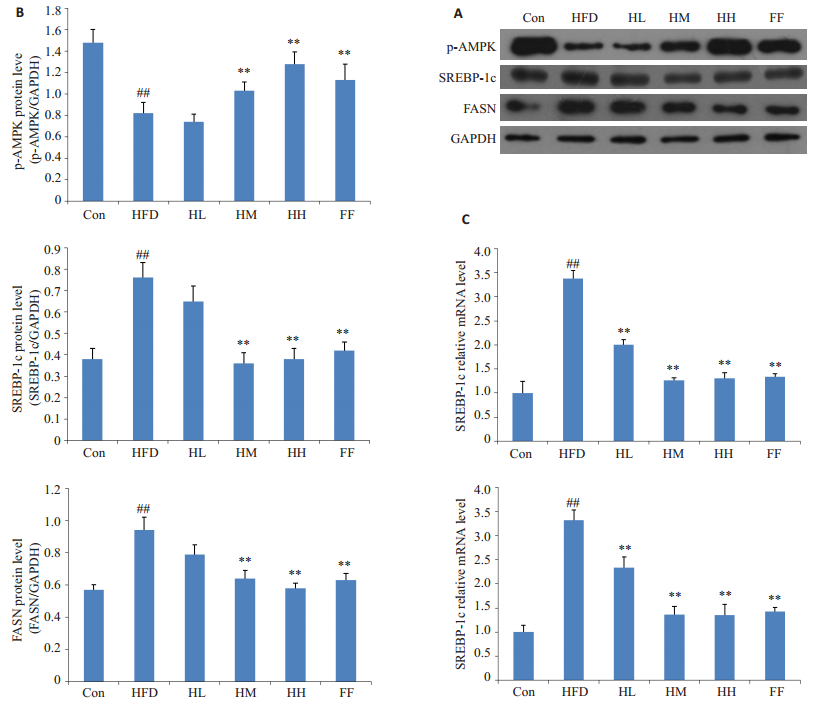
|
图 2 各组大鼠肝组织中p-AMPKα、SREBP-1c、FASN的表达水平 Figure 2 Expressions of p-AMPKα, SREBP-1c and FASN in liver homogenates. A: Western blotting; B: Gray-level scores; C: SREBP-1c and FASN mRNA expression determined by qRT-PCR. ##P < 0.01 versus Con group. **P < 0.01 versus HFD group. Con: control group; HFD: high-fat diet group; HL: HFD + Hugan Qingzhi low dosegroup; HM: HFD + Hugan Qingzhi moderate dosegroup; HH: HFD+Hugan Qingzhi high dosegroup; FF: HFD+fenofibrate group. |
如图 2A、B所示,与正常组相比,模型组中SREBP-1c、FASN蛋白水平显著升高(P < 0.01);与模型相比,护肝清脂片中、高剂量组及非诺贝特组能显著降低大鼠肝脏中SREBP-1c、FASN蛋白的表达水平(P < 0.01)。同时,SREBP-1c和FASN的mRNA表达水平与其蛋白表达水平结果一致(图 2C)。
2.6 护肝清脂片对大鼠肝脏炎症反应的改善作用由表 5可知,护肝清脂片中、高剂量组能显著降低NAFLD大鼠肝组织TNF-α、IL-6、CRP水平(P < 0.01),同时,Western blot检测各组大鼠肝细胞核中NF-κB-p65的蛋白表达水平,结果显示,与正常组相比,模型组大鼠肝细胞核中NF-κB-p65的蛋白表达水平显著升高(P < 0.01),而护肝清脂中、高剂量组及非诺贝特组大鼠肝细胞核中NF-κB-p65的蛋白表达水平较模型组显著降低(P < 0.01,图 3)。
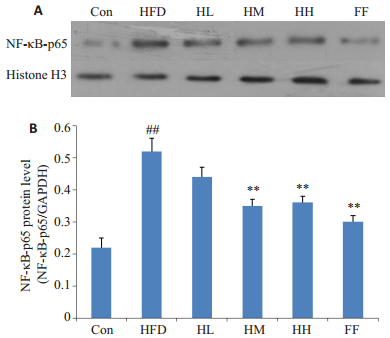
|
图 3 各组大鼠肝细胞核中NF-κB-p65的蛋白表达 Figure 3 Protein level of NF-κB-p65 in the hepatocyte nuclei. A: Western blotting; B: Gray-level scores. ##P < 0.01 versus Con group. **P < 0.01 versus HFD group. Con: control group; HFD: high-fat diet group; HL: HFD + Hugan Qingzhi low dosegroup; HM: HFD + Hugan Qingzhi moderate dosegroup; HH: HFD + Hugan Qingzhi high dosegroup; FF: HFD+fenofibrate group. |
随着生活水平的提高,NAFLD成为最常见的肝脏疾病且发病率逐年升高,尤其在肥胖人群中发病率高达75% [14]。但目前尚没有理想的NAFLD治疗药物。护肝清脂片在降脂及抗炎方面临床疗效确切,但其在体内的作用机制尚不清楚。本文研究结果显示,模型组大鼠体质量及肝指数明显增加,血清TG、CHOL及肝组织TG、CHOL、FFA水平较正常组显著升高(P < 0.01),炎症因子指标也发生相应改变,肝细胞呈弥漫性脂肪病变,由此表明本文NAFLD大鼠造模成功。同时,护肝清脂片中、高剂量组能显著降低NAFLD大鼠血清ALT、AST水平及肝组织TG、CHOL、FFA水平(P < 0.01),抑制炎症因子水平,改善肝脏脂质堆积及炎症反应,说明护肝清脂片能有效缓解NAFLD的发展进程。
AMPK在调节体内能量平衡及脂质代谢过程中具有关键性作用,活化的AMPK可通过抑制脂质合成相关基因表达、诱导脂肪酸代谢基因表达改善肝脏脂质堆积[4, 15-16]。研究表明,给予AMPK敲除的小鼠高脂饲料喂养,在第5周即出现肝脂肪变,血糖升高及胰岛素抵抗,而正常组小鼠第12周才出现肝脂肪变[17];同时在食源性肥胖者恢复体质量的过程中,患者皮下脂肪组织中AMPK表达升高,血清甘油三酯含量降低[18]。白藜芦醇、茶黄素等作为AMPK的激活剂,可用于治疗高脂饮食导致的NAFLD,包括改善脂质代谢、减轻炎症反应、提高细胞活性等[19-20]。这些研究表明AMPK可看作为治疗NAFLD疾病一个重要的机制。本文研究结果显示,护肝清脂片中、高剂量组能显著升高NALFD大鼠肝脏p-AMPK的蛋白表达水平,降低下游靶分子SREBP-1c和FASN的mRNA及蛋白表达水平,减少肝细胞脂质合成。前期研究亦证实,护肝清脂片可通过pAMPK/ACC/CPT1通路改善肝脏脂肪酸氧化[21],由此表明,护肝清脂片可能是通过激活AMPK进而调节下游相关脂质合成蛋白的表达以达到改善NAFLD肝脏脂质代谢,逆转肝细胞脂质沉积的作用。
NF-κB已经被证实是具有多种功能的转录因子,p65是涉及NF-κB激活的一个重要亚基[22]。NF-κB在NAFLD的起始及发展过程中能调控多种基因的表达,譬如:食物中的脂质尤其是FFA能激活转录因子NF-κB,增加TNF-α、IL-6、CRP等炎症细胞因子的表达,引起肝损伤[23-24]。长期的高脂饮食和由此导致的肥胖会通过上述途径诱发炎症反应,导致肝内的炎症因子水平升高,最终引起NAFLD [25]。同时多项研究表明,AMPK可通过抑制NF-κB的活性进而减轻炎症反应[4, 9]。本文结果显示,模型组大鼠肝细胞核中NF-κB-p65的蛋白表达水平较正常组显著升高,且TNF-α、IL-6、CRP水平也显著升高;而护肝清脂片中、高剂量组能显著降低NAFLD大鼠肝细胞核中NF-κB-p65表达水平及TNF-α、IL-6、CRP水平,减轻肝细胞炎症反应,缓解NASH的发展进程。由此推测,护肝清脂片可能通过阻断NF-κB信号通路,减少TNF-α、IL-6、CRP等炎症因子的表达进而发挥其对NAFLD的抗炎作用。
| [1] | Tuyama AC, Chang CY. Non-alcoholic fatty liver disease[J]. J Diabetes, 2012, 4 (3): 266-80. DOI: 10.1111/j.1753-0407.2012.00204.x. |
| [2] | Golabi P, Locklear CT, Austin P, et al. Effectiveness of exercise in hepatic fat mobilization in non-alcoholic fatty liver disease: Systematic review[J]. World J Gastroenterol, 2016, 22 (27): 6318-27. DOI: 10.3748/wjg.v22.i27.6318. |
| [3] | Lin Z, Cai F, Lin N, et al. Effects of glutamine on oxidative stress and nuclear factor-kappaB expression in the livers of rats with nonalcoholic fatty liver disease[J]. Exp Ther Med, 2014, 7 (2): 365-70. |
| [4] | Zou B, Ge ZZ, Zhang Y, et al. Persimmon tannin accounts for hypolipidemic effects of persimmon through activating of AMPK and suppressing NF-kappaB activation and inflammatory responses in high-fat diet rats[J]. Food Funct, 2014, 5 (7): 1536-46. DOI: 10.1039/c3fo60635j. |
| [5] | Li M, Ye T, Wang XX, et al. Effect of Octreotide on Hepatic Steatosis in Diet-Induced Obesity in Rats[J]. PLoS One, 2016, 11 (3): e152085. |
| [6] | Ducommun S, Deak M, Sumpton D, et al. Motif affinity and mass spectrometry proteomic approach for the discovery of cellular AMPK targets: identification of mitochondrial fission factor as a new AMPK substrate[J]. Cell Signal, 2015, 27 (5): 978-88. DOI: 10.1016/j.cellsig.2015.02.008. |
| [7] | Smith BK, Marcinko K, Desjardins EM, et al. Treatment of nonalcoholic fatty liver disease: role of AMPK[J]. Am J Physiol Endocrinol Metab, 2016, 311 (4): E730-E740. DOI: 10.1152/ajpendo.00225.2016. |
| [8] | Lin KT, Hsu SW, Lai FY, et al. Rhodiola crenulata extract regulates hepatic glycogen and lipid metabolism via activation of the AMPK pathway[J]. BMC Complement Altern Med, 2016, 16 : 127. DOI: 10.1186/s12906-016-1108-y. |
| [9] | Salminen A, Hyttinen JM, Kaarniranta K. AMP-activated protein kinase inhibits NF-kappaB signaling and inflammation: impact on healthspan and lifespan[J]. J Mol Med (Berl), 2011, 89 (7): 667-76. DOI: 10.1007/s00109-011-0748-0. |
| [10] | Park HJ, Lee JY, Chung MY, et al. Green tea extract suppresses NFkappaB activation and inflammatory responses in diet-induced obese rats with nonalcoholic steatohepatitis[J]. J Nutr, 2012, 142 (1): 57-63. DOI: 10.3945/jn.111.148544. |
| [11] | Li Y, Ma J, Zhu H, et al. Targeted inhibition of calpain reduces myocardial hypertrophy and fibrosis in mouse models of type 1 diabetes[J]. Diabetes, 2011, 60 (11): 2985-94. DOI: 10.2337/db10-1333. |
| [12] | Li Z, Xu J, Zheng P, et al. Hawthorn leaf flavonoids alleviate nonalcoholic fatty liver disease by enhancing the adiponectin/ AMPK pathway[J]. Int J Clin Exp Med, 2015, 8 (10): 17295-307. |
| [13] | Tang W, Zeng L, Yin J, et al. Hugan Qingzhi Exerts AntiInflammatory Effects in a Rat Model of Nonalcoholic Fatty Liver Disease[J]. Evid Based Complement Alternat Med, 2015, 2015 : 810369. |
| [14] | Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults[J]. Aliment Pharmacol Ther, 2011, 34 (3): 274-85. DOI: 10.1111/apt.2011.34.issue-3. |
| [15] | Um JH, Park SJ, Kang H, et al. AMP-activated protein kinasedeficient mice are resistant to the metabolic effects of resveratrol[J]. Diabetes, 2010, 59 (3): 554-63. DOI: 10.2337/db09-0482. |
| [16] | Yang M, Li X, Zeng X, et al. Rheum palmatum L. Attenuates High Fat Diet-Induced Hepatosteatosis by Activating AMP-Activated Protein Kinase[J]. Am J Chin Med, 2016, 44 (3): 551-64. DOI: 10.1142/S0192415X16500300. |
| [17] | Mottillo EP, Desjardins EM, Crane JD, et al. Lack of Adipocyte AMPK Exacerbates Insulin Resistance and Hepatic Steatosis through Brown and Beige Adipose Tissue Function[J]. Cell Metab, 2016, 24 (1): 118-29. DOI: 10.1016/j.cmet.2016.06.006. |
| [18] | Fritzen AM, Lundsgaard AM, Jordy AB, et al. New Nordic DietInduced Weight Loss Is Accompanied by Changes in Metabolism and AMPK Signaling in Adipose Tissue[J]. J Clin Endocrinol Metab, 2015, 100 (9): 3509-19. DOI: 10.1210/jc.2015-2079. |
| [19] | Kudo N, Arai Y, Suhara Y, et al. A Single Oral Administration of Theaflavins Increases Energy Expenditure and the Expression of Metabolic Genes[J]. PLoS One, 2015, 10 (9): e137809. |
| [20] | Andre DM, Calixto MC, Sollon C, et al. Therapy with resveratrol attenuates obesity-associated allergic airway inflammation in mice[J]. Int Immunopharmacol, 2016, 38 : 298-305. DOI: 10.1016/j.intimp.2016.06.017. |
| [21] | Yin J, Luo Y, Deng H, et al. Hugan Qingzhi medication ameliorates hepatic steatosis by activating AMPK and PPARalpha pathways in L02 cells and HepG2 cells[J]. J Ethnopharmacol, 2014, 154 (1): 229-39. DOI: 10.1016/j.jep.2014.04.011. |
| [22] | Napetschnig J, Wu H. Molecular basis of NF-kappaB signaling[J]. Annu Rev Biophys, 2013, 42 : 443-68. DOI: 10.1146/annurev-biophys-083012-130338. |
| [23] | Glauert HP. Role of NF-kappaB in hepatocarcinogenesis and its potential inhibition by dietary antioxidants[J]. Curr Cancer Drug Targets, 2012, 12 (9): 1160-72. |
| [24] | Zhang B, Roh YS, Liang S, et al. Neurotropin suppresses inflammatory cytokine expression and cell death through suppression of NF-κB and JNK in hepatocytes[J]. PLoS One, 2014, 9 (12): e114071. DOI: 10.1371/journal.pone.0114071. |
| [25] | Zeng L, Tang WJ, Yin JJ, et al. Signal transductions and nonalcoholic fatty liver: a mini-review[J]. Int J Clin Exp Med, 2014, 7 (7): 1624-31. |
 2017, Vol. 37
2017, Vol. 37

