以颈前路椎间盘切除植骨融合术(ACDF)及颈前路椎体次全切植骨融合术(ACCF)为代表的颈椎融合手术是目前治疗脊髓型颈椎病及神经根型颈椎病的标准手术方式[1-3]。但相关生物力学研究发现颈椎融合术后改变了颈椎的正常生理运动规律,可导致手术相邻节段活动度(ROM)的增加以及椎间盘内压力的升高[4-6]。此种改变有可能加速上下相邻椎间盘的老化,引起相邻节段退变(ASD)[4-6]。
虽然目前ASD的发病机制尚不完全明确,但相关研究认为ASD的发病与自然老化[7]、相邻节段ROM和应力改变[4-6]、及手术操作[8-9]等密切相关。目前,关于ASD发病机制的研究方法主要包括临床研究[7-8, 10-11]、体外尸体生物力学研究[4-6, 12]及有限元分析研究[13-14]。相比于其他研究方法,有限元分析在ASD发病机制的研究中具有独特的优势。因为该研究方法可以直观地观察相邻节段椎间盘及关节突关节的应力改变,并可精确地计算颈椎总体及相邻节段的ROM,从而客观地评价颈椎融合手术对相邻节段的影响。因此,本研究拟建立正常下颈椎、ACDF及单椎体ACCF术后下颈椎三维有限元模型,通过对比手术前后相邻阶段ROM、椎间盘及关节突关节的应力改变,从而深入探讨颈椎融合术对颈椎相邻节段的影响。
1 资料和方法 1.1 正常人体三维有限元模型的建立选取1名28岁、身高176 cm、体质量72 kg的健康成年男性为实验志愿者。通过薄层CT平扫(0.625 mm)获取志愿者的颈椎数据并以DICOM格式保存至光盘。将光盘数据导入Mimics 15.0软件,分别定义冠状面,矢状面和横断面。利用Mimics软件进行合理的分割处理将各个椎骨分离。再利用软件的动态区域增长工具,选择人体骨骼阈值,分别建立C3~C7各个椎节模型。最后保存为二进制STL格式文件。
将前述各个椎节的STL文件导入Geomagic 12.0逆向工程软件中进行曲面构建。通过“砂纸”、“删除钉状物”“平滑”等工具合理的修理模型表面的毛刺、空洞。然后对表面三角面片进行编修、降噪处理,保证包络各个椎体的三角面片的空间封闭。最后将空间三角面片拟合成空间封闭的NURBS,以IGES格式导出,为下一步处理做准备。在Mimics15.0中测量颈椎皮质骨厚度约为1.5 mm。故在Geomagic 12中将椎骨模型向内偏移1.5 mm模拟松质骨。历经同样技术过程,建立皮质骨模型。
将保存的各个椎节IGES格式曲面导入Pro/Engineer 5.0中,若IGES格式文件是封闭的,则自动进行实体填充,完成各个椎体的实体化,以软件本身PRT格式保存各个椎骨模型。在此基础上,使用椎骨特征,重建椎间盘纤维环和髓核三维模型,以及其他软骨模型。
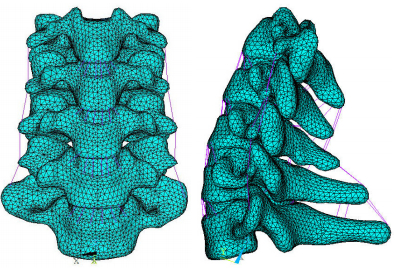
将C3~C7颈椎实体模型导入ANSYS14.0有限元分析软件中,参考前人研究成果,以高阶的六面体单元SOLID92来为实体部分划分网格;以LINK180单元来模拟韧带并设置其只承受拉力;并以三维壳单元SHELL181来模拟终板。综合参考其他学者研究成果[15-17]为各结构赋予材料属性其具体单元材质(表 1),最终完成C3~C7下颈椎有限元模型的建立(图 1)。
| 表 1 有限元模型中各组成部分的材料属性 Table 1 Material property of different components in the finite element model |
|
图 1 正常下颈椎三维有限元模型 Figure 1 A three-dimensional finite element model of the intact lower cervical vertebrae. |
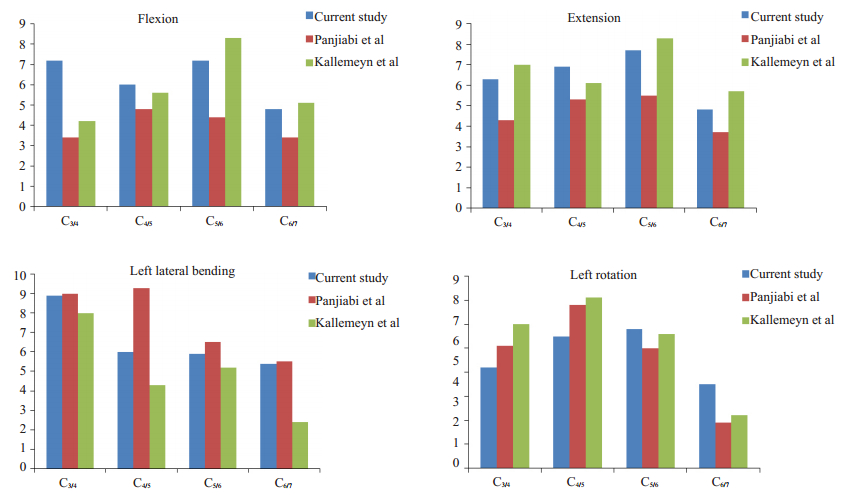
在ANSYS 14.0有限元分析软件中,对有限元模型最下端的C7椎体下表面进行完全约束,使椎体下表面各个节点完全固定。于C3上表面施加1 NM的纯力矩[18-19],使模型产生前屈、后伸、左侧屈及左旋转四个动作。通过测算模型在各种模拟状态下各个颈椎节段的ROM,与经典尸体生物力学研究文献中所得的对应节段ROM进行比较,以验证模型的有效性。如验证结果符合正常人体参数则可用于下一步研究。
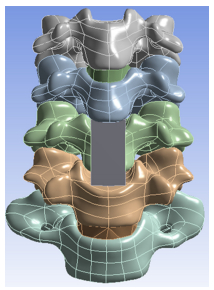
1.3 ACDF、ACCF术后颈椎三维有限元模型的建立在正常下颈椎三维有限元模型中,更改C5/6椎间盘及终板属性为松质骨,使C4与C5之间相对固定,模拟ACDF术后椎间植骨融合状态,从而建立C4/5 ACDF有限元模型,用于分析比较手术前后ROM及应力变化。在ACCF有限元模型的建立时,以C5椎体两端钩椎关节起始处为边界,将两侧边界内的椎体完全切除,并去除C4/5及C5/6椎间盘以模拟ACCF手术中的减压步骤。此后,建立一合适大小的长方体实体模型以模拟髂骨块,材料属性定义为松质骨。修剪其上下两端使其适应C4椎体底面及C6椎体顶面的解剖结构。修剪完成后将该髂骨块放置C5减压槽内,以模拟ACCF手术中的髂骨块移植过程。将髂骨块固定于相邻椎体的上下两端,使其不能产生相对活动,以模拟ACCF术后植骨已融合的状态,从而最终建立ACCF颈椎三维有限元模型用于术后ROM及应力变化分析(图 2)。
|
图 2 ACCF术后下颈椎实体模型 Figure 2 An entity model of the lower cervical vertebrae after ACCF. |
在ANSYS14.0有限元分析软件中,分别将正常下颈椎、ACDF和ACCF三个有限元模型最下端的C7椎体下表面完全约束,使其固定。分别于三个模型的C3上表面施加1NM的力矩,并额外施加74 N的垂直力以模拟头颅重量。载荷加载完成后使模型完成前屈、后伸、左侧屈及左旋转四个动作。经过有限元运算后,记录正常下颈椎、ACDF和ACCF各节段ROM、相邻节段椎间盘及关节突关节的应力云图和应力峰值,比较颈椎活动及力学特性的改变。
2 结果 2.1 三维有限元模型有效性的验证通过CT扫描、利用Mimics 15.0、Geomagic Studio 12、Pro/Engineer 5.0及ANSYS 14.0有限元分析软件,本研究成功建立了正常人体C3~C7三维有限元模型。该模型外观逼真,几何相似性好。所建立模型在前屈、后伸、左侧屈及左旋转4种状态下的ROM与已发表文献研究所测得的ROM数值基本吻合(图 3)。可以认为本有限元模型符合人体颈椎正常参数,能够有效地模拟下颈椎各个方向的生理运动,可以用于下一步试验做进一步研究。
|
图 3 本有限元模型与已发表文献数据ROM的比较 Figure 3 Comparison of the ROM of the finite element model against published data. |
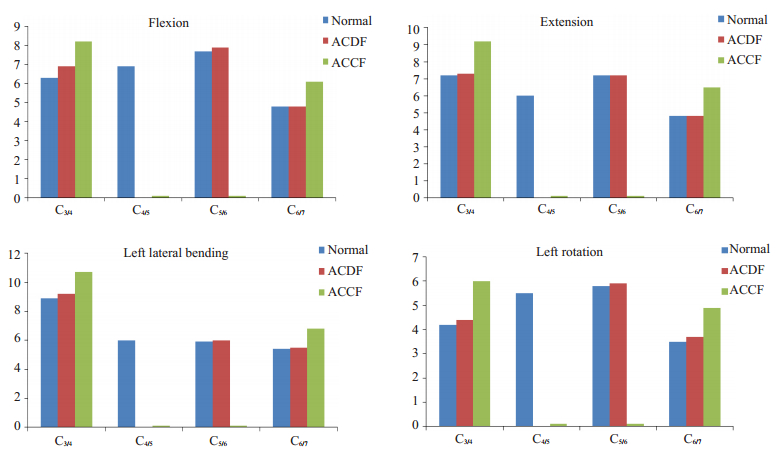
ACDF、ACCF术后下颈椎各节段ROM发生明显变化(图 4)。颈椎总体ROM在前屈、后伸、左侧屈及左旋转四个方向的ROM由术前的25.7°、25.2°、26.2°、19°降低至ACDF术后的19.6°、19.3°、20.7°、14°。而ACCF术后各个方向的ROM进一步下降(14.5°、15.9°、17.7°、11.1°)。在ACDF模型中,相邻节段C3/4在前屈、后伸、左侧屈及左旋转四个方向的ROM由术前的6.3°、7.2°、8.9°、4.2°增长至术后的6.9°、7.3°、9.2°、4.4°;相邻节段C5/6在前屈、后伸、左侧屈及左旋转的ROM由术前的7.7°、7.2°、5.9°、5.8°增长至术后的7.9°、7.2°、6°、5.9°。而在ACCF有限元模型中,ACCF术后相邻节段各个方向的ROM进一步增加。相邻节段C3/4在前屈、后伸、左侧屈及左旋转四个方向的ROM由术前的6.3°、7.2°、8.9°、4.2°增长至术后的8.2°、9.2°、10.7°、6.0°。相邻节段C6/7在前屈、后伸、左侧屈及左旋转的ROM由术前的4.8°、4.8°、5.4°、3.5°增长至术后的6.1°、6.5°、6.8°、4.9°。
|
图 4 ACCF手术前后颈椎ROM的比较 Figure 4 Comparison of the ROM between the intact cervical vertebrae and the cervical vertebrae after ACCF. |
同时,在ACDF和ACCF有限元模型中,融合节段各个方向的ROM急剧丢失。ACDF有限元模型中,融合节段(C4/5)在前屈、后伸、左侧屈及左旋转四个方向的ROM由术前的6.9°、6.0°、6.0°、5.5°显著降低至0°、0°、0°、0°。ACCF模型中,融合节段C4/5在前屈、后伸、左侧屈及左旋转四个方向的ROM由术前的6.9°、6.0°、6.0°、5.5°显著降低至0°、0.1°、0.1°、0.1°。融合节段C5/6在前屈、后伸、左侧屈及左旋转四个方向的ROM由术前的7.7°、7.2°、5.9°、5.8°急剧降低至0.1°、0.1°、0.1°、0.1°。
2.3 ACDF、ACCF相邻节段椎间盘及关节突关节应力的变化ACDF术后相邻节段椎间盘应力峰值明显增加(图 5)。相邻节段C3/4在前屈、后伸、左侧屈及左旋转四个方向应力峰值由术前的5.18、5.37、6.72、6.28 MPa升高至术后的5.18、5.46、7.84、10.91 MPa。相邻节段C5/6在前屈、后伸、左侧屈及左旋转四个方向应力峰值由术前的1.68、3.06、2.76、3.15 MPa升高至术后的1.68、3.16、2.81、3.19 MPa。

|
图 5 ACCF手术前后相邻节段椎间盘应力变化 Figure 5 Variations of stress in the adjacent intervertebral discs before and after ACCF. |
在ACCF术后,相邻节段椎间盘应力峰值也明显增加(图 5)。相邻节段C3/4在前屈、后伸、左侧屈及左旋转四个方向应力峰值由术前的5.18、5.37、6.72、6.28 MPa升高至5.18、5.46、7.83、10.91 MPa。相邻节段C6/7在前屈、后伸、左侧屈及左旋转四个方向应力峰值由术前的1.26、1.85、1.25、1.09 MPa升高至1.26、2.11、1.63、1.57 MPa。
关于相邻节段关节突关节的应力峰值,ACDF术后下颈椎相邻节段关节突关节应力峰值升高(图 6)。C4上关节突前屈、后伸、左侧屈及左旋转四个方向应力峰值由术前的升高至0.25、2.13、3.17、3.57 MPa升高至术后的0.31、2.69、6.18、4.83 MPa。C6上关节突在前屈、后伸、左侧屈及左旋转四个方向应力峰值由术前的0.15、1.56、1.12、3.17 MPa升高至术后的0.29、10.9、8.92、6.24 MPa。
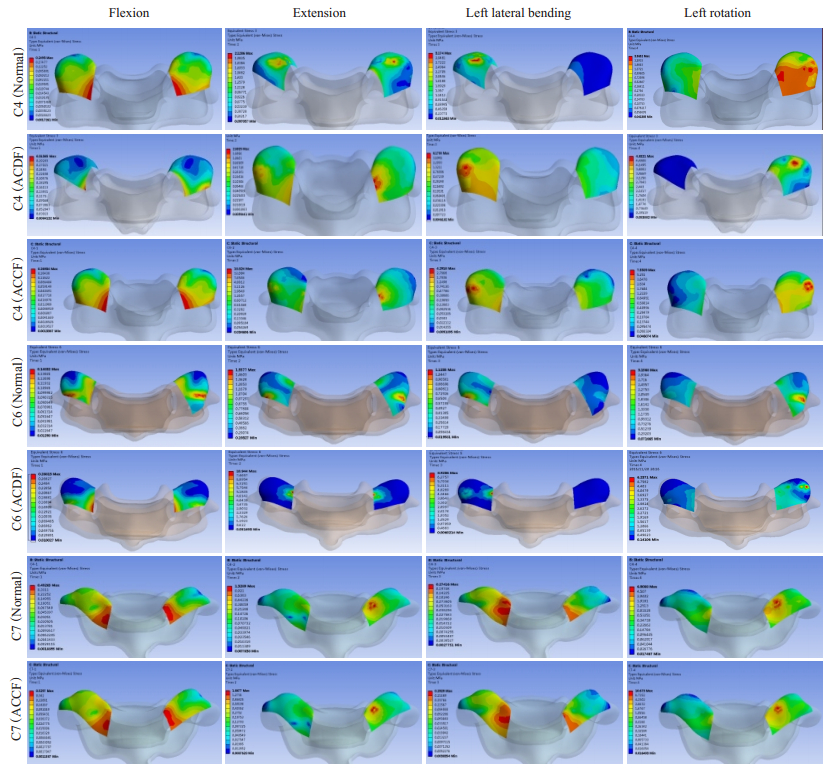
|
图 6 ACCF手术前后相邻节段关节突关节应力变化 Figure 6 Variations of stress in the adjacent facet joints before and after ACCF. |
ACCF术后相邻节段关节突应力峰值也明显升高。C4上关节突前屈、后伸、左侧屈及左旋转四个方向应力峰值由术前的升高至0.25、2.13、3.17、3.57 MPa升高至术后的0.27、18.82、4.29、7.56 MPa。C7上关节突在前屈、后伸、左侧屈及左旋转四个方向的应力峰值由术前的0.49、1.33、0.27、6.91 MPa升高至0.53、1.87、0.3、10.67 MPa。
3 讨论本研究采用有限元分析的方法探讨颈椎融合术后(ACDF和ACCF)对各节段ROM及相邻节段椎间盘和关节突关节应力所产生的影响。研究结果表明颈椎融合术后颈椎总体ROM降低。并且,颈椎总体ROM降低程度与融合节段的多少密切相关。随着融合节段的增加,颈椎总体ROM进一步降低。同时,颈椎融合节段ROM完全丢失,相邻节段ROM代偿性增加。且随着融合节段的增加,相邻节段各个方向ROM进一步增加。此外,颈椎融合术后相邻节段椎间盘和关节突关节应力峰值与术前相比明显升高,这与相邻节段ROM代偿性增加密切相关。以上结果证实颈椎融合术后改变了正常颈椎生理特性,增加了颈椎相邻节段的运动负荷,有可能加速相邻节段椎间盘及关节突关节的退化,引起ASD。
目前颈椎生物力学及有限元分析所采用的研究方法根据载荷加载的方式不同主要分为3种类型[20]。载荷法、位移法和混合法。有关颈椎融合术后ROM的研究[21-23]发现,颈椎融合术后总体ROM减少,这证实在脊柱融合术后患者为保护手术节段而减少运动角度。当该临床观察结果与三种生物力学实验方法比较时,位移法和混合法的实验假设与临床观察结果不符,而载荷法更加符合临床实际情况。本研究采用载荷法用于实验中各个模型载荷的加载,实验结果表明颈椎融合术后总体ROM与术前相比显著降低,相邻节段ROM代偿性增加。这与Chang等[26]的临床观察结果一致。证实本研究能够较为真实地反应患者颈椎融合术后的运动状态。
关于ASD与颈椎融合之间的关系,Hilibrand等[8]认为颈椎融合术后相邻节段退变性疾病的发生率为20%~32%。Loumeau等[24]开展了一项关于人工颈椎间盘置换和颈椎ACDF手术之间的随机对照研究。研究结果表明,在随访的7年中,18.18%的ACDF患者因ASD行二次手术。而人工颈椎间盘置换组所有患者(0%)均无二次手术情况的发生。Lei等[10]回顾分析66例行人工颈椎间盘置换或ACDF患者的术后情况。术后8年,ACDF组ASD的发病率为56.8%,显著高于人工颈椎间盘置换组(28.6%)。人工颈椎间盘置换组术后8年手术节段平均ROM为7.0°,显著高于ACDF组。我们通过有限元分析发现,由于融合节段造成了相邻节段各个方向ROM的增加,椎间盘及关节突关节的应力峰值也随之增加。因此,我们认为这种应力的重新分布有可能是造成颈椎融合术后ASD发生的重要原因之一。
综上所述,颈椎融合术后总体ROM降低、相邻节段各个运动方向ROM升高,显著改变了颈椎正常的运动方式。并且随着融合节段的增加,颈椎总体和相邻节段ROM的改变更加明显。此外,颈椎融合术后相邻节段椎间盘及关节突关节应力峰值升高,有可能加速相邻节段椎间盘及关节突关节的退化,引起ASD。
| [1] | Douglas AF, Cooper PR. Cervical corpectomy and strut grafting[J]. Neurosurgery, 2007, 60 (1): 137-42. |
| [2] | Li J, Jiang J, Wang W, et al. Mid-term outcomes of anterior cervical fusion for cervical spondylosis with Sympathetic symptoms[J]. Clin Spine Surg, 2016, 29 (6): 255-60. |
| [3] | Smith GW, Robinson RA. The treatment of certain cervical-spine disorders by anterior removal of the intervertebral disc and interbody fusion[J]. J Bone Joint Surg Am, 1958, 40-A (3): 607-24. |
| [4] | Ragab A, Escarcega J, Zdeblick A. A quantitative analysis of strain at adjacent segments after segmental immobilization of the cervical spine[J]. J Spinal Disord Tech, 2006, 19 (6): 407-10. DOI: 10.1097/00024720-200608000-00006. |
| [5] | Chang Kyu, Kim H, Lee C, et al. Changes in adjacent-level disc pressure and facet joint force after cervical arthroplasty compared with cervical discectomy and fusion[J]. J Neurosurg Spine, 2007, 7 (1): 33-9. DOI: 10.3171/SPI-07/07/033. |
| [6] | Welke B, Schwarze M, Hurschler C, et al. In vitro investigation of a new dynamic cervical implant: comparison to spinal fusion and total disc replacement[J]. Eur Spine J, 2016, 25 (7): 2247-54. DOI: 10.1007/s00586-015-4361-8. |
| [7] | Goffin J, Geusens E, Vantomme N, et al. Long-term follow-up after interbody fusion of the cervical spine[J]. J Spinal Disord Tech, 2004, 17 (2): 79-85. DOI: 10.1097/00024720-200404000-00001. |
| [8] | Hilibrand S, Carlson D, Palumbo A, et al. Radiculopathy and myelopathy at segments adjacent to the site of a previous anterior cervical arthrodesis[J]. J Bone Joint Surg Am, 1999, 81 (4): 519-28. DOI: 10.2106/00004623-199904000-00009. |
| [9] | Katsuura A, Hukuda S, Saruhashi Y, et al. Kyphotic malalignment after anterior cervical fusion is one of the factors promoting the degenerative process in adjacent intervertebral levels[J]. Eur Spine J, 2001, 10 (4): 320-4. DOI: 10.1007/s005860000243. |
| [10] | Lei T, Liu Y, Wang H, et al. Clinical and radiological analysis of Bryan cervical disc arthroplasty: eight-year follow-up results compared with anterior cervical discectomy and fusion[J]. Int Orthop, 2016, 40 (6): 1197-203. DOI: 10.1007/s00264-015-3098-7. |
| [11] | Zhang XE, Zhang XE, Chen C, et al. Randomized, controlled, multicenter, clinical trial comparing BRYAN cervical disc arthroplasty with anterior cervical decompression and fusion in China[J]. Spine (Phila Pa 1976), 2012, 37 (6): 433-8. DOI: 10.1097/BRS.0b013e31822699fa. |
| [12] | Patwardhan G, Khayatzadeh Saeed, Nguyen Lam, et al. Is cervical sagittal imbalance a risk factor for adjacent segment pathomechanics after multilevel fusion[J]. Spine (Phila Pa 1976), 2016, 41 (10): E580-8. DOI: 10.1097/BRS.0000000000001316. |
| [13] | Kim YE, Choi HW. Effect of disc degeneration on the muscle recruitment pattern in upright posture: a computational analysis[J]. Comput Methods Biomech Biomed Engin, 2015, 18 (15): 1622-31. DOI: 10.1080/10255842.2014.936858. |
| [14] | Yan Z, Qiu X, Wu H, et al. Finite element analysis in adjacent segment degeneration after lumbar fusion[J]. Int J Med Robot, 2011, 7 (1): 96-100. DOI: 10.1002/rcs.v7.1. |
| [15] | Zhang OH, Teo EC, Ng HW. Development and validation of a CO-C7 FE complex for biomechanical study[J]. J Biome Eng, 2005, 127 (5): 729-35. DOI: 10.1115/1.1992527. |
| [16] | Shin DS, Lee K, Kim D. Biomechanical study of lumbar spine with dynamic stabilization device using finite element method[J]. Comput Aided Des, 2007, 39 (7): 559-67. DOI: 10.1016/j.cad.2007.03.005. |
| [17] | Yoganandan N, Kumaresan S, Pintar FA. Biomechanics of the cervical spine Part 2. Cervical spine soft tissue responses and biomechanical modeling[J]. Clin Biomech (Bristol, Avon), 2001, 16 (1): 1-27. DOI: 10.1016/S0268-0033(00)00074-7. |
| [18] | Kallemeyn N, Gandhi A, Kode S, et al. Validation of a C2-C7 cervical spine finite element model using specimen-specific flexibility data[J]. Med Eng Phys, 2010, 32 (5): 482-9. DOI: 10.1016/j.medengphy.2010.03.001. |
| [19] | Panjabi MM, Crisco JJ, Vasavada A, et al. Mechanical properties of the human cervical spine as shown by three-dimensional loaddisplacement curves[J]. Spine (Phila Pa 1976), 2001, 26 (24): 2692-700. DOI: 10.1097/00007632-200112150-00012. |
| [20] | Volkheimer D, Malakoutian M, Oxland R, et al. Limitations of current in vitro test protocols for investigation of instrumented adjacent segment biomechanics: critical analysis of the literature[J]. Eur Spine J, 2015, 24 (9): 1882-92. DOI: 10.1007/s00586-015-4040-9. |
| [21] | Coric D, Nunley D, Guyer D, et al. Prospective, randomized, multicenter study of cervical arthroplasty: 269 patients from the Kineflex|C artificial disc investigational device exemption study with a minimum 2-year follow-up: clinical article[J]. J Neurosurg Spine, 2011, 15 (4): 348-58. DOI: 10.3171/2011.5.SPINE10769. |
| [22] | Chang K, Kim H, Lee C, et al. Range of motion change after cervical arthroplasty with ProDisc-C and prestige artificial discs compared with anterior cervical discectomy and fusion[J]. J Neurosurg Spine, 2007, 7 (1): 40-6. DOI: 10.3171/SPI-07/07/040. |
| [23] | Gao Y, Liu M, Li T, et al. A meta-analysis comparing the results of cervical disc arthroplasty with anterior cervical discectomy and fusion (ACDF) for the treatment of symptomatic cervical disc disease[J]. J Bone Joint Surg Am, 2013, 95 (6): 555-61. DOI: 10.2106/JBJS.K.00599. |
| [24] | Loumeau P, Darden V, Kesman J, et al. A RCT comparing 7-year clinical outcomes of one level symptomatic cervical disc disease (SCDD) following ProDisc-C total disc arthroplasty (TDA) versus anterior cervical discectomy and fusion (ACDF)[J]. Eur Spine J, 2016, 25 (7): 2263-70. DOI: 10.1007/s00586-016-4431-6. |
 2017, Vol. 37
2017, Vol. 37

