癫痫是神经系统常见疾病,尽管大部分癫痫患者接受抗癫痫药物的治疗后可以有效缓解癫痫发作,但是仍有25%的患者发展为药物难治性癫痫]1]。因此新型的抗癫痫药物的开发和研究是十分必要的。难治性癫痫最常见的类型为颞叶癫痫。目前,颞叶癫痫的发病机制尚未阐明,但归根结底,癫痫的发生是神经元功能的异常引起的]2]。GLP-1R是广泛分布于机体外周和中枢等器官的G蛋白偶联受体,GLP-1是GLP-1R的天然激动剂,该受体激动后,可以通过cAMP/PKA/CREB,cAMP/Akt/PKB等信号通路发挥多种生理功能]3-4]。GLP-1是由小肠下段L细胞分泌的一种胃肠激素。然而,最近研究发现,在大脑的最后区和孤束核区均发现有能够表达GLP-1的神经元,且DVC区(中枢迷走神经复合体)和海马等部位分布有高密度的GLP-1结合位点]5-6]。这就说明GLP-1与GLP-1R在中枢神经系统中发挥着重要作用。Xu等]7-11]发现,进入中枢神经系统的GLP-1与GLP-1R结合后,可以促进神经元增殖,减少神经元凋亡,缓解突触重塑和减少tau蛋白磷酸化,而这些都是产生神经退行性疾病特别是癫痫和阿尔茨海默病的重要机制。近年来GLP-1/GLP-1R的神经保护作用在阿尔茨海默病与脑缺血等疾病中研究甚多[12-14],而在癫痫中的研究较少。Koshal等[15]用GLP-1/GLP-1R的激动药物利那鲁肽治疗癫痫小鼠中发现,上调的GLP-1/GLP-1R可以恢复癫痫小鼠中表达改变的GABA受体、谷氨酸受体的水平,达到很好的抗癫痫作用。可见GLP-1/GLP-1R与癫痫的关系十分密切。本实验首先通过对颞叶癫痫患者中GLP-1/GLP-1R表达的研究,观察GLP-1/GLP-1R在颞叶癫痫患者中是否有差异性表达。然后用戊四氮癫痫模型模拟人颞叶癫痫,观察GLP-1/GLP-1R在癫痫大鼠与颞叶癫痫患者中的差异性表达是否一致。最后,通过维格列汀灌胃治疗癫痫大鼠,探索维格列汀是否可以通过上调GLP-1/ GLP-1R而发挥抗癫痫作用。
1 材料和方法 1.1 材料 1.1.1 主要试剂与仪器戊四氮购自于美国SigmaAldrich公司,维格列汀购自于瑞士的Novartis公司,兔抗GLP-1R抗体购自于中国博奥森公司,山羊抗GLP-1R购自于美国Santa Cruz公司,兔抗GFAP购自于中国博士德公司。兔抗β-actin、兔抗MAP2和辣根过氧化物酶标记的山羊抗兔IgG购自于美国proteintech公司,Dylight633标记的驴抗山羊购自于美国ImmunoReagents公司,Alexa Fluor555标记的驴抗兔、组织裂解液RIPA、蛋白酶抑制剂PMSF、BCA蛋白浓度测定试剂盒以及Western blotting试剂购自于中国碧云天公司,免疫组织化学染色试剂盒购自于中国中杉金桥公司。ELISA试剂盒购自于中国武汉优尔生商贸有限公司,冰冻切片机和石蜡切片机均为德国的Leica公司,凝胶成像分析系统为美国Bio Rad公司,Nikon 1R共聚焦显微镜和OLYMPUS PM20全自动显微镜分别为日本Nikon公司和Olympus公司。
1.1.2 人标本的获得人体皮质标本取自于重庆医科大学附属第一医院,第三军医大学大坪医院,第三军医大学新桥医院等医院。癫痫病人纳入标准如下:(1)至少一种典型的发作类型,发作类型符合国际抗癫痫联盟2001分类标准;(2)排除其他神经系统疾病引起的癫痫发作;(3)术中进行了神经导航,影像学等进行癫痫灶的定位,确定切除的皮质为癫痫灶;(4)正规使用3种或3种以上的一线抗癫痫药物。脑外伤病人纳入标准如下:(1)无癫痫发作史;(2)没有使用任何抗癫痫药物;(3)除脑外伤外,无其它神经系统疾病;(4)病理切片证实脑组织基本正常。脑外伤患者切除的皮质为对照组(control;n=14),颞叶癫痫患者行癫痫灶切除的皮质为癫痫组(epilepsy;n=23)。血清收集于上述门诊随访,用于此研究的癫痫组和对照组手术切除标本及血清获得家属和患者的同意并签订了知情同意书。
1.2 方法 1.2.1 癫痫模型的制备[16]90只SPF级雄性SD大鼠(200~250 g)购自于重庆医科大学动物实验中心,平均随机分为对照组(A组,control)、PTZ单纯致痫组(B组,PTZ-induced epilepsy)、生理盐水2 mL/kg干预组(C组,PTZ+2 mL/kg saline)、维格列汀2.5 mg/kg干预组(D组,PTZ+2.5 mg/kg vildagliptin)、维格列汀5 mg/kg干预组(E组,PTZ+5 mg/kg vildagliptin)、维格列汀10 mg/kg干预组(F组,PTZ+10 mg/kg vildagliptin)。B、C、D、E、F组腹腔注射PTZ(35 mg/kg),A组给予腹腔注射等量生理盐水。C、D、E、F组大鼠每日PTZ注射前1 h分别给予生理盐水2 mL/kg、维格列汀2.5 mg/kg、维格列汀5 mg/kg、维格列汀10 mg/kg灌胃[17],PTZ注射后观察行为学1 h,采用Racine评分[18],共连续观测21 d。记录发作级别,大鼠连续3 d出现≥Ⅳ级癫痫发作的被认为完全点燃,3周后处死大鼠。
1.2.2 Western blotting检测GLP-1R蛋白表达 1.2.2.1 人标本中GLP-1R蛋白表达变化用于Western blotting实验的人体标本每例用冻存管单独包装后,立即放入液氮中储存备用。从液氮中取出各组人体标本,按组织质量(mg)、PMSF(μL)及RIPA(μL)以1:0.1:10的比例混合。匀浆器充分研磨后静置20 min,4 ℃ 12 000 g离心20 min后收集上清,即为总蛋白溶液。按BCA试剂盒说明书步骤检测总蛋白的浓度。将5×SDS上样缓冲液与上清液以1:4体积比混合后,沸水变性5 min。变性后的蛋白上样与SDS-PAGE,经电泳电转后,蛋白转至于PVDF膜上。5%脱脂奶粉室温封闭1 h,分别以兔抗GLP-1R(1:400)和兔抗β-actin(1:3000)4 ℃过夜。用TBST清洗PVDF膜3次,每次10 min,然后用辣根过氧化物酶标记的山羊抗兔IgG(1:2000)室温摇床孵育1 h。清洗后用化学发光法采集图像。用Quantity One分析光密度,计算GLP-1R/β-actin的值。
1.2.2.2 大鼠标本中GLP-1R蛋白表达变化大鼠造模完成后,用于Western blotting实验的各组大鼠经4%水合氯醛腹腔注射(10 mL/kg)麻醉后立即断头取脑,在冰上快速分离皮质和海马组织,分别置于不同的冻存管单独包装,液氮中储存备用。余下步骤同1.2.2.1。
1.2.3 免疫组织化学染色观察GLP-1R蛋白表达变化 1.2.3.1 人标本中GLP-1R蛋白表达变化用于免疫组织化学染色实验的人体标本收集后立即用PBS冲洗,经4%多聚甲醛浸泡固定12 h后程序脱水,石蜡包埋。用石蜡切片机连续切片,室温保存备用。取出石蜡切片,进行3% H2O2阻断,0.01 mol/L柠檬酸抗原修复缓冲液微波修复(高火3 min,低火15 min),山羊血清封闭后滴加兔抗GLP-1R(1:30),PBS洗涤3次,每次5 min,滴加生物素化山羊抗兔IgG,SABC孵育后,DAB显色,常规梯度乙醇脱水干燥,二甲苯透明,中性树胶封片。运用OLYMPUS PM20全自动显微镜在400倍显微镜下拍照,通过Image-Pro Plus 6.0软件分析GLP-1R的光密度值。
1.2.3.2 大鼠标本中GLP-1R蛋白表达变化大鼠造模完成后,用于免疫组织化学染色实验的各组大鼠在水合氯醛麻醉下(方法同前),马上进行内固定(用生理盐水和4%多聚甲醛先后经心脏灌注)。然后取出全脑,将全脑浸泡在4%多聚甲醛中固定12 h,然后进行程序脱水,石蜡包埋,用石蜡切片机连续切片,室温保存备用。余下步骤同1.2.3.1。
1.2.4 免疫荧光染色对GLP-1R蛋白的定位 1.2.4.1 人标本中GLP-1R蛋白的定位用于免疫荧光染色实验的人体标本收集后立即用PBS冲洗,经4%多聚甲醛固定12 h后,用15%蔗糖脱水,沉底后换30%蔗糖,沉底后用冰冻切片机切片,-80 ℃保存备用。取出冰冻切片,丙酮固定20 min,PBS洗3次,每次5 min,0.4% Triton 37 ℃破膜20 min,清洗后切片放入柠檬酸抗原修复液中,微波炉中高火3 min,低火15 min,用驴血清封闭液37 ℃封闭2 h,分别用羊来源GLP-1R(1:20)和兔来源MAP2(1:50)混合物以及羊来源GLP-1R(1:20)和兔来源GFAP(1:50)混合物4 ℃过夜,37 ℃复温1 h,PBS清洗后避光滴加驴抗羊Dylight633(1:50)、驴抗兔555(1:50)37 ℃孵育1 h,PBS清洗后滴加DAPI(1:20)室温孵育10 min,封片后用共聚焦显微镜采集图像。
1.2.4.2 大鼠标本中GLP-1R蛋白的定位大鼠造模完成后,用于免疫荧光染色实验的大鼠在在水合氯醛麻醉下(方法同前),马上进行内固定(方法同前)。然后取出全脑,将全脑浸泡在4%多聚甲醛固定12 h,然后用15%蔗糖脱水,沉底后换30%蔗糖,沉底后用冰冻切片机切片,-80 ℃保存备用。余下步骤同1.2.4.1。
1.2.5 ELISA检测血清中GLP-1的表达变化 1.2.5.1 人血清中GLP-1的表达变化人各组血清标本取自于门诊,收集后立即转入冻存管,-80℃保存。按ELISA说明书制作标准曲线和测定GLP-1的含量。
1.2.5.2 大鼠血清中GLP-1的表达变化大鼠麻醉后(方法同前),经眼球取全血,静置30 min后,经4 ℃ 3000 r/min离心15 min获得血清。按ELISA说明书制作标准曲线和测定GLP-1的含量。
1.3 统计学处理采用SPSS19.0软件进行分析,对所得数据分别进行正态性及方差齐性检验,若符合正态分布且方差齐同,计量资料以采用均数±标准差表示。两组比较采用t检验,多组比较采用单因素ANOVA分析,事后检验采用Dunnett's检验两组之间的差异,以P < 0.05为差异有统计学意义。
2 结果 2.1 GLP-1R与GLP-1在颞叶癫痫患者中的表达变化免疫荧光显示,在人皮质中,GLP-1R(紫色)与神经元标志物MAP2(红色)共表达,与星型胶质细胞标志物GFAP(红色)无共表达(图 1A)。在颞叶癫痫患者皮质中,免疫组织化学染色和Western blotting都显示GLP-1R有降低趋势(图 1B,C,P < 0.05)。ELISA显示癫痫患者血清中GLP-1的表达水平降低(图 1D,P < 0.05)。
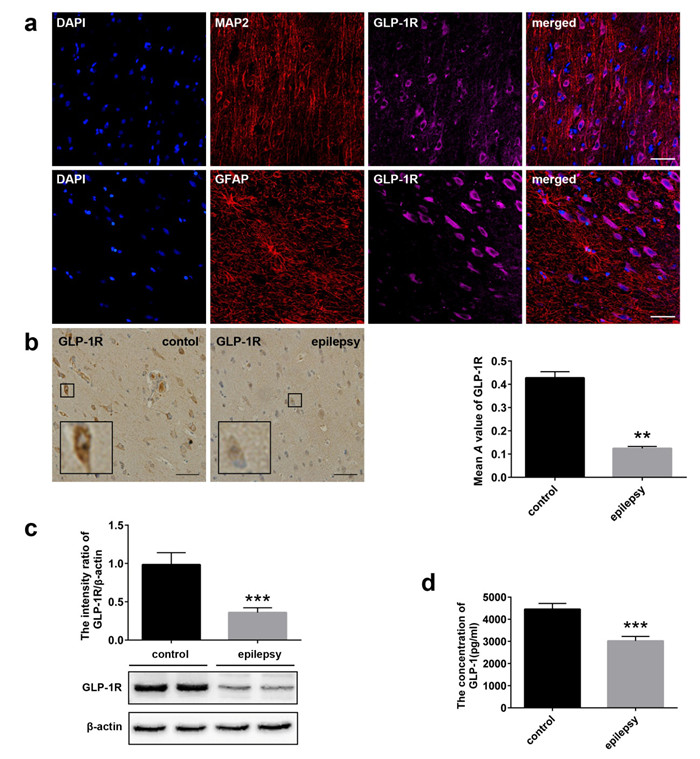
|
图 1 GLP-1R与GLP-1在颞叶癫痫患者中的表达变化 Figure 1 Expressions of GLP-1R and GLP-1 in patients with temporal lobe epilepsy. A: Immunofluorescent staining for GLP-1R (MAP2 is a marker of neurons and GFAP a marker of astrocytes). Scale bar: 50 μm; B: Immunohistochemical staining for GLP-1R. Scale bar: 50 μm; C: Western blotting for GLP-1R; D: Results of ELISA for GLP-1. **P < 0.01 vs control, ***P < 0.001 vs control. |
免疫荧光显示,在大鼠皮质中,GLP-1R(紫色)与MAP2(红色)共表达,与GFAP(红色)无共表达(图 2A)。在戊四氮癫痫大鼠皮质中,免疫组织化学染色和Western blotting都显示GLP-1R有降低趋势(图 2B,C,P < 0.05)。ELISA显示癫痫大鼠血清中GLP-1的表达水平降低(图 2D,P < 0.05)。
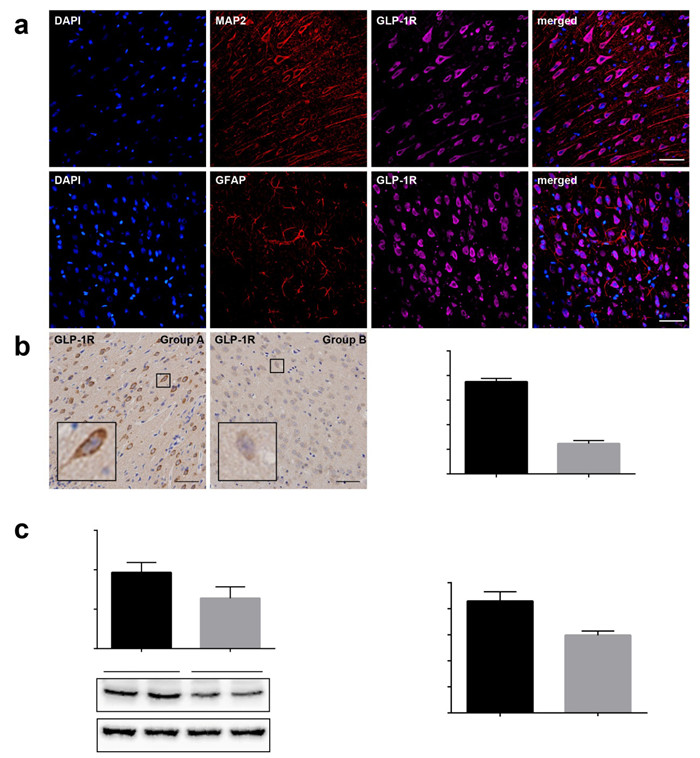
|
图 2 GLP-1R与GLP-1在戊四氮癫痫大鼠皮质中的表达变化 Figure 2 Expressions of GLP-1R and GLP-1 in the cortex of PTZ-induced epileptic rats. A: Immunofluorescent staining for GLP-1R. Scale bar: 50 μm; B: Immunohistochemical staining for GLP-1R. Scale bar: 50 μm; C: Western blotting for GLP-1R; D: Results of ELISA for GLP-1. **P < 0.01 vs Goup A, ***P < 0.001 vs Group A. Group A: Control group; Group B: PTZ-induced epilepsy group. |
免疫荧光显示,在大鼠海马中,GLP-1R(紫色)与MAP2(红色)共表达,与GFAP(红色)无共表达(图 3A)。在戊四氮癫痫大鼠海马中,免疫组织化学染色和Western blotting都显示GLP-1R有降低趋势(图 3B~D,P < 0.05)。
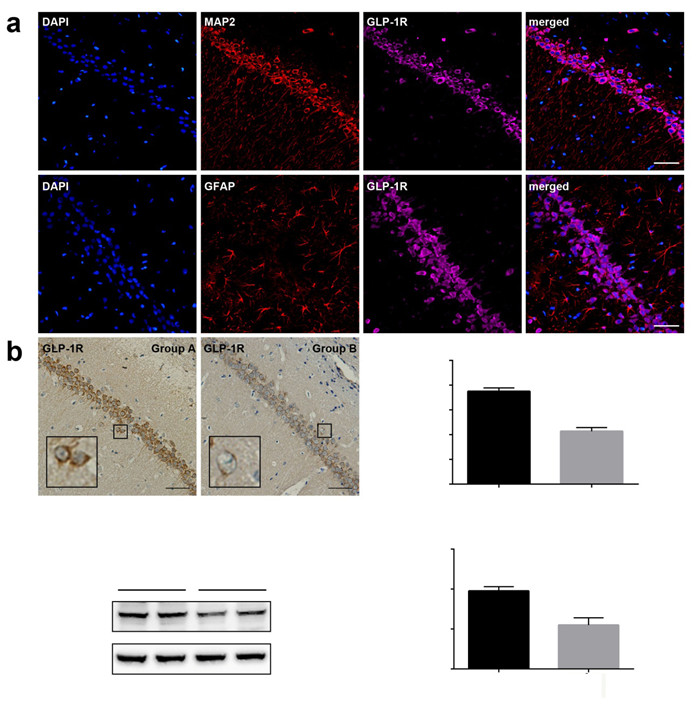
|
图 3 GLP-1R在戊四氮癫痫大鼠海马中的表达变化 Figure 3 Expression of GLP-1R in the hippocampus of PTZ-induced epileptic rats. A: Immunofluorescent staining for GLP-1R (CA1 region). Scale bar: 50 μm; B: Immunohistochemical staining for GLP-1R (CA1 region). Scale bar: 50 μm; C, D: Western blotting for GLP-1R. ***P < 0.001 vs Group A. Group A: Control group; Group B: PTZ-induced epilepsy group. |
对照组大鼠(A组)无癫痫样发作,无死亡,余15只。大鼠注射PTZ后,陆续出现凝视、缩头、反复洗脸样动作、面部及头部抽搐等,以后症状逐渐加重。PTZ单纯致痫组(B组)和生理盐水治疗组(C组)于PTZ注射第6~9 d开始出现全身肌阵挛、双前肢抬起,最终发展为全身强直-阵挛性发作,达到RacineⅣ~Ⅴ级点燃标准,以后每天均有Ⅳ~Ⅴ级。期间B组由于全身强直-阵挛性发作而死亡1只,余14只。C组大鼠无死亡,余15只。维格列汀治疗组(D、E、F组)于PTZ注射第9~16 d达到RacineⅣ~Ⅴ级点燃标准,无大鼠死亡,各组均余15只。由于维格列汀的治疗,每次出现高级别(Ⅳ~Ⅴ级)的癫痫发作后,大鼠的精神状态均比生理盐水治疗组好,且高级别癫痫发作的次数明显低于生理盐水干预组。经统计发现,与生理盐水治疗组(C组)相比,维格列汀治疗组(D、E、F组)癫痫发作的潜伏期明显延长(图 4A,P < 0.05),维格列汀治疗组癫痫发作(Ⅳ~Ⅴ级)的次数明显降低(图 4B,P < 0.05)。且维格列汀浓度越高,效果越明显。
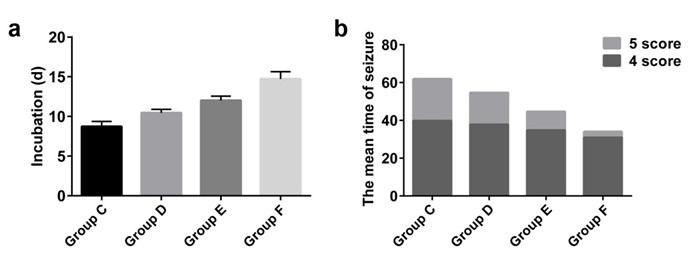
|
图 4 维格列汀干预后癫痫行为学的变化 Figure 4 Changes of epileptic behaviors in rats after vildagliptin treatment. A: Latency time in different groups; B: Mean seizure attack times; Group C: PTZ+2 m L/kg saline; Group D: PTZ+ 2.5 mg/kg vildagliptin; Group E: PTZ+5 mg/kg vildagliptin; Group F: PTZ+10 mg/kg vildagliptin. |
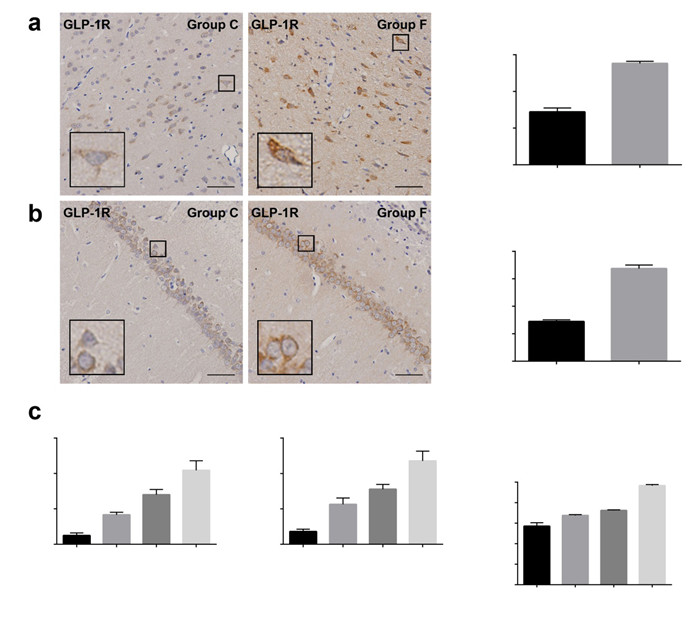
在大鼠皮质和海马中,免疫组织化学染色和Western blotting都显示随着维格列汀的浓度逐渐升高,GLP-1R和GLP-1的表达也增高(图 5A~D,P < 0.05)。血清中的GLP-1水平随维格列汀治疗浓度的增高而增高(图 5F,P < 0.05)。
|
图 5 维格列汀干预后GLP-1R与GLP-1的表达变化 Figure 5 Expressions of GLP-1R and GLP-1 in rats after vildagliptin treatment. A: Immunohistochemical staining for GLP-1R in the cortex. Scale bar: 50 μm; B: Immunohistochemical staining for GLP-1R in the hippocampus (CA1 region). Scale bar: 50 μm; C: Western blotting for GLP-1R in the cortex; D: Western blotting for GLP-1R in the hippocampus; E: ELISA for GLP-1. **P < 0.01 vs. Group C, ***P < 0.001 vs. Group C. Group C: PTZ + 2 mL/kg saline; Group D: PTZ + 2.5 mg/kg vildagliptin; Group E: PTZ+5 mg/kg vildagliptin; Group F: PTZ+10 mg/kg vildagliptin. |
通过对颞叶癫痫患者的皮质和血清研究发现,GLP-1R与GLP-1在癫痫患者中的表达均降低,说明了GLP-1与GLP-1R参与了癫痫形成,我们通过免疫荧光的方法证实了GLP-1R广泛分布于人的神经元,而在星型胶质细胞几乎没有分布,这更加说明了GLP-1对神经元有一定的作用,这与Hamilton的研究是吻合的[19]。Sharma等[20-21]发现,GLP-1能够保护神经元,抑制神经元凋亡和发生炎症反应。戊四氮癫痫模型能很好地模拟颞叶癫痫的发病机理,我们在戊四氮诱导的癫痫大鼠的皮质和海马中发现,GLP-1R同样表达于神经元的细胞膜和细胞质,且在癫痫模型中,GLP-1R和GLP-1的表达降低,这与癫痫患者中发现的现象一致。
维格列汀是目前上市的DPPⅣ抑制性药物,由于其在治疗糖尿病时不良反应事件发生率低,损伤程度小,维格列汀近年来受到了较大的关注[22]。DPPⅣ是一种二肽基肽酶,它可以在GLP-1 N末端的第二个氨基酸位点丙氨酸处裂解GLP-1,将其变为无活性的GLP-1,将GLP-1的半衰期缩短为3 min左右[23]。Katsurada等[24]认为,鉴于肠促激素功能的多样性,维格列汀的功效不仅仅只表现为降糖方面。因此本实验通过维格列汀干预实验,揭露此药的抗癫痫作用。维格列汀的首关效应小,口服利用度高,肠道吸收率高[25],因此本实验通过灌胃的方式研究维格列汀对戊四氮癫痫模型的影响。在维格列汀灌胃治疗后,我们发现在大鼠血清中的GLP-1和大鼠组织中(包括皮质与海马)的GLP-1R的表达升高,这与维格列汀的药物作用是吻合的。研究表明DPP Ⅳ几乎不能通过血脑屏障,说明维格列汀是通过抑制外周的DPPⅣ而增加外周GLP-1的水平,使更多的GLP-1进入中枢发挥脑保护的作用[26]。通过行为学观察,我们发现戊四氮癫痫大鼠的发作潜伏期(首次注射PTZ到≥Ⅳ级癫痫发作的时间)延长,PTZ癫痫大鼠的潜伏期一般在7 d左右,而维格列汀干预后,潜伏期大于10 d,高浓度组甚至达到了14 d。另外我们发现维格列汀可以明显降低癫痫发作次数,在注射PTZ后期,维格列汀干预组≥Ⅳ级癫痫的发作次数更少,这可能是由于维格列汀打破了PTZ的积累,使大鼠一直处于阈下刺激,从而导致癫痫很难爆发。
综上,我们通过观察维格列汀对癫痫大鼠中GLP-1和GLP-1R表达变化的影响,揭露了维格列汀可以通过上调中枢神经系统中GLP-1/GLP-1R的水平而发挥抗癫痫作用。然而,癫痫的发生极为复杂,维格列汀是否通过其它非依赖GLP-1/GLP-1R的途径发挥抗癫痫作用还有待于进一步研究。
| [1] | 尚丽, 王开颜. 难治性癫痫的发病机制[J]. 临床神经病学杂志, 2013, 26 (6): 476-9. |
| [2] | Schmidt D, Löscher W. Drug resistance in epilepsy: putative neurobiologic and clinical mechanisms[J]. Epilepsia, 2005, 46 (6): 858-77. DOI: 10.1111/epi.2005.46.issue-6. |
| [3] | 郭莉霞, 刘建辉, 殷菲. 肠抑胃肽和胰高血糖素样肽1的研究进展[J]. 中国药学杂志, 2012, 47 (13): 1025-8. |
| [4] | Thomas MC, Paldánius PM, Ayyagari R, et al. Systematic literature review of DPP-4 inhibitors in patients with type 2 diabetes mellitus and renal impairment[J]. Diabetes Ther, 2016, 7 (3): 439-54. DOI: 10.1007/s13300-016-0189-4. |
| [5] | Larsen PJ, Tang-Christensen M, Holst JJ, et al. Distribution of glucagon-like peptide-1 and other preproglucagon-derived peptides in the rat hypothalamus and brainstem[J]. Neuroscience, 1997, 77 (1): 257-70. DOI: 10.1016/S0306-4522(96)00434-4. |
| [6] | 李芸, 柳弥, 吴碧华, 等. 胰高血糖素样肽-1受体与紧密连接相关蛋白5在糖尿病大鼠脑微血管内皮的表达变化[J]. 中华脑科疾病与康复杂志:电子版, 2014, 4 (3): 159-64. |
| [7] | Xu W, Yang Y, Yuan G, et al. Exendin-4, a glucagon-like peptide-1 receptor agonist, reduces Alzheimer disease-associated tau hyperphosphorylation in the hippocampus of rats with type 2 diabetes[J]. J Investig Med, 2015, 63 (2): 267-72. DOI: 10.1097/JIM.0000000000000129. |
| [8] | Iwai T, Sawabe T, Tanimitsu K, et al. Glucagon-Like peptide-1 protects synaptic and learning functions from neuroinflammation in rodents[J]. J Neurosci Res, 2014, 92 (4): 446-54. DOI: 10.1002/jnr.v92.4. |
| [9] | Ma T, Du X, Pick J, et al. Glucagon-Like peptide-1 cleavage product GLP-1(9-36) amide rescues synaptic plasticity and memory deficits in alzheimer's disease model mice[J]. J Neurosci, 2012, 32 (40): 13701-8. DOI: 10.1523/JNEUROSCI.2107-12.2012. |
| [10] | Bertilsson G, Patrone C, Zachrisson OA, et al. Peptide hormone exendin-4 stimulates subventricular zone neurogenesis in the adult rodent brain and induces recovery in an animal model of Parkinson's disease[J]. J Neurosci Res, 2008, 86 (2): 326-38. DOI: 10.1002/(ISSN)1097-4547. |
| [11] | Martin B, Golden E, Carlson OD, et al. Exendin-4 improves glycemic control, ameliorates brain and pancreatic pathologies, and extends survival in a mouse model of huntington's disease[J]. Diabetes, 2009, 58 (2): 318-28. DOI: 10.2337/db08-0799. |
| [12] | Calsolaro V, Edison P. Novel GLP-1 (Glucagon-Like peptide-1) analogues and insulin in the treatment for alzheimer's disease and other neurodegenerative diseases[J]. CNS Drugs, 2015, 29 (12): 1023-39. DOI: 10.1007/s40263-015-0301-8. |
| [13] | Perry T, Greig N. A new Alzheimer's disease interventive strategy: GLP-1[J]. Curr Drug Targets, 2004, 5 (6): 565-71. DOI: 10.2174/1389450043345245. |
| [14] | Gejl M, Gjedde A, Egefjord L, et al. In alzheimer's disease, 6-Month treatment with GLP-1 analog prevents decline of brain glucose metabolism: randomized, Placebo-Controlled, Double-Blind clinical trial[J]. Front Aging Neurosci, 2016, 8 : 108. |
| [15] | Koshal P, Kumar P. Neurochemical modulation involved in the beneficial effect of liraglutide, GLP-1 agonist on PTZ kindling epilepsy-induced comorbidities in mice[J]. Mol Cell Biochem, 2016, 415 (1-2): 77-87. DOI: 10.1007/s11010-016-2678-1. |
| [16] | Diehl RG, Smialowski A, Gotwo T. Development and persistence of kindled seizures after repeated injections of pentylenetetrazol in rats and Guinea pigs[J]. Epilepsia, 1984, 25 (4): 506-10. DOI: 10.1111/epi.1984.25.issue-4. |
| [17] | Kosaraju J, Murthy V, Khatwal RB, et al. Vildagliptin: an antidiabetes agent ameliorates cognitive deficits and pathology observed in streptozotocin-induced Alzheimer's disease[J]. J Pharm Pharmacol, 2013, 65 (12, SI): 1773-84. DOI: 10.1111/jphp.12148. |
| [18] | Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972, 32 (3): 281-94. DOI: 10.1016/0013-4694(72)90177-0. |
| [19] | Hamilton A, Holscher C. Receptors for the incretin glucagon-like peptide-1 are expressed on neurons in the central nervous system[J]. Neuroreport, 2009, 20 (13): 1161-6. DOI: 10.1097/WNR.0b013e32832fbf14. |
| [20] | Sharma MK, Jalewa J, Hoelscher C. Neuroprotective and antiapoptotic effects of liraglutide on SH-SY5Y cells exposed to methylglyoxal stress[J]. J Neurochem, 2014, 128 (3): 459-71. DOI: 10.1111/jnc.2014.128.issue-3. |
| [21] | Parthsarathy V, Hölscher C. Chronic treatment with the GLP1 analogue liraglutide increases cell proliferation and differentiation into neurons in an AD mouse model[J]. PLoS One, 2013, 8 (3): e58784. DOI: 10.1371/journal.pone.0058784. |
| [22] | Horie Y, Kanada S, Watada H, et al. Pharmacokinetic, pharmacodynamic, and tolerability profiles of the dipeptidyl peptidase-4 inhibitor linagliptin: a 4-Week multicenter, randomized, Double-Blind, Placebo-Controlled phase IIa study in Japanese type 2 diabetes patients[J]. Clin Ther, 2011, 33 (7): 973-89. DOI: 10.1016/j.clinthera.2011.06.005. |
| [23] | Hansen L, Deacon CF, Orskov C, et al. Glucagon-like peptide-1-(7-36) amide is transformed to glucagon-like peptide-1-(9-36) amide by dipeptidyl peptidase IV in the capillaries supplying the L cells of the porcine intestine[J]. Endocrinology, 1999, 140 (11): 5356-63. |
| [24] | Katsurada K, Yada T. Neural effects of gut-and brain-derived glucagon-like peptide-1 and its receptor agonist[J]. J Diabetes Investig, 2016, 7 Suppl 1 : 64-9. |
| [25] | 蔡倩, 刘蕾. 新型降糖药物二肽基肽酶-4抑制剂的研究进展[J]. 中国新药杂志, 2014, 23 (3): 302-7. |
| [26] | Kastin AJ, Akerstrom V, Pan W. Interactions of glucagon-like peptide-1 (GLP-1) with the blood-brain barrier[J]. J Mol Neurosci, 2002, 18 (1-2): 7-14. DOI: 10.1385/JMN:18:1-2. |
 2017, Vol. 37
2017, Vol. 37

