外阴慢性单纯性苔藓(Lichen simplex chronicus, LSC),也称外阴鳞状上皮增生或增生性营养不良,是以外阴瘙痒为主要症状的妇科常见疾病[1]。已有研究表明免疫、遗传、感染和激素等因素与疾病的发病有关,但LSC的确切的发病机制至今尚不清楚[2]。LSC可能是在阴道分泌物、化学刺激物、局部潮湿和心理因素等诱因下导致外阴瘙痒,引起长期反复的搔抓,释放各种炎性因子加重皮肤损伤,同时破坏皮肤屏障功能,从而形成更加强烈的瘙痒-搔抓循环,给患者身心健康产生极大的影响[3-5]。由于目前关于疾病的发病机制与治疗机制的研究往往需要在患者的外阴取活检,治疗前取活检有助于确诊疾病,一般可以得到患者的配合和理解,但治疗后取活检有违伦理且难以得到患者同意,这样就限制了关于疾病的发病机制及治疗机制的研究,因此迫切地需要可以替代人体的LSC动物模型。动物模型是研究发病机制、评价治疗方法有效性必不可少的实验工具,建立与疾病临床症状及病理表现相一致的动物模型能促进其机制研究。由于目前尚无LSC动物模型研究的相关报道,为此笔者参考口腔黏膜白斑动物模型的相关研究,以期建立外阴LSC动物模型。
蛋白酶激活受体2(protease activated receptor 2, PAR2)属于G蛋白偶联受体家族成员,介导跨膜信号转导,皮肤组织中角质形成细胞、肥大细胞、神经元细胞及血管内皮细胞等均可表达PAR2 [6-8]。近年来研究发现PAR2与皮肤瘙痒和表皮屏障功能密切相关[9-10]。有研究认为PAR2活化后可以直接作用于传导痒感觉的神经末梢导致瘙痒[11]。PAR2在上皮组织中的表达和活化可以干扰皮肤的正常屏障功能,参与皮肤炎症反应[12]。由于LSC是一种瘙痒性皮肤病,所以本研究检测PAR2在LSC模型大鼠外阴皮肤中的表达,拟探讨PAR2在LSC瘙痒发生中的作用机制。
1 材料和方法 1.1 动物雌性SD大鼠70只,体质量140~160 g,6~8周龄,由重庆医科大学实验动物中心提供。
1.2 药品及试剂二甲基苯并蒽(7, 12-Dimethylbenzanthracene, DMBA),Sigma公司;PAR2单克隆抗体,abcam公司;PV9001及辣根酶标记山羊抗兔IgG,北京中杉金桥;TRNzol总RNA提取试剂及2×PCR Mix Taq,北京天根;GAPDH,康成生物;Rever Tre Ace-a-逆转录试剂盒及2×SYBR Green,TOYOBO公司。
DMBA与丙酮溶液配制成0.5%DMBA丙酮溶液。
1.3 实验分组将70只雌性SD大鼠按随机数字表分为A组(空白对照组,n=10)、B组(丙酮对照组,n=10)和C组(单纯机械刺激对照组,n=10)、D组(实验组,n=40)。
A组为正常对照组,不予以任何处理措施。B组予以丙酮溶液10周。C组予以单纯机械刺激(硬毛牙刷刷外阴皮肤)10周。D组予以机械刺激联合0.5%DMBA丙酮溶液涂抹10周。4组都在第6、8、10、12、14周取外阴皮肤活检。
1.4 实验方法 1.4.1 动物模型的建立备皮,清洁外阴皮肤。需要予以机械刺激的大鼠用硬毛牙刷刷大鼠外阴皮肤,刷至皮肤充血发红即可。暴露大鼠外阴,用勾线笔蘸DMBA丙酮溶液涂布于外阴皮肤1次,自然晾干。每周1、3、5日3次涂药,每次均在固定的时间。B组丙酮对照组的丙酮涂布方法与前所述相同。C组只单纯的予以硬毛牙刷刷外阴皮肤。
1.4.2 实验观测整个实验过程中,在相应的时间点对各组大鼠外阴皮肤的形态进行肉眼观测,并观察及触诊大鼠全身是否有肿块,淋巴结是否肿大。在相应的时间点麻醉大鼠用皮肤环钻取外阴皮肤活检进行组织学观察,取下组织由4%多聚甲醛固定,脱水,石蜡包埋,切片,HE染色后显微镜观察。
1.4.3 透射电镜取活检确定为LSC的大鼠外阴皮肤组织,置4%戊二醛液(pH 7.4)预固定2 h以上,再用1%四氧化锇后固定,乙醇梯度脱水,环氧树脂包埋,经半薄切片光镜下定位表皮及真皮组织,超薄切片,经醋酸铀及枸橼酸铅双重染色,Hitachi-7500型透射电镜观察、拍照。
1.4.4 免疫组织化学取A组和D组活检确定为LSC的石蜡块,切片,采用超敏二步法做免疫组织化学染色,按照试剂盒说明书步骤进行,DAB显色,自来水充分冲洗、复染、脱水、透明、封片。抗PAR2单抗工作浓度为1:100。PBS代替一抗为阴性对照。采用IPP 6.0软件对切片的染色信号进行光密度分析。
1.4.5 Western blotting取保存于-80 ℃的A组和D组活检确定为LSC的外阴皮肤组织,按照蛋白提取试剂盒说明书步骤提取皮肤组织蛋白,用Bradford法测定蛋白质浓度。蛋白样品在SDS-聚丙烯酰氨凝胶中电泳分离,电泳结束后采用湿转法将凝胶上的蛋白质转移到PVDF膜上(300 mA, 90 min),5%脱脂奶粉封闭4 h,先后加入GAPDH和PAR2抗体(1:1000)和相对应的二抗山羊抗兔IgG(1:1000),最后经化学发光法显像。凝胶成像系统(Blo-RAO Gel Doc 2000)进行图象分析,计算光密度值。
1.4.6 qRT-PCR取保存于-80 ℃的A组和D组活检确定为LSC的外阴皮肤组织,利用TRNzol提取总RNA,紫外线分光光度计测定RNA浓度。按逆转录试剂盒说明书提取2 μg总RNA逆转录合成cDNA,以SybrGreen作为荧光标记物,在FX9600荧光定量PCR仪器(Bio-Rad公司)上进行PCR反应。引物由重庆金麦生物技术有限公司合成,PAR2引物序列:5'CGCCCTCTGCCTGTCCACC3'/5'GAGCGATATCTGCATGCGTTTCA3';β-actin为内参,引物序列:5'ACCCCGTGCTGCTGACCGAG3'/5'TCCCGGCCAGCCAGGTCCA3'。PCR反应循环条件:预变性(96 ℃ 5 min);PCR反应(96 ℃,30 s;57 ℃,30 s;72 ℃,30 s;共40个循环)。使用2-ΔΔCt法计算PAR2的相对含量。
1.5 统计学分析所有数据均采用SPSS22.0统计软件进行处理。计量数据采用均数±标准差表示。组间PAR2相对表达量的比较采用独立样本t检验,P < 0.05为差异有统计学意义。
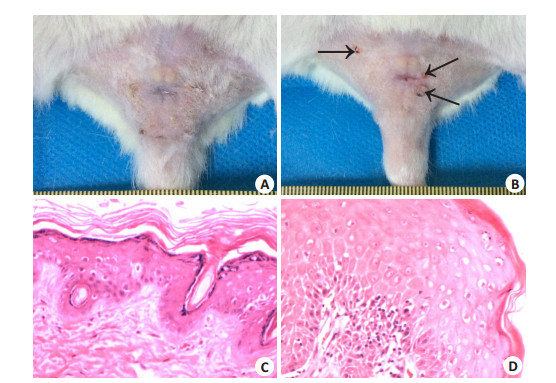
2 结果 2.1 肉眼观察A组:大鼠外阴皮肤正常皮色,富有弹性。B组:皮肤无明显变化,形态和质地与正常SD大鼠外阴皮肤相同。C组:皮肤无明显变化,形态和质地与正常SD大鼠外阴皮肤相同。D组:8周时23只大鼠外阴皮肤较正常皮色稍红,皮肤增厚,粗糙,弹性降低(图 1A)。至第10周,已经有38只大鼠出现类似改变,同时有2只大鼠外阴有乳头状新生物形成。第14周,有22只大鼠外阴皮肤出现了乳头状新生物,数目一般为2~5个,新生物直径都小于1 cm,较大的新生物表面可有出血坏死(图 1B)。
|
图 1 SD大鼠外阴皮肤形态学和病理学 Figure 1 Morphology and pathology of the SD rat genital skin. A: Genital skin at 8 weeks; B: Genital skin at 10 weeks (arrows indicate papillary hyperplasia); C: SD rat vulvar lichen simplex chronicus (HE staining, original magnification:×100); D: Papilloma-like changes (HE staining, ×100). |
A组:正常大鼠外阴皮肤为复层角化鳞状上皮,细胞排列整齐,有极向,基底层细胞明显。B组:涂药全过程中,外阴皮肤无改变,镜下与正常外阴皮肤一样。C组:单纯机械刺激过程中,外阴皮肤无改变,镜下与正常外阴皮肤一样。D组:第6周,鳞状上皮无明显增生,表皮底层及真皮浅层有炎细胞浸润。第8周,57.5%(23/40)的大鼠出现了类似于LSC改变,具体表现为复层鳞状上皮增生,上皮层次增多,角化层增厚,表皮过度角化,真皮层胶原纤维沉积,伴炎细胞浸润(图 1C)。第10周,5%(2/40)的大鼠出现了乳头状新生物,新生物取活检呈乳头瘤样改变,细胞的大小和核形态、染色均正常(图 1D)。第12周,70%(28/40)的大鼠表现为LSC,20%(8/40)表现为乳头状瘤。第14周,25%(10/40)的大鼠表现为LSC,55%(22/40)表现为乳头状瘤(表 1)。
| 表 1 D组不同时期的病理改变 Table 1 Pathological changes in the genital skin at different time points in group D (n) |
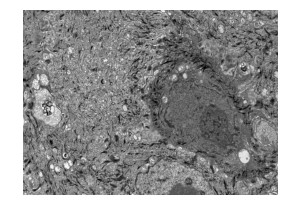
表皮角质层增厚,线粒体肿胀,胞浆空泡,髓样结构形成。真皮中可见线粒体肿胀,细胞之间间隙增大,部分细胞核固缩,纤维蛋白成束状(图 2)。
|
图 2 线粒体肿胀,胞浆空泡,髓样结构形成 Figure 2 Mitochondria swelling, cytoplasmic vacuoles and myelin formation in the genital skin (×5000). |
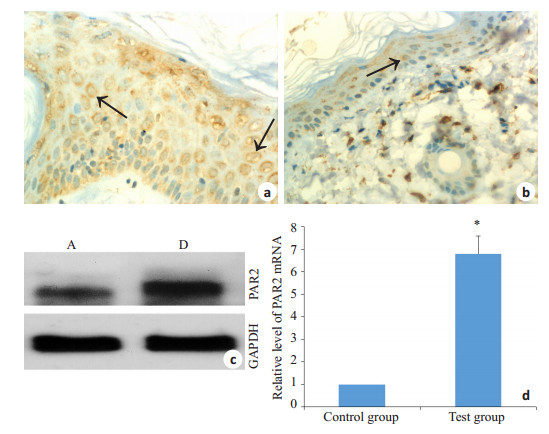
免疫组化结果显示D组可见PAR2的表达,阳性细胞棕黄色颗粒位于细胞膜和胞浆中(图 3a);空白对照组可见PAR2的表达(图 3b)。Western blot结果显示两组均有PAR2的表达(图 3c)。与正常对照组相比,免疫组化及Western blot的结果都显示D组PAR2蛋白的表达增加(P < 0.05,表 2)。2-ΔΔCt法比较PAR2 mRNA的相对表达,以正常组织中PAR2的mRNA水平为对照(即100%),图 3d显示D组的组织中表达量为正常组的6.805±0.787倍。
|
图 3 PAR2在大鼠外阴皮肤中的表达 Figure 3 Expression of PAR2 in the genital skin of the rats. a: PAR2 protein expression detected by immunohisochemistry in a rat with LSC (×400); b: PAR2 protein expression detected by immunohisochemistry in the genital skin of a control rat (× 400); c: PAR2 protein expression in group A and D detected by Western blot; d: PAR2 mRNA expression in group A and D detected by qRT-PCR. *P < 0.05 vs control group. |
| 表 2 大鼠外阴皮肤PAR2蛋白的相对表达量 Table 2 Expression of PAR2 protein in the genital skin of the rats |
1954年Salley首次使用DMBA成功诱导地鼠颊囊粘膜白斑[13]。经过半个多世纪对DMBA诱导方法的标准化、动物种类的选择、病理学变化的特征及其规律等方面的研究,使该模型日臻完善,成为口腔粘膜白斑的经典模型。口腔粘膜白斑的动物模型中单纯性白斑肉眼表现为白斑,均质性,乳白色,稍高起黏膜表面,且观察3个月后白斑仍存在,病理学表现为上皮过度角化,棘层增生,粒层明显,固有层炎症细胞浸润[14]。口腔粘膜与外阴皮肤具有很相似的组织学结构,口腔粘膜由上皮和结缔组织组成,在胚层来源和组织学特点上,前者相当于皮肤的表皮,后者相当于皮肤的真皮[15]。由于口腔粘膜与皮肤在组织学上的相似性,以及口腔粘膜白斑动物模型在肉眼和病理学下均和LSC类似,故考虑应用相似的方法制造外阴LSC的动物模型。本研究结果表明,在大鼠外阴涂药8周后,部分大鼠的外阴就形成了非常典型的单纯性上皮增生,与人LSC在形态学及组织学上表现高度一致。涂药10周后,95%的大鼠形成了类似LSC的改变。本研究也表明随着诱导时间的延长,大鼠的外阴出现肉眼可以看见的乳头状瘤样新生物,考虑由于DMBA作用于表皮角质形成细胞,引起表皮高度增生,故诱导出乳头状瘤[16]。停止干预4周后,虽然有20%的大鼠外阴皮肤恢复正常,但仍有25%表现为LSC,55%表现为乳头状瘤,说明停止涂抹诱导剂后,病变还是会继续发展,但是在我们实验观察时间内暂无恶变的表现,考虑与药物浓度、作用时间和SD大鼠抵抗力强有关。当大鼠外阴皮肤表现为LSC时做电镜观察,其表现也与近年来一些学者对LSC的超微结构观察结果大致相似[17]。
瘙痒是LSC最常见和最主要的临床症状,但是导致疾病瘙痒的机制却不清楚。PAR2是G蛋白偶联受体家族成员之一,介导跨膜信号转导,在不同组织细胞均有表达,丝氨酸蛋白酶裂解PAR2形成新的N-末端序列,从而激活PAR [18]。近年来研究发现PAR2与皮肤瘙痒和表皮屏障功能密切相关[9-10]。本研究发现,当大鼠外阴出现LSC改变时,PAR2的表达较正常大鼠来说明显的增加,PAR2主要表达于表皮中的角质形成细胞。研究证实LSC患者外阴皮肤中肥大细胞增多,本课题组研究也发现当大鼠外阴皮肤表现为LSC时,皮肤中的肥大细胞及脱颗粒的肥大细胞数量均增加,肥大细胞脱颗粒释放类胰蛋白酶,类胰蛋白酶属于丝氨酸蛋白酶家族成员,可激活PAR2 [19-21]。在导致皮肤慢性瘙痒症状的特应性皮炎、银屑病和结节性痒疹中,PAR2的表达都明显增加[22-24]。在老鼠皮下注射PAR2激动剂可引起皮肤持续性瘙痒[25]。外阴皮肤和黏膜中具有丰富的感觉神经纤维,由于部位的特殊性,容易受到出汗、摩擦、微生物等因素的影响而触发感觉神经纤维导致瘙痒[26-27]。PAR2可以被环境中的细菌、真菌、具有丝氨酸蛋白酶活性的尘螨抗原所激活[28],这些都是外阴皮肤容易接触到的环境。活化的PAR2激活原本异常的角质形成细胞,分泌LTB4、PGE2等致痒因子,LTB4与感觉神经元上BLT1受体结合导致瘙痒[29-30]。角质形成细胞上活化的PAR2诱导释放胸腺基质淋巴细胞生成素,通过与表达TRPA1感觉神经元结合导致瘙痒[31]。同时,LSC患者有皮肤屏障功能破坏[4],皮肤屏障功能破坏增加了表皮PH值,促使丝氨酸蛋白酶的活化增加[32],进一步增加了具有蛋白酶活性的变应原和微生物的入侵机会,激活PAR2引起瘙痒[10]。综上,PAR2可能参与疾病致病过程,导致皮肤瘙痒。
总之,该模型在形态学及组织学上类似于人LSC。模型制作方法简便,实验时间短,模型稳定,可重复性强。虽然与人LSC在病因、进展、预后等方面仍有一些差异,但是利用这一动物模型进行一些关于疾病发病机制与治疗方面的研究仍不失为一种选择。本研究发现了当大鼠外阴皮肤表现为LSC时,PAR2的表达增加,但目前却没有关于PAR2在LSC患者外阴皮肤中的表达的相关研究,故还需进一步的研究PAR2在LSC患者皮肤中的表达。
| [1] | Lynch PJ, Moyal-Barracco M, Bogliatto F, et al. 2006 ISSVD classification of vulvar dermatoses: pathologic subsets and their clinical correlates[J]. J Reprod Med, 2007, 52 (1): 3-9. |
| [2] | Liu GL, Cao FL, Zhao MY, et al. Associations between HLAABDRB1 polymorphisms and risks of vulvar lichen sclerosus or squamous cell hyperplasia of the vulva[J]. Genet Mol Res, 2015, 14 (4): 15962-71. DOI: 10.4238/2015.December.7.8. |
| [3] | Lynch PJ. Lichen simplex chronicus (atopic/neurodermatitis) of the anogenital region[J]. Dermatol Ther, 2004, 17 (1): 8-19. DOI: 10.1111/dth.2004.17.issue-1. |
| [4] | Thorstensen KA, Birenbaum DL. Recognition and management of vulvar dermatologic conditions: lichen sclerosus, lichen planus, and lichen simplex chronicus[J]. J Midwifery Womens Health, 2012, 57 (3): 260-75. DOI: 10.1111/jmwh.2012.57.issue-3. |
| [5] | Liao YH, Lin CC, Tsai PP, et al. Increased risk of lichen simplex chronicus in people with anxiety disorder: a nationwide populationbased retrospective cohort study[J]. Br J Dermatol, 2014, 170 (4): 890-4. DOI: 10.1111/bjd.2014.170.issue-4. |
| [6] | Buddenkotte J, Stroh C, Engels IH, et al. Agonists of proteinaseactivated receptor-2 stimulate upregulation of intercellular cell adhesion molecule-1 in primary human keratinocytes via activation of NF-kappa B[J]. J Invest Dermatol, 2005, 124 (1): 38-45. DOI: 10.1111/j.0022-202X.2004.23539.x. |
| [7] | Moormann C, Artuc M, Pohl E, et al. Functional characterization and expression analysis of the proteinase-activated receptor-2 in human cutaneous mast cells[J]. J Invest Dermatol, 2006, 126 (4): 746-55. DOI: 10.1038/sj.jid.5700169. |
| [8] | Vergnolle N, Ferazzini M, D'Andrea MR, et al. Proteinase-activated receptors: novel signals for peripheral nerves[J]. Trends Neurosci, 2003, 26 (9): 496-500. DOI: 10.1016/S0166-2236(03)00208-X. |
| [9] | Mollanazar NK, Smith PK, Yosipovitch G. Mediators of chronic pruritus in atopic dermatitis: getting the itch out[J]. Clinic Rev Allerg Immunol, 2015, 51 (3): 263-92. |
| [10] | Jeong SK, Kim HJ, Youm JK, et al. Mite and cockroach allergens activate protease-activated receptor 2 and delay epidermal permeability barrier recovery[J]. J Invest Dermatol, 2008, 128 (8): 1930-9. DOI: 10.1038/jid.2008.13. |
| [11] | 李仰琪, 陆春. 蛋白酶活化受体-2与相关皮肤病的研究进展[J]. 中国麻风皮肤病杂志, 2012, 28 (1): 38-41. |
| [12] | Elias PM. Skin barrier function[J]. Curr Allergy Asthma Rap, 2008, 8 (4): 299-305. DOI: 10.1007/s11882-008-0048-0. |
| [13] | Salley JJ. Experimental carcinogenesis in the cheek pouch of the syrian hamster[J]. J Dent Res, 1954, 33 : 253-62. DOI: 10.1177/00220345540330021201. |
| [14] | 张振玉, 章魁华. 口腔粘膜白斑症动物模型研究(摘要)[J]. 医学研究通讯, 1982, 4 : 13-4. |
| [15] | 李秉琦. 李秉琦实用口腔黏膜病学[M]. 北京: 科学技术文献出版社, 2011: 1. |
| [16] | 王红丽, 陈苑, 胡银霞, 等. UVC因素对DMBA诱导的小鼠皮肤肿瘤建模的影响[J]. 广东药学院学报, 2012, 28 (6): 677-80. |
| [17] | 陈明霞, 任红莲, 何淑莹, 等. 增生型外阴白色病变43例电子显微镜观察[J]. 陕西医学杂志, 2010, 39 (9): 1233-5. |
| [18] | Han L, Dong X. Itch mechanisms and circuits[J]. Annu Rev Biophys, 2014, 43 : 331-55. DOI: 10.1146/annurev-biophys-051013-022826. |
| [19] | 吴涛.肥大细胞、P物质在外阴上皮内非瘤样病变中的表达及意义[D].中国医科大学硕士学位论文, 2009. |
| [20] | 杨欢, 唐华均, 李成志. 聚焦超声对SD外阴慢性单纯性苔藓模型大鼠外阴皮肤P物质及P物质受体表达的影响[J]. 中国介入影像与治疗学, 2016, 13 (12): 757-61. |
| [21] | Zhu Y, Pan WH, Wang XR, et al. Tryptase and protease-activated receptor-2 stimulate scratching behavior in a murine model of ovalbumin-induced atopic-like dermatitis[J]. Int Immunopharmacol, 2015, 28 (1): 507-12. DOI: 10.1016/j.intimp.2015.04.047. |
| [22] | Steinhoff M, Neisius U, Ikoma A, et al. Proteinase activated receptor-2 mediates itch: a novel pathway for pruritus in human skin[J]. J Neurosci, 2003, 23 (15): 6176-80. |
| [23] | Takei-Taniguchi R, Imai Y, Ishikawa C, et al. Interleukin-17-and protease-activated receptor 2-mediated production of CXCL1 and CXCL8 modulated by cyclosporine A, vitamin D3 and glucocorticoids in human keratinocytes[J]. J Dermatol, 2012, 39 (7): 625-31. DOI: 10.1111/jde.2012.39.issue-7. |
| [24] | 李仰琪, 陆春, 田歆, 等. 结节性痒疹患者皮损中蛋白酶活化受体2的表达与分布[J]. 皮肤性病诊疗学杂志, 2014, 21 (5): 367-71. |
| [25] | Tsujii K, Andoh T, Lee JB, et al. Activation of proteinase-activated receptors induces itch-associated response through histaminedependent and-independent pathways in mice[J]. J Pharmacol Sci, 2008, 108 (3): 385-8. DOI: 10.1254/jphs.08200SC. |
| [26] | Swamiappan M. Anogenital pruitus-an overview[J]. J Clin Diagn Res, 2016, 10 (4): WE1-3. |
| [27] | Schober J, Aardsma N, Mayoglou L, et al. Terminal innervation of female genitalia, cutaneous sensory receptors of the epithelium of the labia minara[J]. Clin Anat, 2015, 28 (3): 392-8. DOI: 10.1002/ca.22502. |
| [28] | Shpacovitch V, Feld M, Bunnett NW, et al. Protease-activated receptors: novel PARtners in innate immunity[J]. Trends Immunol, 2007, 28 (12): 541-50. DOI: 10.1016/j.it.2007.09.001. |
| [29] | Zhu Y, Wang XR, Peng C, et al. Induction of leukotriene B4 and prostaglandin E2 release from keratinocytes by protease-activated receptor-2-activating peptide in ICR mice[J]. Int Immunopharmacol, 2009, 9 (11): 1332-6. DOI: 10.1016/j.intimp.2009.08.006. |
| [30] | Andoh T, Kuraishi Y. Expression of BLT1 leukotriene B4 receptor on the dorsal root ganglion neurons in mice[J]. Brain Res Mol Brain Res, 2005, 137 (1-2): 263-6. DOI: 10.1016/j.molbrainres.2005.02.029. |
| [31] | Wilson SR, The L, Batia LM, et al. The epithelial cell-derived atopic dermatitis cytokine TSLP activates neurons to induce itch[J]. Cell, 2013, 155 (2): 285-95. DOI: 10.1016/j.cell.2013.08.057. |
| [32] | Demerjian M, Hachem JP, Tschachler E, et al. Acute modulations in permeability barrier function regulate epidermal cornification: role of caspase-14 and the protease-activated receptor type 2[J]. Am J Patho, 2008, 172 (1): 86-97. DOI: 10.2353/ajpath.2008.070161. |
 2017, Vol. 37
2017, Vol. 37

