结直肠癌(colorectal cancer, CRC)是全世界范围内的高发恶性肿瘤之一,随着我国人口老龄化进程的发展、居民生活方式的改变及“西方化”饮食习惯的盛行,中国已成为结直肠癌的高发地区[1]。手术切除是治疗结直肠癌的主要方式,但术后感染是提高死亡率、增加住院费用、降低生存质量的关键原因,术后感染能够导致患者住院时间延长4~21 d,住院费用增加1.1万~4.3万美元[2]。传统医学观点认为,机械性肠道准备(mechanical bowel preparation, MBP)能够清除肠道内容物,达到减少肠腔内细菌载量控制术后感染[3]。但是随着医学科学的发展,越来越多的循证医学证据[4-7]提出临床研究的结果并未明确表明MBP在改善结直肠癌患者术后康复方面具有明显优势。国内目前关于结直肠术前是否进行机械性肠道准备的研究较少[8-10],部分研究方案设计不完善,对数据统计分析时Ⅱ型错误明显[8],且国内研究未将结肠与直肠独立讨论[11],本研究拟比较结肠癌术前患者行MBP对患者术后早期康复效果的影响,以探讨择期结肠癌手术患者术前MBP必要性。
1 资料和方法 1.1 纳入标准(1)年龄18~70岁,汉族;(2)确诊为原发性结肠癌;(3)ASA体格情况分级为Ⅰ~Ⅲ;(4)知情同意,自愿加入本研究。排除标准:(1)机体代谢、免疫缺陷;(2)术前3 d进行肠镜检查;(3)术前1月内进行放化疗。剔除标准:(1)中断研究流程;(2)术中改行造口或探查术;(3)腔镜手术。
1.2 研究对象选择某三级甲等医院胃肠外科中心2014年7月~2016年2月结直肠组收治的需行择期一期吻合性切除术的结肠癌患者,采用randomizer随机数字软件生成随机数字编码,将随机分组编号用避光信封密封保存,当接收研究对象时,开启对号入组。偶数组为试验组,奇数组为对照组。随机分组情况由专人负责和实施,随机分组人员不参与试验的其他环节。
对照组:无肠道梗阻的患者,术前12 h使用口服磷酸钠溶液洗肠(磷酸钠溶液45 mL+温开水400 mL/次,共2次);伴有不全性肠梗阻的病人,由临床医生根据影像学检查显示的梗阻程度决定其口服洗肠液或是进行大量不保留灌肠。如果口服洗肠液的不全性肠梗阻患者在服用洗肠液2 h后出现腹胀、少量稀便甚至不排便的情况,则进行再评估并适时采用大量不保留灌肠。
试验组:术前进行常规护理,患者术前12 h禁食,4 h禁饮;不行术前口服洗肠液或大量不保留灌肠。
1.3 手术治疗两组患者围手术期管理流程均由同一组工作人员按照《结肠癌临床路径》来完成,如有特殊则均在同一医疗组长的指导下采取治疗措施。两组患者均行气管插管下全麻一期吻合性结肠癌切除术,参与手术的医生不清楚患者的随机分组情况,按照结肠癌治疗指南对患者实施手术,术后常规进行止血、镇痛、免疫增强等治疗。术后12 h拔除胃肠减压管及引流管,术后24 h下床活动,术后12 h饮用温开水,术后24 h开始肠内营养支持,排气后自主经口进食,由同一组伤口专科护士进行伤口护理。本研究已在伦理审查委员会通过伦理审查,并且在中国临床试验注册中心通过审核予以注册,注册号ChiCTR-TRC-14004962。
1.4 检查指标基线资料纳入患者性别、年龄、TNM分期、ASA评分、手术级别、切口类型、吻合方式、术中失血量等。终点结局指标包括伤口感染发生率、腹腔感染发生率、吻合口瘘发生率、术后早期肠梗阻发生率、术后首次排气时间、血红蛋白(HB)、总蛋白(TP)、白蛋白(ALB)、前白蛋白(PA)、白球比(A/G)、手术时间等。基线指标收集于术后12 h内完成,患者的血红蛋白、总蛋白、白蛋白、前白蛋白及白球比等指标的收集应以术前1 d、术后第1和5天的数据为准,患者并发症资料的收集时间为手术当天至术后第30天。资料收集是由专人负责,资料收集者不清楚随机分组情况,并且不参与研究的其他环节。资料收集和整理由两名研究人员独立完成,并在最终进行两份资料的核查和对比,及时查漏补缺,纠正差错,确保资料的完整性和科学性。
1.5 统计分析应用SPSS17.0统计分析软件进行统计学处理,假设检验水准α=0.05,P < 0.05表示差异有统计学意义。
本研究最终纳入研究的研究对象148例,试验组76例,对照组72例;研究具体流程如下图 1。
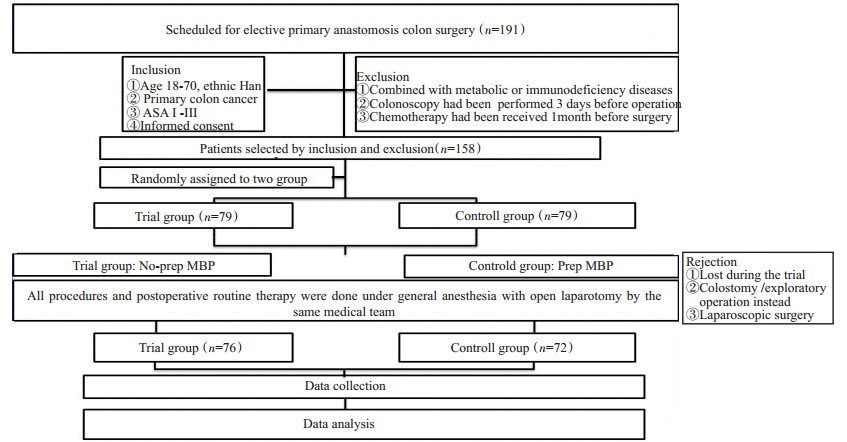
|
图 1 研究流程图 Figure 1 Flow chart of the process of the trial |
两组研究对象基线资料对比无统计学差异(表 1)。
| 表 1 基线资料情况表 Table 1 Demographic and baseline clinical data of the patients |
试验组患者术后早期并发症发生率为5.26%,对照组为16.67%。两组伤口感染、腹腔感染发生率差异有统计学意义(P < 0.05),吻合口瘘、术后早期肠梗阻发生率差异无统计学意义(P > 0.05);两组患者术后首次排气时间差异有统计学意义(P=0.03)。两组患者术后早期康复结果(表 2)。
| 表 2 两组患者术后早期康复结果 Table 2 Early postoperative outcomes in the two groups |
试验组与对照组营养学指标基线一致(P > 0.05);试验组术后第1天前白蛋白水平高于对照组,差异有统计学意义(P=0.03),术后第5天的营养学指标差异无统计学意义(P > 0.05,表 3)。
| 表 3 两组患者术后早期营养状态指标的对比结果 Table 3 Nutrition status indexes early after the operation in the two groups |
试验组患者手术时间为48~150(93.30±26.21)min,对照组患者手术时间为75~150(106.95±20.09)min,两组患者的手术时间比较差异无统计学意义(t=-1.94,P=0.06)。
3 讨论 3.1 结肠癌患者术前MBP对术后早期康复效果的影响分析本研究的结果显示,试验组与对照组患者术后伤口感染发生率、腹腔感染发生率的差异比较有统计学意义(P < 0.05),吻合口瘘发生率及术后早期肠梗阻发生率的比较差异无统计学意义(P > 0.05);与Mangell等的研究结果[12]一致,与Moghadamyeghaneh等的研究[13]结果有差异,应是由于该研究采用回顾性研究方法,且影响结果变量的关键因素如手术方式、机械性肠道准备方式未详细描述,而机械性肠道准备的方式是影响术后康复的独立影响因素,因此须在明确控制相关影响因素的基础上,对研究结果进一步验证和分析。研究表明[14],超过35%的患者进行MBP后出现肠道菌群移位,而结肠癌术后感染的发生主要与肠道内菌群失调和菌群移位有关。谢尚奎等[15]对结肠手术患者进行术前MBP,显微镜下观察肠道黏膜组织切片显示肠道黏膜紧密连接缺损,肠道绒毛末梢损坏,组织间隙水肿或区域性的肠道上皮细胞缺失;研究者认为这些因素造成了肠道黏膜屏障功能受损,通透性增加;这些改变会进一步导致肠道内菌群失调、营养吸收功能障碍及细菌移位等问题,增大患者术后感染发生的可能性。术后胃肠运动功能的早期恢复是确保腹部手术患者早期康复质量和良好预后的重要指标和关键因素,本研究结果显示结肠癌患者术前不进行MBP者术后首次排气时间比MBP者早,与Reddy等[16]的研究结果一致。Reddy等[16]认为MBP作用于肠道,形成异常的分子表达和神经信息传递,破坏肠腔内膜的组织结构,影响肠道运动机制,严重影响结肠的运动功能。Hoffman等[17]针对结肠癌和直肠癌腹腔镜手术患者术前MBP的讨论开展了一项研究,结果发现,术前进行MBP的患者与不进行MBP者术后首次排气时间的差异无统计学意义(P > 0.05);但是该研究纳入的研究对象为腹腔镜手术者,由于腹腔镜手术与开腹手术对患者机体应激水平差异大,因此认为该研究与同类主题的相关研究之间可比性差;而且,就研究本身来讲,结肠癌手术与直肠癌手术由于肿瘤位置、术中暴露范围、吻合肠段的血运情况、张力等因素的不同,对肠道形成的刺激存在差异,但在数据统计分析中并没有进行科学、严谨的亚组分析,因此可能扩大结论中Ⅱ型错误的概率。另外,本研究结果显示,试验组患者术后第1 d的前白蛋白水平高于对照组,差异有统计学意义(P=0.03)。前白蛋白在体内的合成速度和半衰期约为1~2 d,对机体的营养状态反应敏感,能够迅速有效地反映机体的营养平衡状态[18]。观察两组患者术后第5 d的营养学指标水平发现,试验组患者的指标水平与对照组差异无统计学意义(P > 0.05)。分析原因应是随着时间的推移,由于手术和机械性肠道准备等创伤打击对机体的打击程度逐渐减弱;肠黏膜在机体自身调节机制的影响下逐步恢复供血和供氧,营养吸收和代谢作用改善[19-20];另一方面,患者在术后接受营养支持方案,机体营养状态逐渐趋于稳定。
3.2 结肠癌患者术前MBP对手术时长的影响研究本研究结果显示,两组手术差异无统计学意义(P=0.06),郭雄图等[9]持慎重观点,认为手术时长受到手术方案、手术难度、医疗团队配置、医务人员专业实践水平等多方面的因素的影响,而大多研究并未排除这些影响因素,因此现有研究尚不能充分证明术前不进行机械性肠道准备可以有效缩短手术时间。
不论是在我国还是在全世界范围内,术前机械性肠道准备一直被认为是结肠癌手术的护理常规,但是随着循证医学思想深入人心,并且学界对肠道菌群及肠道屏障作用的认识和了解越来越深刻,专家们对术前机械性肠道的作用重新提出了质疑。本研究结果表明结肠癌术前机械性肠道准备增加术后早期并发症发生率,延迟肠道运动功能恢复,影响术后早期营养状态,但鉴于目前针对我国结肠癌患者群术前机械性肠道准备的研究基础整体薄弱,不能形成高质量的循证基础并转化为临床操作的规范性指南。在未来,我国学者应该进一步开展大样本、高质量、多中心的临床研究,为促进结肠癌术前机械性肠道准备的必要性研究提供循证依据。
| [1] | 卫生部. 2015中国卫生统计年鉴(精) EB/OL][2016-12-09]. http://www.moh.gov.cn/zwgkzt/ptjnj/list.shtml. |
| [2] | Scabini S, Rimini E, Romairone E, et al. Colon and rectal surgery for Cancer without mechanical bowel preparation: one-center randomized prospective trial[J]. World J Surg Oncol, 2010, 8 (35): 35. |
| [3] | 林明霞, 严世英, 黄英. 结直肠癌手术部位感染病原学及影响因素分析[J]. 中华医院感染学杂志, 2014, 24 (9): 2244-6. |
| [4] | Dahabreh IJ, Steele DW, Shah N, et al. Oral mechanical bowel preparation for colorectal surgery.[R]. Rockville (MD): Agency for Healthcare Research and Quality (US), 2014: 14-EHC018-EF. |
| [5] | Mckenna T, Macgill A, Porat G, et al. Colonoscopy preparation: polyethylene glycol with Gatorade is as safe and efficacious as four liters of polyethylene glycol with balanced electrolytes[J]. Dig Dis Sci, 2012, 57 (12): 3098-105. DOI: 10.1007/s10620-012-2266-5. |
| [6] | Dahabreh IJ, Steele DW, Shah N, et al. Oral mechanical bowel preparation for colorectal surgery: systematic review and MetaAnalysis[J]. Dis Colon Rectum, 2015, 58 (7): 698-707. DOI: 10.1097/DCR.0000000000000375. |
| [7] | Kumar AS, Kelleher DC, Sigle GW. Bowel preparation before elective surgery[J]. Clin Colon Rectal Surg, 2013, 26 (3): 146-52. DOI: 10.1055/s-00000049. |
| [8] | 何超, 胡立胜. 肠道准备在结直肠手术中的应用[J]. 中国医师杂志, 2012, 14 (3): 351-2. |
| [9] | 郭雄图, 胡玉萍, 陈元岩, 等. 结直肠非急诊手术患者术前机械性肠道准备的临床研究[J]. 消化肿瘤杂志:电子版, 2012, 4 (1): 30-3. |
| [10] | 赖玮婧, 汪晓东, 李立. 大肠择期手术前行机械肠道准备的必要性探讨[J]. 中国循证医学杂志, 2009, 9 (9): 1022-5. |
| [11] | Cao F, Li J, Li F. Mechanical bowel preparation for elective colorectal surgery: updated systematic review and meta-analysis[J]. Int J Colorectal Dis, 2012, 27 (6): 803-10. DOI: 10.1007/s00384-011-1361-y. |
| [12] | Mangell P, Thorlacius H, Syk I, et al. Jeppsson B. Lactobacillus plantarum 299v does not reduce enteric bacteria or bacterial translocation in patients undergoing colon resection[J]. Dig Dis Sci, 2012, 57 (7): 1915-24. DOI: 10.1007/s10620-012-2102-y. |
| [13] | Moghadamyeghaneh Z, Hanna MH, Carmichael JC, et al. Nationwide analysis of outcomes of bowel preparation in colon surgery[J]. J Am Coll Surg, 2015, 220 (5): 912-20. DOI: 10.1016/j.jamcollsurg.2015.02.008. |
| [14] | Ohigashi S, Sudo K, Kobayashi D, et al. Significant changes in the intestinal environment after surgery in patients with colorectal cancer[J]. J Gastrointest Surg, 2013, 17 (9): 1657-64. DOI: 10.1007/s11605-013-2270-x. |
| [15] | 谢尚奎, 任东林, 吴印爱, 等. 两种肠道准备对结直肠癌患者术前肠屏障功能的影响[J]. 中国普外基础与临床杂志, 2009, 16 (9): 710-3. |
| [16] | Reddy BS, Macfie J, Gatt M, et al. Randomized clinical trial of effect of synbiotics, neomycin and mechanical bowel preparation on intestinal barrier function in patients undergoing colectomy[J]. Br J Surg, 2007, 94 (5): 546-54. DOI: 10.1002/(ISSN)1365-2168. |
| [17] | Hoffman A, Baxter R, Nasar A, et al. Perioperative polyphenon E, a green tea extract, does not affect the wound complication rate in mice after sham laparotomy yet has an inhibitory effect on wound healing[J]. Surg Innov, 2012, 19 (4): 399-406. DOI: 10.1177/1553350612436565. |
| [18] | Zhou J, Hiki N, Mine S, et al. Role of prealbumin as a powerful and simple index for predicting postoperative complications after gastric cancer surgery[J]. Ann Surg Oncol, 2016, 9 (8): 1120-3. |
| [19] | 闫红丽, 宁向军, 郭书霞. 结肠癌病人围术期实施肠内营养支持的临床观察[J]. 全科护理, 2011, 9 (18): 1610-1. |
| [20] | Xu R, Ding Z, Zhao P, et al. The effects of early Post-Operative soluble dietary fiber enteral nutrition for colon cancer[J]. Nutrients, 2016, 8 (9): E584-7. DOI: 10.3390/nu8090584. |
 2017, Vol. 37
2017, Vol. 37

