2. 广州军区广州总医院药学部,广东 广州 510010
2. Department of Pharmacy, General Hospital of Guangzhou Military Command, Guangzhou 510010, China
分子靶向显影能实现在细胞分子水平监测肿瘤进展状况, 为癌症治疗提供更详细的信息。分子靶向显影探针主要包括3个部分:靶向配体、连接子和荧光染料。目前常用的肿瘤靶向配体包括小分子、抗体、多肽、核酸适配体等等, 相比其他靶向分子, 生物素具备分子量小、稳定、容易修饰、低毒、经济适用性高等优势[1]。研究显示肿瘤组织中生物素水平明显高于正常组织[2], 其吸收主要通过钠依赖的复合维生素转运体(SMVT)介导[3], 近年研究显示乳腺癌、前列腺癌、卵巢癌等多种肿瘤细胞对生物素有很强的特异性吸收能力[4-7], 以生物素为靶头的肿瘤靶向已被广泛应用于肿瘤靶向治疗及显影研究[8-12]。二硫键在细胞外的氧化环境中二硫键稳定性高, 而在还原性细胞内环境中容易断裂。研究报道肿瘤细胞中还原性谷胱甘肽(GSH)水平比正常细胞高出几十倍[13-14], 因此, 通过二硫键连接靶向分子可实现对肿瘤细胞的双重靶向, 进一步提高对肿瘤细胞的靶向特性。
流行病学研究显示, 中国的乳腺癌发病率占世界范围的11%, 近几十年来中国乳腺癌发病率迅速上升, 因此, 针对乳腺癌的靶向治疗及监测水平的提高显得尤为重要[15]。研究显示生物素对乳腺癌有极好的靶向性[16], Bhuniya等[17]以罗丹明类染料piperazine rhodol为荧光分子, 生物素为靶向配体, 二硫键为连接子合成靶向显影探针3a, 研究显示3a可作为靶向探针与抗肿瘤药物偶联, 体内外研究显示偶联物对宫颈癌具有良好靶向性, 表明3a作为一种新型靶向显影探针, 在肿瘤靶向治疗和监测方面具有极好的应用前景。3a对乳腺癌的靶向性能尚未报道, 本文主要研究3a对乳腺癌细胞的靶向性能, 评价3a的稳定性和细胞毒性, 为乳腺癌的靶向显影提供新型靶向分子。
1 材料和方法 1.1 材料人乳腺癌MDA-MB-231、MCF-7细胞及人正常乳腺Hs 578Bst细胞为广州军区广州总医院药剂科保藏。3a (根据文献[17]合成)、二甲基亚砜(DMSO)、MTT、4, 6-联脒-2-苯基吲哚(DAPI)、多聚甲醛、L-还原型谷胱甘肽购自sigma; PBS、胎牛血清购自HyClone。
1.2 方法 1.2.1 GSH处理前后3a的吸收光谱和荧光光谱的变化用PBS缓冲液将3a稀释到15 μmol/L。用蒸馏水配制5.0 mmol/L的GSH溶液。将以下溶液依次加入比色皿中, 紫外分光光度计进行全波段扫描, 检测的狭缝宽度为2 nm:(1)15 μmol/L 3a溶液; (2)以0.5 mL 5.0 mmol/L GSH溶液处理5 min后的15 μmol/L 3a溶液。另用PBS缓冲液将3a稀释至5 μmol/L。将以下溶液依次加入比色皿中, 荧光分光光度计进行全波段扫描, 激发波长为510 nm, 狭缝宽度为3 nm, 检测荧光强度变化:(1) 5 μmol/L 3a溶液; (2)以0.5 mL 5.0 mmol/L GSH溶液处理5 min后的5 μmol/L 3a溶液。
1.2.2 分析Hs 578Bst细胞、MDA-MB-231细胞和MCF-7细胞对3a的摄取率将对数生长期的Hs 578Bst细胞、MDA-MB-231细胞和MCF-7细胞接种于6孔板, 待细胞贴壁后, 加入终浓度为5、10、20、50 μmol/L的3a, 对照组加入新鲜培养基, 继续培养2 h。之后消化收集各组细胞, PBS洗2次, 上流式细胞仪在510 nm激发波长处检测绿色荧光, 分析3种细胞对3a的摄取率。
1.2.3 3a的活细胞荧光成像将MCF-7细胞、MDAMB-231细胞和Hs 578Bst细胞分别接种于48孔板, 细胞贴壁后, 每孔加入20 μg/mL DAPI染色20 min, PBS洗3次, 实验组加入10 μmol/L 3a处理2 h。对照组用100 μmol/L的生物素预处理2 h后, PBS洗3次, 以10 μmol/L 3a处理2 h。各组细胞用PBS洗3次, 4 ℃下4%多聚甲醛固定20 min, PBS洗2次, 每次3 min, 弃PBS, 荧光倒置显微镜下观察拍照。
1.2.4 MTT法评价3a对MCF-7细胞、MDA-MB-231细胞和Hs 578Bst细胞的毒性将MCF-7细胞、MDAMB-231细胞和Hs 578Bst细胞分别接种于96孔板, 细胞贴壁后, 加入终浓度为0、2、5、10、20 μmol/L的3a, 对照组加入新鲜培养基, 每组设5个复孔, 分别作用24、48、72 h后吸去培养基, 每孔加入20 μL MTT溶液(5 mg/mL), 避光孵育4 h, 吸去孔内液体, 每孔加入150 μL DMSO, 震荡10 min, 充分溶解结晶, 酶标仪于570 nm处测吸光值。细胞存活率=实验组吸光度值/对照组吸光度值×100%。
1.2.5 统计学分析采用SPSS 20.0软件进行统计学分析。数据以均数±标准差表示, 不同处理组之间的比较采用单因素方差分析, P < 0.05说明差异有统计学意义。
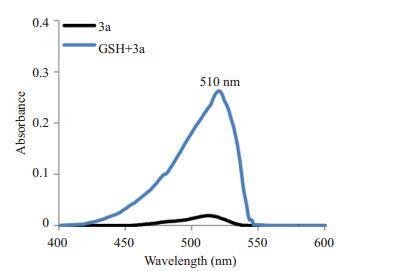
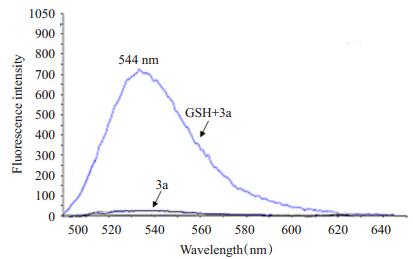
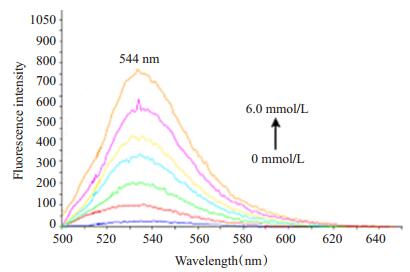
2 结果 2.1 GSH处理前后3a的吸收光谱和荧光光谱的变化3a的紫外光谱和荧光光谱扫描结果分别见图 1, 2, 光谱结果显示, 3a的最强吸收峰在510 nm处, 最强荧光发射信号在544 nm处。GSH处理后, 紫外光谱510 nm波长处的吸光度和荧光光谱544 nm处的荧光强度均明显高于未处理溶液。结果表明在GSH存在的条件下, 3a的二硫键断裂, 荧光基团释放, 发出强烈的荧光信号。为进一步确认GSH对3a稳定性的影响, 用0~6 mmol/L递增浓度的GSH处理3a溶液, 图 3结果显示, 随着GSH浓度升高, 544 nm波长处的荧光强度越高, 表明3a二硫键的裂解与GSH浓度相关。
|
图 1 GSH(5mmol/L)处理前后3a(15μmol/L)的吸收光谱 Figure 1 Absorption spectra of 3a (15 μmol/L) detected in the presence or absence of GSH (5 mmol/L). |
|
图 2 GSH (5 mmol/L)处理前后3a (5 μmol/L)的荧光光谱 Figure 2 Fluorescence spectra of 3a (5 μmol/L) detected in the presence or absence of GSH (5 mmol/L). |
|
图 3 GSH (0~6 mmol/L)处理后3a (5 μmol/L)荧光光谱的变化 Figure 3 Fluorescence changes of 3a (5 μmol/L) after treatment with increasing concentrations of GSH (0-60 mmol/L). |
不同浓度的3a作用于Hs 578Bst细胞、MDA-MB-231细胞和MCF-7细胞2 h后, 3种细胞对3a的摄取率如表 1所示, 结果显示, 3种细胞均能摄取3a, 且摄取率呈浓度依赖性上升。两种高表达生物素受体的乳腺癌细胞对3a的吸收率比消极受体的正常乳腺细胞高, 且该差异有统计学意义(P < 0.05), 具体表现为: 3a浓度为10 μmol/L时, 乳腺癌细胞摄取率比正常细胞高出数十倍; 3a浓度为20 μmol/L时, MCF-7细胞对3a摄取率高达80%, MDA-MB-231细胞摄取率为64%, 而Hs 578Bst细胞吸收率却在10%以下; 当3a浓度为50 μmol/L时, Hs 578Bst细胞的吸收率亦高达50%。结果表明, 3a的靶向浓度以10~20 μmol/L为最佳。
| 表 1 不同浓度3a作用于Hs 578Bst、MDA-MB-231、MCF-7细胞2h后的细胞摄取率 Table 1 Cellular uptake of 3a by Hs 578Bst, MDA-MB-231, and MCF-7 cells |
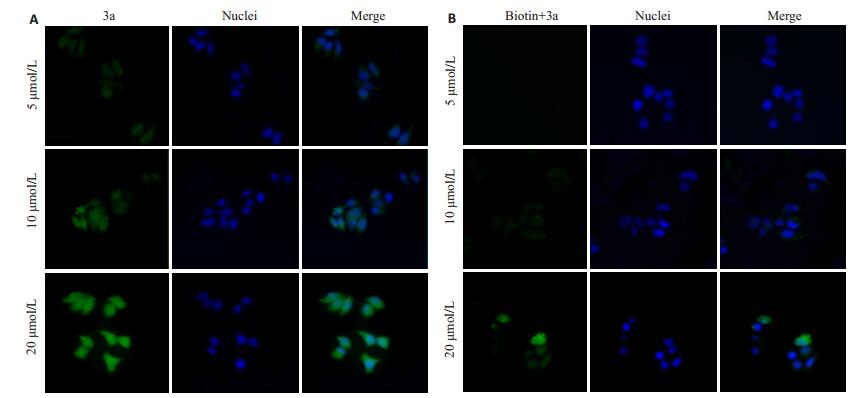
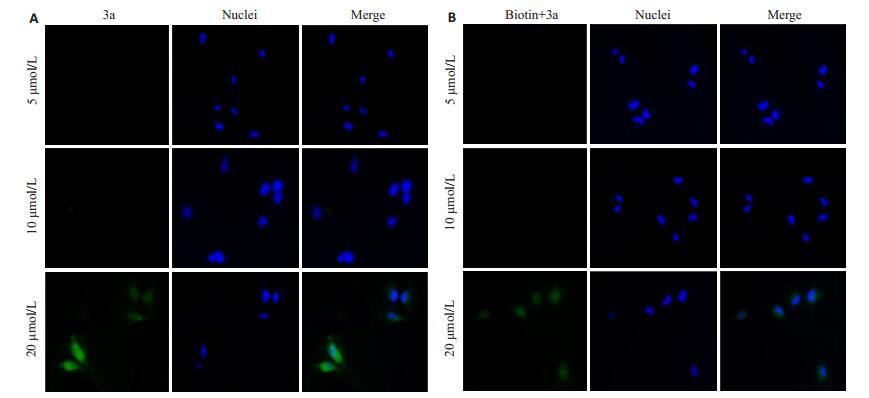
图 4~6分别为3a对MCF-7细胞、MDA-MB-231细胞和Hs 578Bst细胞的荧光成像结果, 结果表明, 随着3a浓度升高, 乳腺癌细胞MCF-7和MDA-MB-231细胞的荧光信号增强, 且在10 μmol/L浓度下, 3a对乳腺癌细胞的靶向像效果良好, 对人正常乳腺细胞成像效果极微, 说明3a实现靶向的最佳浓度为10 μmol/L。生物素预处理后, 两种乳腺癌细胞对3a的吸收明显减少, 荧光减弱, 表明3a通过生物素介导特异性靶向肿瘤细胞。
|
图 4 不同浓度3a对MCF-7细胞的荧光成像效果 Figure 4 Fluorescence images of MCF-7 cells treated with different concentrations of 3a (Original magnification: ×400). A: Cells without biotin pretreatment; B: Cells pretreated with biotin. |
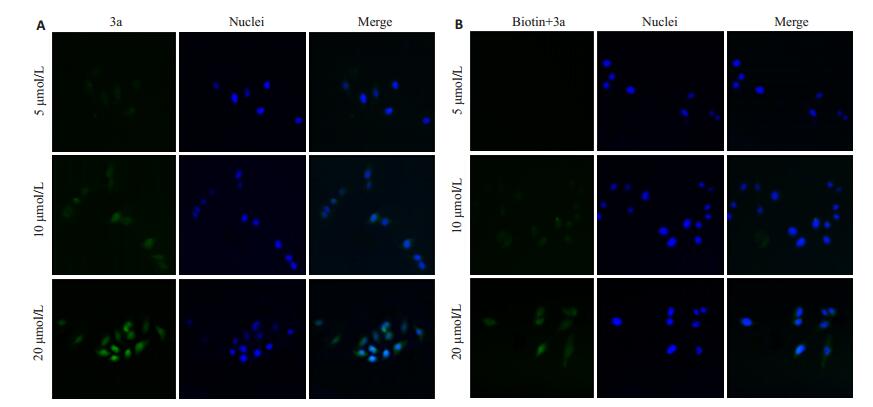
|
图 5 不同浓度3a对MDA-MB-231细胞的荧光成像效果 Figure 5 Fluorescence images of MDA-MB-231 cells treated with different concentrations of 3a (× 400). A: Cells without biotin pretreatment; B: Cells pretreated with biotin. |
|
图 6 不同浓度3a对Hs 578Bst细胞的荧光成像效果 Figure 6 Fluorescence images of Hs 578Bst cells treated with different concentrations of 3a (×400). A: Cells without biotin pretreatment; B: Cells pretreated with biotin. |
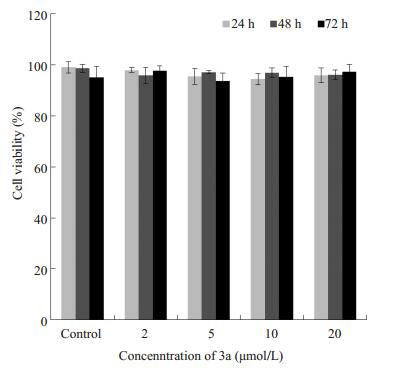
MTT结果(图 7~9)显示, 2~20 μmol/L 3a对MCF-7细胞、MDA-MB-231细胞的存活率影响相似, 与对照组相比, 细胞存活率降低, 差异有显著学意义, 但3a对MCF-7细胞的抑制作用不随浓度升高或时间延长而升高, 该结果表明2~20 μmol/L3a可在一定程度上抑制乳腺癌细胞增殖。2~20 μmol/L 3a作用于Hs 578Bst细胞24、48、72 h后, 与对照组相比, Hs 578Bst细胞存活率的差异无统计学意义(P>0.05), 表明3a对人正常乳腺细胞无明显毒性。
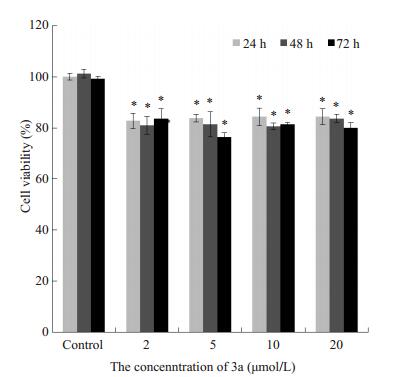
|
图 7 0~20 μmol/L 3a孵育不同时间对MCF-7细胞存活率的影响 Figure 7 Effect of 0-20 μmol/L 3a on MCF-7 cell viability over time (Mean±SD, n=3). *P < 0.05 vs control group. |
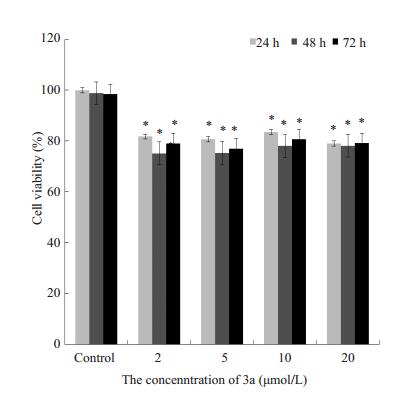
|
图 8 0~20 μmol/L 3a孵育不同时间对MDA-MB-231细胞存活率的影响 Figure 8 Effect of 0-20 μmol/L 3a on MDA-MB-231 cell viability over time (Mean±SD, n=3). *P < 0.05 vs control group. |
|
图 9 0~20 μmol/L 3a孵育不同时间对Hs 578Bst细胞存活率的影响 Figure 9 Effect of 0-20 μmol/L 3a on Hs 578Bst cell viability over time (Mean±SD, n=3). *P < 0.05 vs control group. |
小分子类靶向配体中, 叶酸和B12高表达的肿瘤通常对生物素的摄取率也较高, 而叶酸高表达的肿瘤对B12的摄取率较低, 这意味着, 相比叶酸和B12, 生物素具有更广泛的肿瘤靶向范围[16], 因此, 本研究选择通过生物素介导靶向效应的3a为研究对象。3a的荧光基团piperazine-rhodol是一种罗丹明类染料, 其发光机理为piperazine-rhodol的烯丙基芳基醚经过克莱森重排生成酸性酚基, 酚基进一步发生分子内酸-碱反应, 打开分子内酯环, 发出绿色荧光。当piperazine-rhodol通过二硫键与生物素相连时, 其荧光淬灭[17], 这种荧光的"开-关效应"为靶向显影提供了双重保障。Bhuniya等[17]已报道3a对Hela细胞的靶向性能, 本研究主要考察3a对高表达生物素的乳腺癌细胞MDA-MB-231和MCF-7的靶向成影性能。
本研究首先考察3a的二硫键可裂解性。吸收光谱和荧光光谱研究结果表明, 3a的二硫键在高水平谷氨酸存在的条件下能有效断裂, 释放出活性荧光基团, 发出荧光实现显影。细胞摄取反应结果亦表明3a能有效靶向乳腺癌细胞, 乳腺癌细胞对3a的摄取率明显高于人正常乳腺细胞, 3a在肿瘤细胞高水平的谷氨酸条件下二硫键断裂, 释放piperazine-rhodol, 发出荧光, 结果显示3a在10~20 μmol/L浓度范围内靶向效果更佳, 该浓度范围内, 乳腺癌细胞MCF-7和MDA-MB-231细胞对3a的摄取率在60%以上, 人正常乳腺细胞Hs 578Bst细胞的对3a的摄取率低于10%。为直观评价3a的靶向显影性能, 采用活细胞荧光成像观察10 μmol/L和20 μmol/L的3a对乳腺癌细胞MCF-7和MDA-MB-231和人正常乳腺细胞Hs 578Bst细胞的成像性能, 结果反映10 μmol/L的3a的肿瘤靶向显影性能较好, 能准确定位肿瘤细胞, 成像清晰, 且对人正常乳腺细胞Hs 578Bst细胞几乎无成像效果。经生物素预处理后MCF-7和MDA-MB-231细胞的荧光强度明显降低, 说明3a的乳腺癌靶向性是通过生物素受体介导的。3a作为肿瘤显影分子, 应用时应考虑到对细胞的毒性, 因此本实验采用MTT法评价3a对MCF-7细胞、MDA-MB-231细胞和Hs 578Bst细胞的毒性, 结果显示, 20 μmol/L 3a作用72 h对人正常乳腺细胞无毒性, 说明3a的细胞毒性极低, 安全性高。此外, 2~20 μmol/L 3a作用24~72 h降低MCF-7细胞和MDA-MB-231细胞的存活率, 说明3a可选择性抑制乳腺癌细胞存活。
综上, 3a作为一种新型生物素靶向显影探针, 具备以下优点:(1)特异性好, 能专一靶向乳腺癌细胞; (2)对正常乳腺细胞毒性极低, 对乳腺癌细胞有一定细胞毒作用; (3)肿瘤细胞定位准确, 成像清晰; (4)3a具有可偶联基团--羟基, 可通过羟基偶联其他强抗肿瘤药物制成前药, 通过生物素介导将前药靶向至肿瘤细胞, 在肿瘤细胞内高还原性条件下, 3a的二硫键断裂, 可释放出抗肿瘤化合物发挥抗肿瘤作用, 实现靶向-显影-治疗三合一功效。3a作为一种有潜力的肿瘤实时靶向显影探针, 对其进行进一步研究, 对肿瘤治疗的实时监测及预后具有一定意义。3a的下一步研究方向可能是:(1)探索3a对其它高表达生物素受体的肿瘤的靶向功能, 发掘3a的新应用范围。考虑到肺癌细胞A549高表达生物素受体[18], 而人胚胎肺成纤维细胞为阴性生物素受体[19-20], 下一步可研究3a对A549细胞的靶向显影性能; (2)合成3a的抗肿瘤药物偶联物, 开发新型靶向诊断治疗药物。
| [1] | 邓春月, 龙莹莹, 刘厦, 等. 生物素介导的胰腺癌靶向聚合物胶束制备及其用于光动力治疗的初步研究[J]. 药学学报, 2015, 50 (8): 1038. |
| [2] | Tripodo G, Mandracchia D, Collina S, et al. New perspectives in cancer therapy: the biotin-antitumor molecule conjugates[J]. Med Chem, 2014, 35 (8): 1. |
| [3] | Balamurugan K, Ortiz A, Said M. Biotin uptake by human intestinal and liver epithelial cells: role of the SMVT system[J]. Am J Physiol Gastrointest Liver Physiol, 2003, 285 (1): G73-7. DOI: 10.1152/ajpgi.00059.2003. |
| [4] | Vadlapudi AD, Vadlapatla RK, Pal D, et al. Biotin uptake by T47D breast cancer cells: Functional and molecular evidence of sodiumdependent multivitamin transporter (SMVT) J][J]. Int J Pharm, 2013, 441 (1/2): 535-43. |
| [5] | Patel M, Vadlapatla RK, Shah S, et al. Molecular expression and functional activity of Sodium dependent multivitamin transporter in human prostate cancer cells[J]. Int J Pharm, 2012, 436 (1/2): 324-31. |
| [6] | Jwala J, Vadlapatla RK, Vadlapudi AD, et al. Differential expression of folate Receptor-Alpha, Sodium-Dependent multivitamin transporter, and amino acid transporter (B (0, +)) in human retinoblastoma (Y-79) and retinal pigment epithelial (ARPE-19) cell lines[J]. J Ocul Pharmacol Ther, 2012, 28 (3): 237-44. DOI: 10.1089/jop.2011.0155. |
| [7] | Yellepeddi VK, Kumar A, Maher DM, et al. Biotinylated PAMAM dendrimers for intracellular delivery of cisplatin to ovarian cancer: role of SMVT[J]. Anticancer Res, 2011, 31 (3): 897-906. |
| [8] | Lis LG, Smart MA, Luchniak A, et al. Synthesis and biological evaluation of a biotinylated paclitaxel with an Extra-Long chain spacer arm[J]. ACS Med Chem Lett, 2012, 3 (9): 745-8. DOI: 10.1021/ml300149z. |
| [9] | Shi JF, Wu P, Jiang ZH, et al. Synthesis and tumor cell growth inhibitory activity of biotinylated annonaceous acetogenins[J]. Eur J Med Chem, 2014, 71 (8): 219-28. |
| [10] | Maiti S, Park N, Han JH, et al. Gemcitabine-Coumarin-Biotin conjugates: a target specific theranostic anticancer prodrug[J]. J Am Chem Soc, 2013, 135 (11): 4567-72. DOI: 10.1021/ja401350x. |
| [11] | Fahrer J, Schweitzer B, Fiedler K, et al. C2-Streptavidin mediates the delivery of Biotin-Conjugated tumor suppressor protein P53 into tumor cells[J]. Bioconjug Chem, 2013, 24 (4): 595-603. DOI: 10.1021/bc300563c. |
| [12] | Chen H, Nan W, Wei X, et al. Toxicity, pharmacokinetics, and in vivo efficacy of biotinylated chitosan surface-modified PLGA nanoparticles for tumor therapy[J]. Artif Cells Nanomed Biotechnol, 2016, 30 (7): 1-8. |
| [13] | Lash LH, Putt DA, Jankovich AD. Glutathione levels and susceptibility to chemically induced injury in two human prostate cancer cell lines[J]. Molecules, 2015, 20 (6): 10399-414. DOI: 10.3390/molecules200610399. |
| [14] | Traverso N, Ricciarelli R, Nitti M, et al. Role of glutathione in cancer progression and chemoresistance[J]. Oxid Med Cell Longev, 2013, 34 (9): 972913-7. |
| [15] | Li T, Mello-Thoms C, Brennan PC. Descriptive epidemiology of breast cancer in China: incidence, mortality, survival and prevalence[J]. Breast Cancer Res Treat, 2016, 159 (3): 395-406. DOI: 10.1007/s10549-016-3947-0. |
| [16] | Ren WX, Han JY, Uhm S, et al. Recent development of biotin conjugation in biological imaging, sensing, and target delivery[J]. Chem Commun (Camb), 2015, 51 (52): 10403-18. DOI: 10.1039/C5CC03075G. |
| [17] | Bhuniya S, Maiti S, Kim EJ, et al. An activatable theranostic for targeted cancer therapy and imaging[J]. Angew Chem Int Ed Engl, 2014, 53 (17): 4469-74. DOI: 10.1002/anie.201311133. |
| [18] | Jung D, Maiti S, Lee JH, et al. Rational design of biotin-disulfidecoumarin conjugates: a cancer targeted thiol probe and bioimaging[J]. Chem Commun (Camb), 2014, 50 (23): 3044-7. DOI: 10.1039/c3cc49790a. |
| [19] | Chen SY, Zhao XR, Chen JY, et al. Mechanism-Based TumorTargeting drug delivery system. validation of efficient vitamin Receptor-Mediated endocytosis and drug release[J]. Bioconjug Chem, 2010, 21 (5): 979-87. DOI: 10.1021/bc9005656. |
| [20] | Vineberg JG, Zuniga ES, Kamath A, et al. Design, synthesis, and biological evaluations of Tumor-Targeting Dual-Warhead conjugates for a Taxoid-Camptothecin combination chemotherapy[J]. J Med Chem, 2014, 57 (13): 5777-91. DOI: 10.1021/jm500631u. |
 2017, Vol. 37
2017, Vol. 37

