创伤一直以来都是全球公共卫生关注的重要话题。全球每年死于创伤的人数高达580万人[1], 控制创伤后活动性出血可避免相当一部分患者的死亡。如何早期识别出血风险、控制活动性出血、减少失血量、恢复组织灌注、实现血流动力学的稳定已成为相关领域亟待解决的关键问题。
创伤性凝血病(trauma-induced coagulopathy, TIC)是机体在严重创伤后出现以凝血功能障碍为主要表现的临床综合征[2]。约1/3创伤后失血的患者在入院前就已经出现创伤性凝血病的表现, 这大大增加了患者多器官功能衰竭的发生率及死亡率[3]。早期研究证实, 采用大量输血方案救治创伤性凝血病患者可以提高他们的生存率[4]。大量输血(massive transfusion, MT)是指伴有严重活动性出血的患者在短时间内需要输注大量血制品进行救治[5], 即24 h内输注红细胞≥10 U。研究表明该类患者死亡率高, 因此选择合适的输注比例将对患者的预后产生重要影响[6]。近几年, 有很多研究分别发现输注血浆与红细胞的比例高于1: 4、1: 2以及2: 3时, 明显改善了创伤患者的预后[7]。也有研究认为高比例输注血浆及红细胞是预测接受大量输血患者存活率的独立因子, 更加积极的输注新鲜冰冻血浆可能提高他们的存活率[8]。这些研究者们提倡对预测到即将需要大量输血的患者实行1: 1(血浆:红细胞)输血方案, 以实现大部分患者的输注比例可以达到1: 2, 以此提高患者的存活率[8]。Anthony等[9]研究发现, 患者输注血浆与红细胞的比例是不断变化的, 与其存活率无明显相关。另一些研究则认为输注时间的管理可能会影响输注结果, 输注高比例血浆及红细胞所表现出的生存率提高可能只是因为这类患者存活时间足够长, 可以接受更多血制品的输注[7]。2016年《欧洲创伤后严重出血和凝血障碍管理指南》建议对预期需要大量输血救治的患者输注血浆与红细胞之比≥1: 2, 证据等级为1 B级[3]。Kashuk等[10]在研究133名入院后6 h输注红细胞>10 U的患者后发现, 血浆与红细胞的输注量呈U形曲线关系, 证实最佳血浆及红细胞输注比例为1: 3~1: 2。
针对创伤后需要大量输血救治患者血制品输注比例问题, 本文率先将血浆及红细胞的输注比例以1: 2作为分界点, 设定了严格的纳入及排除标准, 最终纳入5篇研究进行数据合并、综合分析及讨论, 将血浆及红细胞比值当作与时间相关的变量, 以明确高/低(≥1: 2/ < 1: 2)比例输注血浆及红细胞对患者预后的影响, 为临床诊疗提供依据。
1 资料和方法 1.1 文献检索计算机检索Cochrane Library、Pubmed、Web of science、EMBASE, 手工检索相关领域杂志。语种仅限英文。检索时间为2009年1月~2016年4月。英文检索词:trauma/injury/wound、massive transfusion、plasma/ component、red blood cell/erythrocyte、ratio/FFP:RBC ratio。
1.2 纳入/排除标准 1.2.1 纳入标准(1)研究类型:随机对照实验、前瞻性观察性研究和回顾性队列研究; (2)研究对象:年龄≥18岁; 外伤后采取大量输血救治的患者; (3)干预措施:高比例组输注血浆(含新鲜冰冻血浆)及红细胞比例为≥1: 2、低比例组 < 1: 2;组间的创伤严重度评分(Injury Severity Score, ISS)无统计学差异; (4)观察指标:患者24 h及30 d死亡率、24 h生存率。
1.2.2 排除标准(1)个案报道、综述、读者评论、随访资料不全以及只有摘要而缺乏全文的研究; (2)输注比例中未涉及高低比例分组; (3)未提供ISS或者两组ISS有显著差异; (5)伴严重颅脑损伤的患者。
1.3 资料提取由2位研究者独立提取资料, 对任何一篇潜在的相关研究阅读其全文, 根据纳入和排除标准复核纳入研究, 排除重复发表文献, 确定纳入文献后, 提取相关数据。提取数据的主要内容包括:(1)一般资料:题目、作者、发表日期和文献来源; (2)研究特征:研究对象的一般情况、各组病人的基线可比性及干预措施; (3)观察指标:患者24 h及30 d死亡率、24 h生存率。如遇分歧, 则通过讨论或者根据第3位研究人员的意见协商决定。
1.4 统计分析采用RevMan 5.3软件进行数据分析。采用相对危险度(OR)以及其95%可信区间(CI)作为死亡率的统计学测量指标, P < 0.05。采用风险比(HR)以及其95%CI作为生存率的统计学测量指标, lnHR及SE是通过Tierney[11]发表在《Trials》上的生存曲线数据提取软件"Engauge Digitizer"及其附带计算表格计算得来。采用χ2来评估文献之间的异质性, 当P≥0.1, I2 < 50%时, 采用固定效应模型; 若P < 0.1, I2>50%, 先分析异质性来源, 若无明显临床异质性, 采用随机效应模型分析; 若存在临床异质性, 则根据可能出现的异质性因素进行亚组分析; 若亚组内存在明显的临床和方法学异质性时, 则采用描述性分析。
2 结果 2.1 纳入研究的一般情况检索文献880篇、纳入5篇, 均为回顾性研究, 共计1024例患者(筛选流程见图 1、纳入研究的基本特征见表 1)。
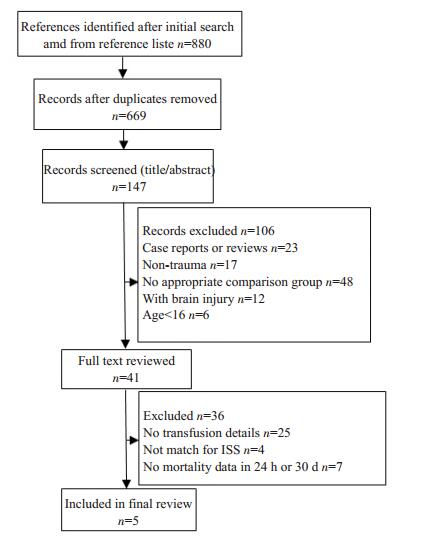
|
图 1 文献筛选流程图 Figure 1 Flow chart of the process of trial selection. |
| 表 1 纳入研究的基本特征以及NOS评分结果 Table 1 Basic demographics of included studies |
采用观察性研究质量评估量表纽卡斯尔-渥太华量表(the Newcastle-Ottawa Scale, NOS)进行质量评估[12], 该量表包括研究人群选择、组间可比性以及结果测量等方面, 满分9分。本文仅纳入了7分以上的高质量文献, 得分具体情况见表 1。
2.3 荟萃分析的结果 2.3.1 组间可比性及敏感性分析各研究对大量输血定义一致, 组间创伤严重程度评分无统计学差异, 具有可比性(表 1)。数据合并后各I2值均 < 50%, 采用固定效应模型分析; I2≠0时, 考虑异质性与某些研究样本量少、研究年限不同有关。总体而言, 各文献研究的方法、结果等一致性较高。
2.3.2 死亡率高比例组患者24 h及30 d死亡率较低比例组明显降低, OR、95%CI及P值分别为0.35[0.25, 0.48], P < 0.000 01(图 2)及0.55[0.41, 0.75], P=0.0001(图 3)。
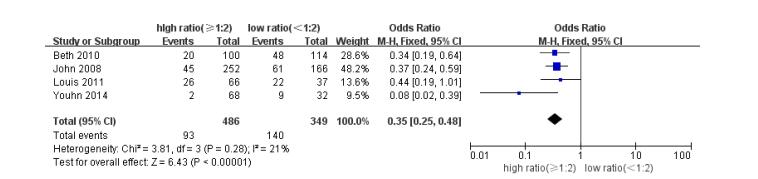
|
图 2 高/低比例组患者24 h死亡率,OR及95%CI Figure 2 Meta-analysis of 24-h mortality between high and low plasma: RBC ratio groups with a cut-off value at 1:2. Odds ratios are shown with 95% confidence intervals (CI). |
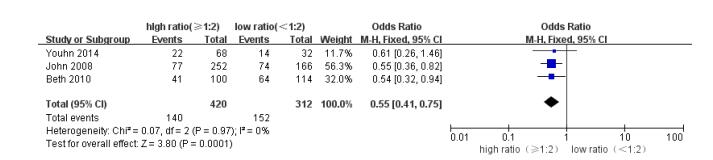
|
图 3 高/低比例组患者30 d死亡率,OR及95%CI Figure 3 Meta-analysis of 30-day inpatient mortality between high and low plasma: RBC ratio groups with a cut-off value at 1:2. Odds ratios are shown with 95% CI. |
高比例组患者24 h生存率显著提高(HR 2.34, 95%CI[1.46, 3.73], P=0.000 01, 图 4)。
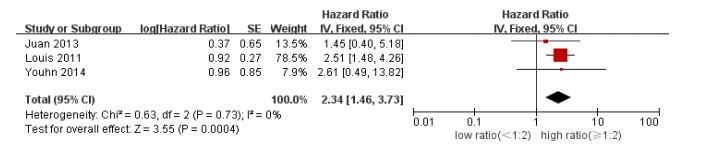
|
图 4 高/低比例组患者24 h生存率,HR及95%CI Figure 4 Meta-analysis of 24-h survival rate between high and low plasma: RBC ratio groups with a cut-off value at 1:2. Odds ratios are shown with 95% CI. |
创伤的发生率正在逐步上升, 患有创伤性凝血病、需要大量输血方案救治的患者也在不断增加, 明确最佳血浆及红细胞输注比例可以挽救许多患者的生命[1]。先前曾有国外学者采用meta分析方法研究过血浆及红细胞输注比例问题[13], 所得的结论并不完全一致, 国内尚未见相关的系统性分析。针对创伤后大量输血血浆及红细胞输注比例问题, 本研究率先将输注比例以1:2作为分界点, 设定了严格的纳入及排除标准, 最终入选了5篇符合要求的研究进行荟萃分析。
结果显示, 高比例组患者24 h及30 d死亡率较低比例组明显降低, 高比例组患者24 h生存率显著提高, 因此输注高比例血浆及红细胞可以降低创伤后需要大量输血救治患者的死亡率。该结论与Pati等[14]对动物出血模型的研究结论一致。该研究表明, 血浆对血管内皮细胞具有潜在的保护功能, 选择血浆代替晶体进行复苏将有助于血管内皮细胞的修复、维持血管的稳定性。影响创伤后需要大量输血救治患者的预后因素众多, 血浆与红细胞的输注比例是其中重要且可控的因素之一, 因此输注比例一直是创伤救治领域的研究热点。
高比例输注血浆及红细胞可以提高患者的生存率, 这一结论被许多战伤救治中心所证实。Hardin等[15]对930名战伤后接受大量输血救治患者的回顾性研究显示, 不论是爆炸还是枪击所导致的创伤, 高比例组(血浆:红细胞>1: 1.5)患者的生存率均高于低比例组(血浆:红细胞≤1: 1.5), 也表明血制品的输注比例对患者预后的改善与其受伤机制关系不大。
鉴于普通居民创伤与战伤在受伤机制、部位以及输血成分均有所不同, 不少学者对将战伤研究结论运用于普通居民的创伤救治中是否也能使患者获益进行了研究。Bui等[16]一项前瞻性观察性研究显示, 当血浆与红细胞之比≥1.5时, 患者入院后24 h的生存率明显高于输注比例低于1: 1.5的患者, Bui还认为输注比例≥1: 1.5是预测患者创伤后需要大量输血救治的独立的预测因子(R=0.59)。
在对创伤后血浆及红细胞输注比例的相关研究中, 对高比例的具体定义缺乏统一。本研究结果显示, 创伤后高比例输注血浆及红细胞将使患者明显获益, 但对于输注比例超过1: 2, 如当比值为1: 1时, 输注比例对患者预后的影响尚不明确。John等[17]开展的一项多中心随机试验(PROPPR)研究了血浆、血小板及红细胞3者输注比例分别为1: 1: 1及1: 1: 2时患者24 h及30 d的死亡率。结果发现两组间的死亡率并无明显差异, 即使前者输注较多的血浆及血小板, 两组间包括急性呼吸窘迫综合征等在内的预先设想的23种并发症的发生率也无明显差异。因此, 创伤后采用大量输血方案救治患者时, 血浆及红细胞的最佳输注比例还有待进一步探讨。
患者经大量输血方案救治后并发症的发生率是否与其输注血浆与红细胞比例相关尚无定论。Park等[18]对1475例创伤后接受输血治疗的患者进行研究后发现, 接受大量输血救治的患者急性呼吸窘迫综合征的发生率高于没有接受大量输血的患者(8.4% vs 5.3%), 两组间的死亡率没有明显差异。Younghwan [19]在研究中发现, 高比例组患者血源性感染发生率高, 具有统计学意义(P=0.028), 而两组导管相关感染、ARDS的发生率并无差异。Starkey等[20]在研究了80名战伤后接受大量输血救治的患者后发现, 两组患者急性呼吸窘迫综合征发生率无明显差异(18.2% vs 23.3%, P=1.000)。因此高比例输注血制品与患者并发症发生率之间的关系尚不明确。患者的基础病、用药史以及受伤部位的不同会对并发症的发生产生影响; 不同研究因研究对象、样本量的差异, 也可能得出不同的结论。此外该研究认为, 出血控制后减少血制品及晶体的用量, 可在一定程度上预防ARDS的发生, 减轻容量负荷导致的并发症。
许多学者在研究血浆与红细胞输注比例时采用回顾性研究, 有人提出此类研究存在生存者偏移, 结论的真实性有待进一步评估[21]。生存者偏移是指在研究不同的治疗方法对患者生存率的影响时, 所观察的结局指标在研究的开始或者治疗前已经出现, 这通常会影响研究结果的真实性[22]。例如, 在研究创伤后患者输注血浆及红细胞比例与生存率之间的关系时, 由于部分患者在入院后短时间内死亡, 使得他们所输注血浆及红细胞的比例来不及达到高比例的范围, 而由此得到的高比例输注血浆及红细胞能降低患者死亡率的结论可能仅仅是因为这部分患者存活时间足够长, 能够接受更多的血制品输注而已[23]。Magnotti等[24]在研究中剔除入院后6 h内死亡的患者后发现, ISS无统计学差异的两组患者, 高比例组入院后6~24 h的存活率并没有明显提高。另外, 由于高比例组患者入院时碱剩余及乳酸值相对于低比例组更倾向于正常, 这表明前者受伤严重程度更低, 进一步证实了生存者偏移的存在。目前多数文献都是研究某个特定时间点(如24 h)患者累计输注血浆及红细胞比例与患者死亡率之间的关系, 常常忽略了该比值会随时间不断变化的特征, 使研究的结论常受生存者偏移的影响。本研究在合并患者24 h生存率时, 将患者血浆及红细胞的输注比例与其入院时间相结合, 将输注比例看作与时间相关的变量进行分析, 最终得出高比例组患者相对于低比例组具有明显的生存优势(HR 2.34, 95%CI[1.46, 3.73], P=0.000 01), 此种分析方法在一定程度上减少了生存者偏移, 使研究结论更加可信。
研究仍存在以下不足:(1)所纳入文献皆为回顾性研究, 难以避免此类研究所产生的偏移; (2)对研究结果有影响的混杂因素很多, 虽已使组间ISS无统计学差异, 本研究尚缺乏对其他因素如年龄、碱剩余等潜在混杂因素的控制; (3)所纳入文献缺乏国内研究数据, 能否将该结论直接应用于国内创伤患者救治中, 需要更多大样本多中心随机对照临床试验提供更加可靠的证据。
| [1] | GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and National age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015, 385 (9963): 117-71. DOI: 10.1016/S0140-6736(14)61682-2. |
| [2] | Davenport RA, Brohi K. Cause of trauma-induced coagulopathy[J]. CurrOpinAnaesthesiol, 2016, 29 (2): 212-9. |
| [3] | Rossaint R, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition[J]. Critical Care, 2016, 20 : 100. DOI: 10.1186/s13054-016-1265-x. |
| [4] | Holcomb JB, Del Junco DJ, Fox EE, et al. The prospective, observational, multi-center major trauma transfusion (PROMMTT) study: comparative effectiveness of a time-varying treatment with competing risks[J]. JAMA Surg, 2013, 148 (2): 127-36. DOI: 10.1001/2013.jamasurg.387. |
| [5] | Raymer JM, Flynn LM, Martin RF. Massive transfusion of blood in the surgical patient[J]. SurgClin North Am, 2012, 92 (2): 221-34. DOI: 10.1016/j.suc.2012.01.008. |
| [6] | Wijaya R, Cheng HM, Chong CK. The use of massive transfusion protocol for trauma and non-trauma patients in a civilian setting: what can be done better[J]. ? Singapore Med J, 2016, 57 (5): 238-41. DOI: 10.11622/smedj.2016088. |
| [7] | Zink A, Sambasivan N, Holcomb B, et al. A high ratio of plasma and platelets to packed red blood cells in the first 6 hours of massive transfusion improves outcomes in a large multicenter study[J]. Am J Surg, 2009, 197 (5): 565-70; discussion 570. DOI: 10.1016/j.amjsurg.2008.12.014. |
| [8] | Shaz BH, Dente CJ, Nicholas JA, et al. Increased number of coagulation products in relationship to red blood cell products transfused improves mortality in trauma patients[J]. Transfusion, 2010, 50 (2): 493-500. DOI: 10.1111/trf.2010.50.issue-2. |
| [9] | Ho M, Dion W, Yeung H, et al. Prevalence of survivor bias in observational studies on fresh frozen plasma: erythrocyte ratios in trauma requiring massive transfusion[J]. Anesthesiology, 2012, 116 (3): 716-28. DOI: 10.1097/ALN.0b013e318245c47b. |
| [10] | Kashuk JL, Moore EE, Johnson JL, et al. Postinjury Life threatening coagulopathy: Is 1: 1 fresh frozen plasma: Packed red blood cells the answer[J]. ? J Trauma, 2008, 65 (2): 261-70. DOI: 10.1097/TA.0b013e31817de3e1. |
| [11] | Tierney JF, Stewart LA, Ghersi D, et al. Practical methods for incorporating summary time-to-event data into meta-analysis[J]. Trials, 2007, 8 : 16. DOI: 10.1186/1745-6215-8-16. |
| [12] | Wells GA. The Newcastle-Ottawa scale (NOS) for assessing the quality if nonrandomized studiesin meta-analyses[EB/OL].http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp(2012). |
| [13] | Bhangu A, Nepogodiev D, Doughty H, et al. Metaanalysis of plasma to red blood cell ratios and mortality in massive blood transfusions for trauma[J]. Injury, 2013, 44 (12): 1693-9. DOI: 10.1016/j.injury.2012.07.193. |
| [14] | Pati S, Matijevic N, Doursout MF, et al. Protective effects of fresh frozen plasma on vascular endothelial permeability, coagulation, and resuscitation after hemorrhagic shock are time dependent and diminish between Days 0 and 5 after thaw[J]. J Trauma, 2010, 69 (Suppl 1): S55-63. |
| [15] | Hardin MO, Ritchie JD, Aden JK, et al. Plasma-to-Red cell ratio and mechanism of injury in massively transfused combat casualties[J]. Mil Med, 2014, 179 (1): 92-8. DOI: 10.7205/MILMED-D-13-00005. |
| [16] | Bui E, Inaba K, Ebadat A, et al. The impact of increased plasma ratios in massively transfused trauma patients: a prospective analysis[J]. Eur J Trauma EmergSurg, 2016, 42 (4): 519-25. DOI: 10.1007/s00068-015-0573-1. |
| [17] | Holcomb JB, Tilley BC, Baraniuk S, et al. Transfusion of plasma, platelets, and red blood cells in a 1: 1: 1 vs a 1: 1: 2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial[J]. JAMA, 2015, 313 (5): 471-82. DOI: 10.1001/jama.2015.12. |
| [18] | Park K, Cannon W, Ye Wen, et al. Transfusion strategies and development of acute respiratory distress syndrome in combat casualty care[J]. J Trauma Acute Care Surg, 2013, 75 (2 Suppl 2): S238-46. |
| [19] | Kim Younghwan, Lee KiYoung, KimJihyun, et al. Application of damage control resuscitation strategies to patients with severe traumatic hemorrhage: review of plasma to packed red blood cell ratios at a single institution[J]. J Korean Med Sci, 2014, 29 (7): 1007-11. DOI: 10.3346/jkms.2014.29.7.1007. |
| [20] | Starkey K, Keene D, Morrison JJ, et al. Impact of high ratios of plasma-to-red cell concentrate on the incidence of acute respiratory distress syndrome in UK transfused combat casualties[J]. Shock, 2013, 40 (1): 15-20. DOI: 10.1097/SHK.0b013e3182991f37. |
| [21] | Ho AM, Zamora JE, Holcomb JB, et al. The many faces of survivor bias in observational studies on trauma resuscitation requiring massive transfusion[J]. Ann Emerg Med, 2015, 66 (1): 45-8. DOI: 10.1016/j.annemergmed.2014.12.030. |
| [22] | Savage A, Zarzaur L, Croce A, et al. Redefining massive transfusion when every second counts[J]. J Trauma Acute Care Surg, 2013, 74 (2): 396-400; discussion 400-2. DOI: 10.1097/TA.0b013e31827a3639. |
| [23] | Brown B, Cohen J, Minei P, et al. Debunking the survival bias myth: characterization of mortality during the initial 24 hours for patients requiring massive transfusion[J]. J Trauma Acute Care Surg, 2012, 73 (2): 358-64; discussion 364. DOI: 10.1097/TA.0b013e31825889ba. |
| [24] | Magnotti J, Zarzaur L, Fischer E, et al. Improved survival after hemostatic resuscitation: does the emperor have no clothes[J]. ? J Trauma, 2011, 70 (1): 97-102. DOI: 10.1097/TA.0b013e3182051691. |
| [25] | Duchesne Carlos, Heaney Jiselle, Guidry Chrissy, et al. Diluting the benefits of hemostatic resuscitation: a multi-institutional analysis[J]. J Trauma Acute Care Surg, 2013, 75 (1): 76-82. DOI: 10.1097/TA.0b013e3182987df3. |
| [26] | Holcomb JB, Wade CE, Michalek JE, et al. Increased plasma and platelet to red blood cell ratios improves outcome in 466 massively transfused civilian trauma patients[J]. Ann Surg, 2008, 248 (3): 447-58. |
 2017, Vol. 37
2017, Vol. 37

