2. 南方医科大学南方医院,广东 广州 510515
2. Department of Cardiology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
周围动脉疾病(PAD)是一类常见的临床综合征,包括主动脉和肢体供血动脉的狭窄和阻塞性疾病。动脉硬化,炎症,遗传,创伤等因素导致大血管发生狭窄甚至闭塞后,其供血区骨骼肌发生缺血性损伤导致微循环障碍,引起间歇性跛行、静息性疼痛及肢体坏疽等临床表现。目前临床主要的治疗手段为早期处理高危因素、外科手术、溶栓、介入取栓和支架置入等。虽然上述治疗措施可以起到疏通大血管的作用,但对于因血管闭塞而造成的微循环损伤却效果欠佳。
减阻剂(DRPs)是一类具有减少流体阻力的线性高分子化合物,而聚氧化乙烯(PEO)是属于DRP的一种高分子物质[1]。已有的研究表明PEO能有效恢复大鼠急性缺血后肢骨骼肌的血流灌注[2],并将微动脉血管壁的切应力提高30% [3]。那么,能否通过提高缺血性损伤区域的血流剪切力来促进小动脉形成,从而促进该缺血区域的微循环恢复呢?本实验拟通过超声造影方法测定微循环血流量,观察PEO对慢性缺血骨骼肌微循环灌注的影响,并探讨减阻剂通过提高血流剪切力促进缺血组织动脉生长的可能性。
1 材料和方法 1.1 实验动物选取雄性SPF级Wistar大鼠12只,体质量220~250 g,由南方医科大学实验动物中心提供,实验动物质量合格证号:0073596。
1.2 减阻剂的制备与提纯用生理盐水将PEO配制成终浓度为0.1%的溶液,随后放入透析袋(分子截留量为5000)中透析24 h,并使用过滤器(孔径0.2 μm)进行过滤除菌。通过凝胶渗透色谱法测定PEO的相对分子质量(4.99×106)。最后用生理盐水进行稀释(终浓度为50 ppm),并放置于4 ℃冰箱中备用[4]。
1.3 大鼠静脉输液通道的建立腹腔注射3%戊巴比妥钠(50 mg/kg体质量)麻醉大鼠,固定于操作台,备皮备毛、消毒。采用无菌操作,首先在大鼠背部做一切口(长约8 mm),随后在其左侧颈部做一切口(长约1 cm),分离颈静脉。在颈静脉内做一“V”形切口,插入PE50管,并用肝素生理盐水(10 U/mL)冲管,用细钢丝(长约1 cm)封闭留置管。皮下固定导管后,将导管引导至背部切口并固定,背部皮肤外保留导管长度约1 cm后,常规缝合伤口,消毒,解除固定。术后大鼠分笼饲养,并予肝素生理盐水(10 U/mL,总计0.1 mL/d)冲管及光照保暖(图 1)。

|
图 1 大鼠给药场景图 Figure 1 Administration of PEO and saline in the rats. |
建立大鼠输液通道后第3天,腹腔注射3%戊巴比妥钠(50 mg/kg)麻醉大鼠,固定于操作台,备皮、消毒。采用无菌操作在大鼠右侧后肢腹股沟韧带下缘做一纵行切口(长约1 cm),分离右股动脉及其分支后,将其结扎并切断,同时应避免损伤周围静脉及神经[5],左侧后肢不做处理。
1.5 给药方法将上述模型大鼠随机分为两组,于第1、3、5、7、9、11、13天自由活动状态下通过静脉输液通道进行给药。治疗组输注PEO(以大鼠体质量的6%计算血容量,使血中PEO终浓度达到2 μg/mL [6],输注时间共计30 min);对照组以相同速度和时间输注生理盐水。治疗结束后予肝素生理盐水(10 U/mL,总计0.1 mL/d)冲管及光照保暖。
1.6 评估骨骼肌血流灌注情况于术前及术后第1、3、7、14、21、28天行超声造影评价大鼠后肢的血流情况。采用实时成像技术分别进行心腔和骨骼肌声学造影,测定心腔和后肢骨骼肌的血流容积(代表血管的密度,A)及微泡速度(代表血流速度,β)[7]。具体方法是:将大鼠麻醉、固定、备皮后,使用Sequoia 512超声仪(SIEMENS,17L5探头),将17L5超声探头定位在大鼠左心室短轴切面,二维模式下调整切面至图像满意后,固定探头,将超声模式调整为相干脉冲序列成像技术(CPS),设定超声频率7.0 MHz,机械指数(MI)为0.18,动态范围为55 dB,调整图像增益(CPS gain)至显像满意,保持参数不变,通过输液管道输液泵持续滴注声学造影剂全氟丙烷,速度为20 μL/min,以大鼠心电图R波触发间歇成像取的心腔造影图像,存取图像备分析;再将超声探头定位在大鼠后肢中部(髌骨和踝关节连线中点),二维模式选取满意切面后改用CPS模式,参数如心腔造影,以时间触发成像(触发间期为500 ms),使用微量泵经静脉通道持续滴注全氟丙烷(速度为200 μL/min),当造影图像提示造影剂充盈达稳态后,调高机械指数(MI)至0.63破坏造影剂微泡后,开始存取造影图像至造影剂再次达到稳态充盈。全部造影图像存储于光盘,使用MCE软件脱机分析图像及数据,记录A、β及A×β值μ。代入公式
| $ \frac{60*{{\beta }_{m}}*{{A}_{m}}/\left( {{A}_{LV}}*10 \right)}{{{\rho }_{m}}} $ |
计算骨骼肌的绝对血流量,其中Am/ALV为利用心腔造影进行标准化后的声学平台强度,即标准化后大鼠后肢骨骼肌血管密度(标准化的A值),由于本实验中骨骼肌的超声造影剂浓度是心腔的造影剂浓度的10倍,ρm为大鼠肌肉的密度(ρm=1.05 g/mL)[8]。
1.7 测定模型大鼠慢性缺血后肢的血流储备在第28天,大鼠后肢骨骼肌在平静状态下行声学造影后,继续持续滴注全氟丙烷(200 μL/min),使用临时起搏器刺激大鼠后肢骨骼肌(频率为120次/min)2 min后,重新开始声学造影并留取图像,期间超声造影的模式及参数均保持不变。使用MCE软件脱机分析图像及数据,记录A、β及A×β值。根据公式:
血流储备=负荷状态血流量/平静状态血流量
可以得到血流储备值。
1.8 统计学方法采用SPSS13.0软件进行统计学分析,对于不同时间和组别之间以及同一治疗组的不同时间之间的血流灌注情况采用重复测量的方差分析;对于同一时间的两组间的血流量采用两独立样本t检验;对于负荷状态的血流量及血流储备量采用两独立样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 聚氧化乙烯对慢性缺血模型大鼠后肢骨骼肌血流灌注的影响利用超声造影血流灌注成像技术评估模型大鼠术前及术后1、3、7、14、21、28 d慢性缺血后肢骨骼肌的血流灌注情况(图 2)。术前,PEO组及对照组大鼠后肢血流定量结果无统计学差异(0.55±0.13 vs 0.54±0.11 mL· g-1·min-1,t=0.179,P=0.862)(图 3)。术后第1天,PEO组和对照组之间的缺血后肢血流量无统计学差异分别为0.10±0.03 vs 0.09±0.02 mL·g-1·min-1,各为术前的(19.1±7.3)%和(19.1±10.7)%,t=1.003,P=0.340)。术后第14天,PEO组血流量恢复已经显著快于对照组(P=0.007)。术后第28天,PEO组大鼠缺血后肢的血流量高于对照组,结果有统计学差异(0.32±0.04 vs 0.21±0.04 mL·g-1·min-1,P=0.001),PEO组的血流恢复到术前的(65.3±22.0)%,而对照组仅恢复到(48.9±15.8)%。
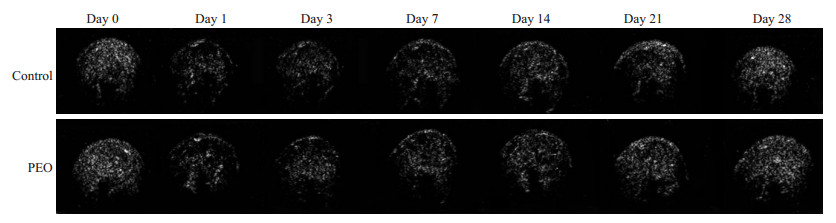
|
图 2 大鼠缺血后肢不同时间点的声学造影图像 Figure 2 Contrast-enhanced ultrasound (CEU) of ischemic hindlimbs of rats at different time points. |
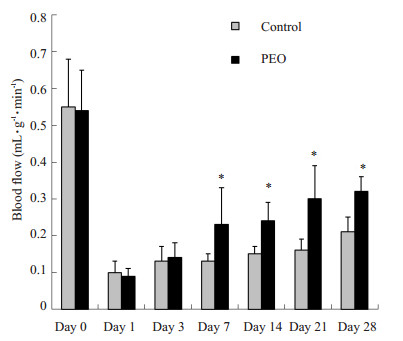
|
图 3 大鼠缺血后肢血流灌注的比较 Figure 3 Comparison of blood perfusion in the ischemic hindlimb of rats. *P < 0.05 for comparison between the two groups at the same time point. |
术前,两组大鼠间的右侧后肢标化A值无统计学差异(t=0.743,P=0.474);术后第1天,两组的标化A值分别为0.28±0.10及0.30±0.08(t=0.392,P=0.703);术后第14天,PEO组的标化A值与对照组的比较有显著性差异(t=2.245,P=0.049 < 0.05),这与血流量的变化趋势是一致的;术后第28天,PEO组血管容积较对照组明显增加,结果有统计学差异(0.45±0.11 vs 0.31±0.06,t=2.249,P=0.024 < 0.05)(图 4)。
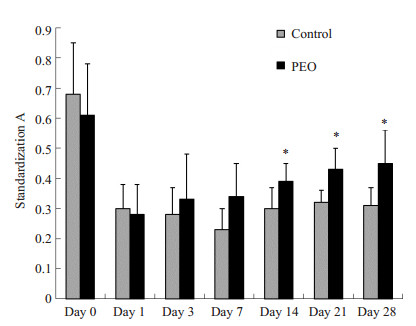
|
图 4 大鼠缺血后肢标化A值的比较 Figure 4 Comparison of standardized A in CEU of the ischemic hindlimbs of rats. *P < 0.05 for comparison between the two groups at the same time point. |
术前,两组大鼠间的后肢缺血的骨骼肌的β值无统计学差异(t=0.757,P=0.467);术后第1天,两组的β值分别为0.06±0.03及0.07±0.03 s-1(t=0.169,P=0.869);术后第28天,PEO组的β值与对照组比较无统计学差异(0.13±0.03 vs 0.12±0.04 s-1,t=0.371,P=0.719>0.05),但两组的β值与术前相比较,PEO组的β值在第7天时与术前比较无统计学差异(P>0.05),而对照组在术后第28天时与术前比较无统计学差异,说明PEO组模型大鼠缺血骨骼肌血流速度的恢复仍快于对照组(图 5)。
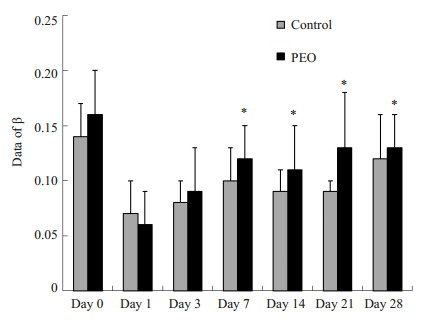
|
图 5 大鼠缺血后肢β值的比较 Figure 5 Comparison of parameter β of CEU of the ischemic hindlimbs of rats. *P < 0.05 for comparison between the two groups at the same time point. |
术后第28天,分别观察在静息状态及刺激状态下大鼠缺血后肢的血流量和血流储备量。在刺激状态下,PEO组和对照组的血流量均较静息状态下明显增加(P < 0.05);而分别在静息和刺激状态下,PEO组的血流量也均较对照组显著提高(P < 0.05),PEO组的血流储备量也明显高于对照组(3.23±0.94 vs 1.87±0.55 mL·g-1·min-1,t=3.054,P=0.012,表 1)。
| 表 1 第28天大鼠缺血后肢血流储备数据 Table 1 Rest and stress blood perfusion of the ischemic hindlimb of rats on day 28 (mL·g-1·min-1) |
周围动脉疾病是一类临床常见的综合征,病变的主要原因是动脉粥样硬化引起上肢或下肢的动脉发生狭窄甚至闭塞。其他的发病因素还包括遗传性发育不良,炎症以及创伤等。在大血管发生狭窄甚至闭塞后,其供血区的骨骼肌发生缺血性损伤引起微循环障碍,从而引起静息性疼痛、间歇性跛行、肢体坏疽等临床表现。目前的治疗措施主要包括戒烟、降脂、控制血糖、抗凝、抗血小板、溶栓、经皮介入取栓、支架植入及外科手术等。但对于严重病变导致的微循环障碍,临床上尚无有效的治疗方法。近年有研究者通过向局部缺血组织输注血管生长因子或重组蛋白等方式促进血管新生,从而改善缺血组织的微循环状态[5, 9-11],但因其不可控的促血管生成效应可能引起较多并发症[12-13],所以目前临床应用仍较少。因此,如何在安全有效的前提下寻找更加合适的治疗措施就显得尤为重要。
研究表明,如果要在不改变流体驱动压的前提下降低流体阻力,可通过加入少量减阻剂的方式实现,这种方式能增加流速,降低耗能[5, 14-15]。不仅如此,在急性缺血的动物模型中,减阻剂也能显著增加缺血组织的血流灌注[16-17]。而对于减阻剂在模拟人类周围动脉疾病的慢性缺血模型中的研究,目前鲜有报道。本研究旨在通过采用单侧股动脉结扎方法制作成功的大鼠后肢的慢性缺血模型,以便模拟周围动脉疾病的发生,进而观察减阻剂在慢性缺血模型中发挥的作用。
在使用对比超声技术(CEU)定量血流量的方法学上,以往的研究都只局限在半定量的方法上,而本研究使用全氟丙烷人血白蛋白微气泡(直径约2.0~4.0 μm)示踪红细胞;利用心腔的超声造影来标定骨骼肌造影的声学强度,以此减少由于超声微泡的浓度及大小的不均一导致的测量误差,进而对骨骼肌的血流量进行“绝对”定量[7, 18],以此来评价PEO对于改善大鼠后肢慢性缺血骨骼肌血流灌注的效能,并对减阻剂在其中发挥的可能机制进行初步的探讨。
从超声造影的结果分析,将大鼠单侧股动脉进行结扎后,结扎侧的骨骼肌血流量较术前显著减少(19.1±8.7)%,P < 0.05。提示已成功构建了大鼠后肢股动脉闭塞性慢性缺血模型[5]。
当慢性缺血模型构建成功后,PEO是否能改善缺血骨骼肌的微循环灌注以及通过何种方式改善呢?通过实验结果证实可能是血管容积(即小动脉和毛细血管的容积)的增加改善了该缺血区域的血流灌注。术后大鼠后肢骨骼肌的血管容积减少,这是骨骼肌血流量减少的原因之一。但随着时间的变化,PEO组的血管容积恢复速度明显快于对照组(P < 0.05)。在术后第7天,PEO组血流量的恢复显著快于对照组(P < 0.05)。PEO组标化A值的恢复速度也快于对照组,尽管在术后第7天未达到明显的统计学差异,但呈明显增加趋势;而在术后第14天,PEO组的标化A值与对照组相比有统计学差异,标化A值与血流量呈相同的增长趋势。而PEO组和对照组的β值,尽管两者的比较尚无统计学差异,但其随时间的变化也在逐渐增加。值得注意的是,PEO组的血流速度在第7天时已经恢复到与术前无统计学差异的水平,明显快于对照组,推测其原因可能是PEO促进了大鼠缺血后肢血管侧支的新生及重建。
从血流储备量上看,PEO组的血流储备量显著高于对照组,说明PEO组的大鼠缺血后肢在负荷状态下可募集更多的毛细血管并开放更多的侧支循环;而对照组缺血区域的侧支循环已开放充分、毛细血管募集和反募集的能力已被动员,故其在负荷状态下能开放的侧支循环非常有限,所以增加的血流量明显低于PEO组。
血管发生包括血管新生和动脉形成,血管新生和动脉形成的始动因素分别是缺氧和血流切应力的增加[19-20]。缺血缺氧只能引起“血管新生”,它对缺血的耐受力有限;只有通过提高“动脉生成”的始动因素--血流切应力,才可能建立广泛的侧支循环[17]。而小动脉生成是建立侧支循环的重要机制之一,也称微小血管动脉化,指原有的微小动脉通过细胞增殖和血管重塑形成具有功能性的肌性小动脉。当血管发生狭窄甚至闭塞时,侧支循环血管的血液流速加快,管腔切应力也相应地增加,侧支循环血管最终形成管径较大的动脉,即侧支循环血管的生成[21]。因而我们推测,建立广泛的侧支循环是缺血后肢血流恢复的主要机制。
综上所述,PEO可能通过提高剪切力促进大鼠慢性缺血后肢骨骼肌小动脉形成,建立广泛的侧支循环,提高缺血区域的微循环血流量。PEO能显著增加缺血组织的微循环血流灌注及血流储备,以保证静息或负荷状态下血流供应。PEO为化学合成产品,是减阻剂研究中常用的物质,目前其应用于医学研究中尚处于早期的机制研究中,由于其使用的剂量浓度为纳摩尔级别,个别文章报道较高浓度PEO可能对肾脏存在一定的损害[22],但是使用较低浓度剂量PEO在急性缺血模型[3, 23-24]、急性感染性休克模型[23]和慢性缺血模型[25]的研究中,暂时未观察到大鼠急性肾损害甚至死亡的报道,同时有研究者已经开始使用具有减阻芦荟多糖开展初步研究并取得一定的成果[26],其为天然的多糖聚合物,具有减阻剂的一般效用,而对这类药物的药代动力学及生物安全性进一步研究,可能为临床上治疗缺血性疾病开辟新的前景。
| [1] | Pacella JJ, Kameneva MV, Brands JA, et al. Modulation of Pre-Capillary arteriolar pressure with Drag-Reducing polymers: a novel method for enhancing microvascular perfusion[J]. Microcirculation, 2012, 19 (7): 580-5. DOI: 10.1111/micc.2012.19.issue-7. |
| [2] | 胡锋, 杜荣生, 查道刚, 等. 减阻剂对大鼠腹主动脉血流量影响的实验研究[J]. 岭南心血管病杂志, 2010, 16 (2): 140-2. |
| [3] | Chen X, Zha D, Xiu J, et al. A new hydrodynamic approach by infusion of drag-reducing polymers to improve left ventricular function in rats with myocardial infarction[J]. Int J Cardiol, 2011, 147 (1): 112-7. DOI: 10.1016/j.ijcard.2010.09.008. |
| [4] | Zhang Q, Deng Y, Zhang W, et al. Drag-reducing polymers increase exercise tolerance in an ischemic hind-limb rat model[J]. Vascular, 2016, 24 (3): 241-5. DOI: 10.1177/1708538115592092. |
| [5] | Wang MJ, Cai WJ, Li N, et al. The Hydrogen sulfide donor NaHS promotes angiogenesis in a rat model of hind limb ischemia[J]. Antioxid Redox Signal, 2010, 12 (9): 1065-77. DOI: 10.1089/ars.2009.2945. |
| [6] | Marascalco PJ, Blair HC, Nieponice A, et al. Intravenous injections of soluble drag-reducing polymers reduce foreign body reaction to implants[J]. ASAIO J, 2009, 55 (5): 503-8. DOI: 10.1097/MAT.0b013e3181b1840f. |
| [7] | Vogel R, Indermühle A, Reinhardt J, et al. The quantification of absolute myocardial perfusion in humans by contrast echocardiography: algorithm and validation[J]. J Am Coll Cardiol, 2005, 45 (5): 754-62. DOI: 10.1016/j.jacc.2004.11.044. |
| [8] | 郑德仲, 张泉, 查道刚, 等. 对比超声定量大鼠后肢骨骼肌绝对血流量的研究[J]. 临床超声医学杂志, 2011, 13 (1): 1-3. |
| [9] | Lederman RJ, Mendelsohn FO, Anderson RD, et al. Therapeutic angiogenesis with recombinant fibroblast growth factor-2 for intermittent claudication (the TRAFFIC study): a randomised trial[J]. Lancet, 2002, 359 (9323): 2053-8. DOI: 10.1016/S0140-6736(02)08937-7. |
| [10] | Kalka C, Asahara T, Krone W, et al. Angiogenesis and vasculogenesis^ Therapeutic strategies for stimulation of postnatal neovascularization[J]. Herz, 2000, 25 (6): 611-22. DOI: 10.1007/PL00001974. |
| [11] | Schratzberger P, Kirchmair R, Vale PR, et al. Therapeutic angiogenesis by gene transfer in critical limb and myocardial ischemia[J]. Curr Pharm Des, 2003, 9 (13): 1041-7. DOI: 10.2174/1381612033455062. |
| [12] | Cooper LT, Gersh BJ. Viral infection, inflammation, and the risk of idiopathic dilated cardiomyopathy: can the fire be extinguished[J]. Am J Cardiol, 2002, 90 (7): 751-4. DOI: 10.1016/S0002-9149(02)02603-6. |
| [13] | Aiello LP, Wong JS. Role of vascular endothelial growth factor in diabetic vascular complications[J]. Kidney Int Suppl, 2000, 77 (8): S113-9. |
| [14] | Faruqui FI, Otten MD, Polimeni PI. Protection against atherogenesis with the polymer drag-reducing agent Separan AP-30[J]. Circulation, 1987, 75 (3): 627-35. DOI: 10.1161/01.CIR.75.3.627. |
| [15] | Toms BA. Some observations on the flow of linear polymer solution through straight tubes at large Reynolds numbers[C]. North Holland, Amsterdam: Proceedings of the First International Congress on Rheology, 1948135-141. |
| [16] | Feng H, DG C, XH C, et al. Effects of drag-reducing polymers on microcirculation of normal rat hindlimb skeletal muscle[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2011, 33 (2): 189-93. |
| [17] | Pipp F, Boehm S, Cai WJ, et al. Elevated fluid shear stress enhances postocclusive collateral artery growth and gene expression in the pig hind limb[J]. Arterioscler Thromb Vasc Biol, 2004, 24 (9): 1664-8. DOI: 10.1161/01.ATV.0000138028.14390.e4. |
| [18] | Wei K. Assessment of myocardial blood flow and volume using myocardial contrast echocardiography[J]. Echocardiography, 2002, 19 (5): 409-16. DOI: 10.1046/j.1540-8175.2002.00409.x. |
| [19] | Schaper W. On arteriogenesis--a reply[J]. Basic Res Cardiol, 2003, 98 (3): 183-4. |
| [20] | Scholz D, Ziegelhoeffer T, Helisch A, et al. Contribution of arteriogenesis and angiogenesis to postocclusive hindlimb perfusion in mice[J]. J Mol Cell Cardiol, 2002, 34 (7): 775-87. DOI: 10.1006/jmcc.2002.2013. |
| [21] | Pascotto M, Leong-Poi H, Kaufmann B, et al. Assessment of ischemia-induced microvascular remodeling using contrastenhanced ultrasound vascular anatomic mapping[J]. J Am Soc Echocardiogr, 2007, 20 (9): 1100-8. DOI: 10.1016/j.echo.2007.02.016. |
| [22] | 胡振华, 陈仲清, 方琴. 聚环氧乙烷对脓毒症大鼠液体复苏的作用[J]. 中国急救医学, 2014 (4): 292-6. |
| [23] | Zeng Z, Zhang Q, Gao Y, et al. Drag-reducing polyethylene oxide improves microcirculation after hemorrhagic shock[J]. J Surg Res, 2016, 202 (1): 118-25. DOI: 10.1016/j.jss.2015.12.044. |
| [24] | Bragin DE, Thomson S, Bragina O, et al. Drag-Reducing Polymer Enhances Microvascular Perfusion in the Traumatized Brain with Intracranial Hypertension[J]. Acta Neurochir Suppl, 2016, 122 (10): 25-9. |
| [25] | Hu F, Zha D, Du R, et al. Improvement of the microcirculation in the acute ischemic rat limb during intravenous infusion of drag-reducing polymers[J]. Biorheology, 2011, 48 (3/4): 149-59. |
| [26] | 方琴, 胡振华, 陈仲清, 等. 聚环氧乙烷对内毒素休克兔肾血流动力学的影响[J]. 南方医科大学学报, 2012, 32 (5): 718-21. |
 2017, Vol. 37
2017, Vol. 37

