蛋白尿是肾脏疾病主要的临床表现之一,也是肾脏病持续性进展的重要指标.糖皮质激素作为临床常用抗蛋白尿药物的机制尚不明确,以往认为是通过抗炎和免疫调节发挥抗蛋白尿作用,现研究表明,肾脏足细胞存在糖皮质激素的功能受体[1]而起到保护作用.近几年从分子水平的研究,发现多种信号传导通路对足细胞的生长、表型转化、凋亡、自噬[2]等起着重要的调控作用.PI3K/Akt信号通路是介导细胞存活的一条经典信号通路,广泛存在于真核细胞内,在人类的生理功能中起关键作用,涉及细胞生长、存活的众多过程[3-5].研究表明PI3K/Akt信号通路在成纤维细胞、听毛细胞及肾小管上皮细胞[6]等损伤中发挥重要保护作用.Xavier等[7]发现肾脏的足细胞分子CD2AP参与Tbeta RI 与PI3K调节亚基p85之间的相互作用,激活PI3K/Akt的信号通路抗Tbeta诱导的足细胞凋亡.Wada等[8]研究发现地塞米松(DEX)是通过下调P53,上调Bcl-xL和抑制AIF 的转移而抑制足细胞的凋亡.我们前期的研究[9]也表明PI3K/Akt信号通路在抗足细胞凋亡中起着重要的作用,且发现DEX能抑制嘌呤霉素(PAN)致足细胞损伤的作用.以往的研究在体外阐明DEX通过PI3K/Akt信号通路与细胞的关系;但在活体动物体内,DEX是否通过PI3K/Akt信号传导通路降低蛋白尿的相关性尚未见报道.本实验通过活体阿霉素(ADR)大鼠肾病模型探讨受DEX及LY294002(PI3K抑制剂)影响下,PI3K/Akt信号通路的蛋白激酶(Akt)磷酸化的状况、下游分子凋亡蛋白Bad、Bad-mRNA的表达与尿蛋白变化的相关性及其意义.
1 材料和方法 1.1 实验材料与分组SPF级动物,雄性SD大鼠(购于中山大学实验动物中心)6~8周龄,24只;应用随机数表法分为正常对照组(NC组);阿霉素肾病组(ADR组);阿霉素+地塞米松治疗组(DEX组);阿霉素+地塞米松+LY294002 干预组(LY294002 组).动物饲养于中山大学实验动物中心[设施合格证:SYXK(粤)2011-0112].
1.2 投药程序适应饲养1周后,ADR组,DEX组,LY294002组接受尾静脉注射5 mg/kg ADR(D107159-25mg阿拉丁,中国);NC组注射等量生理盐水.地塞米松干预:ADR注射后第7 天和第14 天,按剂量1 mg/kg 对DEX组及LY294002 组行地塞米松(D4902,sigma,美国)溶液腹腔注射;NC 组、ADR 组接受等量0.1% DMSO 溶剂(D4540,sigma,美国)腹腔注射.LY294002干预:ADR注射后第7天和第14天,LY294002组接受尾静脉注射LY294002(L9908,sigma,美国)0.3 mg/kg;NC组、ADR组与DEX组接受等量0.1% DMSO溶剂尾静脉注射.ADR注射后第7、14、28天采集动物24 h尿液.ADR注射后第28天处死动物摘取肾脏.
1.3 实验方法 1.3.1 24 h尿蛋白检测ADR注射后第7、14、28天,代谢笼收集24 h尿液(BFSS19981大鼠代谢笼南京便诊生物科技有限公司).采用Bradford方法检测24 h尿蛋白(Bradford蛋白定量试剂盒购于广州永诺生物科技有限公司):按照试剂盒说明书操作,采用DR-200BS多功能酶标仪(无锡华卫德郎仪器有限公司)检测样本595 nm吸光度,计算尿蛋白含量.
1.3.2 取材及标本制作每组各用2 mL EP 管称取约100 mg的肾皮质部分组织物,用4 ℃预冷的PBS洗去血迹,加入700 μL的4 ℃预冷的PBS;剪碎组织物,电动离心,吸弃PBS,重复3次;加入300 μL RIPA,匀浆5~8 min,12 000 r/min,4 ℃离心30 min;离心结束后取中间层液体(蛋白液)至新的已标记好的2 mL EP管,记录样品量,-80 ℃冰箱保存备用.
1.3.3 Western blot检测肾皮质p-Akt、AKT、Bad蛋白表达水平每个样本每孔加入50 μg蛋白液行聚丙烯酰胺凝胶电泳(积层胶电泳:95 V,40 min;分离胶电泳:200 V,120 min),湿转至硝酸纤维膜上(250 mA,1 h),以5%脱脂奶粉封闭,加稀释一抗(p-AKT,AKT,Bad,GAPDH均购自Cell Signaling Technology)4 ℃孵育过夜,TBST洗涤7 min×2,然后加稀释二抗(购自Jackson)室温下摇床孵育60 min,经TBST洗涤7 min×3后加入ECL发光液(购自广州永诺生物科技有限公司),避光反应5 min,化学成像系统上曝光显影,用Image J分析目标条带的光密度值,采用GAPDH作为内参,用Image Tool软件进行定量分析.
1.3.4 QPCR 检测肾皮质Bad-mRNA 表达水平用Invitrogen公司的Trizol试剂盒,按试剂盒提供程序提取肾皮质总RNA.20 μL 逆转录反应体系含有5 μg 总RNA,0.1 μg的随机引物,200 U的M-MLV(Invitrogen),用黑马9600型PCR仪37 ℃,60 min;95 ℃,3 min反应条件循环1次得到cDNA.50 μL的QPCR反应体系含有5 μL逆转录产物,10 μL 5×SYBR Green 1 buffer,l μL10 mmol/L dNTPs(Promega),25 μmol/L的上、下游引物各l μL(广州锐博生物设计的引物),5UTaqDNA聚合酶(Promega).用Bio-RAD MJ mini 型荧光PCR仪(Bio-RAD)进行实时荧光定量PCR反应.
1.4 统计学方法用SPSS17统计软件,对各组间的数值进行方差分析,以P<0.05为差异有统计学意义.
2 结果 2.1 24 h蛋白尿第7、14天ADR组、DEX组、LY294002组蛋白尿不同程度增加,ADR 组、LY294002 组与NC 组比对P<0.05,差异有统计学意义,而DEX组与NC组比对P>0.05,差异无统计学意义;第28 天ADR 组、DEX 组、LY294002组蛋白尿与NC组相互比对均为P<0.05差异有统计学意义;LY294002组与DEX组比对P<0.05,差异有统计学意义(表 1).
| 表 1 各组各时间点24 h尿蛋白总量 Table 1 Total urine protein in 24-h urine collected at different time points in the groups (mg/24 h, Mean±SD, n=6) |
ADR组的p-AKT/AkT 下降,Bad 蛋白表达升高,与NC组比对P<0.05,有统计学差异;DEX组的p-AKT/AkT升高,Bad蛋白表达下降,与NC组比对P>0.05,无统计学差异;LY294002 组的p-AKT/AkT下降,Bad 蛋白的表达亦升高,与NC组比对P<0.05,有统计学差异.另外,LY294002 组与DEX组的p-AKT/AkT、Bad蛋白表达相互比对P<0.05有统计学差异(图 1).
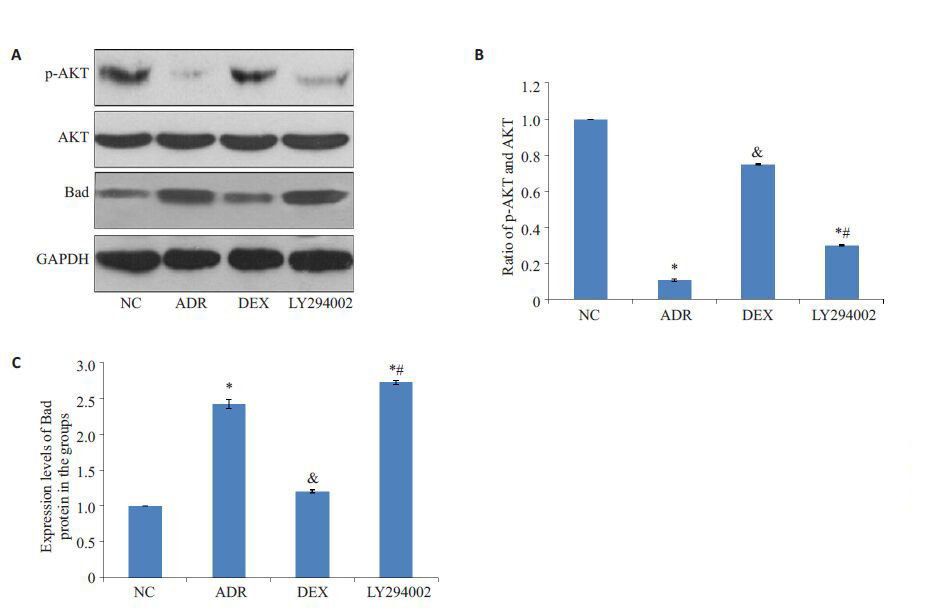
|
图 1 各组大鼠肾组织p-AKT、AKT和Bad蛋白的表达变化 Figure 1 Expression of p-AKT, AKT and Bad proteins detected by Western blotting (A) and quantitative analysis of p-AKT/ AKT ratio (B) and Bad protein expression (C) in rat kidney tissues in different groups. *P<0.05 vs NC group; &P>0.05 NC group; #P>0.05 vs DEX group |
ADR组的Bad-mRNA表达升高,与NC组比对P<0.05,有统计学差异;DEX组的Bad-mRNA表达下降,与NC组比对P>0.05,无统计学差异;LY294002 组的Bad-mRNA表达亦升高,与NC组比对P<0.05,有统计学差异;LY294002 组与DEX组的Bad-mRNA表达差异P<0.05,有统计学差异(图 2).
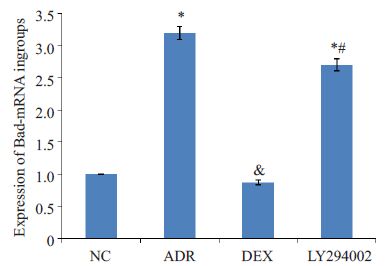
|
图 2 各组大鼠肾组织Bad-mRNA的表达变化 Figure 2 Expression of Bad mRNA in rat kidney tissues detected by qRT-PCR. *P<0.05 vs NC group; &P>0.05 vs NC group; #P>0.05 vs DEX group |
研究发现PI3K/Akt 信号通路通过磷酸化多种底物,促进细胞生长、增殖,抑制细胞凋亡[10],Akt 作为PI3K的重要下游靶激酶,磷酸化Akt(p-AKT)是必要的条件[11].Woroniecki等[12]发现正常足细胞受信号分子刺激后,PI3K很快被磷酸化而起到保护细胞作用.另发现PAN刺激后CD2AP的表达下降,Akt磷酸化率下降,抑制了PI3K/Akt信号通路致足细胞凋亡率显着升高[9].又有研究发现PI3K/Akt信号传导通路下游存在多种转录因子而抑制凋亡基因的表达(FKHRLl)和增强抗凋亡基因的表达(NF-κB和Bcl-2)以及直接磷酸化促凋亡蛋白Bad、caspase-9使其失活从而中断下游信号[13].其中凋亡蛋白Bad (bcl-xl/bcl-2 associated deathpromoter)是PI3K/Akt 信号通路的主要下游作用靶蛋白,Bad蛋白在外周及中枢神经元、淋巴细胞、骨髓造血细胞、生殖细胞及许多上皮细胞中均有表达并参与细胞凋亡机制[14-15].生理状态下Bad蛋白以磷酸化状态存在,稳定发挥抗凋亡效应,而去磷酸化的游离Bad蛋白通过易位和一系列细胞活动促进细胞凋亡发生[16].本实验中,观察到ADR组大鼠p-AKT/AkT的比值降低,Bad-mRNA、Bad 蛋白的表达水平均升高;24 h尿蛋白总量明增加,尿蛋白总量的结果与蒋罗等[17]结果相似,我们认为p-AKT降低,是ADR抑制了PI3K/Akt信号通路的磷酸化,下游表达产物Bad-mRNA、Bad蛋白表达升高,推测其促进了肾小球的足细胞凋亡,产生尿蛋白.同时也显示本实验ADR大鼠肾病造模是成功的.
肾上腺皮质激素作为临床使用的一线治疗药物,对减轻肾病蛋白尿已得到临床认可但其作用机制尚不明晰,以往认为主要通过抗炎和免疫调节发挥作用,有研究表明足细胞存在糖皮质激素的功能受体[18],DEX可直接作用于足细胞,稳定足细胞分子CD2AP的表达和分布,使CD2AP与PI3K调节亚基p85相互作用,激活PI3K/Akt 信号通路,升高GSK3p 磷酸化水平,降低GSK3B活性,下调下游靶蛋白Bad-mRNA和Bad的表达,修复受损足细胞,起到抗足细胞凋亡的作用[19-20].本研究在DEX组,p-AKT/AkT 增加,Bad-mRNA 及Bad蛋白表达水平下降,与上述的研究相吻合;在此实验中,发现第1、2 周尿蛋白与NC组比对明显减少,可表明DEX在活体ADR大鼠中有可能通过PI3K/Akt信号通路减少ADR肾病模型的尿蛋白.另一结果显示,本组的尿蛋白在第4周明显增加,与陈小英等[21]的结果略有差异,此结果我们认为DEX 对ADR大鼠肾病模型只能缓解而非“治愈”.
有报道LY294002是PI3K/Akt信号通路特异性阻断剂[22],LY294002在上游非特异性阻断PI3K/Akt信号通路,导致Akt磷酸化水平降低,细胞周期阻滞、凋亡增加[23];本实验的LY294002组结果显示与ADR组相似,p-AKT/AkT下降、Bad-mRNA表达水平增加,下游产物Bad 蛋白表达升高,尿蛋白增加.我们认为,因为LY294002 阻断了PI3K/Akt 信号通路,使DEX 失去PI3K/Akt信号通路激活作用,由此可见,PI3K/Akt信号通路是DEX减少尿蛋白的信号传导机制之一.
综上所述,本研究各组大鼠的PI3K/Akt信号传导通路下游蛋白的表达和尿蛋白的变化说明,DEX通过激活PI3K/Akt信号通路,下调其下游分子Bad-mRNA、Bad的表达,减少阿霉素肾病大鼠的尿蛋白,LY294002可抑制该信号通路从而阻断DEX减少尿蛋白的作用,从而表明PI3K/Akt 信号通路是DEX减少尿蛋白的信号传导机制之一.结合以往的研究,该通路有可能成为保护足细胞,治疗蛋白尿的理想治疗靶点之一.
| [1] | Lowenberg M, Verhaar AP, Van Den Brink GR. Glucocorticoid signaling: a nongenomic mechanism for T-cell immunosuppression[J]. Trends Mol Med, 2007, 13 (4): 158-63. DOI: 10.1016/j.molmed.2007.02.001. |
| [2] | 朱吉莉, 马特安, 陈星华, 等. 高糖通过PI3K-AKT-mTOR信号通路增 加足细胞自噬[J]. 中华肾脏病杂志, 2013, 29 (7): 515-9. |
| [3] | Porta C, Paglino C, Mosca A. Targeting PI3K/Akt/mTOR signaling in cancer[J]. Front Oncol, 2014, 4 (4): 64. |
| [4] | 刘金坤, 郝亚娟, 黄嘉维, 等. 硫利达嗪诱导SW480细胞凋亡的机制[J]. 南方医科大学学报, 2015, 35 (4): 511-5. |
| [5] | 兰凤鸣, 岳晓, 韩磊, 等. PI3K/AKT信号通过介导β-catenin 通路的 活性影响胶质瘤细胞的生长[J]. 中华神经外科杂志, 2012, 28 (3): 275-8. |
| [6] | 周文祥, 杨永丽, 杨晓, 等. PI3K/Akt/GSK3β信号通路在肾小管上皮 细胞缺血再灌注损伤中的调控作用及重组人红细胞生成素预保护效 应[J]. 华中科技大学学报: 医学版, 2010, 39 (3): 314-20. |
| [7] | Xavier S, Niranjan T, Krick S, et al. TbetaRI independently activates Smad- and CD2AP-dependent pathways in podocytes[J]. J Am Soc Nephrol, 2009, 20 (10): 2127-37. DOI: 10.1681/ASN.2008070806. |
| [8] | Wada T, Pippin JW, Marshall CB, et al. Dexamethasone prevents podocyte apoptosis induced by puromycin aminonucleoside: role of p53 and Bcl-2-related family proteins[J]. J Am Soc Nephrol, 2005, 16 (9): 2615-25. DOI: 10.1681/ASN.2005020142. |
| [9] | 吴汪丽, 于力, 张瑶, 等. Bad蛋白在地塞米松抑制嘌呤霉素诱导足 细胞凋亡中的表达及意义[J]. 中华实用儿科临床杂志, 2011, 26 (11): 856-8. |
| [10] | Hixon ML, Paccagnella L, Millham R, et al. Development of inhibitors of the IGF-IR/PI3K/Akt/Mtor pathway[J]. Rev Recent Clin Trials, 2010, 5 (3): 189-208. DOI: 10.2174/157488710792007329. |
| [11] | 张颖, 胡舜英, 尹彤, 等. 利拉鲁肽通过PI3K/Akt和MAPK/ERK通 路促进心肌微血管内皮细胞的增殖和迁移[J]. 南方医科大学学报, 2015, 35 (9): 1221-6. |
| [12] | Woroniecki RP, Schiffer M, Shaw AS, et al. Glomerular expression of transforming growth factor-beta(TGF-beta)isoforms inmice lackingCD2-associated protein[J]. Pediatric Nephrol, 2006, 21 (3): 333-8. DOI: 10.1007/s00467-005-2102-7. |
| [13] | Kong DX, Yamori T. Phosphatidylinositol 3-kinase inhibitors: promising drug candidates for cancer therapy[J]. Cancer Sci, 2008, 99 (9): 1734-40. |
| [14] | 徐小红, 谭建新, 冯华俊, 等. 慢性缺氧致大鼠右心室心肌细胞凋亡及 其机制研究[J]. 中国病理生理杂志, 2009, 25 (1): 64-8. |
| [15] | Yu B, Sun X, Shen HY, et al. Expression of the apoptosis-related genes BCL-2 and BAD in human breast carcinoma and their associated relationship with chemosensitivity[J]. J Exp Clinic Cancer Res, 2010, 29 (1): 1-7. DOI: 10.1186/1756-9966-29-1. |
| [16] | 何家璇, 薛荣亮, 吕建瑞, 等. 全脑缺血再灌注后Bad蛋白的表达与细 胞凋亡的关系及ERK信号转导途径对其的影响[J]. 山西医科大学学 报, 2015, 46 (9): 853-7. |
| [17] | 蒋罗, 于力, 于生友, 等. 自噬与阿霉素大鼠肾组织损伤的关系[J]. 中华肾脏病杂志, 2015, 31 (5): 372-9. |
| [18] | Löwenberg M, Verhaar AP. Van den brink GR, et al. glucocorticoid signaling: a nongenomic mechanism for t-cell immunosuppression[J]. Trends Mol Med, 2007, 13 (4): 158-63. DOI: 10.1016/j.molmed.2007.02.001. |
| [19] | 王辉阳, 于力, 于生友, 等. 地塞米松对肾小球足细胞瞬时受体电位阳 离子通道蛋白6 表达和分布的影响[J]. 中华肾脏病杂志, 2014, 30 (5): 377-83. |
| [20] | 邹敏书, 余健, 聂国明, 等. 地塞米松抑制肾小球上皮间质转化[J]. 医 学研究杂志, 2011, 40 (12): 77-80. |
| [21] | 陈小英, 王菊霞, 郑京, 等. 泼尼松对阿霉素肾病大鼠肾组织FAK/ Pyk2表达的影响[J]. 南方医科大学学报, 2014, 34 (8): 1149-53. |
| [22] | Wen PY, Lee EQ, Reardon DA, et al. Current clinical devel-opment of PI3K pathway inhibitors in glioblastoma[J]. Neuro Oncol, 2012, 14 (7): 819-29. DOI: 10.1093/neuonc/nos117. |
| [23] | Wang XJ, Feng CW, Li M, et al. Adam 17 mediates hypoxiainduced drug resistance in hepatoceellular carcinoma cell through activation of EGFR/PI3K/Akt pathway[J]. Molecul Cellul Bioch, 2013, 380 (1/2): 57-66. |
 2016, Vol. 36
2016, Vol. 36

