免疫异常常被认为是溃疡性结肠炎发病的重要因素,是UC研究最为活跃的领域.其中,细胞因子起着不可忽略的作用,尤其是促炎因子与抗炎因子之间的失衡是目前UC研究的热点[1].IL-23 与IL-17 作为IL-23/IL-17轴最主要的促炎细胞因子,是近年来国内外学者研究的热点.既往文献报道IL-23、IL-17可能是引起肠道炎症的关键促炎介质[2].
至今虽有多项研究表明IL-23、IL-17在UC肠黏膜组织及血浆中表达均升高[3-5].但IL-23、IL-17表达相关性及两者与UC患者预后肠黏膜愈合的关系尚不明确.白介素-22(IL-22)、IL-11,已被证实参与多种炎症性疾病以及自身免疫性疾病的发病过程[6].许多研究表明IL-22在IBD患者血浆中表达增强[7],IL-22与促炎因子的表达相关而具有致病作用,近期研究逐渐表明其对肠黏膜损害具有保护作用.而IL-11 作为一种多效性细胞因子,在许多体内外模型中显示出抗炎性作用,其中包括肠炎模型[8].
但目前,IL-22、IL-11 在UC肠道粘膜组织中的表达,与UC疾病活动程度、肠黏膜组织病理分级关系以及对UC预后粘膜的影响尚不明确.因此,本研究通过检测细胞因子IL-23、IL-17、IL-22、IL-11 在活动期UC患者肠黏膜组织中的分布与表达水平,分析其变化与UC疾病活动度、内镜下活动度分级、病理组织学分级的关系,各指标间相互关系,并评估其对短期治疗后黏膜愈合预后的影响.探讨他们在UC发病机制中的作用和相互关系.
1 材料和方法 1.1 一般资料首先收集2008年1月~2015年1月于南方医科大学南方医院消化科诊断为活动期UC患者40例,纳入标准参照2012年广州会议中华医学会消化病学分会炎症性肠病学组制定的《炎症性肠病诊断与治疗的共识意见》.并排除以下情况:(1)伴有严重心、肝、肺、肾疾病者;(2)合并严重感染、糖尿病的患者;(3)妊娠及脯乳期妇女;(4)患有其他自身免疫性疾病患者;(5)使用生物制剂治疗者.
另选取40名经规范化治疗且治疗2个月后复查结肠镜的活动期UC患者40例,治疗方案参考参照2012年广州会议中华医学会消化病学分会炎症性肠病学组制定的《炎症性肠病诊断与治疗的共识意见》.根据治疗2月后复查内镜下黏膜是否愈合分为黏膜愈合良好组(20例)和黏膜愈合欠佳组(20例).黏膜愈合评估参考2007年AGA制定的“治疗终点共识”[9].
1.2 试剂一抗IL-23 antibody、IL-17 antibody、IL-22 antibody、IL-11antibody均购买自GeneTex公司.二步法免疫组化检测试剂盒(PV6001)购买自北京中杉金桥生物技术公司.
1.3 检测方法 1.3.1 实验方法免疫组化检测标本均经10%福尔马林固定,常规石蜡包埋.全部蜡块均行4 μm厚连续切片,经常规脱蜡至水,阻断内源性过氧化物酶活性、微波修复抗原、封闭抗原后分别滴加一抗(兔抗人IL-17、兔抗人IL-23,兔抗人IL-22、兔抗人IL-11),4 ℃冷藏过夜后滴加二抗(山羊抗兔IgG);DAB显色,苏木素复染,中性树胶封片,晾干后显微镜下阅片.
1.3.2 结果判定 1.3.2.1 定性免疫组织化学结果判定阳性结果为细胞质内出现棕褐色颗粒或棕黄色颗粒,免疫组织化学得分参考既往文献[10],为阳性着色细胞占细胞总数的百分比计分与染色强度计分的乘积.阳性着色细胞数的百分比计分:<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分.染色强度计分:无着色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分.两项结果相乘:0~1分为阴性(-),2~4分为弱阳性(1+),5~8分为(2+),9~12分为(3+),(2+-3+)为强阳性.结果均经2 次重复观察,计分不一致者经再次观察确认.将阴性和弱阳性归为低表达组,将强阳性归为高表达组.
1.3.2.2 半定量免疫组化结果判定每张切片选取5个不重复的高倍镜视野(×400),运用Image-Pro Plus 6.0图像分析软件进行分析,计算平均光密度并取均值.
1.4 统计学方法数据采用SPSS 20.0软件进行统计学处理.计量资料以均数±标准差表示,用单因素方差分析进行活动期UC、缓解期UC 组、健康对照组间的比较;IL-23、IL-17、IL-22、IL-11表达水平相关性的分析采用Pearson相关分析;活动期UC内镜下活动度分级、病理组织学分级分别与肠黏膜组织IL-23、IL-17、IL-22、IL-11表达水平相关性的分析采用Spearman相关分析,卡方检验进行黏膜愈合良好组与黏膜愈合欠佳组治疗前肠黏膜组织表达水平的比较;所有的检验均以P<0.05为差异有统计学意义.
2 结果 2.1 纳入患者的一般资料及临床病理特点第1部分研究,共纳入活动期UC患者40例,其中男23 例,女17例;平均年龄45.8±13.66岁,疾病活动度轻度12 例、中度19 例、重度9 例.缓解期UC患者15例,其中男9例,女6例;平均年龄42.7+13.40岁,健康对照者15 例,其中男8 例,女7 例;平均年龄43.5+14.27岁.3组间在年龄、性别构成比,差异无统计学意义(P>0.05).
第2部分研究共纳入活动期UC患者40例,黏膜愈合良好组与粘膜愈合欠佳组两组各20例,两组治疗前活动期的临床特征见表 1,两组间性别、年龄分布、病变范围、疾病活动度、内镜下活动度分级、病理组织学分级、处理方式构成相比,差异均无统计学意义(P>0.05),两组间具有可比性.
| 表 1 黏膜愈合良好组、黏膜愈合欠佳组临床特征 Table 1 Clinical characteristics of patients with good and poor mucosal healing |
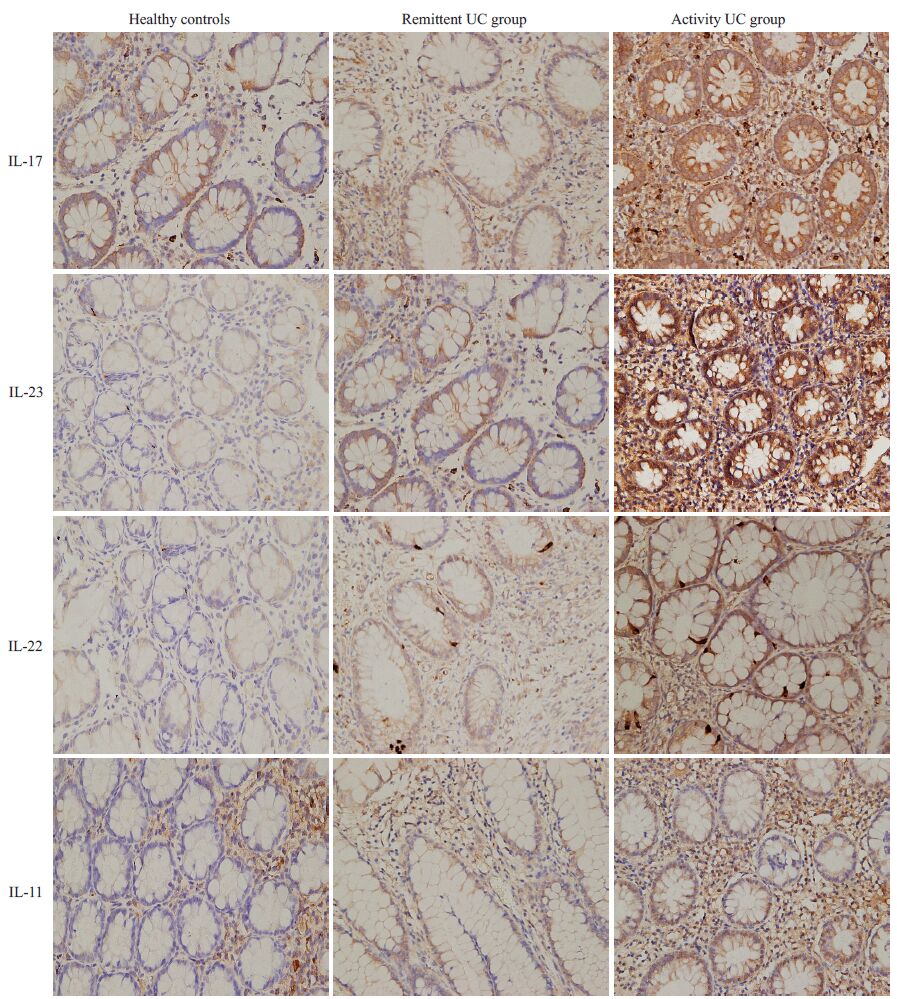
活动期UC肠黏膜、缓解期UC组、健康对照组均可见不同程度的各炎性细胞因子阳性表达,表达逐渐减弱.IL-17、IL-23、IL-22、IL-11主要表达于结肠上皮细胞、固有层内单个核细胞胞质,呈棕黄色.
2.3 IL-17、IL-23 、IL-22、IL-11在肠道黏膜中的表达比较IL-17、IL-23、IL-22、IL-11 在活动期UC组中表达的平均光密度明显高于缓解期UC组及健康对照组(图 1),表达差异有统计学意义(P<0.05).其中,缓解期UC组中的IL-23表达的平均光密度较健康对照组亦有显着性升高(P<0.05,表 2).
|
图 1 免疫组化检测炎性相关因子在活动期UC、缓解期UC、健康对照组结肠黏膜中的表达 Figure 1 Immunohistochemical staining of the 4 inflammatory cytokines in the intestinal mucosa of patients with active and remittent UC and normal control subjects (Original magnification: ×400) |
| 表 2 各组肠道黏膜中炎性细胞因子表达平均光密度 Table 2 Expression levels (mean absorbance) of inflammatory cytokines in the 3 groups (Mean±SD) |
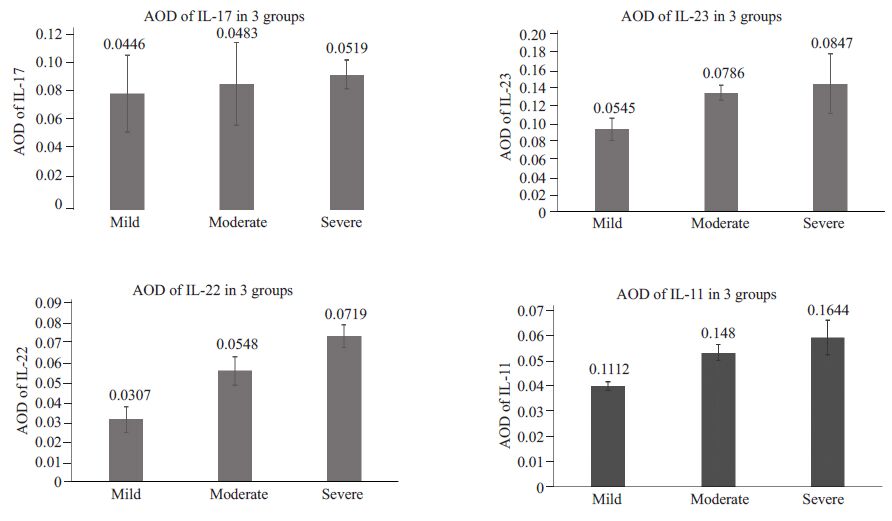
IL-17、IL-23、IL-22在活动期UC轻、中、重度3组肠黏膜中表达的平均光密度随疾病活动度增加而明显增加(0.0545±0.0072 vs 0.0786±0.0051 vs 0.0847±0.0197;0.1112 ± 0.0046 vs 0.1480 ± 0.0089 vs 0.1644 ± 0.0190;0.0307±0.0063 vs 0.0548±0.0071 vs 0.0719±0.0056),且3组间差别均有统计学差异(P<0.05).IL-11在活动期UC轻、中、重度3组肠黏膜中表达的平均光密度虽随疾病活动度增加而增高(0.0446 ± 0.0042 vs 0.0483 ±0.0036 vs 0.0519±0.0018),但3者间差异无统计学意义(P>0.05,图 2).
|
图 2 平均光密度分析炎性因子在活动期UC疾病不同活动度患者中肠道黏膜的表达 Figure 2 Analysis of expressions (mean absorbance) of inflammatory cytokines in the intestinal mucosa of patients with active UC of different disease activity |
活动期UC患者肠黏膜组织中IL-17、IL-23、IL-22、IL-11表达的平均光密度,与内镜下活动度分级呈正相关(分别为r=0.613;r=0.438;r=0.649,r=0.539),P 均<0.05.此外,活动期UC患者肠黏膜组织中IL-17、IL-22表达的平均光密度,与病理组织学分级亦呈正相关(r=0.426;r=0.374)(P<0.05,表 3).
| 表 3 炎性相关因子表达与内镜下活动度分级及组织学分级的相关分析 Table 3 Correlation analysis of inflammatory cytokines with endoscopic activity grades and histological grades |
入选病例结肠黏膜中炎性细胞因子IL-17、IL-23、IL-22、IL-11 表达的平均光密度均呈正态分布,经Pearson相关分析,结果显示各指标相互之间平均光密度表达水平均呈正相关.具体见表 2所示.
2.7 IL-17、IL-23、IL-22、IL-11 在黏膜愈合良好组和黏膜愈合欠佳组治疗前活动期肠道黏膜中的表达统计分析结果显示黏膜愈合良好组与黏膜愈合欠佳组间IL-17表达的分布差异有统计学意义.IL-17高表达组中黏膜的愈合欠佳率为66.67%,IL-17低表达组中黏膜愈合欠佳率为25%,IL-17高表达组的黏膜愈合欠佳情况较低表达组明显增多,两组间差异有统计学意义(P<0.05).而IL-23、IL-22、IL-11的表达水平分布在黏膜愈合良好组与黏膜愈合欠佳组中差异均无统计学意义(P>0.05,表 4).
| 表 4 两组肠道黏膜组织IL-17、IL-23、IL-22、IL-11免疫组化染色表达对比 Table 4 Comparison of expression levels of IL-17, IL-23, IL-22, and IL-11 between patients with good and poor mucosal healing |
既往对溃疡性结肠炎免疫机制方面的研究主要集中于Th1与Th2细胞二者之间反应的失衡,当中,传统观点认为,UC与主要与Th2细胞产生的细胞因子IL-4、IL-5 和IL-13 参与体液免疫关系密切相关[13-14].近年来,随着一些新型CD4+T辅助细胞亚群逐渐被发现,其分泌的细胞因子日益受到重视,也被证实具有重要的免疫调节作用,能介导炎性反应、自身免疫性疾病、肿瘤和移植排斥等的发生和发展[15].然而这些细胞因子在溃疡性结肠炎中的作用尚未完全明了,这一发现为炎症性肠病的诊治提供了新的思路,是当前UC研究的热点领域.
在本课题中,我们研究发现IL-23、IL-17在健康对照组、缓解期UC组、活动期UC肠黏膜均可见阳性表达,但表达水平逐渐增强.既往也有研究发现,正常的肠道黏膜组织中可检测到低水平的IL-23及IL-17 的表达,考虑这可能与其在肠道中起到维持肠上皮屏障的完整和抑制肠道细菌增殖相关[16].但在活动期UC患者病变肠黏膜中的IL-23、IL-17表达水平均明显高于缓解期UC组和健康对照组正常黏膜,与既往报道的推测一致[5].因此我们猜测,在肠道黏膜免疫处于正常情况下,IL-23、IL-17主要在肠道粘膜中起保护功能.但当肠道免疫功能出现异常,IL-23、IL-17等促炎因子分泌增加,通过炎症的级联放大介导其他使炎性细胞过度分泌,免疫系统内细胞间网络调节失衡,导致免疫应答强烈且持续存在时,从而使溃疡性结肠炎发生及迁延难愈.但具体的IL-23、IL-17随环境中其他因子的不同而发挥何种作用,有待进一步研究.在上述研究中,我们发现IL-23在缓解期仍较正常对照升高,差异有统计学意义,我们考虑临床缓解期患者黏膜可能仍处于一个低度炎症状态.既往有研究表明,缓解期UC患者达到内镜镜检下的黏膜愈后,仍有50%患者的肠道黏膜组织中存在不同程度的炎性改变[17].IL-23在缓解期UC中的表达是否与黏膜低度炎症有关,其起的作用是促进组织修复亦或诱导组织炎症加重导致复发,暂不明确,有待需进一步研究.
在本研究中,IL-22不仅在活动期UC肠黏膜组织中表达高于缓解期UC组及健康对照组,与既往文献IL-22在UC患者血液标本表达升高的结果一致[18].而且我们初次证实了IL-11在活动期UC中的表达较健康对照组显着增高,推测其在溃疡性结肠炎的发病发展中发挥一定作用.
此外,我们研究还发现,随疾病活动度指数的增加,IL-23、IL-17、IL-22的表达逐渐增强.而且,研究还表明IL-17、IL-23、IL-22的表达与内镜下活动度分级均成正相关,其中IL-17、IL-22的表达与病理组织学分级亦呈正相关.由此推断,IL-23、IL-17、IL-22与疾病的活动、粘膜的损伤程度密切相关,肠道粘膜IL-23、IL-17、IL-22表达的高低某个程度上也反映了UC疾病炎症的严重程度.而IL-11在活动期UC组中表达的也较缓解期UC组及健康对照组明显升高,差异有统计学意义.IL-11在活动期UC轻、中、重度3组肠黏膜中表达虽随疾病活动度增加而增高,但目前3组间差异无统计学意义,可能因纳入病例数尚少所致,可通过扩大样本量进一步验证.
近年来,黏膜愈合逐渐替代临床缓解成为溃疡性结肠炎首要的治疗终点.修复损伤的肠道黏膜屏障,从而达到并维持完全的黏膜愈合是溃疡性结肠炎治疗的关键[19].早期有研究显示,溃疡性结肠炎短期治疗后肠道黏膜是否愈合对疾病的复发具有预测作用,达到黏膜愈合的溃疡性结肠炎患者有更高的远期缓解率和更低的复发风险[20].此外,亦有研究表明是否达到黏膜愈合与癌变风险、外科手术率、患者生活质量相关,虽然目前仍有争议,黏膜愈合的重要性,被广泛的认可.因此,若能早期对肠道黏膜愈合情况,进行预测,将有利于制定更好的治疗策略.临床工作中我们也发现,溃疡性结肠炎患者经过相应治疗后,部分患者短期可获得临床缓解及达到内镜下的黏膜愈合状态,而部分患者即使临床缓解,但内镜下仍处于活动期.是什么因素导致的这些肠道黏膜对治疗反应的个体差异,目前尚未完全明了,而目前关于对黏膜愈合的预测的指标,也较少有文献涉及.
因此,本研究首次将治疗前各炎性细胞因子的表达水平与黏膜的愈合情况进行初探,发现IL-17高表达组的黏膜愈合欠佳情况较低表达组明显增多.在此之前,我们通过卡方检验排除了性别、年龄分布、病变范围、疾病活动度、内镜下疾病分级、病理组织学分级、处理方式对其的可能造成的干预.因此我们认为IL-17的高表达可能对短期治疗后黏膜愈合的预后预测有一定参考价值,但其具体预测价值评估仍需扩大样本以进一步验证.
综上所述,我们认为IL-17、IL-22、IL-23、IL-11在溃疡性结肠炎的发病发展中均发挥一定作用,可一定程度上评估患者病情的严重程度,IL-17的表达水平可能对短期治疗后黏膜愈合的预后预测有一定参考价值.当然,各炎性细胞因子作用的确切机制仍需进一步进行深入研究.我们旨在通过初步分析上述细胞因子的表达差异,从而对其与疾病活动度的关系、与黏膜愈合预后的关系进行初探,为下一步深入研究提供参考依据,以期将来通过更深入而全面的研究,寻找对疾病病情的评估及对黏膜愈合的预测有价值的指标,指导临床医师更全面的把握病情、更早的采用更积极的治疗手段以促进其黏膜的愈合.
| [1] | 解春静, 庄彦华, 栾雨茏. 溃疡性结肠炎发病机制中免疫因素的研究 进展[J]. 细胞与分子免疫学杂志, 2013, 29 (8): 889-92. |
| [2] | Fitzpatrick LR. Novel Pharmacological Approaches for Inflammatory Bowel Disease: Targeting Key Intracellular Pathways and the IL-23/ IL-17 Axis[J]. Int J Inflam, 2012 : 389404. |
| [3] | 张晓斐, 蒋文瑜, 于鹏丽, 等. Th17细胞及其相关因子在活动期溃疡性 结肠炎患者中的表达及意义[J]. 世界华人消化杂志, 2013 (01): 19-26. |
| [4] | Liu ZJ, Yadav PK, Xu XR, et al. The increased expression of IL-23 in inflammatory bowel disease promotes intraepithelial and lamina propria lymphocyte inflammatory responses and cytotoxicity[J]. J Leukoc Biol, 2011, 89 (4): 597-606. DOI: 10.1189/jlb.0810456. |
| [5] | Fujino S, Andoh A, Bamba S, et al. Increased expression of interleukin 17 in inflammatory bowel disease[J]. Gut, 2003, 52 (1): 65-70. DOI: 10.1136/gut.52.1.65. |
| [6] | 黄小丽, 郭晓云, 姜海行. Th22细胞在炎症免疫性疾病及肿瘤中的研 究进展[J]. 世界华人消化杂志, 2014 (13): 1812-9. |
| [7] | Hanash AM, Dudakov JA, Hua GQ, et al. Interleukin-22 protects intestinal stem cells from Immune-Mediated tissue damage and regulates sensitivity to graft versus host disease[J]. Immunity, 2012, 37 (2): 339-50. DOI: 10.1016/j.immuni.2012.05.028. |
| [8] | Schwertschlag US, Trepicchio WL, Dykstra KH, et al. Hematopoietic, immunomodulatory and epithelial effects of interleukin-11[J]. Leukemia, 1999, 13 (9): 1307-15. DOI: 10.1038/sj.leu.2401514. |
| [9] | D'haens G, Sandborn WJ, Feagan BG, et al. A review of activity indices and efficacy end points for clinical trials of medical therapyin adults with ulcerative colitis[J]. Gastroenterology, 2007, 132 (2): 763-86. DOI: 10.1053/j.gastro.2006.12.038. |
| [10] | 张楠, 李一鑫, 陶林, 等. 胃癌患者IL-11和Survivin高表达的临床病 理学意义及其在癌进展和生存预后中的作用[J]. 世界华人消化杂志, 2015, 35 (3): 373-80. |
| [11] | Baron JH, Connell AM, Lennard-Jones JE. Variation between observers in describing mucosal appearances in proctocolitis[J]. Br Med J, 1964, 1 (5375): 89-92. DOI: 10.1136/bmj.1.5375.89. |
| [12] | 钟英强, 朱兆华, 幸连春. 活动期溃疡性结肠炎活检黏膜的组织学分 级与临床分级和内镜分级的关系[J]. 中华消化内镜杂志, 2003, 20 (4): 249. |
| [13] | Kelly-Welch AE, Hanson EM, Boothby MR, et al. Interleukin-4 and interleukin-13 signaling connections maps[J]. Science, 2003, 300 (5625): 1527-8. DOI: 10.1126/science.1085458. |
| [14] | Fuss IJ, Neurath M, Boirivant M, et al. Disparate CD4 + lamina propria(LP)lymphokine secretion profiles in inflammatory bowel disease. Crohn's disease LP cells manifest increased secretion of IFN-gamma, whereas ulcerative colitis LP cells manifest increased secretion of IL-[J]. J Immunol, 1996, 157 (3): 1361-70. |
| [15] | Weaver CT, Harrington LE, Mangan PR, et al. Th17: an effector CD4 T cell lineage with regulatory T cell ties[J]. Immunity, 2006, 24 (6): 677-88. DOI: 10.1016/j.immuni.2006.06.002. |
| [16] | Kinugasa T, Sakaguchi T, Gu XB, et al. Claudins regulate the intestinal barrier in response to immune mediators[J]. Gastroenterology, 2000, 118 (6): 1001-11. DOI: 10.1016/S0016-5085(00)70351-9. |
| [17] | Baars JE, Nuij VJ, Oldenburg BA, et al. Majority of patients with inflammatory bowel disease in clinical remission have mucosal inflammation[J]. Inflamm Bowel Dis, 2012, 18 (9): 1634-40. DOI: 10.1002/ibd.21925. |
| [18] | 张陈霏, 赵光耀, 虞竹雯, 等. 炎症性肠病患者外周血白细胞介素-22、 基质金属蛋白酶-9、巨噬细胞移动抑制因子表达及其临床意义[J]. 胃 肠病学, 2015 (7): 389-93. |
| [19] | 炎症性肠病诊断与治疗的共识意见(2012 年·广州)[J]. 胃肠病学, 2012, 12: 763-81. |
| [20] | Meucci G, Fasoli R, Saibeni S, et al. Prognostic significance of endoscopic remission in patients with active ulcerative colitis treated with oral and topical mesalazine: a prospective, multicenter study[J]. Inflamm Bowel Dis, 2012, 18 (6): 1006-10. DOI: 10.1002/ibd.21838. |
 2016, Vol. 36
2016, Vol. 36

