2. 蚌埠医学院 生物科学系,安徽 蚌埠 233030
2. Department of Biological Sciences, Bengbu Medical College, Bengbu 233030, China
心血管疾病威胁着人类的生命健康,再灌注疗法改善了心脏功能,取得了很好的疗效,也引起了新问题--缺血/再灌注(ischemia/reperfusion,I/R)损伤.研究I/R损伤的相关机制,有助于防治临床心肌损伤的发生,Rho激酶和自噬都参与了心肌I/R损伤.Rho激酶是一类丝-苏氨酸蛋白家族,抑制Rho激酶可以起到抗心肌缺血/再灌注损伤作用[1-2].自噬是现阶段的各种疾病机制的研究热点,早期认为自噬是进化过程中高度保守的、在溶酶体内降解细胞质成分的正常生理过程,除维持生理机体稳态功能外,近年来相继报道自噬功能的失调还与衰老、神经退行性病变、心血管疾病等相关[3-4],自噬在心肌I/R损伤中的作用存在争议,一方面认为自噬增强可能导致细胞死亡,加重心肌I/R损伤[5],另一方面却认为自噬在I/R损伤中起着有益的作用[6-7].因此,尽管多种研究表明自噬参与心肌I/R损伤,但自噬的作用仍无定论.有研究表明Rho激酶与自噬之间存在一定的联系[8],但在法舒地尔抑制Rho激酶对抗心肌I/R损伤中,自噬如何发生,发挥何种作用尚未见报道,尽早明确自噬的作用及可能机制可为减轻心肌I/R损伤提供治疗新途径.本研究通过复制离体大鼠心肌I/R损伤模型,观察抑制Rho激酶心肌保护作用的同时,检测自噬相关基因Atg5、Beclin1 mRNA表达的变化,以明确自噬是否参与抑制Rho激酶的心肌保护;应用自噬抑制剂进一步探讨自噬在法舒地尔心肌保护中的作用,并观察凋亡相关因子的改变,分析自噬与凋亡的发生在心肌保护作用中的关联.
1 材料和方法 1.1 实验动物和材料健康Sprague-Dawley(SD)大鼠,雄性,SPF级,体质量220~250 g,共24只,由蚌埠医学院实验动物中心提供.川威(盐酸法舒地尔注射液),Rho激酶抑制剂,购自天津红日药业股份有限公司.自噬抑制剂渥曼青霉素(Wortmannin,Wort)购自于Sigma 公司.改良Krebs-Henseleit(K-H)液成分:NaCl 118 mmol/L,KCl4.7mmol/L,KH2PO4 1.2 mmol/L,MgSO4 1.2 mmol/L,CaCl2 2.5mmol/L,NaHCO3 25mmol/L,Glucose 11mmol/L,pH 7.3~7.4.Trizol总RNA提取试剂购自Invitrogen公司;逆转录试剂盒和PCR试剂盒购自Fermentas公司;引物合成于上海生工生物工程技术服务有限公司,Atg5引物:上游序列5'-AGT GGA GGC AAC AGAACC-3',下游序列5'-GAC ACG AAC TGG CAC ATT-3',预计扩增产物长度205 bp;Beclin1 引物:上游序列5'-GAGCCA TTT ATT GAA ACT CGC CA-3',下游序列5'-CCT CCC CGA TCA GAG TGAA-3',预计扩增产物长度为106 bp;Bax引物:上游序列5'-GGA TCG AGCAGA GAG GAT GG-3',下游序列5'-TGG TGA GTGAGG CAG TGA GG-3',预计扩增产物长度464 bp;Bcl-2 引物:上游序列5'-CTG GTG GAC AAC ATCGCT CTG-3',下游序列5'-GGT CTG CTG ACC TCACTTGTG-3',预计扩增产物长度228 bp;以β-actin为内参照,引物上游序列5'-CTG TAT GCC TCT GGT CGTAC-3',下游序列5'-TGA TGT CAC GCA CGA TTTCC-3',预计扩增产物长度214 bp.一抗小鼠抗大鼠β-actin 抗体、兔抗大鼠caspase 3 抗体均购自CellSignaling Technology公司,二抗HRP标记的羊抗兔IgG、HRP标记的羊抗小鼠Ig G均购自Affinity公司.
1.2 离体大鼠心肌缺血/再灌注损伤模型制备及分组4%水合氯醛麻醉大鼠,断头器上断头,开胸迅速取心脏置冰水停搏,Langendorff装置上行主动脉干逆行灌流.K-H 液恒压(76 mmHg)灌流,以95% O2+5%CO2饱和,维持灌流液温度37 ℃恒温.切开左心耳将乳胶囊插入至左心室,囊内压力经特氟纶管传递至压力传感器,Medlab 生物信号采集处理系统记录实验结果.待心脏稳定25 min后,进行实验干预.将大鼠随机分3组,每组8 只:(1)缺血/再灌注(ischemia/reperfusion,I/R)损伤组:将大鼠冠状动脉左前降支结扎30 min复制局部心肌缺血,随之解开结扎线灌流120 min作为单纯I/R;(2)Fasudil组:同I/R组,期间(缺血前10 min至再灌注初期10 min)给予法舒地尔30 μmol/L,共灌流50 min;(3)Fasudil+Wort组:同I/R组,期间(同上)同时给予法舒地尔30 μmol/L+渥曼青霉素100 nmol/L,共灌流50 min.
1.3 左心室功能指标向乳胶囊注水调整左心室舒张末压(left ventricular end diastolic pressure,LVEDP)维持在4~10 mmHg,Medlab生物信号采集处理系统记录左心室发展压(left ventricular developed pressure,LVDP)、LVEDP和左心室内压最大上升和下降速率(maximal rise/fall rate of left ventricular pressure,±dp/dtmax),计算左心室做功量(rate pressure product,RPP),RPP=LVDP×HR[9].
1.4 离体心脏冠脉流出液中乳酸脱氢酶(lactate dehydrogenase,LDH)含量测定再灌注第5 min和第10 min收集冠脉流出液,分光光度法测定冠脉流出液中乳酸脱氢酶(lactatedehydrogenase,LDH)的含量,单位以U/L表示.
1.5 RT-PCR 检测Atg5、Beclin1、Bax 和Bcl-2 mRNA表达利用Trizol 总RNA提取试剂提取左心室组织总RNA,取总RNA 3 μL 作模板,逆转录试剂盒合成cDNA,PCR 试剂盒取1.5 μL cDNA 为模板,进行扩增.扩增条件:95 ℃预变性3 min后,以(1)95 ℃ 30 s变性;(2)Atg5 退火温度56 ℃ 30 s,Beclin1 退火温度57 ℃ 30 s,Bax 退火温度64.5 ℃ 30 s,Bcl-2 退火温度61.5 ℃ 30 s,β-actin退火温度58℃ 30 s;(3)72 ℃ 35 s,循环数为30,最后一轮延伸10 min.取4 μL PCR扩增产物进行琼脂糖凝胶电泳,溴化乙锭显色.GIS凝胶图像处理系统拍摄记录,图像分析软件扫描泳带净光密度值作半定量分析,以目的基因与内参的净光密度比值(Atg5/β-actin;Beclin1/β-actin;Bcl-2/β-actin;Bax/β-actin)表示mRNA相对表达量,并计算Bcl-2/Bax比值.
1.6 Western blotting检测心肌组织caspase 3的表达收集再灌后心肌组织,试剂盒提取蛋白,BCA蛋白定量法测定蛋白浓度.配制6%~15% SDS聚丙烯酰胺凝胶,进行电泳分离蛋白,然后200 mA将蛋白转至PVDF膜上.室温下5%脱脂奶粉封闭2 h,用相应的I抗(1∶1000)4 ℃孵育膜过夜,洗涤后换HRP标记II抗室温孵育2 h.洗涤后采用化学发光试剂盒在CE Image Quant LAS 4000 mini超灵敏化学发光成像仪显影,使用Image J的软件分析条带灰度值.
1.7 统计分析实验数据以均数±标准差表示.各组间数据显着性检验采用单因素方差(One-way ANOVA)分析,两两比较采用q检验,P<0.05为有统计学意义.
2 结果 2.1 左心室功能改变单纯I/R组大鼠心脏缺血与复灌期间LVDP降低,LVEDP上抬,±dp/dtmax降低,RPP降低;与单纯I/R组相比,Fasudil 组LVDP和±dp/dtmax 得到恢复,LVEDP降低,RPP增加;与Fasudil组相比,自噬抑制剂Wort干预后LVDP、±dp/dtmax和RPP均降低,再灌期间LVED明显升高,提示抑制自噬减弱了法舒地尔的作用(表 1).
| 表 1 离体大鼠心脏动力学指标 Table 1 Hemodynamic parameters of the isolated rat heart (Mean±SD, n=8) |
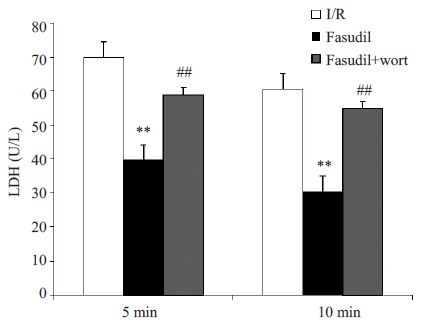
与单纯I/R相比,Fasudil使复灌不同时间点大鼠心脏冠脉流出液中LDH 释放减少;与Fasudil 组相比,Fasudil+Wort组LDH释放增加(图 1).
|
图 1 心脏冠脉流出液中乳酸脱氢酶含量 Figure 1 LDH content in the coronary effluent in different groups (n=8, U/L, Mean±SD). **P<0.01 vs I/R group; ##P<0.01 vs Fasudil group. |
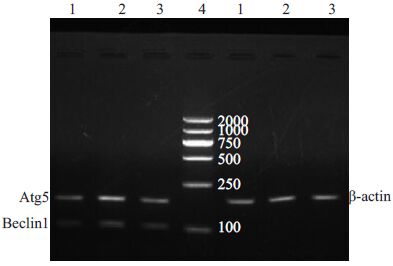
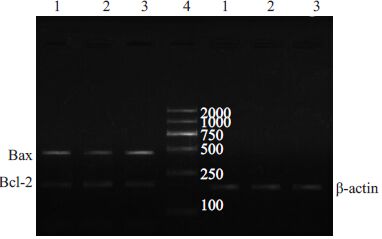
单纯I/R组自噬相关基因Atg5和Beclin1和凋亡相关因子Bcl-2和Bax mRNA均有表达,提示自噬和凋亡均参与心肌I/R损伤;与单纯I/R组相比,Fasudil组Atg5和Beclin1 mRNA表达增加,抑制凋亡因子Bcl-2表达增加,Bcl-2/Bax比值增高;与Fasudil组比较,Fasudil+Wort组Atg5和Beclin1 mRNA表达减少,Bcl-2/Bax比值降低(表 2,图 2,图 3).
| 表 2 各组心肌组织中Atg5、Beclin1、Bcl-2和Bax mRNA表达 Table 2 Atg5, Beclin1,Bcl-2 and Bax mRNA expressions in myocardial tissue and the ratio of Bcl-2/Bax in different groups (Mean±SD, n=8) |
|
图 2 各组心肌组织中Atg5和Beclin1 mRNA琼脂糖凝胶电泳 Figure 2 Agarose gel electrophoresis of Atg5 and Beclin1 mRNA in different groups. 1: I/R group; 2: Fasudil group; 3: Fasudil+Wort group; 4: Marker |
|
图 3 各组心肌组织中Bcl-2和Bax mRNA琼脂糖凝胶电泳 Figure 3 Agarose gel electrophoresis of Bcl-2 mRNA and Bax mRNA in different groups. 1: I/R group; 2: Fasudil group; 3: Fasudil+Wort group; 4: Marker |
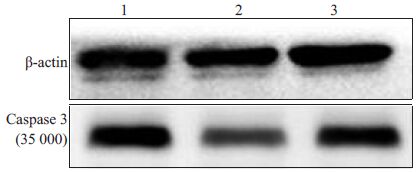
与单纯I/R组相比,Fasudil组caspase 3蛋白表达降低;与Fasudil组比较,Fasudil+Wort组caspase 3蛋白表达升高(图 4,表 3).
|
图 4 各组心肌组织中caspase 3蛋白表达 Figure 4 Caspase 3 protein expression in rat myocardial tissue in different groups. 1: I/R group; 2: Fasudil group; 3: Fasudil+Wort group |
| 表 3 各组心肌组织中caspase 3蛋白表达平均灰度值 Table 3 Caspase 3 protein expression average grey value in rat myocardial tissue of different groups (Mean±SD, n=8) |
心血管疾病的再灌注疗法带来新的问题--缺血/再灌注(ischemia/reperfusion,I/R)损伤,钙超载、氧化应激、中性粒细胞学说等现已得到公认,但其发生机制还需进一步阐明.Rho激酶在I/R损伤中起到很重要的作用,抑制Rho激酶可以激活PI3K/Akt信号通路保护心脏[10-11];我们前期的研究显示法舒地尔能够抑制Rho激酶信号通路发挥心肌保护作用,其机制可能与激动ALDH2、抑制细胞凋亡发生有关[12],可见Rho激酶可能通过不同机制参与了心肌I/R损伤,其中是否有自噬的参与、自噬发挥何种作用以及相关机制未见报道,还需进一步探讨.
本研究应用Langendorff装置复制心肌I/R损伤模型,检测大鼠心肌缺血再灌注不同时间点心肌动力学改变,LVDP、+dp/dtmax反映心肌收缩功能;LVDEP、-dp/dtmax 反映心肌的舒张功能[13].实验结果显示,与I/R组相比,Rho激酶抑制剂Fasudil组大鼠心肌再灌注期间各时间点LVDP、±dp/dtmax 及RPP升高,抑制LVEDP的升高,说明Fasudil抑制Rho激酶后,心脏再灌注后收缩和舒张机能得到改善.
乳酸脱氢酶是一种糖酵解酶,早期血清中LDH的升高见于急性心肌梗塞发作后,临床上常作为诊断急性心梗的标准之一;I/R损伤时细胞膜通透性增加,LDH释放增多,因此可将冠脉流出液中LDH含量作为判断受损的指标[14].实验中观察到Fasudil抑制Rho激酶后降低了心肌再灌注期间LDH的释放,说明Fasudil 抑制Rho激酶后减轻I/R损伤.
细胞死亡分为坏死、凋亡和自噬.凋亡和自噬的均参与I/R损伤[15].抑制Rho激酶的心肌保护作用与降低细胞凋亡相关[1],那么自噬是否亦参与其中呢?我们检测了自噬相关基因Atg5和Beclin1 mRNA的表达.哺乳动物的自噬相关基因Beclin1是酵母自噬基因Apg6/Vps30的同源物,是自噬重要的正调节因子,常作为自噬的定量检测的重要指标[16].Atg5是参与自噬调控的重要基因,Atg5 与Atg12 复合物定位于自噬体膜的表面,促进自噬体膜的伸展扩张,诱导自噬体的形成,是自噬体形成所必须的重要因素[17-18].结果显示Fasudil组Atg5和Beclin1 mRNA表达增加,提示Fasudil抑制Rho激酶抗心肌I/R损伤作用中诱导了自噬的发生.进一步应用自噬抑制剂渥曼青霉素发现,自噬减弱的同时Fasudil 的抗心肌I/R 损伤作用减弱,提示Fasudil 抑制Rho激酶后可能通过诱导自噬的发生发挥心肌保护作用.
I/R损伤中凋亡和自噬共同参与,且两者间存在一定联系.HL-1心肌细胞研究中发现,下调自噬相关基因Beclin1或Atg5抑制自噬发生,同时也使I/R损伤诱导的细胞凋亡增加,而过表达Beclin1增强自噬,则使细胞凋亡发生率降低[19].肝脏的缺血预处理上调小鼠体内自噬和凋亡的关键因素之一-血红素氧合酶1,通过p38-MAPK信号通路诱导自噬,然后吞噬受损的线粒体抑制细胞凋亡,最终保护肝细胞免受I/R损伤[20].那么抑制Rho激酶后,自噬与凋亡是何种关系呢?我们进一步检测caspase 3蛋白表达和Bcl-2和Bax mRNA的表达.Caspase 3,属于效应caspase蛋白,位于细胞凋亡有序级联反应的下游,是最为重要的凋亡执行者、多种凋亡刺激信号的汇聚点,被激活后促进细胞凋亡.Bax与线粒体渗透性转换孔蛋白结合促进细胞色素C从线粒体释放入细胞诱发细胞凋亡,Bcl-2则可抑制Bax移位到线粒体膜上,从而抑制凋亡.可见Bcl-2、Bax 和caspase 3均为参与细胞凋亡的重要分子[21-23].实验结果显示Fasudil 抑制Rho 激酶诱导自噬发生的同时,caspase 3蛋白表达降低,Bcl-2/Bax比值增高,细胞凋亡减弱;自噬抑制剂渥曼青霉干预后,自噬降低的同时caspase 3蛋白表达增加,Bcl-2/Bax比值降低,细胞凋亡增加,提示抑制Rho激酶后诱导自噬的发生,可减轻细胞凋亡.
综上所述,离体大鼠心肌I/R 损伤模型中,在Fasudil抑制Rho激酶对抗心肌损伤而保护心肌中可能诱导了自噬的发生,自噬的发生影响了细胞凋亡,使凋亡降低.但是抑制Rho激酶通过何种途径诱导自噬的发生,以及自噬和凋亡相互作用的具体机制还需阐明,这也是我们下一步的研究工作.
| [1] | Zhang J, Liu XB, Cheng C, et al. Rho-kinase inhibition is involved in the activation of PI3-kinase/Akt during ischemic-preconditioning- induced cardiomyocyte apoptosis[J]. Int J Clin Exp Med, 2014, 7 (11): 4107-14. |
| [2] | Kiss A, Tratsiakovich Y, Gonon AT, et al. The role of arginase and rho kinase in cardioprotection from remote ischemic preconditioning in non-diabetic and diabetic rat in vivo[J]. PLoS One, 2014, 9 (8): 0104731. DOI: 10.1371/journal.pone.0104731. |
| [3] | Li L, Xu J, He L, et al. The role of autophagy in cardiac hypertrophy[J]. Acta Biochim Biophys Sin (Shanghai), 2016, 48 (6): 491-500. DOI: 10.1093/abbs/gmw025. |
| [4] | Mijaljica D, Prescott M, Devenish RJ. Autophagy in disease[J]. Methods Mol Biol, 2010, 648 : 79-92. DOI: 10.1007/978-1-60761-756-3. |
| [5] | Jiang H, Xiao J, Kang B., et al. PI3K/SGK1/GSK3β signaling pathway is involved in inhibition of autophagy in neonatal rat cardiomyocytes exposed to hypoxia/reoxygenation by Hydrogen sulfide[J]. Exp Cell Res, 2016, 345 (2): 134-40. DOI: 10.1016/j.yexcr.2015.07.005. |
| [6] | Yan L, Vatner DE, Kim SJ, et al. Autophagy in chronically ischemic myocardium[J]. Proc Natl Acad Sci USA, 2005, 102 (39): 13807-12. DOI: 10.1073/pnas.0506843102. |
| [7] | Araki M, Motojima K. Hydrophobic statins induce autophagy in cultured human rhabdomyosarcoma cells[J]. Biochem Biophys Res Commun, 2008, 367 (2): 462-7. DOI: 10.1016/j.bbrc.2007.12.166. |
| [8] | Bessho M, Aki T, Funakoshi T, et al. Rho-Kinase inhibitor Y-27632 attenuates Arsenic trioxide toxicity in H9c2 cardiomyoblastoma cells[J]. Cardiovasc Toxicol, 2013, 13 (3): 267-77. DOI: 10.1007/s12012-013-9206-2. |
| [9] | Kang PF, Wu WJ, Tang Y, et al. Activation of ALDH2 with Low Concentration of Ethanol Attenuates Myocardial Ischemia/ Reperfusion Injury in Diabetes Rat Model[J]. Oxid Med Cell Longev, 2016, 2016 : 6190504. |
| [10] | Yada T, Shimokawa H, Hiramatsu O, et al. Beneficial effect of hydroxyfasudil, a specific Rho-kinase inhibitor, on ischemia/ reperfusion injury in canine coronary microcirculation in vivo[J]. JAm Coll Cardiol, 2005, 45 (4): 599-607. DOI: 10.1016/j.jacc.2004.10.053. |
| [11] | Hamid SA, Bower HS, Baxter GF. Rho kinase activation plays a major role as a mediator of irreversible injury in reperfused myocardium[J]. Am J Physiol Heart Circ Physiol, 2007, 292 (6): H2598-606. DOI: 10.1152/ajpheart.01393.2006. |
| [12] | 叶红伟, 康品方, 王洪巨, 等. 乙醛脱氢酶2在法舒地尔心肌保护作用 中的机制探讨[J]. 中国老年学杂志, 2013, 33 (5): 1070-2. |
| [13] | 董淑英, 童旭辉, 刘浩, 等. 石榴多酚对心肌缺血/再灌注损伤大鼠心 功能的保护作用[J]. 南方医科大学学报, 2012, 32 (7): 924-7. |
| [14] | 赵亮, 李芝, 钱令波, 等. 海州香薷总黄酮对大鼠离体心脏缺血/再灌 注损伤的保护作用[J]. 中国应用生理学杂志, 2014, 30 (2): 161-5. |
| [15] | Chen C, Hu LX, Dong T, et al. Apoptosis and autophagy contribute to gender difference in cardiac ischemia-reperfusion induced injury in rats[J]. Life Sci, 2013, 93 (7): 265-70. DOI: 10.1016/j.lfs.2013.06.019. |
| [16] | Kang R, Zeh HJ, Lotze MT, et al. The beclin 1 network regulates autophagy and apoptosis[J]. Cell Death Differ, 2011, 18 (4): 571-80. DOI: 10.1038/cdd.2010.191. |
| [17] | Vij A, Randhawa R, Parkash J, et al. Investigating regulatory signatures of human autophagy related gene 5 (ATG5) through functional in silico analysis[J]. Meta Gene, 2016, 9 : 237-48. DOI: 10.1016/j.mgene.2016.07.012. |
| [18] | Cao L, Fu M, Kumar S, et al. Methamphetamine potentiates HIV-1 gp120-mediated autophagy via Beclin-1 and Atg5/7 as a pro-survival response in astrocytes[J]. Cell Death Dis, 2016, 7 (10): e2425. DOI: 10.1038/cddis.2016.317. |
| [19] | Hamacher-Brady A, Brady NR, Gottlieb RA. Enhancing macroautophagy protects against ischemia/reperfusion injury in cardiac myocytes[J]. J Biol Chem, 2006, 281 (40): 29776-87. DOI: 10.1074/jbc.M603783200. |
| [20] | Wang Y, Shen J, Xiong X, et al. Remote ischemic preconditioning protects against liver Ischemia-Reperfusion injury via Heme oxygenase-1-Induced autophagy[J]. PLoS One, 2014, 9 (6): e98834. DOI: 10.1371/journal.pone.0098834. |
| [21] | 邱晓晓, 戴雍月, 宋张娟, 等. SP600125对大鼠肺缺血/再灌注损伤的 保护作用及机制[J]. 中国应用生理学杂志, 2012, 28 (3): 255-8. |
| [22] | 王洪巨, 康品方, 叶红伟, 等. 乙醛脱氢酶2在糖尿病大鼠心肌缺血/再 灌注损伤中的抗凋亡作用[J]. 南方医科大学学报, 2012, 32 (3): 345-8. |
| [23] | Zhang WP, Zong QF, Gao Q, et al. Effects of endomorphin-1 postconditioning on myocardial ischemia/reperfusion injury and myocardial cell apoptosis in a rat model[J]. Mol Med Rep, 2016, 14 (4): 3992-8. |
 2016, Vol. 36
2016, Vol. 36

