肾小管上皮细胞转分化(epithelial-messenchymal transition,EMT)过程中产生的细胞外基质在肾间质中的积聚是慢性肾纤维化的主要病因[1].EMT过程涉及上皮细胞经历表型的改变,包括细胞黏性和极性的丧失,获得具有迁移能力的间质细胞特征[2-5],在小鼠肾纤维化过程中,约12%成纤维细胞来源于骨髓,约30%的成纤维细胞则是来源于肾小管上皮细胞的转分化过程[6],而成纤维细胞是转分化过程中产生的细胞外基质的主要成分[7].波动性高糖能显着促进内皮细胞、心肌细胞的纤维化进程[8].高糖诱导上皮细胞转分化的可能机制是:高糖导致活性氧的增多,而活性氧通过激活多种生长因子与激素类因子,导致细胞外基质的沉积[9].本课题组在前期研究中已建立波动高糖诱导肾小管上皮细胞转分化模型,且在实验中也得到了验证[10].
miRNAs 是一类分布广泛而非编码蛋白质的RNAs,一般约含18~24个寡核苷酸,它们不具有开放阅读框,虽然不编码蛋白质,但参与机体各种重要的生理和病理过程;它们通过与靶mRNA 3'UTR(untranslated region)区的碱基互补配对,使其降解或抑制其表达,从而导致特定基因的沉默.miR-21在早期糖尿病肾病中下调表达,过表达miR-21能够抑制模型小鼠系膜细胞的增殖并降低其24 h尿蛋白排泄率[11].高糖环境中肾小管上皮细胞miR-29a的表达水平降低,因miR-29a可通过调控胶原Ⅳ型基因转录过程中3'UTR位点,使胶原Ⅳ型蛋白的表达水平得以下调,从而改善肾脏纤维化病情[12].mir-192的过表达促进了TGF-β1诱导肾脏纤维化进程,而敲除mir-192 时则抑制了肾脏纤维化的发展[13].miR-200a、miR-21、miR-8 与Wnt/β-catenin 信号途径密切相关[14],miR-146a,miR-145,miR-217 在肾纤维化中也发挥重要的作用[15-17].EMT 过程中miR-205表达下降,但ZEB1表达增强了,从而抑制了上皮细胞粘性分子E-cadherin 的表达水平,促进了EMT过程的发生和发展进程[18] .miR-200 家族(miR-200a,-200b,-200c,-141,-429)和miR-205 在EMT过程中表达下调超过100倍[19].既往研究表明,特异性miRNAs的差异表达在肾小管上皮细胞转分化过程中发挥着重要的作用,但关于mir-205在转分化过程中的调控机制方面尚未见文献报道.通过靶基因扫描,miR-205 在ZEB1 和ZEB2 3'UTR存在调控结合位点;本研究发现,mir-205可通过下调ZEB1和ZEB2的表达水平以抑制肾小管上皮细胞转分化进程.
1 材料和方法 1.1 材料人肾近端小管上皮细胞系HK-2购自美国ATCC.Real-time qPCR 试剂盒购自TaKaRa 公司;培养基D-MEM/F12、胰蛋白酶(Trypsin)、胎牛血清购自Gibco公司,D-glucose 购自Sigma 公司,脂质体2000 购自Thermo公司,DAB显色试剂盒和苏木素染色液购自碧云天生物技术公司.miRNeasy mini 试剂盒均购自Qiagen 公司.ZEB1、ZEB2、E-cadherin、β-catenin 和α-SMA抗体均购自Abcam公司,所用内参和二抗购自santa cruz公司.实时定量PCR引物委托上海吉玛制药技术有限公司合成.
Applied Stepone plus PCR 仪购自美国ABI,NanoDrop-1000仪购自德国NanoDrop技术公司,25 cm2培养瓶和细胞培养板购自美国Corning,研究型倒置显微镜购自日本Olympus.
1.2 细胞培养HK-2 细胞培养于D-MEM/F12 培养基中,内含10 %胎牛血清、100 U/mL青霉素和100 μg/mL链霉素,在37 ℃、5% CO2孵箱中培养,1~2 d 换液,据生长情况用胰酶消化传代.采用波动高糖建立HK-2转分化模型,将生长状态良好的HK-2细胞均匀接种于6 孔板中,细胞融合达到60%左右,无血清培养基饥饿培养12 h后,分为正常组和波动高糖组(D-Glucose 5.5 mmol/L与D-Glucose 25 mmol/L交替培养,波动周期为12 h)培养,48 h后进行建模评估,正常组和建模有效组进入后续实验.
1.3 细胞分组和转染有效建模组分为波动高糖对照组(HG)、阴性对照组(SC,25 nmol/L scrambled control)、mir-205 干预组(MG,25 nmol/L miR-205-5p mimics),将SC和MG组按照Invitrogen 说明书将待转染的miRNA oligomer与脂质体2000 均匀混合后,室温静置20 min 后滴入各组细胞孔板,6 h 后换完全培养基液,以上3组采用波动高糖培养;正常组为D-Glucose 5.5 mmol/L常规培养.所有分组均在37 ℃、5% CO2培养箱中培养3 d,分别收集48 h和72 h细胞.
1.4 定量PCR检测各组细胞转染后48 h收集各组细胞,提取细胞总RNA,用分光光度计定量检测RNA质量.先将RNA样品逆转录为cDNA,以cDNA 为模板定量样本中miR-205、ZEB1、E-cadherin、α-SMA 和GAPDH 表达量.miR-205 和U6 snRNA 采用TaKaRa SYBRPrimeScriptTM miRNA RT-PCR Kit,非miRNA 组采用TaKaRa SYBR Fast qPCR Mix Kit,各组均采用Applied StepOnePlus Real-Time PCR System 进行扩增.采用特异性引物序列见表 1.miR-205 以U6snRNA为内参,非miRNA组以GAPDH为内参.根据公式计算目的基因相对含量:2-△△CT,即得到各组的相对含量,实验独立重复3次.
| 表 1 实时荧光定量PCR引物 Table 1 Primers used in real-time qPCR |
将赖氨酸处理过的无菌盖玻片爬片放于6孔板中,按实验分组处理48 h.细胞用4%的多聚甲醛固定,3%H2O2室温孵育10 min 灭活内源性过氧化物酶,0.1%Triton X-100 孵育20 min,10% BSA封闭.分别加入β-catenin和E-cadherin抗体(1∶50),4 ℃过夜(PBS为阴性对照).漂洗后滴加二抗(1∶50)孵育2 h,DAB显色,苏木素对比复染、漂洗.Olympus IX71倒置研究型显微镜观察拍照(×400).
1.6 Western blot检测ZEB1、ZEB2、E-cadherin和α-SMA的表达分别收集各组培养72 h 的细胞,用预冷PBS洗3遍,加入细胞裂解液RIPA和蛋白酶抑制剂,冰浴30 min(每10 min 振荡10 s),4 ℃、12 000 r/min离心10 min,提取细胞总蛋白;BCA 法测定蛋白浓度.取细胞裂解蛋白30 μg,经10% SDS-PAGE 凝胶电泳2 h,PVDF转膜(200 mA、1 h);5%脱脂奶粉封闭PVDF膜2 h,分别加入E-cadherin、α-SMA、ZEB1 和ZEB2 抗体,4 ℃过夜,洗膜后加辣根过氧化物酶标记的羊抗兔抗体或羊抗小鼠抗体(1∶5000 稀释),37 ℃孵育1 h;洗膜后加ECL试剂,然后将PVDF 膜放入Bio-Rad 化学发光成像系统中成像,每组实验独立重复3 次.所得免疫印迹通过Image J软件获得各实验组与内参灰度值的比值.
1.7 统计学分析实验数据以均数±标准差表示,用SPSS 13.0软件进行方差分析,以P<0.05为差异有统计学意义.
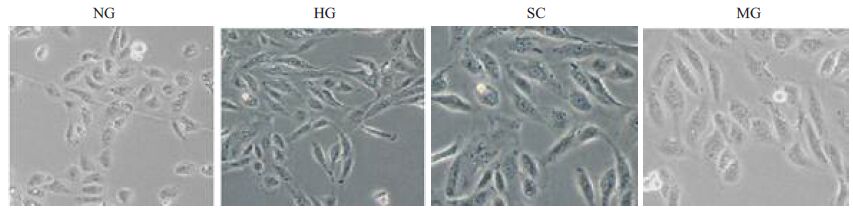
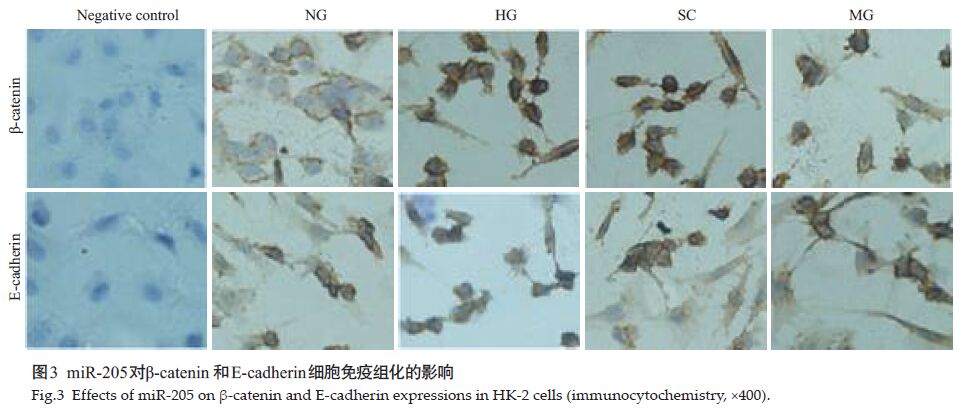
2 结果 2.1 波动高糖诱导HK-2细胞转分化模型建立HG组中的细胞形态变为具有间质细胞形态的梭形(图 1),E-cadherin表达水平大幅降低,α-SMA表达水平显着提高(图 2,4),同时细胞核中的β-catenin的异位表达水平明显增强(图 3),说明HK-2细胞经波动高糖培养建立HK-2转分化模型是成功的.
|
图 1 各组细胞形态改变 Figure 1 Morphological changes of HK-2 cells with different treatments (Original magnification: × 400). NG group: Cells cultured in 5.5 mmol/L D-glucose; HG group: Cells exposed intermittently to high glucose (25 mmol/L D-glucose); SC group: Cells exposed intermittently to high glucose and transfected with 25 nmol/L scrambled control; MG group: Cells exposed intermittently to high glucose and transfected with 25 nmol/L miR-205 mimics |
|
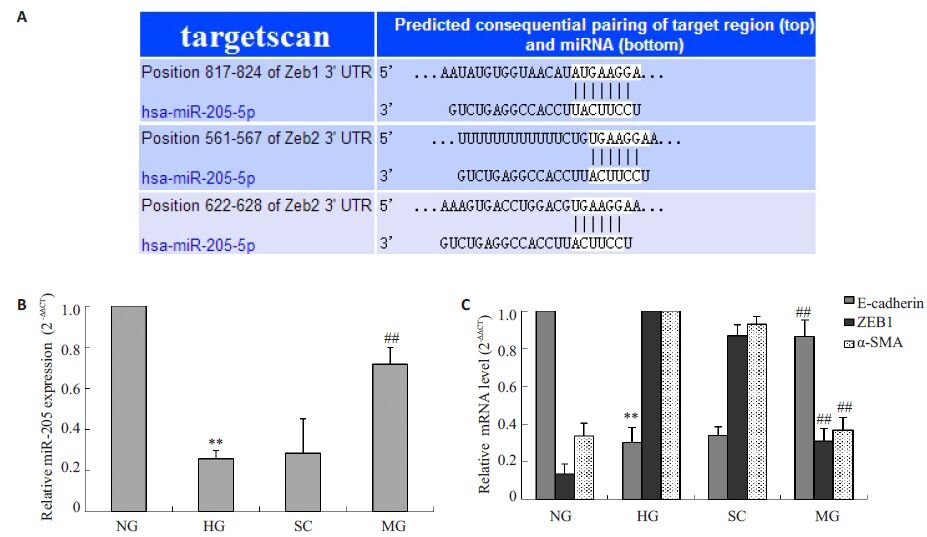
图 2 miR-205对ZEB1、E-cadherin和α-SMA mRNA的影响 Figure 2 Effects of miR-205 on ZEB1, E-cadherin and α-SMA mRNA expressions in HK-2 cells. A: Targetscan analysis of the 3'UTR of the ZEB1 and ZEB2 genes, which contain binding sites for miR-205; B: Relative miR-205 expression; C: Effects of miR-205 mimics on ZEB1, E-cadherin and α-SMAmRNAin HK-2 cells. **P<0.01 vs NG group; ##P<0.01 vs HG group |
|
图 3 miR-205对β-catenin 和E-cadherin细胞免疫组化的影响 Figure 3 Effects of miR-205 on β-catenin and E-cadherin expressions in HK-2 cells (immunocytochemistry, ×400) |
|
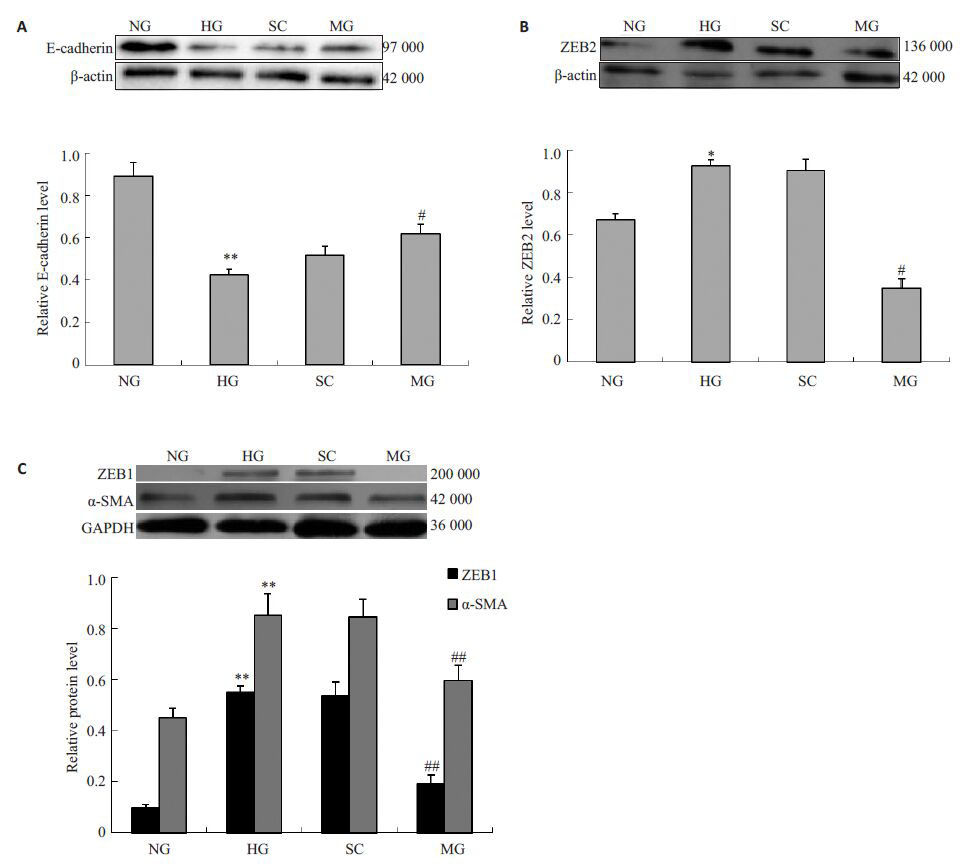
图 4 各组ZEB1、ZEB2、E-cadherin 与α-SMA的相对表达情况 Figure 4 Relative protein expression levels of ZEB1, ZEB2, E-cadherin and α-SMA in HK-2 cells. A: Expression level of E-cadherin; B: Expression level of ZEB2; C: Expression levels of ZEB1 and α-SMA. *P<0.05, **P<0.01 vs NG group; #P<0.01, ##P<0.01 vs HG group |
实验各组HK-2细胞培养72 h,通过倒置显微镜观察细胞形态,发现HG组细胞较NG组发生明显形态改变,NG组细胞为椭圆形的形态,为正常内皮细胞细胞;而HG组细胞转变为具有间质细胞形态的梭形,但MG组梭形细胞较HG组和NC组的比例明显下降(图 1).说明miR-205 mimics对维持HK-2内皮细胞形态具有积极的作用.
2.3 miR-205mimics对ZEB1、E-cadherin和α-SMAmRNA的影响通过targetscan靶点扫描,获得miR-205在转分化过程中潜在的作用靶点为ZEB1 和ZEB2,ZEB1 和ZEB2在转分化过程中是E-cadherin 的转录抑制因子.通过实时荧光定量PCR检测,如图 2C所示,HG组的E-cadherin mRNA相对表达量较NG组显着下降(P<0.01),而且HG组α-SMA mRNA相对表达较NG组显着增强(P<0.01),符合HK-2细胞在转分化过程中所具有的特性.HG组miR-205的相对表达量较NG组大幅下降(P<0.01),MG组中miR-205相对表达量较HG组显着提高(P<0.01)(图 2B).同时,MG 组中ZEB1mRNA 相对表达量较HG 组有显着下降(P<0.01),E-cadherin mRNA相对表达量较HG组显着提高(P<0.01),而α-SMA mRNA相对表达量较HG显着下降(P<0.01).这说明HK-2 细胞在转分化过程中,miR-205 对转分化进程发挥着重要的作用,而且增强miR-205的表达有利于抑制HK-2细胞的转分化过程.
2.4 miR-205 mimics 抑制β-catenin异位表达和维持上皮细胞极性如图 3细胞免疫组化结果所示,波动高糖HG组中的β-catenin的表达聚集在细胞核中,E-cadherin的表达量较NG组明显下降,符合上皮细胞转分化的特性.但通过miR-205 mimics的干预,MG组的β-catenin表达量得到明显下降,同时增强了E-cadherin 的表达.说明miR-205在肾小管上皮细胞向间质细胞转分化过程中,参与了抑制β-catenin 的异位表达,对抑制E-cadherin表达下降也发挥着重要的作用.
2.5 miR-205 通过下调ZEB1 和ZEB2 抑制HK-2 细胞转分化过程HG组细胞转染miR-205 mimics后,维持了HK-2上皮细胞椭圆形的细胞形态(图 1),增强了上皮细胞粘性重要分子E-cadherin的表达水平(图 2,4),降低了间质细胞特征分子α-SMA的表达水平(图 2,4),同时MG组ZEB1 和ZEB2 的表达量较HG组也得到大幅下调(图 2,4).
ZEB1 和ZEB2 是上皮细胞向间质细胞转分化过程中E-cadherin的转录抑制因子,提高ZEB1和ZEB2的表达水平,可抑制E-cadherin的表达.本研究发现,通过miR-205 mimics 提高miR-205 的水平,可显着抑制ZEB1和ZEB2的表达水平(图 2,4),促进了E-cadherin的表达,从而抑制了HK-2细胞转分化的过程.
3 讨论miRNAs与靶mRNA的3'UTR区的碱基互补配对而起作用,使其降解或抑制其表达,从而导致特定基因的沉默,对机体生长、发育及各种疾病尤其是肿瘤的发生和发展具有重要的调节功能.它们调节了多种生物学信号通路,生物信息学数据显示,每个miRNA可以调节数百个靶基因,这也表明miRNAs 可能影响所有的信号途径.如在先天性梗阻性肾病肾小鼠上皮细胞中miR-205的逐步增加与肾积水的严重程度呈现正相关[20].同时,miR-205可通过调控SMAD2/SMAD7参与TGF-β1 信号途径的调控过程[21],miR-205在造血细胞中有致癌基因的作用[22],而在骨肉瘤中发挥着肿瘤抑制基因功能[23].miR-205和Krüppel样因子具有作为诊疗基底样乳腺癌的生物学标记分子的潜能[24],miR-205 也可作为乳腺癌和炎性乳腺癌的治疗学靶点[25].这些研究说明,miR-205在EMT和肿瘤发生过程中发挥着重要的作用,深入研究miR-205功能对相关疾病的诊疗具有重要临床指导意义;但关于miR-205在肾纤维化过程中的功能研究尚未见文献报道.
本研究中,通过targetscan进行miR-205靶基因扫描,发现ZEB1 3'UTR 817-824 区域和ZEB2 3'UTR561-567/622-628 区域有miR-205 的结合位点.ZEB1和ZEB2 是E-cadherin 的转录抑制因子,而E-cadherin在上皮细胞EMT过程中发挥着重要的作用,是具有维持上皮细胞粘性和极性的作用[2-4],也是上皮细胞EMT过程的标志性分子.HG组细胞分别转染scrambledcontrol 和miR-205 mimics后,SC组的各项指标未发现与HG组有统计学意义.MG组中ZEB1和ZEB2的表达水平较HG组得到大幅下调(P<0.01),而E-cadherin的表达水平较HG组显着提高(P<0.01),同时间质细胞特征分子α-SMA的表达水平显着降低(P<0.01)(图 2,4).miR-205 mimics 也显着抑制了MG组中β-catenin异位表达(图 3),在维持上皮细胞的形态方面也起着重要的作用(图 1).
研究表明,miR-200家族的调控靶点都是ZEB1和ZEB2,它们抑制许多上皮细胞的基因表达,其中也包括了E-cadherin[26].也有研究证实过表达miR-205可以修复E-cadherin的表达[27].本研究发现,通过miR-205 mimics抑制ZEB1 和ZEB2 的表达,也可促进E-cadherin 在抑制HK-2细胞转分化过程中的表达修复.
肾纤维化早期临床病症不明显,不易被检出,因此,探寻一个无创伤性、易于连续监测且能准确反映肾纤维化进程的客观评价指标是肾纤维化早期诊断和防治CKD的关键.miRNAs分子表达水平的变化先于疾病的发生,而且miRNAs的表达具有组织特异性,疾病状态下miRNAs出现差异表达,这为miRNAs作为肾纤维化诊断指标奠定了理论基础;而近年来的研究进一步验证了miRNAs作为疾病诊断的可能性和可行性[24-25, 28-30].
本文通过miR-205 mimics对HK-2细胞转分化过程中潜在靶点进行研究,表明miR-205的过表达,通过与ZEB1 和ZEB2 3'UTR 特异位点结合,下调了ZEB1和ZEB2 的表达,抑制了肾小管上皮间质转分化.综上,miR-205可通过下调ZEB1和ZEB2的表达,以抑制肾小管上皮细胞转分化进程,为肾间质纤维化的治疗提供了新的靶点.后续将探究肾纤维化患者体液中miR-205的差异表达情况,探寻无创途径的肾纤维化早期临床诊断方法,这将给临床实践中肾纤维化早期诊断提供科学依据与实践基础.
| [1] | Liu YH. Cellular and molecular mechanisms of renal fibrosis[J]. Nat Rev Nephrol, 2011, 7 (12): 684-96. DOI: 10.1038/nrneph.2011.149. |
| [2] | Lovisa S, Zeisberg M, Kalluri R. Partial Epithelial-to-Mesenchymal transition and other new mechanisms of kidney fibrosis[J]. Trends Endocrinol Metab, 2016, 27 (10): 681-95. DOI: 10.1016/j.tem.2016.06.004. |
| [3] | Stone RC, Pastar I, Ojeh N, et al. Epithelial-mesenchymal transition in tissue repair and fibrosis[J]. Cell Tissue Res, 2016, 365 (3): 495-506. DOI: 10.1007/s00441-016-2464-0. |
| [4] | Xu MH, Gao X, Luo D, et al. EMT and acquisition of stem cell-like properties are involved in spontaneous formation of tumorigenic hybrids between lung cancer and bone marrow-derived mesenchymal stem cells[J]. PLoS One, 2014, 9 (2): e87893. DOI: 10.1371/journal.pone.0087893. |
| [5] | Ravikrishnan A, Ozdemir T, Bah M, et al. Regulation of Epithelial-to-Mesenchymal transition using biomimetic fibrous scaffolds[J]. ACS Appl Mater Interfaces, 2016, 8 : 17915-26. DOI: 10.1021/acsami.6b05646. |
| [6] | Kalluri R, Neilson EG. Epithelial-mesenchymal transition and its implications for fibrosis[J]. J Clin Invest, 2003, 112 (12): 1776-84. DOI: 10.1172/JCI200320530. |
| [7] | Lebleu VS, Taduri G, O'connell J, et al. Origin and function of myofibroblasts in kidney fibrosis[J]. Nat Med, 2013, 19 (8): 1047-53. DOI: 10.1038/nm.3218. |
| [8] | Fragiadaki M, Mason RM. Epithelial-mesenchymal transition in renal fibrosis-evidence for and against[J]. Int J Exp Pathol, 2011, 92 (3): 143-50. DOI: 10.1111/iep.2011.92.issue-3. |
| [9] | Carew RM, Wang B, Kantharidis P. The role of EMT in renal fibrosis[J]. Cell Tissue Res, 2012, 347 (1): 103-16. DOI: 10.1007/s00441-011-1227-1. |
| [10] | 曹罗元, 黄宝英, 富显果, 等. 波动性高糖对肾小管上皮细胞Wnt/ β-catenin 信号途径的影响[J]. 中国细胞生物学学报, 2012, 34 (7): 690-4. |
| [11] | Zhang Z, Peng H, Chen J, et al. MicroRNA-21 protects from mesangial cell proliferation induced by diabetic nephropathy in db/ db mice[J]. FEBS Lett, 2009, 583 (12): 2009-14. DOI: 10.1016/j.febslet.2009.05.021. |
| [12] | Du B, Ma LM, Huang MB, et al. High glucose down-regulates miR-29a to increase collagen IV production in HK-2 cells[J]. FEBS Lett, 2010, 584 (4): 811-6. DOI: 10.1016/j.febslet.2009.12.053. |
| [13] | Krupa A, Jenkins R, Luo DD, et al. Loss of MicroRNA-192 promotes fibrogenesis in diabetic nephropathy[J]. J Am Soc Nephrol, 2010, 21 (3): 438-47. DOI: 10.1681/ASN.2009050530. |
| [14] | Huang K, Zhang JX, Han L, et al. MicroRNA roles in beta-catenin pathway[J]. Mol Cancer, 2010, 9 (1): 252. DOI: 10.1186/1476-4598-9-252. |
| [15] | Morishita Y, Imai T, Yoshizawa HA, et al. Delivery of microRNA- 146a with polyethylenimine nanoparticles inhibits renal fibrosis in vivo[J]. Int J Nanomedicine, 2015, 10 : 3475-88. |
| [16] | Mclendon JM, Joshi SR, Sparks J, et al. Lipid nanoparticle delivery of a microRNA-145 inhibitor improves experimental pulmonary hypertension[J]. J Control Release, 2015, 210 : 67-75. DOI: 10.1016/j.jconrel.2015.05.261. |
| [17] | Han F, Konkalmatt P, Chen JH, et al. miR-217 mediates the protective effects of the dopamine D2 receptor on fibrosis in human renal proximal tubule cells[J]. Hypertension, 2015, 65 (5): U856-1118. |
| [18] | Paterson EL, Kolesnikoff N, Gregory PA, et al. The microRNA-200 family regulates epithelial to mesenchymal transition[J]. Sci World J, 2008, 8 : 901-4. DOI: 10.1100/tsw.2008.115. |
| [19] | Gregory PA, Bert AG, Paterson EL, et al. The mir-200 family and mir-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1[J]. Nat Cell Biol, 2008, 10 (5): 593-601. DOI: 10.1038/ncb1722. |
| [20] | Wilhide ME, Feller JD, Li BR, et al. Renal epithelial miR-205 expression correlates with disease severity in a mouse model of congenital obstructive nephropathy[J]. Pediatr Res, 2016, 80 (4): 602-9. DOI: 10.1038/pr.2016.121. |
| [21] | Duan YJ, Chen QX. TGF-beta 1 regulating miR-205/miR-195 expression affects the TGF-beta signal pathway by respectively targeting SMAD2/SMAD7[J]. Oncol Rep, 2016, 36 (4): 1837-44. |
| [22] | Jang SJ, Choi IS, Park G, et al. MicroRNA-205-5p is upregulated in myelodysplastic syndromes and induces cell proliferation via PTEN suppression[J]. Leuk Res, 2016, 47 : 172-7. DOI: 10.1016/j.leukres.2016.06.003. |
| [23] | Zhang C, Long F, Wan J, et al. MicroRNA-205 acts as a tumor suppressor in osteosarcoma via targeting RUNX2[J]. Oncol Rep, 2016, 35 (6): 3275-84. |
| [24] | Guan B, Li Q, Li XH, et al. MicroRNA-205 targeted Krüppel-like factor 12 and regulated MDA-MB-468 cells apoptosis in basal-like breast carcinoma[J]. Zhonghua Yi Xue Za Zhi, 2016, 96 (26): 2070-5. |
| [25] | Huo L, Wang Y, Gong Y, et al. MicroRNA expression profiling identifies decreased expression of miR-205 in inflammatory breast cancer[J]. Mod Pathol, 2016, 29 (4): 330-46. DOI: 10.1038/modpathol.2016.38. |
| [26] | Vandewalle C, Van Roy F, Berx G. The role of the ZEB family of transcription factors in development and disease[J]. Cell Mol Life Sci, 2009, 66 (5): 773-87. DOI: 10.1007/s00018-008-8465-8. |
| [27] | Hurteau GJ, Carlson JA, Spivack SD, et al. Overexpression of the microRNA hsa-miR-200c leads to reduced expression of transcription factor 8 and increased expression of E-cadherin[J]. Cancer Res, 2007, 67 (17): 7972-6. DOI: 10.1158/0008-5472.CAN-07-1058. |
| [28] | Wang G, Kwan BC, Lai FM, et al. Urinary miR-21, miR-29, and miR-93: novel biomarkers of fibrosis[J]. Am J Nephrol, 2012, 36 (5): 412-8. DOI: 10.1159/000343452. |
| [29] | Yamada Y, Enokida H, Kojima S, et al. MiR-96 and miR-183 detection in urine serve as potential tumor markers of urothelial carcinoma: correlation with stage and grade, and comparison with urinary cytology[J]. Cancer Sci, 2011, 102 (3): 522-9. DOI: 10.1111/cas.2011.102.issue-3. |
| [30] | Lv LL, Cao YH, Ni HF, et al. MicroRNA-29c in urinary exosome/ microvesicle as a biomarker of renal fibrosis[J]. Am J Physiol Renal Physiol, 2013, 305 (8): F1220-7. DOI: 10.1152/ajprenal.00148.2013. |
 2016, Vol. 36
2016, Vol. 36

