2. 益阳市中心医院,湖南 益阳 413000
2. Yiyang Central Hospital,Yiyang 413000, China
特发性不育包括弱精症、少精症和畸形精子症等,是一类原因不明的男性不育症。据统计,目前全球不育率呈升高的趋势,其中男方因素占50% .导致男性不育的因素有多种,其中60%~75%的患者找不到原因,称为特发性不育,包括弱精症、少精症和畸形精子症等。在特发性不育患者中,30%由基因突变或染色体异常等遗传因素造成[1-2].精子发生是指精原细胞经过一系列发育阶段发育成成熟精子的过程,这一过程受到众多基因、分子的调控,如Sox9,Eif2s3y,miRNAs,PAIP2A[3-5]等。精子发育障碍会导致精子畸形少精。精子运动是通过鞭毛摆动的快速前向运动,鞭毛的结构异常,能量代谢障碍,都可以引起精子活力下降导致不育,即弱精症。相关基因有溶质载体22a14,纤维鞘蛋白CABYR,NDUFA13,PP1γ2 和PPP1R11等[6-9].特发性不育症的病因研究必然会给临床治疗带来新的指导。
前期工作中我们克隆了人/鼠睾丸组织高表达热休克蛋白家族HSP40 家族新基因DnaJB13/Dnajb13,其mRNA表达于各级生精细胞,蛋白主要定位在精子细胞和成熟精子尾部[10],提示其功能与精子形成和运动相关。国内外学者近年来对DNAJB13 的功能也更加关注[11-12],各研究皆显示了DNAJB13在纤毛和鞭毛运动中起了重要作用。
我们对精子蛋白Co-IP 结合质谱分析结果显示DNAJB13 可能与HK1 存在相互作用。为验证DNAJB13与HK1的相互作用,我们将其cDNA全长克隆到pGEX-4T-1 上表达GST 融合蛋白[13-14],行GSTpull down技术检测DNAJB13相互作用蛋白,揭示了其作用机制的一个方面,给予临床工作一定的指导。
1 材料和方法 1.1 材料C57成年雄性小鼠睾丸组织、绿水,引物由上海生工公司合成。限制性内切酶EcoRⅠ和XhoⅠ购自NEB公司,DNAJB13抗体购自Santa Cruz公司,pGEM T载体试剂盒购自promega公司,胶回收试剂盒和质粒小抽试剂盒购自TAKARA公司,蛋白Marker购自thermo公司。1.5 mL EP管购自Axygen公司。pGEX-4T-1质粒本实验室保存。感受态细胞DH5α购自TAKARA.GST pull down试剂盒购自Promega公司。
1.2 方法 1.2.1 pGEM-T/Dnajb13重组质粒的构建(TA克隆)与鉴定(1)Dnajb13开放阅读框全长扩增:使用带EcoRⅠ和XhoⅠ酶切位点保护碱基的引物Dnajb-pGEX-T-F:CTAGCCGGAATTCATGGGGCTGGATTACTATGCTGTGCTT(EcoR Ⅰ),Dnajb-pGEX-T-R:CTAGCCGCTCGAGTTAGGTCAGCAATGCCTGGCGCA(XhoⅠ),以小鼠睾丸组织cDNA为模板进行PCR扩增。10 μL体系如下:绿水5 μL,引物20 μmol各0.1 μL,模板1 μL,双蒸水3.8 μL,同时设阴性对照。Eppendorf MastercyclerGradient PCR仪上完成PCR扩增,条件为:95 ℃预变性1min 30 s,94 ℃变性10 s,55 ℃退火30 s,72 ℃延伸2 min,完成35个循环,最后72 ℃延伸5 min,最后4 ℃保温。2%琼脂糖凝胶电泳检测PCR产物大小。
(2)TA克隆:PCR 产物大小符合实际大小之后,pGEM T载体试剂盒连接pGEM-T Vector.10 μL体系条件如下:2×rapid ligation buffer 5 μL,pGEMT vector1μL,PCR产物0.2 μL,双蒸水2.8 μL,T4连接酶1 μL,4 ℃过夜。
(3)TA克隆载体转化:连接产物转化感受态大肠杆菌DH5α,取10 μL感受态细胞冰上解冻,取1 μL连接产物与DH5α混匀,冰浴30 min.42 ℃热激50 s后立即冰浴3~5 min.加入预热的AMP阴性LB液体培养基300 μL,37 ℃,225 r/min,摇菌1 h.向已加0.1 mg/mLAMP的固体培养基中加4 μL IPTG和40 μL X-Gal混合液,再取100~200 μL 菌液铺板,自然干燥5~10 min,37 ℃培养箱倒置培养过夜。
(4)TA克隆鉴定:挑单克隆菌落到无菌EP管,加70 μL LB(含AMP 0.1 mg/mL),37 ℃,225 r/min,摇床摇4 h.菌液PCR鉴定,10 μL体系如下:绿水5 μL,引物对0.2 μL,菌液1 μL,双蒸水3.8 μL,PCR条件同上,PCR鉴定阳性的菌液扩大培养小抽质粒送华大基因公司测序。
1.2.2 pGEX/Dnajb13重组表达质粒的构建与鉴定(1)胶回收Dnajb13和载体酶切片段:用EcoRⅠ和XhoⅠ对pGEM/Dnajb13与PGEX-4T-1进行双酶切,分别回收目的基因和表达载体酶切产物。
(2)酶切产物连接:Dnajb13 和pGEX-4T-1 酶切产物按物质的量比3∶1连接,10 μL体系:10×ligase buffer1μL,目的基因片段5 μL,质粒3.2 μL,T4连接酶0.3 μL,双蒸水0.5 μL,PCR仪16 ℃过夜。
(3)重组质粒鉴定:重组质粒转化和鉴定同上。
1.2.3 融合蛋白表达和鉴定[15](1)表达:挑选经测序验证的菌液,37 ℃培养过夜,次日按1∶20比例加入4 mL含100 μg/mL氨苄青霉素的LB培养基中,37 ℃,225 r/min培养至A600 nm为0.6~0.8,IPTG诱导时间和浓度进行梯度实验。浓度梯度:加入IPTG 浓度设1、10、40、70、100 mmol/L,分别诱导4 h,取1 mL菌液离心加裂解液超声裂解取上清加适量上样缓冲液煮沸5 min;时间梯度:加入IPTG 1 mmol/L 诱导,分别在1~4 h 时取出1mL菌液12 000 r/min离心1 min收集菌体,加入细胞裂解液15 μL重悬细菌,再加15 μL上样缓冲液混匀煮沸5 min.10% SDS-PAGE检测。
(2)融合蛋白Western blotting 鉴定:利用羊抗DNAJB13 进行Western blotting 检测,重组蛋白经SDS-PAGE电泳后半干转至PVDF膜上,用含5%脱脂奶粉的PBST封闭1 h 以上,一抗DNAJB13 抗体F-201∶100,4 ℃,摇床慢摇孵育过夜。次日,1×PBST洗膜3遍,10 min/遍,二抗抗羊1∶2000,室温摇床慢摇孵育1 h.1×PBST洗膜3遍,10 min/遍,ECL化学发光检测试剂盒显色。
1.2.4 GST pull down(1) GST-DNAJB13 融合蛋白(诱饵蛋白)和GST 蛋白(阴性)制备:PGEX-4T-1/Dnajb13 重组质粒与空质粒转化感受态细胞DH5α,1mmol/L IPTG诱导4 h,各离心10 mL菌液收集菌体,各加400 μL MagneGSTTM Cell Lysis Reagent,冰水混合物中超声破碎30 min,超1 min停45 s.4 ℃,12 000 r/min,离心20 min,取上清。
(2)小鼠睾丸蛋白提取:(i)全程冰上操作,取2 个C57小鼠睾丸组织加1 mL预冷的RIPA,电动匀浆器匀浆,冰上静置20 min.(ii)4 ℃,12 000 r/min,离心20 min.(iii)BCA法测定蛋白浓度。
(3)GST pull down[16-17]:平衡:每组取20 μL磁珠于1.5mL EP管,加250 μL binding/wash buffer平衡磁珠两次,EP管置于磁铁之上吸附磁珠,取上清。
吸附:再加40 μL binding/wash buffer、200 μLGST-DNAJB13融合蛋白或GST蛋白、60 μL 5% BSA,室温慢摇30 min.洗:磁铁吸附去上清,洗3遍。捕获:每管磁珠再加150 μL小鼠睾丸蛋白、60 μL 5% BSA、70 μL buffer,室温慢摇1 h.短震荡,留上清做Western分析。洗脱:400 μL buffer洗5遍,最后加20 μL loading煮沸。
(4)Western blot分析:设阳性对照:小鼠睾丸蛋白,实验组和阴性对照的pull-down组和上清组,SDS-PAGE电泳后130 mA,30 min半干转至PVDF膜上,用含5%脱脂奶粉的PBST 封闭1 h 以上,一抗HK1 抗体1∶1000,4 ℃,摇床慢摇孵育过夜。次日,1×PBST洗膜3遍,10 min/遍,二抗驴抗兔1∶5000,室温摇床慢摇孵育1 h.1×PBST洗膜3遍,10 min/遍,ECL化学发光检测试剂盒显色。
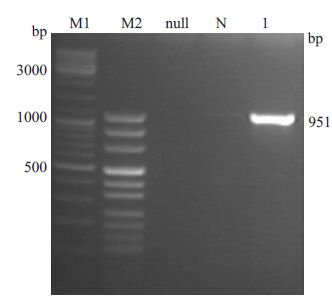
2 结果 2.1 pGEM-T/Dnajb13重组质粒的构建(TA克隆)与鉴定 2.1.1 小鼠Dnajb13全长PCR扩增PCR产物经2%琼脂糖凝胶电泳分析,大小为951 bp,符合预期(图 1).
|
图 1 Dnajb13开放阅读框全长PCR扩增产物 Figure 1 PCR product of full length Dnajb13 open reading frame. M1: DNA ladder; M2: Puc mix marker; Null: Blank; N: Negative control. Lane 1:PCR product |
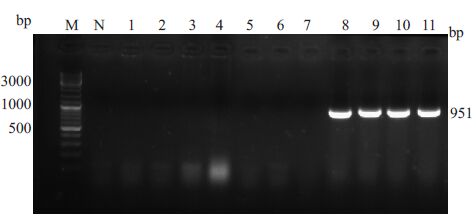
挑pGEM-T/Dnajb13重组质粒转化大肠杆菌单克隆11个,做菌液PCR鉴定,4个阳性大小符合,送华大基因公司测序,Dnajb13-8,9序列完全正确(图 2).
|
图 2 单克隆菌液PCR产物2%琼脂糖凝胶电泳结果 Figure 2 Result of monoclonal PCR product. M: DNA ladder mix;Lanes 1-11: 11 monoclones; N: Negative control |
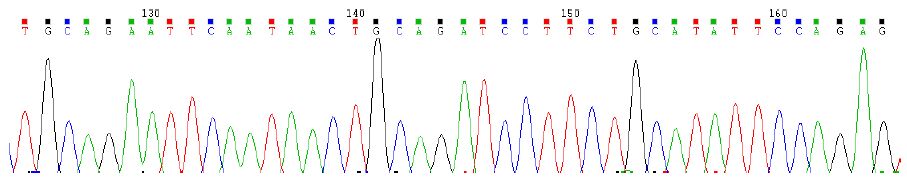
pGEX-4T-1 载体带有GST 标签,与pGEM-T/Dnajb13重组质粒分别用HindⅢ和EcoRⅠ双酶切,酶切产物经1%琼脂糖凝胶电泳成像,胶回收载体片段和目的基因片段。连接产物转化感受态细胞挑单克隆摇菌PCR鉴定,pGEX/Dnajb13有两个阳性结果大小符合,送华大基因公司测序,结果和预期结果一致(图 3).
|
图 3 pGEX/Dnajb13部分测序结果图 Figure 3 Partial sequencing result of pGEX/Dnajb13 |
浓度梯度:IPTG浓度从0、1、10、40、70、100 mmol/L分别诱导4 h,结果显示:IPTG未诱导时,GST-DNAJB13有少量表达,浓度梯度间融合蛋白表达量无明显变化(图 4).
|
图 4 不同浓度IPTG融合蛋白的表达 Figure 4 Result of GST fusion protein expression induced by different concentrations of IPTG (0 to 100 mmol/L). M:Protein marker. Lanes 1-6: 0, 1, 10, 40, 70, and 100 mmol/L, respectively |
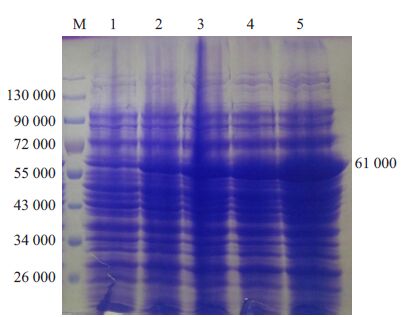
固定浓度为1mmol/L,设置时间梯度:1、2、3、4 h.结果显示:IPTG未诱导时,GST-DNAJB13有少量表达,随着诱导时间延长,融合蛋白表达量明显增加(图 5).
|
图 5 SDS-PAGE检测重组质粒在大肠杆菌中蛋白表达,考马斯亮蓝染色结果 Figure 5 SDS-PAGE analysis of the recombinant plasmid pGEX/Dnajb13. M: Protein marker; 1: pGEX/Dnajb13 without IPTG induction; Lanes 2-5: pGEX/Dnajb13 after IPTG induction (1-4 h) |
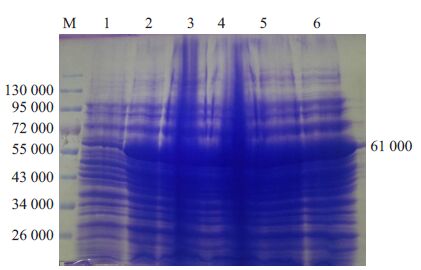
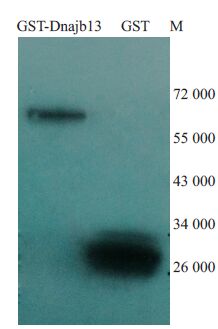
Western用GST抗体检测重组质粒和空质粒转化菌体裂解蛋白,结果有融合蛋白和标签蛋白的表达。融合蛋白为61 000,标签蛋白为26 000,大小符合预期。(图 6).
|
图 6 Western blot检测融合蛋白和标签蛋白的表达 Figure 6 Western blot analysis of GST fusion protein and GST protein |
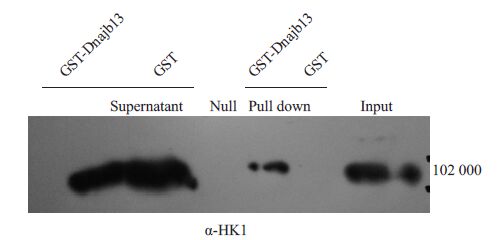
GST pull down实验中,GST-DNAJB13 与磁珠上的GSH特异结合作为诱饵蛋白,与睾丸总蛋白孵育后洗脱,Western 用HK1 抗体检测沉淀下来的蛋白,GST-DNAJB13 组HK1 阳性说明DNAJB13 与HK1 有相互作用,实验组和阴性对照组洗脱液HK1阳性说明HK1是足量的(图 7).
|
图 7 Western blot检测GST pull down结果 Figure 7 SDS-PAGE and Western blot analysis of GST pull down.Input: HK1 expressed in mouse testis. Pull down:GST-DNAJB13 was pulled down with HK1 while GST protein (negative control) was not. Supernatant: HK1 in the supernatant of experimental and mock groups were excessive. Null: Blank |
目前特发性不育症是个研究热点,其中生精相关基因Dnajb13日益引起国内外学者的关注,其在纤毛或鞭毛运动中的作用得到了广泛的证实。2004年,刘刚[18]等发现小鼠睾丸组织高表达HSP40家族新基因Dnajb13,人鼠Dnajb13具有高度同源性,开放阅读框长度为951 bp,编码316个氨基酸,DNAJB13蛋白由DNAJ结构域和C结构域组成[19].Guan等[20-22]通过免疫电镜将DNAJB13定位于轴丝9+2结构的放射辐。2014年,李维娜[10]研究结果显示Dnajb13 mRNA在小鼠出生后1周开始表达,3周后骤升,Western和免疫组化显示DNAJB13定位于精子细胞胞浆和成熟精子尾部,免疫电镜将其进一步定位于熟精子尾部鞭毛中段纤维鞘,Asami[11]等认为其为致死基因,通过CRISPR/CAS9技术对小鼠进行基因敲除Dnajb13,结果导致小鼠4周前全部脑积水死亡,小鼠精子出现无尾短尾和无活力。Elma El Khouri[12]等在3名纤毛不动综合征患者中筛查出Dnajb13基因点突变和截断突变,突变导致患者部分纤毛缺失中央微管,显示9+0结构。精子鞭毛和鼻腔纤毛DNAJB13蛋白表达明显下降。以上对该基因蛋白表达和定位的研究提示其功能与精子运动相关。目前的研究仅停留在定位及功能研究水平,具体分子机制尚不清楚。
前期我们对精子蛋白免疫共沉淀结合质谱分析结果提示DNAJB13 的一个可能互作蛋白为糖代谢酶HK1,为验证上述结果,我们成功构建pGEX-4T-1-Dnajb13重组质粒,测序结果与预期一致;转化重组质粒的大肠杆菌在37 ℃,IPTG浓度1 mmol/L诱导下高效表达融合蛋白,GST pull down 检测结果显示DNAJB13与HK1存在相互作用。己糖激酶是糖酵解途径的第一个酶,利用ATP将葡萄糖转化为葡萄糖-6-磷酸(G6P).免疫印迹法显示HK1S在精子中高表达,免疫组化证实其主要定位在精子鞭毛部位,以上结果表明,HK1可能参与精子运动。Hironmoy[23]等对不同年龄小鼠差异表达基因Q-PCR结果显示从5 d到60 d HK1、NME5等基因表达量显着增高,提示以上基因与精子形成相关。Nakamura[24]等研究发现生精细胞特异己糖激酶HK1S有不同的5‘非编码区,含有生精细胞特异结构域(SSR),取代了HK1 与线粒体外膜特异结合结构域PBD.Noriko Nakamura[25]等通过酵母双杂交发现HK1 在主段通过SSR与PFKM结合,后者通过睾丸特异结构域TSR结合到纤维鞘的成分GSTM5.以上学者对HK1的定位及功能研究都证明了其参与精子的形成和运动,并且揭示可能的作用机制。我们的研究发现DNAJB13与HK1有相互作用,提示DNAJB13可能通过影响精子的能量代谢参与精子的形成和运动。
精子运动涉及3个方面,结构完整,离子通道和能量代谢,其中前两者是后者的基础,后者是精子运动的马达,任何影响能量代谢的因素都将导致精子活力下降。DNAJB13 定位于精子鞭毛纤维鞘,与HK1 和GSTM5定位相符。GST pull down实验表明DNAJB13与HK1 存在相互作用。综上所述,DNAJB13 可能与HK1 相互作用,形成DNAJB13/HK1/GSTM5 复合物,定位于精子尾部纤维鞘,参与精子糖代谢途径而影响精子运动。如果DNAJB13有突变或缺失时,HK1/GSTM5在尾部组装障碍,精子尾部形成缺陷供能缺陷则导致无尾短尾或无活力,机体其他富含纤毛的组织也会发生纤毛运动障碍引起肺炎,输卵管运输障碍等。任何引起结构、代谢和信号转导障碍的因素都将导致精子运动障碍,本实验揭示了DNAJB13可能的作用机制,但其结合部位、具体机制以及其是否影响精子尾部结构和信号转导尚有待进一步研究。
| [1] | Wise P. Male infertility update[J]. West J Med, 1991, 155 (6): 635-6. |
| [2] | Neto FT, Bach PV, Najari BB, et al. Genetics of male infertility[J]. Curr Urol Rep, 2016, 17 (10): 70. DOI: 10.1007/s11934-016-0627-x. |
| [3] | Hilz Stephanie, Modzelewski J, Cohen E, et al. The roles of microRNAs and siRNAs in mammalian spermatogenesis[J]. Development, 2016, 143 (17): 3061-73. DOI: 10.1242/dev.136721. |
| [4] | Yamauchi Y, Riel M, Ruthig A, et al. Two genes substitute for the mouse Y chromosome for spermatogenesis and reproduction[J]. Science, 2016, 351 (6272): 514-6. DOI: 10.1126/science.aad1795. |
| [5] | Delbes G, Yanagiya A, Sonenberg N, et al. PABP interacting protein 2A (PAIP2A) regulates specific key proteins during spermiogenesis in the mouse[J]. Biol Reprod, 2012, 86 (3): 95. DOI: 10.1095/biolreprod.111.092619. |
| [6] | Maruyama SY, Ito M, Ikami Y, et al. A critical role of solute carrier 22a14 in sperm motility and male fertility in mice[J]. Sci Rep, 2016, 6 : 36468. DOI: 10.1038/srep36468. |
| [7] | Young SA, Miyata H, Satouh Y, et al. CABYR is essential for fibrous sheath integrity and progressive motility in mouse spermatozoa[J]. J Cell Sci, 2016 : 93151. |
| [8] | Yang Y, Cheng L, Wang Y, et al. Expression of NDUFA13 in asthenozoospermia and possible pathogenesis[J]. Reprod Biomed Online, 2016 (16): 3. |
| [9] | Cheng L, Pilder S, Nairn AC, et al. PP1gamma2 and PPP1R11 are parts of a multimeric complex in developing testicular germ cells in which their steady state levels are reciprocally related[J]. PLoS One, 2009, 4 (3): e4861. DOI: 10.1371/journal.pone.0004861. |
| [10] | Li W, Liu G. DNAJB13, a type II HSP40 family member, localizes to the spermatids and spermatozoa during mouse spermatogenesis[J]. BMC Dev Biol, 2014, 14 : 38. DOI: 10.1186/s12861-014-0038-5. |
| [11] | Oji A, Noda T, Fujihara Y, et al. CRISPR/Cas9 mediated genome editing in ES cells and its application for chimeric analysis in mice[J]. Sci Rep, 2016, 6 : 31666. DOI: 10.1038/srep31666. |
| [12] | El Khouri Elma, Thomas Lucie, Jeanson Ludovic, et al. Mutations in DNAJB13, encoding an HSP40 family member, cause primary ciliary dyskinesia and male infertility[J]. Am J Hum Genet, 2016, 99 (2): 489-500. DOI: 10.1016/j.ajhg.2016.06.022. |
| [13] | Qiao Y, Zhao T, Liu Z, et al. Construction of lentivirus vector containing human homeobox gene HOXB4 and its expression in human umbilical cord mesenchymal stem cells[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2012, 20 (3): 703-9. |
| [14] | 朱莉, 刘刚. 小鼠生精相关基因pQE/Dnajb13 重组载体的构建和蛋 白表达[J]. 南方医科大学学报, 2013, 33 (12): 1757-60. |
| [15] | Mohajeri A, Pilehvar-Soltanahmadi Y, Pourhassan-Moghaddam M, et al. Cloning and expression of recombinant human endostatin in periplasm of escherichia coli expression system[J]. Adv Pharm Bull, 2016, 6 (2): 187-94. DOI: 10.15171/apb.2016.026. |
| [16] | Anang S, Subramani C, Nair VP, et al. Identification of critical residues in Hepatitis E virus macro domain involved in its interaction with viral methyltransferase and ORF3 proteins[J]. Sci Rep, 2016, 6 : 25133. DOI: 10.1038/srep25133. |
| [17] | Kimura T, Han W, Pagel P, et al. Protein phosphatase 2A interacts with the Na,K-ATPase and modulates its trafficking by inhibition of its association with arrestin[J]. PLoS One, 2011, 6 (12): e29269. DOI: 10.1371/journal.pone.0029269. |
| [18] | Liu G, Lu X, Xing W. Molecular cloning of TSARG6 gene related to apoptosis in human spermatogenic cells[J]. Acta Biochim Biophys Sin (Shanghai), 2004, 36 (2): 93-8. DOI: 10.1093/abbs/36.2.93. |
| [19] | 朱复希, 刘刚, 卢光琇. 生精相关HSP40家族蛋白的研究进展[J]. 现 代生物医学进展, 2009, 9 (10): 1960-3. |
| [20] | Guan J, Ekwurtzel E, Kvist U, et al. DNAJB13 is a radial spoke protein of mouse '9+2' axoneme[J]. Reprod Domest Anim, 2010, 45 (6): 992-6. DOI: 10.1111/j.1439-0531.2009.01473.x. |
| [21] | Guan J, Kinoshita M, Yuan L. Spatiotemporal association of DNAJB13 with the annulus during mouse sperm flagellum development[J]. BMC Dev Biol, 2009, 9 (23): 23. |
| [22] | Guan J, Yuan L. A heat-shock protein 40, DNAJB13, is an axoneme-associated component in mouse spermatozoa[J]. Mol Reprod Dev, 2008, 75 (9): 1379-86. DOI: 10.1002/mrd.v75:9. |
| [23] | Sarkar H, Arya S, Rai U, et al. A study of differential expression of testicular genes in various reproductive phases of hemidactylus flaviviridis (wall Lizard) to derive their association with onset of spermatogenesis and its relevance to mammals[J]. PLoS One, 2016, 11 (3): e0151150. DOI: 10.1371/journal.pone.0151150. |
| [24] | Nakamura N, Shibata H, O'brien A, et al. Spermatogenic cellspecific type 1 hexokinase is the predominant hexokinase in sperm[J]. Mol Reprod Dev, 2008, 75 (4): 632-40. DOI: 10.1002/(ISSN)1098-2795. |
| [25] | Nakamura N, Mori C, Eddy M. Molecular complex of three testis-specific isozymes associated with the mouse sperm fibrous sheath: hexokinase 1, phosphofructokinase M, and glutathione S-transferase mu class 5[J]. Biol Reprod, 2010, 82 (3): 504-15. DOI: 10.1095/biolreprod.109.080580. |
 2016, Vol. 36
2016, Vol. 36

