2. 南方医科大学南方医院 惠侨医疗中心,广东 广州 510515 ;
3. 南方医科大学南方医院 广东省妇幼保健院,广东 广州 511400
2. Huiqiao Medical Center, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China ;
3. Guangdong Maternal and Child Health Hospital, Guangzhou 511400, China
趋化因子家族目前被认为是引导炎性细胞朝着排斥部位趋化的最主要因子,在器官移植术后排斥反应中起着重要作用[1-2].基质细胞衍生因子-1(SDF-1)是趋化因子家族中的一员,与其特异性受体趋化因子受体4(CXCR4)结合后能介导免疫细胞的活化与运动[3-5],在肾移植、胰腺移植、动脉移植等领域已经证实SDF-1/CXCR4参与了移植术后的排斥反应[6-8],而在角膜移植领域未见有任何相关的研究。角膜移植术后免疫排斥反应是一个多种免疫细胞和免疫分子参与的复杂的免疫应答,虽然角膜存在免疫赦免和前房相关性免疫偏离,但炎性细胞±旧能浸润角膜植片,排斥反应仍是角膜移植失败的主要限制因素[9-11].为研究SDF-1/CXCR4是否参与角膜移植术后的排斥反应,既角膜植片上的炎性细胞浸润是否与SDF-1/CXCR4相关,及为今后抗角膜移植排斥反应药物提供可能的新作用靶点,我们设计了如下实验
1 材料和方法 1.1 实验动物与材料选用SD大鼠22只作为供体,Wistar大鼠66只做为受体行穿透性角膜移植术,另取Wistar大鼠15只作为正常对照。所有大鼠均购于南方医科大学实验动物中心,雌性,6~8周龄,体质量180~220 g,SPF级。实验动物的使用遵循实验动物管理条例。麻醉剂为3%戊巴比妥钠注射液(按1.5 mL/kg进行麻醉),散瞳剂为复方托品酰胺滴眼液,10-0尼龙线购于美国Ethicon,典必殊购于美国Alcon,免疫组化抗体购于英国Abcam,RNA提取试剂盒、逆转录试剂盒、实时荧光定量PCR试剂盒购于日本Takara,引物由上海英潍捷基贸易有限公司合成
1.2 分组和手术方法采用完全随机分组设计方案,随机抽取15只未行角膜移植的Wistar大鼠作为正常对照组;取22只Wistar大鼠行自体角膜移植手术(自体组);取22只SD大鼠作为供体,44只Wistar大鼠作为受体进行同种异体角膜移植,术后第2天,随机抽取22只Wistar大鼠,以典必殊滴眼液滴术眼,2次/d,每次1滴,持续30 d(典必殊组);剩余22只滴同等量生理盐水(异体组).供、受体大鼠术前20 min给予复方托品酰胺滴眼液充分散瞳,腹腔注射3%戊巴比妥钠麻醉(1.5 ml/kg),常规消毒铺巾。手术过程在手术显微镜(Leica,德国)下进行.采用直径3.5mm环钻钻取供体角膜植片,以直径3.0 mm环钻制备受体眼植床,10-0尼龙线间断缝合8针,术中及术后注入粘弹剂(Bausch Lomb,中国)保持前房深度。术毕结膜囊涂泰利必妥眼膏(santen,日本).术后不拆除角膜缝线
1.3 观察排斥反应及其判断标准在自体组、异体组、典必殊组每个组里各随机选取10只用于临床排斥评价。术后30 d内,每日在手术显微镜下观察植片情况按照Larkin[12]等的评分方法,记录角膜各参数。当各项评分之和≥5分时,或者混浊一项达到3分时,即为发生排斥反应术后3 d内有严重感染、前房出血、晶状体混浊、虹膜广泛黏连、伤口裂开、晶体脱出等并发症者剔除,并及时补充例数。
1.4 组织病理学检查及免疫组织化学检测术后第5天、第9天各从每组随机抽取3只大鼠,处死后取术眼眼球,4%多聚甲醛液固定,常规酒精梯度脱水,石蜡包埋,4 μm切片,选取部分切片采用苏木素-伊红(HE)染色法,显微镜下观察角膜植片厚度、炎性细胞浸润情况。选取部分切片行免疫组织化学检测,分别选用兔抗大鼠SDF-1 抗体(ab9797,Abcam)、兔抗大鼠CXCR4抗体(ab124824,Abcam)为一抗,以山羊抗兔抗体(ab97049,abcam)为二抗,采用SP三步法,热修复抗原,DAB显色,封片后显微镜下观察并染色情况;以PBS代替一抗作为阴性对照,分别将已知的阳性片设为阳性对照,细胞质或细胞核呈棕黄色为反应阳性细胞。在显微镜下观察,并在400×的视野下拍照(OLYMPUSDIGITAL CAMERA,Japan).每张角膜免疫组化切片随机选择5个视野,运用Image-Pro Plus软件计算5个视野的平均光密度作为此切片的阳性染色半定量结果。
1.5 荧光定量PCR检查术后第5天、第9天各从每组随机抽取3只大鼠,取术眼角膜,置于1 mL离心管中,采用Trizol 法提取总RNA.在Nanodrop 上测定RNA浓度及其A260/A280值。用逆转录试剂盒(Cat:RR037A,Takara)将RNA逆转录为cDNA.以大鼠GAPDH 为内参行qPCR 检测。GAPDH 上游引物为5'-ACCACAGTCCATGCCATCAC-3',下游为5'-TCCACCACCCTGTTGCTGAT-3';SDF-1 上游引物为5'-CCCTAACCAGTTAGCTTCATCC-3',下游为5'-GAGAAGCTCCAAAGCAAACC-3';CXCR4 上游引物为5'-TGAATGAGTGTCTAGGCAGGA-3',下游为5'-CACATTCTGGAGCGTTCAGT-3'.参照qPCR试剂盒(Cat:RR420A,Takara)说明书配置反应液,采用三步法进行实时荧光定量PCR 检测。应用7500 q-PCR仪(ABI,USA)对反应体系进行扩增:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,共40个循环,重复检测2次。
1.6 统计学方法实验数据应用IBM SPSS Statistics 20 进行分析处理,应用单因素方差分析检验各组之间SDF-1/CXCR4的mRNA是否存在差异,两两比较采用LSD检验;绘制Kaplan-Meier生存曲线比较植片的存活率。
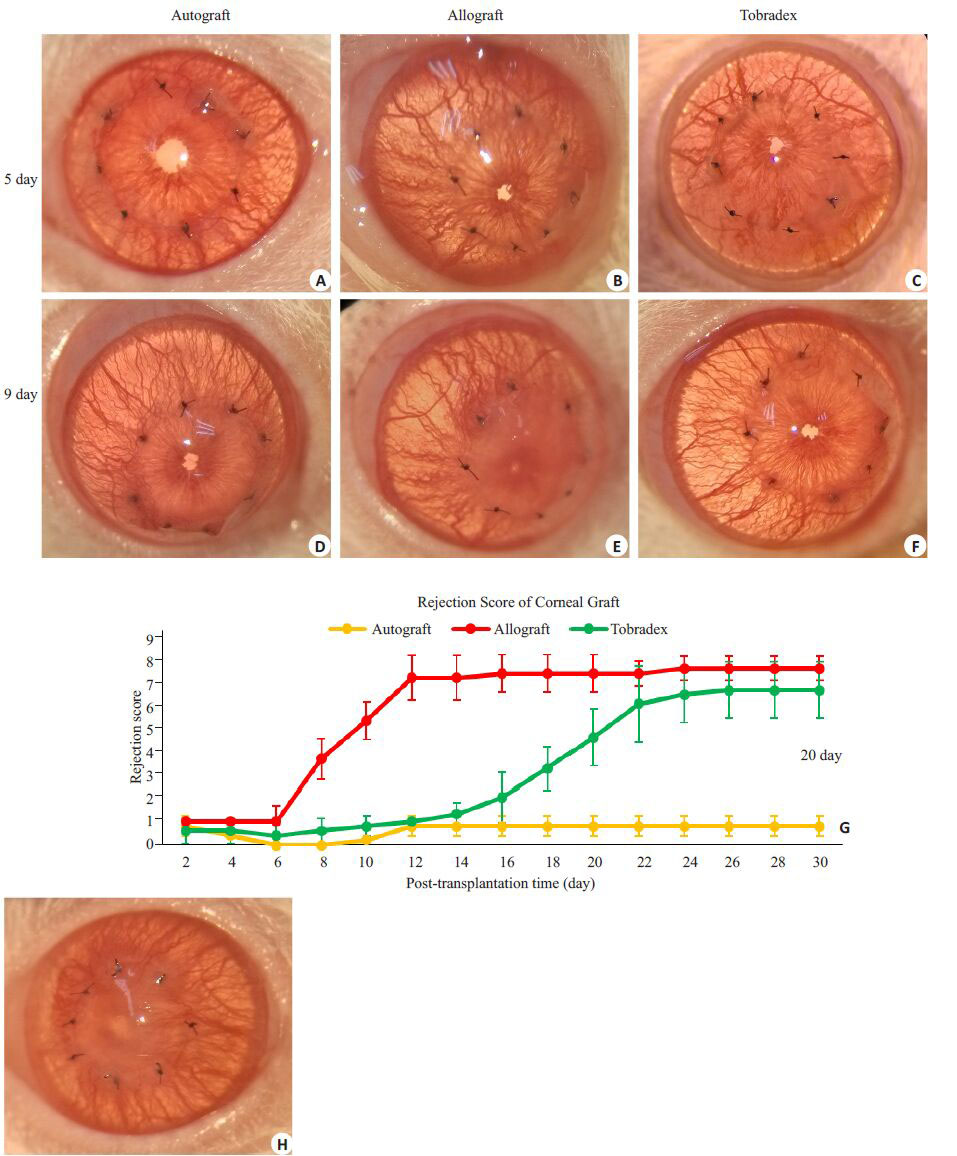
2 结果 2.1 排斥反应的临床观察术后7 d内,手术本身与缝线刺激等可产生炎症反应,手术各组角膜植片均出现轻微的一过性的水肿、混浊,未出现明显排斥现象。如图 1所示,术后5 d,自体组、异体组与典必殊组的角膜植片在显微镜下差异不明显,缝线周围均出现了少量新生血管,角膜植片均保持透明(图 1A~C).术后第8天开始,各组角膜植片呈现不同情况:自体组角膜植片在整个观察期内均保持透亮,未发生排斥反应,缝线及植片周围可见大量新生血管(图 1D);同种异体角膜移植组的角膜植片在第8天开始出现严重的水肿、混浊,虹膜纹理无法看清,瞳孔轮廓±稀可见,伴有大量的新生血管生成,部分象限新生血管长入植片中央,逐渐发生排斥反应(图 1E),植片的中位生存时间10±0.36 d.典必殊组的角膜植片在第9天±旧保持透明,缝线可见少量新生血管(图 1F),术后第20天开始出现水肿及混浊逐渐加重,然后出现排斥反应,植片的中位生存时间24±0.32 d.应用Kaplan-Meier检验,比较异体组与典必殊组角膜植片平均存活时间,差异有统计学意义(χ2=21.60,P<0.001)。
|
图 1 角膜移植术后不同处理组之间角膜植片情况 Figure 1 Corneal grafts after transplantation in different groups |
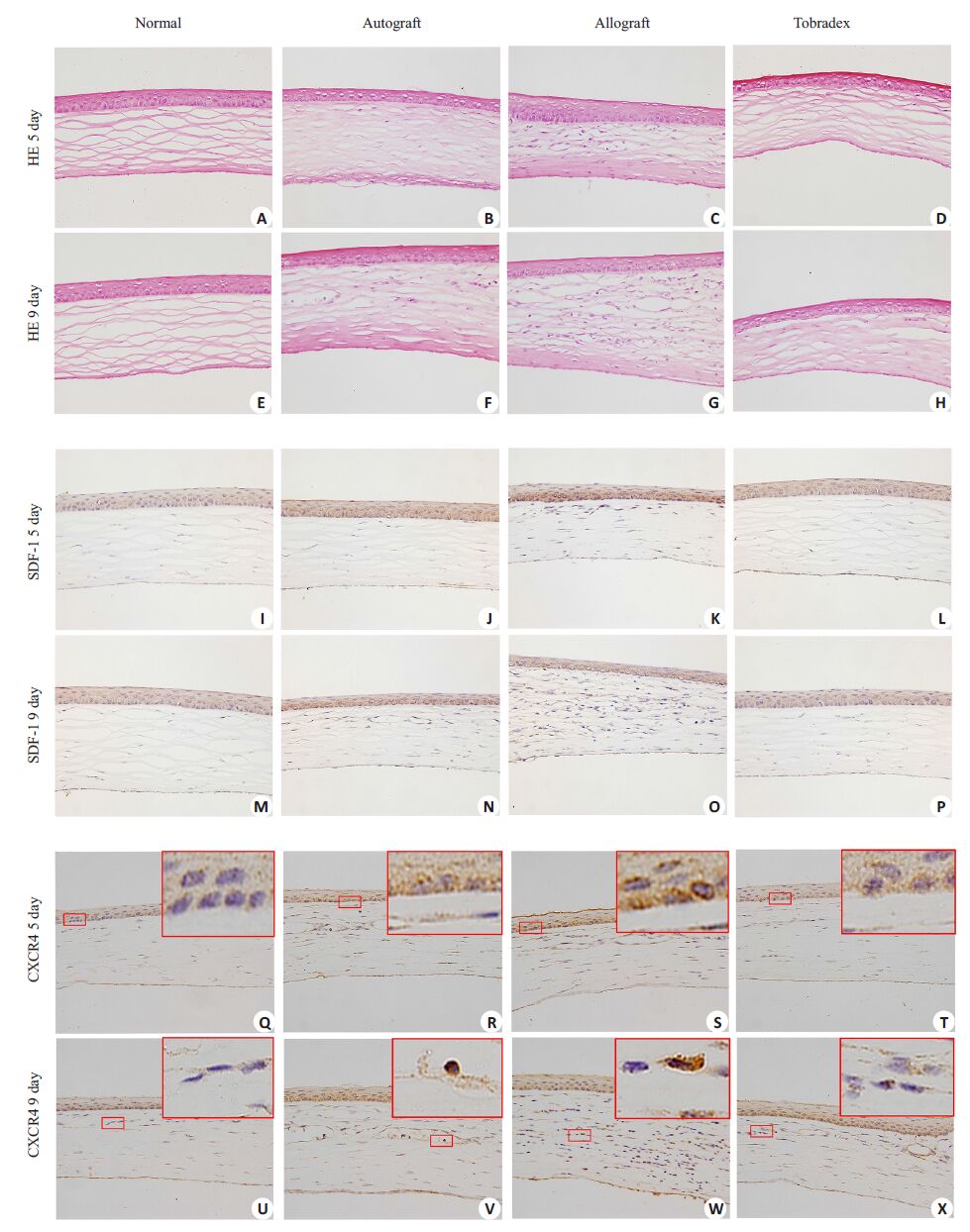
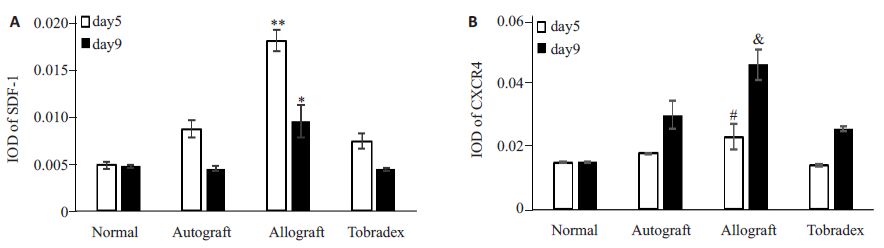
如图 2A、E,HE染色结果显示,正常组大鼠角膜各层结构清楚,无血管及淋巴细胞浸润。术后第5天,自体角膜移植组中角膜各层结构清楚,基质层可见个别炎性细胞浸润(图 2B);异体角膜移植组角膜植片可见较多炎性细胞细胞浸润,未见明显新生血管管腔(图 2C);典必殊组角膜结构正常,未见明显血管腔及淋巴细胞浸润(图 2D).术后第9天,自体组角膜植片炎性细胞较5天时多,基质层可见明显新生血管管腔(图 2F);异体组角膜植片可见大量炎性细胞浸润,角膜结构紊乱,基质层可见明显新生血管管腔(图 2G);典必殊组可见少量新生血管管腔,基质层有少量炎性细胞浸润(图 2H).免疫组化结果显示,SDF-1在正常大鼠角膜中有少量表达(图 2I、M);自体组、异体组与典必殊组SDF-1阳性染色程度均比正常组高,其中异体组阳性染色程度最强,特别在上皮层,呈现强阳性(图 2K、O).术后第9天,各组角膜植片上皮层中的SDF-1阳性染色程度均明显低于第5 天,而基质层SDF-1 阳性程度稍高于第5 天。CXCR4在正常大鼠角膜上皮层个别细胞表面可见少量表达(图 2Q、U);在术后第5天自体组与异体组的角膜上皮可见少数阳性染色细胞(图 2R、S);术后第9天,自体组与典必殊可见少量阳性染色细胞(图 2V、X),异体组可见大量阳性染色细胞,主要分布在基质层跟上皮层(图 2W).利用Image-Pro Plus软件进行半定量分析发现术后第5 天异体组的SDF-1 IOD(Mean)为0.0174±0.0010,远高于术后第5 天典必殊组的0.0071±0.0007(P<0.01,图 3A)及术后第9天异体组的0.0921±0.0017(P<0.01).术后第9天异体组的CXCR4 IOD(Mean)为0.0449±0.0047,远高于术后第9天典必殊组的0.0251±0.0007(P<0.05)及术后第5天异体组的0.0225±0.0038(图 3B).
|
图 2 各组术后第5天和第9天角膜植片的组织病理石蜡切片HE染色和免疫组化石蜡切片镜下照片 Figure 2 HE staining (A-H) and immunohistochemistry for SDF-1 (I-P) and CXCR4 (Q-X) of the corneal grafts on posttransplant day 5 and 9 (Original magnification: ×400). The inserts on the upper left corners in Q-X represent magnified images (×20) of the areas in red box |
|
图 3 为各组大鼠各组术后第5天和第9天角膜植片的免疫组化半定量结果 Figure 3 Mean optical density (IOD) of immunohistochemistry SDF-1 (A) and CXCR4 (B) in different groups on days 5 and 9. *P<0.05 vs the other groups on day 9; **P<0.01 vs the other groups on day 5 and vs allograft group on day 9; &P<0.05 vs the other groups on day 9 and vs allograft group on day 5; #P<0.05 vs normal and Tobradex groups on day 5 |
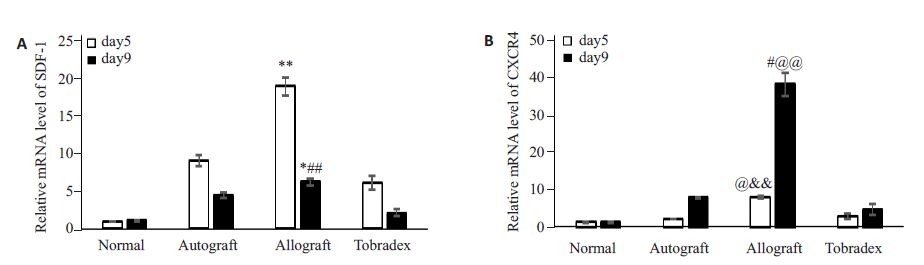
术后第5 天,自体组、异体组、典必殊组SDF-1 的mRNA表达量均高于正常组,其中异体组最高(与其他3组比均P<0.001);术后第9天趋势与第5天相同,但各组SDF-1 mRNA表达均比第5 天低(P<0.05,图 4A).术后第5天,CXCR4 mRNA在正常组、自体组、典必殊组表达无统计学差异,在异体组表达显着增高(P<0.05);术后第9 天,CXCR4 mRNA在自体组、异体组、典必殊组的表达水平均高于正常组,其中异体组最高(P<0.01);术后第9天,各组CXCR4 mRNA的表达水平均高于术后第5 天(自体组、异体组P<0.01,典必殊组P<0.05,图 4B).
|
图 4 术后第5天、第9天,各组大鼠角膜植片中SDF-1、CXCR4 mRNA的相对表达量 Figure 4 Relative mRNA expression levels of SDF-1 (A) and CXCR4 (B) in the groups on days 5 and 9 (n=3). *P<0.05 vs normal group on day 9; **P<0.01 vs the other groups on day 5 and vs allograft group on day 9; ##P<0.01 vs normal and TobraDex group on day 9 and vs allograft group on day 5; #P<0.05 vs normal and autograft group on day 9 and vs allograft group on day 5; @@P<0.01 vs TobraDex group on day 9; @P<0.05 vs TobraDex group on day 5 and allograft group on day 9; @@P<0.01 vs normal and autograft groups on day 5 |
角膜移植术后免疫排斥反应是一类以T 细胞介导为主,多种免疫细胞及免疫分子共同参与调节的复杂的免疫应答过程。角膜移植术后的免疫应答过程主要有感应阶段、免疫细胞增殖与活化阶段和效应阶段[13-14].趋化因子是一类结构相似、对某些细胞具有定向趋化作用的小分子(8~10 000)蛋白质。趋化因子受体属于7次跨膜的G蛋白偶联受体超家族。根据结合趋化因子的种类分为CXCR 类、CCR 类、CR 类和CX3CR类。CXCR4 属于CXCR 类趋化因子受体,是趋化因子SDF-1 的特异性受体。SDF-1 与CXCR4 特异性结合后,可通过G蛋白±赖的转导通路和非G蛋白±赖的转导通路,来介导免疫细胞的的成熟及趋化[3, 5, 15-16].
在角膜碱烧伤领域,已有研究发现SDF-1/CXCR4在角膜组织中有表达,并参与角膜新生血管的形成[17-19];在免疫学领域,有研究表明CXCR4主要表达在淋巴细胞、单核细胞、中性粒细胞表面,SDF-1对这些细胞的成熟及游走中起着重要作用[20-23];在造血干细胞移植模型中,发现用AMD3100阻断SDF-1/CXCR4通路后能显着提高宿主存活率[24].在胰腺移植、肾移植、动脉移植等研究领域,发现阻断SDF-1/CXCR4 通路后能提高移植物的存活时间[6-8, 25-26].由于角膜的解剖位置特殊,导致其存在前房相关的免疫偏离,移植术后的免疫反应也跟其他实体器官不尽相同[10].然而搜索国内外相关研究,SDF-1/CXCR4在角膜移植领域±旧是一片空白。
本研究首次探讨SDF-1/CXCR4 在大鼠角膜移植术后排斥反应中的作用,发现在排斥组的大鼠角膜中,SDF-1与CXCR4表达均明显增高,用典必殊处理后,排斥反应得到缓解,SDF-1 与CXCR4 的表达也相应下降。因此我们认为SDF-1/CXCR4 可能参与了大鼠角膜移植术后的排斥反应过程。在术后第5天与第9天这两个观察时间点中,我们发现术后第5天SDF-1在角膜植片中的含量明显上升,术后第9天呈下降趋势。因此我们认为SDF-1主要参与了角膜移植早期的排斥反应过程。利用免疫组化来研究这两个蛋白的表达位置,我们发现术后第5天排斥组SDF-1主要在角膜上皮层表达,CXCR4阳性细胞在术后第5天也只出现在角膜上皮层;术后第9天,排斥组角膜上皮层表达的SDF-1稍减少,在基质层表达增加,CXCR4阳性细胞也大量出现在基质层。因此我们认为,SDF-1在诱导CXCR4+细胞成熟及朝着排斥部位趋化方面起到了重要作用,而且SDF-1/CXCR4可能是介导上皮型和基质型角膜移植排斥反应的重要分子。与异体组相比,典必殊组的新生血管数量明显减少,结合前人在角膜碱烧伤领域的研究,我们还认为SDF-1/CXCR4 可能参与了角膜植片新生血管的生成,破坏了角膜的免疫赦免,进一步促进排斥反应的发生。当然,要明确SDF-1/CXCR4的具体作用可能需要我们特异性阻断SDF-1/CXCR4 或者用SDF-1/CXCR4基因敲除模型进行实验,才能得出比较准确的结论。这是本研究的不足之处,也是我们课题组今后的一个研究方向。
综上所述,本研究首次在角膜移植领域探讨SDF-1/CXCR4 的作用,并发现SDF-1/CXCR4 可能参与了大鼠角膜移植术后早期的排斥反应,其机制可能为SDF-1特异性诱导CXCR4+细胞成熟及朝着排斥部位趋化,并促进角膜新生血管形成。
| [1] | Vacchini A, Locati M, Borroni EM. Overview and potential unifying themes of the atypical chemokine receptor family[J]. J Leukoc Biol, 2016, 99 (6): 883-92. DOI: 10.1189/jlb.2MR1015-477R. |
| [2] | Zweemer AJ, Toraskar J, Heitman LH. Bias in chemokine receptor signalling[J]. Trends Immunol, 2014, 35 (6): 243-52. DOI: 10.1016/j.it.2014.02.004. |
| [3] | 杨志峰, 杨清玲, 陈昌杰. 趋化因子SDF-1及受体CXCR4研究进展[J]. 分子诊断与治疗杂志, 2011, 3 (1): 11-3. |
| [4] | 杨飞华, 龙北国, 谭毅, 等. CXCR4特异性拮抗剂SDF-1P2G54的构 建及活性评价[J]. 南方医科大学学报, 2012, 32 (1): 55-60. |
| [5] | Hummel S, Van Aken H, Zarbock A. Inhibitors of CXC chemokine receptor type 4[J]. Curr Opin Hematol, 2014, 21 (1): 29-36. DOI: 10.1097/MOH.0000000000000002. |
| [6] | Fiorina P, Jurewicz M, Vergani A, et al. Targeting the CXCR4-CXCL12 axis mobilizes autologous hematopoietic stem cells and prolongs islet allograft survival via programmed death ligand 1[J]. J Immunol, 2011, 186 (1): 121-31. DOI: 10.4049/jimmunol.1000799. |
| [7] | Thomas MN, Kalnins A, Andrassy M, et al. SDF-1/CXCR4/CXCR7 is pivotal for vascular smooth muscle cell proliferation and chronic allograft vasculopathy[J]. Transpl Int, 2015, 28 (12): 1426-35. DOI: 10.1111/tri.12651. |
| [8] | Gao C, Huan J. SDF-1 plays a key role in chronic allograft nephropathy in rats[J]. Transplant Proc, 2008, 40 (5): 1674-8. DOI: 10.1016/j.transproceed.2008.03.129. |
| [9] | Yu T, Rajendran V, Griffith M, et al. High-risk corneal allografts:A therapeutic challenge[J]. World J Transplant, 2016, 6 (1): 10. DOI: 10.5500/wjt.v6.i1.10. |
| [10] | Niederkorn JY. Corneal transplantation and immune privilege[J]. Int Rev Immunol, 2013, 32 (1): 57-67. DOI: 10.3109/08830185.2012.737877. |
| [11] | Pedram HQ. Corneal allograft rejection: immunopathogenesis to therapeutics[J]. J Clin Cell Immunol, 2013, 14 (1): 66-87. |
| [12] | Larkin DF, Calder VL, Lightman SL. Identification and characterization of cells infiltrating the graft and aqueous humour in rat corneal allograft rejection[J]. Clin Exp Immunol, 1997, 107 (2): 381-91. DOI: 10.1111/cei.1997.107.issue-2. |
| [13] | Ziaei M, Sharif-Paghaleh E, Manzouri B. Pharmacotherapy of corneal transplantation[J]. Expert Opin Pharmacother, 2012, 13 (6): 829-40. DOI: 10.1517/14656566.2012.673588. |
| [14] | Amouzegar A, Chauhan SK, Dana R. Alloimmunity and tolerance in corneal transplantation[J]. J Immunol, 2016, 196 (10): 3983-91. DOI: 10.4049/jimmunol.1600251. |
| [15] | Gebura K, Bogunia-Kubik K. Clinical relevance of chemokine receptor CXCR4[J]. Postepy Hig Med Dosw (Online), 2012, 66 (23): 252-66. |
| [16] | Allegretti M, Cesta MC, Garin AA. Current status of chemokine receptor inhibitors in development[J]. Immunol Lett, 2012, 145 (1/ 2, S): 68-78. |
| [17] | 彭亮红, 柳林. 碱烧伤小鼠角膜组织中SDF-1/CXCR4的表达及意义[J]. 眼科研究, 2010, 28 (2): 135-9. |
| [18] | 蔡琴华. SDF-lα/CXCR4信号对角膜新生血管形成的作用及其可能 机制[D]. 苏州: 苏州大学, 2012. |
| [19] | 李鹏程, 王国军, 胡燕华, 等. SDF-1和CXCR4在鼠角膜碱烧伤新生 血管中的表达[J]. 眼科新进展, 2010, 30 (9): 832-6. |
| [20] | Nagafuchi Y, Shoda H, Sumitomo S, et al. Immunophenotyping of rheumatoid arthritis reveals a linkage between HLA-DRB1 genotype, CXCR4 expression on memory CD4(+ ) T cells, and disease activity[J]. Sci Rep, 2016, 6 (4): 29338. |
| [21] | Zemani F, Silvestre JS, Fauvel-Lafeve F, et al. Ex vivo priming of endothelial progenitor cells with SDF-1 before transplantation could increase their proangiogenic potential[J]. Arterioscler Thromb Vasc Biol, 2008, 28 (4): 644-50. DOI: 10.1161/ATVBAHA.107.160044. |
| [22] | Holdfeldt A, Winther M, Gabl M, et al. Data on human neutrophil activation induced by pepducins with amino acid sequences derived from β2AR and CXCR4[J]. Data Brief, 2016, 8 (1): 411-4. |
| [23] | Bryant J, Ahern DJ, Brennan FM. CXCR4 and vascular cell adhesion molecule 1 are key chemokine/adhesion receptors in the migration of cytokine-activated T cells[J]. Arthritis Rheum, 2012, 64 (7): 2137-46. DOI: 10.1002/art.v64.7. |
| [24] | Kang YB, Chen BJ, Deoliveira D, et al. Selective enhancement of donor hematopoietic cell engraftment by the CXCR4 antagonist AMD3100 in a mouse transplantation model[J]. PLoS One, 2010, 5 (6): e11316. DOI: 10.1371/journal.pone.0011316. |
| [25] | Chen T, Yuan J, Duncanson S, et al. Alginate encapsulant incorporating CXCL12 supports Long-Term allo- and xenoislet transplantation without systemic immune suppression[J]. Am J Transplant, 2015, 15 (3): 618-27. DOI: 10.1111/ajt.13049. |
| [26] | Roux N, Leveque S, Freguin-Bouilland CA, et al. A kinetic study of SDF-1, VEGF and MCP-1 blood and tissue levels after aortic transplantation in mice[J]. Acta Histochem, 2012, 114 (6): 636-8. DOI: 10.1016/j.acthis.2011.10.001. |
 2016, Vol. 36
2016, Vol. 36

