小儿复杂先天性心脏病(CCHD)是一类包括法乐四联症、肺动脉闭锁、右室双出口、大动脉转位等复杂心血管畸形的疾病;小儿重症CHD除前述CCHD外还包括心内畸形合并严重肺血管损害,包括肺高压型损害或肺血管发育不良,单纯心血管畸形合并心功能不全及低体重儿[1]。本研究以CCHD来代指重症及复杂先天性心脏病。这类患儿围手术期并发症的发生率和死亡率都比单纯性先心病要高得多,其救治成功率是检验一个单位先天性心脏病治疗水平的重要指标。急性呼吸窘迫综合征(ARDS)是心脏手术及体外循环术后的常见并发症,李胜利等[2]报道法乐四联症术后ARDS发生率为7.6%,陈霞等[3]报道22例单侧肺动脉缺如的法乐四联症患儿,术后全部发生ARDS,Gajic等[4]报道的心脏手术后ARDS的发生率可高达20%。但对于重症及复杂先心的患儿,检索国内外文献并未有大样本的研究这类患儿术后ARDS发生情况的相关报道。在临床上,这类患儿往往病情危重,畸形复杂,手术难度大,术中体外循环容易造成肺血管缺血再灌注损伤[5],因此ARDS的发生并不少见,这大大增加了术后处理的难度,延长机械通气时间及ICU滞留时间,是影响患儿生存率的严重并发症。为提高对重症及复杂先心病术后ARDS的临床认识及处理,本研究回顾性分析了本院外科ICU2009年1月~2014年5月收治的155例重症及复杂先天性心脏病患儿的资料,采用多因素Logistic回归分析的方法探讨术后发生ARDS的危险因素,为预防和治疗该并发症提供依据,从而有助于提高该类患儿的救治水平。
1 资料和方法 1.1 研究对象初筛入选本组重症及复杂先天性心脏病患儿共176例,于2009年1月~2014年5月收住我院心外科,临床资料完整,皆行一期矫正术。参照ARDS柏林定义[6],符合下列标准的判定为ARDS:(1)1周之内急性起病或加重;(2)PEEP≥5 cm H2O 的情况下氧合指数≤300 mmHg;(3)病情不能完全用心功能不全或液体过负荷来解释;(4)胸部X片提示双肺浸润影,且不能由胸腔积液、结节、肿块、肺叶塌陷所完全解释。轻度、中度及重度ARDS的判定按柏林定义的标准。
排除标准:(1)术后24 h内死亡;(2)病程中主要表现为心功能不全;(3)1周后发病或出现病情加重;(4)年龄大于12岁。排除以上患儿后入选155例,将术后发生ARDS的患儿80例作为病例组(Ⅱ组),未发生ARDS的患儿75例作为对照组(Ⅰ组),其中Ⅱ组即ARDS组又分为轻度、中度及重度3个亚组(Ⅱa组为轻度ARDS组27例,Ⅱb为中度ARDS组25例,Ⅱc为重度ARDS组28例)。本研究采用的临床观察指标主要在Ⅰ组和Ⅱ组之间进行对比分析,部分观察指标在Ⅰ组和Ⅱ组的3个亚组(Ⅱa、Ⅱb、Ⅱc)之间进行分析。155例患儿中男性86例,女性69例,小于3个月24例,大于3个月131例,体质量<5 kg的30例,体质量≥5 kg的125例。肺动脉闭锁,法乐氏四联症及VSD,ASD,PDA合并肺动脉高压患儿共118例,而其中重度肺动脉闭锁16例,重度法乐氏四联症(肺血管发育差)25例,合并中度以上肺动脉高压的44例。患儿的病种分布见表 1。
| 表 1 两组患儿病种分布 Table 1 Disease distribution in the two groups of patients |
手术在气管插管全麻、低温、体外循环下进行,一期行心内直视手术进行畸形矫正,术后入SICU常规呼吸机辅助呼吸,均应用小剂量多巴胺、多巴酚丁胺、肾上腺素、米力农或硝普钠维持血流动力学稳定,监测电解质、血气分析,维持内环境稳定,抗生素预防感染,并行床旁胸片和心脏彩超评估肺部和心功能情况。患儿出现ARDS多数在术后早期,72 h内发生者居多,患儿表现为烦躁、呼吸困难、顽固性低氧血症,临床上不能完全用心功能不全或液体过负荷来解释,胸部X片提示双肺不均质浸润,机械通气下肺顺应性明显降低,随着病情的进展有些患儿会出现严重循环功能障碍及多脏器功能衰竭,本组患儿有17例因严重ARDS合并多脏器功能衰竭而死亡。
1.3 临床观察指标未出现ARDS的患儿75 例归入Ⅰ组,出现ARDS 的患儿80例归入Ⅱ组,其中Ⅱ组又按ARDS程度分为轻度、中度及重度3个亚组(Ⅱa、Ⅱb及Ⅱc)。选取围手术期的下列临床指标做为观察项目:性别、年龄、体质量、术前氧分压、术前二氧化碳分压、术前血白蛋白、术前血肌酐、术前左室射血分数、术前肺动脉压、术前合并肺部感染、术前合并凝血异常、术前血红蛋白、术中主动脉阻断时间(ACC)、体外循环时间(CPB)、手术时间、术中出血量/kg、术中输液总量/kg、术中输血总量/kg、术中出入量平衡情况/kg、术中平均小时尿量/kg、术后早期血清球蛋白、术中畸形矫正是否完全、术后肺高压情况、术后8 h胸液量/kg、术后8 h输血量/kg、术后8 h平均小时尿量/kg、术后早期高热、术后血白蛋白、术后血肌酐、术后起始乳酸值、术后24 h 最大乳酸增高率、术后24 h BNP、机械通气时间、ICU住院时间、术后呼吸机相关肺炎(VAP)发生、28 d死亡、术后24 h降钙素原(PCT)、术后24 h C-反应蛋白(CRP)、术后24 h 血清前白蛋白(PA),以上共39项临床指标在两组间进行观察。其中机械通气时间、ICU住院时间、术后呼吸机相关肺炎发生、28 d死亡这4项指标不是ARDS发生的原因,仅作为预后相关观察指标在两组之间进行比较,涉及出血量或液体量的除以公斤体质量进行标准化。术后患儿连续监测24 h的乳酸动态变化,借鉴Schumacher[7]的方法留取患儿术后初始乳酸值,并计算24 h之内的最大乳酸增高率,乳酸增高率=连续测量的乳酸差值/两值之间的时间间隔,最大乳酸增高率=最大的两个连续测量值的差值/时间间隔。
1.4 统计学方法应用SPSS 19.0统计软件,对各临床指标变量先进行单因素分析,连续变量采用t检验,多组间比较采用单因素方差分析,分类变量采用卡方检验,然后将单因素分析中有统计学意义的变量纳入多因素Logistic回归分析,选择后退法筛选危险因素,引入标准:P<0.05;剔除标准:P>0.10。P<0.05做为显著性标准。
2 结果分析纳入研究的患儿资料,出现ARDS的患儿多集中于以下病种:合并中度以上肺动脉高压的先心、重症法乐四联症、重度肺动脉闭锁,这3 种占所有患儿的54.8%,其他则为一些少见的复杂先心。纳入研究的本组患儿ARDS发生率为51.6%。
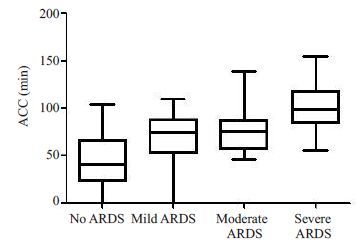
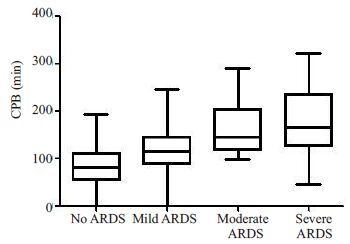
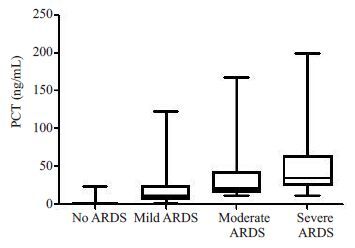
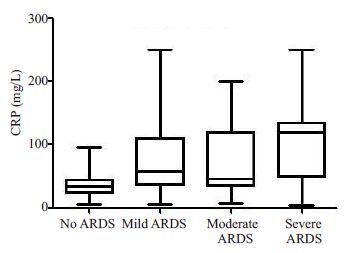
单因素分析提示,两组患儿的体质量、术前二氧化碳分压、术前左室射血分数、术后早期球蛋白、ACC、CPB,手术时间、术中出血量/kg、术中输血总量/kg、术后8 h胸液量/kg、术后8 h输血量/kg、术后初始乳酸值、术后24 h最大乳酸增高率、术后血白蛋白、术后血肌酐、术后早期BNP、术后24 h PCT、术后24 h CRP、术后24 h 血清前白蛋白、机械通气时间、ICU住院时间、年龄分布、肺动脉压、术前肺部感染、术前凝血异常、28 d死亡以及术后VAP发生等均有显著性差异(P<0.05,表 2)。其中ACC时间、CPB 时间、术后24 h PCT、术后24 h CRP在Ⅰ组和Ⅱ组的3个亚组(Ⅱa、Ⅱb、Ⅱc)之间具有逐渐增高的趋势(图 1~4),这4个指标采用单因素方差分析评估在4 个组之间的差异,其结果具有显著意义(P<0.05,表 3)。
| 表 2 两组患儿的单因素分析结果 Table 2 Univariate analyses of the two groups of patients |
|
图 1 ACC时间在各组的变化 Figure 1 Comparison of ACC time among different groups. |
|
图 2 CPB时间在各组的变化 Figure 2 Comparison of CPB time among different groups. |
|
图 3 术后PCT在各组的变化 Figure 3 Comparison of postoperative PCT among different groups. |
|
图 4 术后CRP在各组的变化 Figure 4 Comparison of CRP among different groups. |
| 表 3 多组间比较的单因素方差分析 Table 3 One-way ANOVAamong the 4 subgroups |
将VAP发生、28 d死亡、机械通气时间及住ICU时间这4项预后因素剔除后,将单因素分析有显著意义的其余因素纳入多因素Logistic 回归分析,Logistic 回归分析结果表明术中ACC时间、CPB时间、术后24 h最大乳酸增高率、术后24 h PCT及术中出血量是ARDS发生的独立危险因素(表 4)。
| 表 4 各危险因素的Logistic回归分析 Table 4 Logistic regression analysis of the risk factors for ARDS |
先天性心脏病是新生儿出生缺陷的首要原因,国内刘凯波[8]报道发生率为0.8%左右,每年新出生先心病18~22万人,而其中复杂先天性心脏病及CCHD由于纠治难度大,手术并发症发生率及死亡率高,一直是先心病治疗的重点及难点,也是考验一个单位先心病治疗水平的主要指标。ARDS是先心病围手术期常见的并发症,其发生与患儿原发病的畸形复杂程度、手术创伤应激、体外循环、术后肺部血流动力学改变、输血等多种综合因素导致肺损伤等因素相关[9]。目前国内外文献并没有ARDS在CCHD术后发生率的大宗报道,李胜利等[2]在法乐四联症患儿中发现ARDS发生率为7.6%,Gajic等[4]报道的心脏手术后ARDS的发生率可达20%,本组患儿发生率达51.6%,分析可能原因为本组患儿合并中度以上肺动脉高压、重度肺动脉闭锁以及重症法乐四联症的比例较高,这3种合并中重度畸形的患儿占入选患儿数的54.8%,因此手术后并发ARDS的比例必然比单纯或单病种的先心病要高得多。
本研究通过多因素Logistic回归分析多项临床指标与CCHD 术后发生ARDS 的关系,结果发现术中ACC时间、CPB时间、术后24 h最大乳酸增高率、术中出血量以及术后24 h PCT值是ARDS发生的独立危险因素。ARDS实质是全身炎症反应综合征对肺部所造成的损伤,造成肺血管内皮细胞损伤、呼吸屏障受损及呼吸膜通透性增加[10]。Alten等[11]研究发现,肺表面活性物质缺乏或失活是ARDS的主要病理机制,产生肺不张与肺内分流,减少肺容积与肺顺应性,CPB导致肺表面活性蛋白缺失与失活,伴随肺间质水肿,肺泡蛋白增加,造成肺萎陷。Güvener等[12]的研究发现,CPB时间、低体质量以及术前诊断右向左分流是先心病术后发生全身炎症反应综合征的独立危险因素,并且也是死亡率增高的危险因素。李胜利等[2]也发现,先心病术后ARDS 的危险因素为炎症反应以及体外循环损伤。Hammer等[13]研究发现,术中ACC时间长的患儿PCT 升高明显,直到术后第4天才下降,同一研究还发现,循环IL-6水平也与ACC时间密切相关,而主动脉阻断是机体所能承受的最强烈的生理及代谢性应激因素。本研究也发现,ACC时间与术后的PCT 增高都与术后ARDS的发生密切相关,ACC时间的相对危险度OR值为4.376,PCT的相对危险度OR值为3.127,说明ACC 时间延长使得ARDS的发生比率增高4.376倍,而PCT 增高的患儿其ARDS发生的比率增高3.127倍。这两个因素造成ARDS的内在机制可能为体外循环及主动脉阻断对机体特别是肺部造成缺血再灌注损伤并诱发剧烈炎症反应,造成肺血管通透性增加,Verheij等[14]研究发现,在CPB期间,高达60%的患者出现肺血管通透性增加。而ACC时间延长也相应使得CPB时间延长,这与外科医生的技术水平、疾病本身畸形的复杂程度及病情轻重所造成的手术难度增加有密切关系。Meisner等[15]也发现,体外循环时间和手术时间也与PCT的增高密切相关。李敏豪等[16]研究也发现,血清PCT可预测ARDS 的发生。在本研究中,重症及复杂先心病的患儿术后发生ARDS的比例很高,ACC时间、CPB时间、术后PCT 及CRP都随着ARDS的严重程度而呈现出明显的增加趋势,经过统计学分析,ACC时间、CPB时间、术后PCT 及CRP 在发生ARDS 与未发生ARDS 组之间,以及ARDS各亚组之间的差异都具有统计学意义,并且ACC 时间、CPB时间以及PCT是发生ARDS的独立危险因素,这与以上文献的结论基本一致。因此,对于由各种原因造成术中ACC时间及CPB时间延长的患儿,以及术后早期PCT增高明显的患儿,要密切关注术后发生ARDS的风险。
血乳酸水平是机体微循环灌注的反映,其可作为有效的临床指标来早期监测组织缺血并预测预后。在无氧环境下,细胞乳酸增加,导致血乳酸增高,高乳酸血症反映了组织氧债的增加。高乳酸血症是体外循环术后早期常见的代谢紊乱,既往的研究发现高乳酸血症的患儿常具有较高的并发症发生率和死亡率[17-18]。Ghaffari 等[19]研究也发现,连续监测血乳酸水平对于先心病的术后管理是至关重要的,术后24 h内持续增高的动脉血乳酸水平(>4 mmol/L)会大大增加死亡率。过去的研究多采用术后初始乳酸水平、乳酸峰值或乳酸清除率来对乳酸进行动态监测。但初始乳酸水平仅能反映术后当时的病理生理变化,乳酸峰值也非最好的临床指标,乳酸清除率虽然预测价值较好,但如术后乳酸持续增高时则应用价值有限。Schumacher[7]等对231例先心病患儿术后24 h的动脉血乳酸进行连续监测,结果发现在预后差组的患儿中,术后初始乳酸值中位数为6.2 mmol/L,术后24 h乳酸峰值的中位数为10.9 mmol/L,而最大乳酸增高率的中位数为2 mmol/(L·h),而在预后良好的患儿组,相应值的中位数分别为2.0 mmol/L、2.4 mmol/L 及0.25 mmol/L/h。在本研究中发现,出现ARDS的患儿的血乳酸在术后会呈现不断增高的趋势,此时使用传统的乳酸清除率来监测乳酸水平变化则不太合适,因此本研究借鉴Schumacher[7]的方法,将术后初始乳酸值与24 h内的动态乳酸增高率相结合,结果发现,无ARDS 的患儿的初始乳酸中位数为2.25 mmol/L,最大乳酸增高率中位数为0.22 mmol/(L·h),而ARDS组的相应值的中位数则分别为6.85 mmol/L 及2.25 mmol/L/h,与Schumacher[7]的结果较为接近。并且在本研究中,这两个指标在两组患者中的对比都具有显著意义,并且术后24 h的最大乳酸增高率也为ARDS发生的独立危险因素,说明小儿CCHD术后连续动态监测乳酸增高率并计算最大乳酸增高率可以用来预测术后并发症特别是ARDS的发生,从而有助于早期预警并采取早期干预措施。
本研究还发现,术中的大量出血与CCHD患儿术后ARDS密切相关,出血后为维持有效循环血容量需要及时输入大量的血液制品。输血容易造成输血相关性急性肺损伤,在输血后6 h 内出现的急性低氧血症(PO2/FiO2<300 mmHg)和影像学上的双侧肺浸润,肺毛细血管嵌顿压<18 mmHg,并且无左心功能不全的证据[20]。Vlaar等[21]研究认为,心脏手术是输血相关性急性肺损伤发生的一个独立危险因素。陈柏成等[22]研究也发现,术后胸液引流多、术后输血量大等是心内直视手术后发生ARDS的危险因素。术中大量出血而补液及输血量又相对不足,会导致有效循环血容量减少及肾灌注不足,容易出现急性肾前性肾功能不全、液体潴留、肺水增加从而影响肺部气体交换。Ware等[23]研究发现,库存血液中的白细胞、血小板碎片和变性蛋白等会形成20~400 μm的微聚物,进入体内会广泛阻塞肺毛细血管,直接造成肺损伤。本研究也证实,术中大量出血及由此造成的大量输血与术后ARDS的发生有密切关系,并且术中大量出血是CCHD术后ARDS发生的独立危险因素。
在本研究中,发生ARDS的这组患儿的机械通气时间明显长于未发生ARDS的这组患儿,并且ICU住院时间也相应延长很多,且死亡患儿都出现在ARDS组,ARDS组的VAP发生率也大大高于无ARDS组,因此ARDS是CCHD患儿术后严重影响其预后的并发症,文献报道心脏术后ARDS具有极高的死亡率,甚至可高达80%[24]。李胜利等[2]也发现ARDS是法乐四联症患儿根治术后死亡原因的首要因素,因此对于CCHD的围手术期处理,重视并防范ARDS的发生是提高CCHD纠治效果的重要步骤,结合本研究的结果,对于术中各种原因造成的ACC时间及CPB时间延长,术后24 h内最大乳酸增高率明显增高、PCT增高以及术中大量出血的患儿,具有发生ARDS的高风险,必须早期加以重视并及时采取有效措施。而这5 个独立危险因素中,ACC时间、CPB时间、术中出血量与手术操作直接相关,ACC 时间长与术后PCT增高关系密切,术后乳酸水平的变化也与围手术期循环的稳定状况有关,因此提高手术操作技巧,尽量缩短手术时间也能减少ARDS的发生。
| [1] | 刘迎龙. 我国小儿重症及复杂先天性心脏病治疗的进展[J]. 继续医学教育, 2006, 20 (10): 8-12. |
| [2] | 李胜利, 王旭, 贺彦, 等. 小儿法洛四联症根治术后急性呼吸窘迫综合征危险因素分析[J]. 北京医学, 2009, 31 (4): 208-10. |
| [3] | 陈霞, 刘迎龙, 王旭, 等. 法洛四联症合并单侧肺动脉缺如术后呼吸窘迫综合征[J]. 中国胸心血管外科临床杂志, 2001, 8 (3): 209-10. |
| [4] | Gajic O, Dabbagh O, Park PK, et al. Early identification of patientsat risk of acute lung injury: evaluation of lung injury predictionscore in a multicenter cohort study[J]. Am J Respir Crit Care Med, 2011, 183 (4): 462-70. DOI: 10.1164/rccm.201004-0549OC. |
| [5] | Cornet D, Kingma D, Trof J, et al. Hepatosplanchnic ischemia/reperfusion is a major determinant of lung vascular injury afteraortic surgery[J]. J Surg Res, 2009, 157 (1): 48-54. DOI: 10.1016/j.jss.2008.09.021. |
| [6] | Ranieri VM, Rubenfeld GD, Thompson B, et al. Acute respiratorydistress syndrome the Berlin definition[J]. JAMA, 2012, 307 (23): 2526-33. |
| [7] | Schumacher R, Reichel A, Vlasic R, et al. Rate of increase in serumlactate level risk-stratifies infants after surgery for congenital heartdisease[J]. J Thorac Cardiovasc Surg, 2014, 148 (2): 589-95. DOI: 10.1016/j.jtcvs.2013.09.002. |
| [8] | 刘凯波, 张雯, 徐宏燕, 等. 2007年-2012年北京市先天性心脏病监测资料分析[J]. 中国优生与遗传杂志, 2013, 21 (12): 128-42. |
| [9] | 李瑞冰, 郭立新, 贺焱. 41例先天性心脏病术后急性呼吸窘迫综合征的综合治疗[J]. 中国医师进修杂志, 2012, 35 (29): 62-3. |
| [10] | 刘改英, 林广, 刘颖, 等. 急性肺损伤/急性呼吸窘迫综合征新生儿血清Clara细胞分泌蛋白, 肺表面活性蛋白A变化的意义[J]. 中华实用儿科临床杂志, 2013, 28 (14): 1090-1. |
| [11] | Alten A, Borasino S, Pearce B, et al. Surfactant treatment forcongenital heart disease patients with acute respiratory distresssyndrome[J]. Congenit Heart Dis, 2010, 5 (6): 624-8. DOI: 10.1111/chd.2010.5.issue-6. |
| [12] | Güvener M, Korun O, Demirtürk S. Risk factors for systemicinflammatory response after congenital cardiac surgery[J]. J CardSurg, 2015, 30 (1): 92-6. |
| [13] | Hammer S, Fuchs T, Rinker C, et al. Interleukin-6 and procalcitonin inserum of children undergoing cardiac surgery withcardiopulmonary bypass[J]. Acta Cardiol, 2004, 59 (6): 624-9. DOI: 10.2143/AC.59.6.2005245. |
| [14] | Verheij J, van Lingen A, Raijmakers PG, et al. Effect of fluidloading with saline or colloids on pulmonary permeability, oedemaand lung injury score after cardiac and major vascular surgery[J]. Br J Anaesth, 2006, 96 (1): 21-30. |
| [15] | Meisner M, Rauschmayer C, Schmidt J, et al. Early increase ofprocalcitonin after cardiovascular surgery in patients withpostoperative complications[J]. Intensive Care Med, 2002, 28 (8): 1094-102. DOI: 10.1007/s00134-002-1392-5. |
| [16] | 李敏豪, 董超, 吴乾龙, 等. 血清降钙素原对小儿细菌性重症肺炎及并发急性呼吸窘迫综合征的预测价值[J]. 中华临床医师杂志: 电子版, 2015, 9 (12): 2300-3. |
| [17] | Maillet JM, Le BP, Cantoni M, et al. Frequency, risk factors andoutcome of hyperlactatemia after cardiac surgery[J]. Chest, 2003, 123 (5): 1361-6. DOI: 10.1378/chest.123.5.1361. |
| [18] | 吴莉莉, 段文元, 王振祥, 等. 婴幼儿先天性心脏病围手术期动脉血乳酸检测及分析[J]. 中国体外循环杂志, 2009, 7 (4): 211-3. |
| [19] | Ghaffari S, Malaki M. Arterial lactate level changes in first dayafter cardiac operation[J]. J Cardiovascul ThoracicRes, 2013, 5 (4): 143-5. |
| [20] | Silliman CC, Ambruso DR, Boshkov LK. Transfusion-related acutelung injury[J]. Blood, 2005, 105 (6): 2266-73. DOI: 10.1182/blood-2004-07-2929. |
| [21] | Vlaar AP, Binnekade JM, Prins D, et al. Risk factors and outcomeof transfusion-related acute lung injury in the critically ill: a nestedcase-control study[J]. Crit Care Med, 2010, 38 (3): 771-8. DOI: 10.1097/CCM.0b013e3181cc4d4b. |
| [22] | 陈柏成, 肖颖彬, 钱桂生, 等. 心内直视手术后急性呼吸窘迫综合征发生的危险因素[J]. 中华急诊医学杂志, 2006, 15 (5): 429-32. |
| [23] | Ware LB, Matthay M. The acute respiratory distress syndrome[J]. N Engl J Med, 2000, 342 (18): 1334-49. DOI: 10.1056/NEJM200005043421806. |
| [24] | Weissman C. Pulmonary complications after cardiac surgery[J]. Semin Cardiothorac Vasc Anesth, 2001, 8 (3): 185-211. |
 2016, Vol. 36
2016, Vol. 36

