2. 新乡医学院第一附属医院 口腔科,河南 卫辉 45310
2. Depatment of Stomatology, First Affiliated Hospital of XinxiangMedical University, Weihui 453100, China
食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)是人类常见的恶性肿瘤之一,占全身恶性肿瘤的2%,全世界每年ESCC新发病例约31.04万,而我国病例就达16.72万[1],我国是ESCC的高发国家,也是本病死亡率最高的国家。ESCC病因和发病机制尚未完全明确,目前认为胰岛素抵抗和活性氧自由基、脂质过氧化损伤在ESCC发病中起重要作用,并与环境因素、遗传因素密切相关[2-3]。幽门螺杆菌(H.pylori)作为消化系统最常见的感染细菌之一,其在慢性活动性胃炎消化性溃疡胃黏膜相关淋巴组织(MALT)淋巴瘤和胃癌等中的致病作用已得到证实[4-5]。近年研究还发现,H. pylori感染不仅与胃肠疾病相关,而且与一些胃肠以外的疾病也存在密切的相关性,可通过影响血脂代谢、胰岛素抵抗、炎症反应和氧化应激来参与其他部位恶性肿瘤的发生、发展[4]。过氧化物酶体增殖因子活化受体(peroxisomeproliferater-activatedreceptor, PPARs)是核激素受体配体激活的转录因子的超家族其中PPAR-γ2主要富含于脂肪组织,对维持人类胰岛素敏感性、葡萄糖稳态是不可缺少的,当PPAR-γ2基因突变或受其他因素抑制时,将导致胰岛素抵抗,促进ESCC等恶性肿瘤的进展[7]。烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶是机体产生活性氧自由基的关键酶,其活性变化将直接影响机体活性氧自由基水平,在恶性肿瘤的发生、发展中发挥重大作用[8]。PPAR-γ2、NADPH氧化酶基因具有多态性,即具有多个等位基因,不同的等位基因编码的PPAR-γ2或NADPH氧化酶活性有差异。PPAR-γ2或NADPH氧化酶基因的多态性可使机体对外界环境(如H. pylori感染)的反应能力有所不同,这是决定机体ESCC易感性的一个重要因素。PPAR-γ2、NADPH氧化酶基因多态性与ESCC易感性的研究日渐增多,但尚未见H. pylori感染与上述基因多态性的联合作用对ESCC易感性影响的报道。为了研究PPAR-γ2、NADPH氧化酶在当地人群中的分布状态,进而探索其和H. pylori感染相互作用与ESCC高发的关系,我们在国内首次开展了PPAR-γ2 和NADPH 氧化酶联合基因多态性与ESCC易感性关系的研究。
1 材料和方法 1.1 诊断标准根据Broder的分级标准,将ESCC分为Ⅰ~Ⅳ级[9]。Ⅰ级鳞癌:其中所含的非典型鳞状细胞低于25%,癌细胞团块边缘在一些部位可见基底细胞排列尚完整,而在另一些部位则排列紊乱,甚至没有基底细胞。此时癌细胞与周围的间质无明显分界,癌组织的细胞排列不规则,大小不等,有不少角珠。有的中心部位已完全角化,有的仅部分角化。Ⅱ级鳞癌:癌细胞团块与周围间质的境界不清,非典型鳞状细胞较Ⅰ级为多,约25%~50%,角化情况轻,仅有少数角珠,其中心多见角化不全。周围的炎症反应较Ⅰ级为轻。Ⅲ级鳞癌:有大量的非典型鳞状细胞,约50%~70%,角化情况不明显,或根本见不到。不见角珠,可见个别角化不良细胞。胞核不典型,有丝分裂象显著,周围炎症不明显,说明组织对癌细胞的反应已不强。Ⅳ级鳞癌:几乎整个癌组织的细胞均为非典型鳞状细胞,且无细胞间桥。有丝分裂象多,已完全看不到角化情况,如癌细胞呈梭形时,常呈旋涡状排列。
1.2 纳入标准(1)病理学确诊为ESCC;(2)年龄39~71岁,性别不限;(3)纳入研究时均为第1次就诊,未经任何化疗和放射治疗;(4)签署知情同意书。
1.3 排除标准(1)合并有其他系统良、恶性肿瘤或癌前病变;(2)合并免疫系统疾病;(3)服抗H. pylori药物史;(3)合并其他如心功能、肾功能不全、呼吸功能障碍等重大疾病者;合并局部或全身严重感染;(4)妊娠及哺乳期妇女;(5)合并精神疾病或严重神经官能症患者,或由于智力或语言障碍,不能表达主观不适症状,妨碍与研究者的交流与合作者。
1.4 一般资料按照上述的诊断、纳入和排除标准收集2010 年5月~2015年3月在新乡医学院第一附属医院门诊和病房收治的ESCC病例和同期健康体检者。各组按照年龄(±3)、性别、居住地进行1:1配对,包括BroderⅠ级组、BroderⅡ级组和BroderⅢ级组各200例,200例健康体检者作为对照组,均为豫北居民或在豫北10年及以上,各组性别比(男:女)均为127:73例;Ⅰ级组年龄41~68(49.25±11.46)岁;Ⅱ级组年龄40~69(49.42±9.83)岁;Ⅲ级组年龄42~68(48.74±12.26)岁;对照组年龄39~68(48.94±12.68)岁。4组在年龄、性别、民族和籍贯统计学处理差异无显著性,无血缘关系。Ⅳ级仅收集15例,不列入统计分析。采用统一的流行病学调查表,由经过专门培训的调查员对病例和对照组进行询问调查,收集研究对象的一般情况、健康相关行为、吸烟、饮酒、饮食习惯、运动情况、疾病史。饮食因素主要包括:饮食习惯、碳水化合物、蔬菜水果、肉类、蛋类、油脂、家禽内脏、家畜内脏、煎炸食品等。饮食调查采用询问法,对主要膳食因素详细记录并折算成各种食物成分摄入量和产热量。饮食状况分为低脂饮食、高脂饮食(饮食中脂肪的产热量占总热量百分比超过25%持续1年以上定义为高脂饮食),吸烟状况本文分为不吸烟者、吸烟者(将每天至少吸1支烟,持续半年以上定义为吸烟者)。饮酒定义为饮酒折合乙醇量男性大于140 g/周(女性>70 g/周),持续半年以上。
1.5 H. pylori检测14C-UBT试剂盒由深圳市中核海得威生物科技有限公司提供,所有待用试剂的配制均按试剂盒说明书进行。检测仪器为HUBT-01卡式幽门螺杆菌检测仪(深圳市中核海得威生物科技有限公司)。患者在清晨空腹时或至少禁食6 h以后受试,受试前漱口,口服14C-尿素胶囊一粒,嘱受试者整粒服下,20 mL温水送服,不得咬碎胶囊,3 min后再饮水20 mL,然后静坐15~20 min,等待采样。开启CO2吸收剂1瓶,倾入洁净的液闪瓶内,嘱受试者通过吹气导管向CO2吸收剂徐徐吹气,不能倒吸入嘴内,力度适中,避免液体溅出,当CO2吸收剂的紫红色褪尽变为无色透明时,停止吹气。此时CO2吸收剂刚好吸收到所需的CO2采样量。向已采集呼气样品的液闪瓶内加入稀闪烁液4.5 mL,摇匀,测量样品每分钟衰变数(disntegration per minute, DPM),以试剂盒提供的DPM≥100为阳性标准,本研究将H. pylori感染状况分为未感染者(DPM<100)、100≤DPM<500 感染者和DPM≥500感染者。
1.6 标本采集每人各抽取静脉血2~3 mL,置乙二胺四乙酸钠抗凝管,分离白细胞层。用QIAampDNA提取试剂盒提取白细胞DNA,DNA置-30 ℃低温冰箱保存备用。
1.7 基因测定(1)PPAR-γ2 基因-C34G多态性分析[10]:引物序列为:上游引物5'-:CAAGCCCAGTCCTTTCTGTC3',下游引物5'-:AGTGAAGGAATCGCTTTCCG-3',由美国Research Genetics公司合成,PCR反应体系包括:基因组DNA 1 μL,上下游引物各2 μL,Taq DNA聚合酶Mix 液(Takara公司)6 μL。反应条件为:94 ℃预变性5 min;94 ℃变性及56 ℃退火各45 s,72 ℃延伸30 s,40 个循环;最后72 ℃延伸7 min。PCR产物经Bio-Rad染色琼脂糖凝胶电泳确认扩增结果后,以限制性内切酶HpaⅡ酶切,37 ℃孵育4 h,取酶切产物4 μL经Bio-Rad染色琼脂糖凝胶电泳后,酶切产物放入紫外线凝胶成像仪观测;(2)NADPH氧化酶p22phox 亚基基因-C242T多态性分析[11]:引物序列为:上游引物5'TGCTTGTGGGT AAACCAAGGCCGGTG3',下游引物:5'AACACTGA GGTAAGTGGGGGTGGCTCCTGT',由上海生工生物技术有限公司合成。应用T aKaRa PCR Am-plification Kit(大连宝生物工程有限公司)PCR 试剂盒在25 μL PCR 反应体系中进行基因组DNA 扩增,0.5 μg DNA 基因组DNA,10×PCR Buffer 2.5 μL,含M gCl2 1.5 μL (25 mol/L),2dNTP Mix ture 2 μL、TaKaRa Taq DNA 聚合酶0.125 μL(5 U/μL),引物各1 μL(10 pmol/μL),灭菌去离子水17.375 μL。PCR反应条件如下:94 ℃4 min,94 ℃变性30 s,65 ℃ 3 min, 70 ℃ 1 min ,33个循环,最后70 ℃延伸10 min。取12 μL的PCR 反应产物与限制性内切酶RsaⅠ(NEB公司)于37 ℃温浴过夜。酶切产物经3.5%琼脂糖凝胶电泳(含0.5 μg/mL溴乙啶)进行分析。
1.8 统计方法Hardy-Weinberg 平衡检验研究样本的群体代表性,以P>0.05为符合Hardy-Weinberg规律。用比值比(OR)值和95%可信区间(95% CI)评价相对风险,病例组和对照组之间的基因型频率和等位基因频率采用χ2检验检验,P<0.05为差异有统计学意义。非条件logistic 回归模型分析交互作用。根据Khoury和Wagener提出的交互作用模型和交互系数(γ=βeg/βe)判断基因一环境交互作用模型以及交互作用类型[12]。判定依据1:γ>1,表示基因对环境暴露的效应有放大作用,正向交互作用;γ<1,表示基因对环境暴露的效应有减弱作用,负向交互作用;γ=1,表示基因对环境暴露没有交互作用。在病例对照研究中,γ为两变量lgOR的比值。判定依据2:OReg=ORe×ORg为相乘模型;OReg>ORe×ORg为超相乘模型;OReg<ORe×ORg为次相乘模型;OReg=ORe+ORg-1为相。
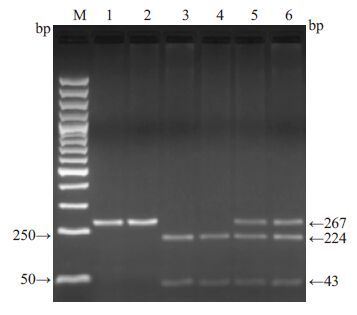
2 结果 2.1 PPAR-γ2基因-C34G和NADPH氧化酶p22phox亚基基因-C242T多态性检测结果的判断PPAR-γ2基因-C34G PCR扩增片段长度为267 bp,扩增产物经限制性内切酶HpaⅡ消化后分为3种基因型:-C34G(CC)纯合子为224 和43 bp 的2 条区带,-C34G(GG)纯合子为267的1条区带,-C34G(CG)杂合子为267、224和43 bp的3条区带(图 1)。每组随机抽取20个初步确定了基因型的样本,用PCR扩增后,送上海生工生物工程技术服务公司进行DNA序列测定进行验证,获得了100%的一致。
|
图 1 PPAR-γ2基因-C34G PCR 产物检测 Figure 1 PCR product of PPAR-γ2 gene-C34G. M:Marker; 1, 2: GG; 3, 4: CC; 5, 6: CG. |
PCR 扩增后的NADPH 氧化酶p22phox 亚基基因-C242T片段为348 bp,经限制性内切酶RsaⅠ酶切分为3种基因型:-C242T(CC)纯合子基因型个体显示1条348 bp长的DNA片段,-C242T(TT)纯合子基因型个体显示188和160 bp两条区带,-C242T(CT)杂合子基因型个体则显示348、188和160 bp的3条区带(图 2)。每组随机抽取20个初步确定了基因型的样本,用PCR扩增后,送上海生工生物工程技术服务公司进行DNA序列测定进行验证,获得了100%的一致。
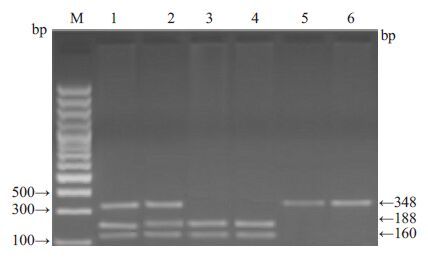
|
图 2 NADPH 氧化酶p22phox 亚基基因-C242T PCR 产物检测 Figure 2 PCR product of NADPH oxidase subunit p22phox gene-C242T. M: Marker; 1, 2: CT; 3, 4: TT; 5, 6: CC. |
LSCC组和对照组性别、年龄分布差异无显著性意义(P>0.05);LSCC BroderⅠ级、BroderⅡ级和Broder Ⅲ级各组高脂饮食率、吸烟率和饮酒率均显著高于对照组(P<0.05,表 1)。
| 表 1 ESCC组和对照组的一般资料 Table 1 General data of the ESCC cases and control group[n (%)] |
100≤DPM<500和DPM≥500H. pylori感染者频率分布在Ⅰ级组分别为22.50%和26.50% ,在Ⅱ级组分别为29.00%和40.50%,在Ⅲ级组分别为34.00%和51.50%,在对照组分别为15.50%和12.00%,上述H. pylori 感染状况频率在Ⅰ级、Ⅱ级、Ⅲ级组与对照组之间均有显著差异(P 均<0.01)。100≤DPM<500 和DPM≥500H. pylori 感染者患ESCC的风险性均明显增高(ORⅠ级=2.0636,ORⅡ级4.4474,ORⅢ级=10.9677;ORⅠ级=3.1393,ORⅡ级8.0225,ORⅢ级=21.4583),而DPM≥500 H. pylori 感染者患ESCC的风险性则又明显高于100≤DPM<500H. pylori感染者(P<0.01)(表 2)。
| 表 2 ESCC易感性与H. pylori感染的相关性分析 Table 2 Correlation analysis of ESCC susceptibility and H. pylori infection |
基基因-C242T基因型和等位基因频率关联分析经Hardy-Weinberg平衡检验,PPAR-γ2基因-C34G 各基因型在对照组中的分布均符合Hardy-Weinberg 规律(P>0.05),说明研究群体具有代表性(表 3)。CC、CG 和GG基因型频率在病例组和对照组差异有显著性(P<0.01);等位基因G在ESCC组和对照组之间的分布差异具有统计学意义(P<0.01),且OR值大于1,说明含等位基因G的个体发生ESCC的风险相对较高;两位点的不同基因型在病例、对照组之间的分布差异均具有统计学意义(P<0.01)。结果表明:PPAR-γ2基因-C34G(C→G 突变)可能增加ESCC的患病风险(表 3)。NADPH氧化酶p22phox亚基基因-C242T3种基因型、等位基因频率亦符合上述规律(表 4)。
| 表 3 PPAR-γ2 基因-C34G基因型与等位基因分布 Table 3 Distribution of PPAR-γ2 gene-C34G genotypes and alleles |
为进一步分析LSCC的危险因素,将H. pylori感染状况、-C34G和-C242T基因型作为自变量,以是否发生LSCC作为因变量Y(0:未患LSCC;1:患-C242T,即Ⅰ级、Ⅱ级、Ⅲ级组各组患者),采用逐步后退法进行非条件Logistic回归,主要变量赋值见表 5。结果显示,H. pylori感染、-C34G和-C242T有统计学关联(表 6)。
| 表 4 NADPH氧化酶p22phox亚基基因-C242T与等位基因分布 Table 4 Distribution of NADPH oxidase subunit p22phox gene-C242T genotypes and alleles |
| 表 5 非条件Logistic回归分析变量赋值表 Table 5 Assignment of variables in non-conditional Logistic regression analysis |
| 表 6 LSCC危险因素的非条件Logistic回归分析 Table 6 Non-conditional Logistic regression analysis of the risk factors of LSCC |
基因突变的协同分析发现-C34G(GG)/-C242T (TT)基因型者频率在Ⅰ级、Ⅱ级、Ⅲ级和对照组的分布频率分别为7.00%、13.50%、21.00%和2.00%,此基因型频率在各组之间均有显著性差异(P均<0.01)。-C34G (GG)/-C242T(TT)基因型者患ESCC的风险显著增加(ORⅠ级=7.2800,ORⅡ级=41.2941,ORⅢ级=363.9724),-C34G (GG)和-C242T(TT)基因型在ESCC发生、发展存在正向的交互作用(γ2=β2*4/β4,γ4=β2*4/β2;γ2Ⅰ级=2.2071,γ4 Ⅰ级=2.0773;γ2 Ⅱ级=2.1084,γ4 Ⅱ级=2.0543;γ2 Ⅲ级=2.1387,γ4 Ⅲ级=2.0004),另外在-C34G(CG)和-C242T(TT)之间、-C34G (CG)和-C242T(CT)之间及-C34G(GG)和-C242T (CT)之间均存在正向交互作用(γ均大于1)(表 7)。
| 表 7 PPAR-γ2基因-C34G和NADPH氧化酶p22phox亚基基因-C242T多态性在ESCC发病中的交互作用 Table 7 Interaction of polymorphisms of PPAR-γ2 gene-C34G and NADPH oxidase subunit p22phox gene-C242T with ESCC[n (%)] |
单纯100≤DPM<500 的H. pylori 感染的ORe1在Ⅰ级组为2.2189,在Ⅱ 级组为4.7273,在Ⅲ 级组为12.6061,单独携带-C34G(CG)型的ORg1在ESCC*H组为2.5267,在ESCC*M 组为6.1176,在Ⅲ 级组为19.8095,两者同时存在时,交互作用OReg1在Ⅰ级组为5.8367,在Ⅱ级组为30.5882,在ESCC*L组为251.3332,交互系数γ=βeg1/βe=>1,OReg1>ORe×ORg1为超相乘模型;另外数据分析显示在100≤DPM<500和-C34G(GG)之间、DPM≥500和-C34G(CG)之间及DPM≥500 和-C34G (GG)之间均存在正向交互作用(γ均大于1)(表 8)。同样在100≤DPM<500和-C242T(CT)之间、100≤DPM<500 和-C242T(TT)之间、DPM≥500 和-C242T(CT)之间及DPM≥500和-C242T(TT)在ESCC发生、发展中也存在正向交互作用(γ均大于1)(表 9)。
| 表 8 H. pylori感染和PPAR-γ2基因-C34G多态性在ESCC发病中的交互作用 Table 8 Interaction between H. pylori infection and PPAR-γ2 gene-C34G polymorphism in ESCC[n (%)] |
| 表 9 H. pylori感染和NADPH氧化酶p22phox亚基基因-C242T多态性在ESCC发病中的交互作用 Table 9 Interaction between H. pylori infection and NADPH oxidase subunit p22phox gene-C242T polymorphism in ESCC[n (%)] |
胰岛素抵抗除了造成患者能量物质代谢紊乱之外,可能通过高胰岛素血症、胰岛素样受体-1、核因子-κB抑制因子激酶- β/核因子-κB信号通路等参与恶性肿瘤的发病机制[13],PPAR-γ2是核受体家族中的成员,属于配体诱导的转录因子,作为脂肪酸的感受器,通过感受食物脂肪酸的信息,调节靶基因的转录,影响脂代谢酶、脂肪细胞因子的表达, 通过调节其活性可促进脂肪细胞分化、预防脂质产生、增加脂肪酸氧化,提高胰岛素敏感性,另外PPARγ具有抗增殖及预调亡和促分化的功能,因而具有较全面的抗癌活性[14-15]。PPAR-γ2的表达受基因的控制和环境因素的诱导,其表达和诱导表达水平均有显著的个体差异。人PPAR-γ2基因定位于3p25,包括3个外显子和2个内含子,目前发现人类PPAR-γ2存在着多态性,最为普遍的是外显子B上34位点的C被G替换(C→G突变)而造成蛋白质12位点脯氨酸(Pro)替换为丙氨酸(Ala),此突变属于功能性变异,可影响PPAR- γ2 的活性,减少血液和组织中PPAR-γ2的表达,从而影响其生物学效应。PPAR-γ2基因-C34G多态性具有三种基因型:-C34G(CC)、-C34G(CG)和-C34G (GG),国内外已有研究报道认为-C34G位点的多态性与代谢综合征有关[16-17]。本研究发现-C34G(CG)和-C34G(GG)基因型与ESCC发生、发展有关,与对照组比较差异有统计学意义,携带-C34G(CG)和-C34G (GG)基因型者ESCC的风险高于携带-C34G(CC)的个体与-C34G位点变异增加代谢综合征发病风险的结论一致。-C34G(CG)和-C34G(GG)基因型基因型者易患ESCCC的机理还不清楚,相关研究[18]显示PPAR-γ2的氨基酸端含有一个不依赖于配体而依赖于胰岛素的活化区域,-C34G(即Pro12Ala)即位于该区域内,脯氨酸(Pro)有防止α螺旋形成的作用,而丙氨酸(Ala)有促进α螺旋形成的作用该氨基酸的改变将造成PPAR-γ2结构的改变从而影响PPAR-γ2的转录活性降低PPAR-γ2表达,降低胰岛素敏感性,增加ESCC恶性肿瘤发生的危险性。
人体过多的活性活性氧簇(ROS)诱导nDNA单双链的结构断裂或者DNA链之间交联,或引起嘌呤、嘧啶及脱氧核糖改变而引发nDNA突变,其结果将介导原癌基因的激活或抑癌基因的失活,基因的改变将导致细胞异常增生而形成肿瘤,另一方面,ROS能攻击生物膜磷脂中诱发发脂质过氧化反应,形成的脂质过氧化物可通过氧化碱基、损伤生物膜结构进而引起代谢失调、加重组织损伤参与肿瘤的发生发展[19-20]。氧化应激机制中,NADPH氧化酶是生成活性氧簇的主要来源,其主要亚基中质膜结合成分p22phox为跨膜亚基,是NADPH氧化酶酶促的核心作用部分,p22phox亚基的多态性影响NADPH氧化酶的功能。位于16号染色体4号外显子上的第242密码子存在C→T基因突变,使得编码的72号氨基酸由组氨酸变为酪氨酸。72 号组氨酸残基是p22phox 结合血红素的部位,由于基因的改变使p22phox结合血红素的能力下降,从而影响了NADPH 氧化酶的活性[21]。研究证明NADPH氧化酶p22phox 亚基基因-C242T多态性可增加氧化应激相关疾病如冠心病、脑血管疾病等的的发病率[22-23]。本研究发现-C242T(CT)和-C242T(TT)基因型与ESCC的发生有关,与对照组比较差异有统计学意义(P<0.01),携带-C242T(CT)和-C242T(TT)基因型者患ESCC的风险高于携带-C242T(CC)的个体与相关研究结果一致。
本研究发现PPAR-γ2 基因-C34G突变纯合型与NADPH氧化酶p22phox亚基基因-C242T突变纯合型的交互作用增加了ESCC 的发病风险,-C34G(GG)和-C242T(TT)基因型对ESCC的发生风险有相互显著放大效应;另外本研究显示,两基因的杂合子与杂合子之间、杂合子与突变纯合型之间也存在明显的正向交互作用(γ均大于1)。通过对H. pylori感染状况的分析发现,100≤DPM<500 和DPM≥500 H. pylori感染者患ESCC 的风险明显高于未感染者,而DPM≥500 H. pylori 感染者患ESCC的风险性则又明显高于100≤DPM<500H. pylori 感染者(P<0.01);数据分析显示H. pylori感染与-C34G(CG)、-C34G(GG)、-C242T(CT)和-C242T (TT)基因型均存在正向交互作用(γ均大于1),携带-C34G(CG)、-C34G(GG)、-C242T(CT)和-C242T (TT)基因型者H. pylori 感染的危害效应更大;-C34G (CG)、-C34G(GG)、-C242T(CT)和-C242T(TT)与H. pylori 感染交互作用OReg均大于相应相应的OR e×ORg,显示-C34G(CG)、-C34G(GG)、-C242T(CT)和-C242T(TT)与H. pylori感染交互作用机制在ESCC 发生中均为超相乘模型。H. pylori感染可能通过炎症、纤维蛋白原自身免疫反应来引起胰岛细胞损伤,胰岛功能下降,胰岛素分泌减少;H. pylori慢性感染可诱导炎症反应,刺激炎症因子如TNF-、IL-1β、IL-6、及IL-8 等释放。而低水平的炎症状态正是胰岛素抵抗的病因之一,TNF-α和IL-6 作为炎症递质,参与了胰岛素抵抗的发生和发展,它们可以干扰胰岛素信号转导,降低胰岛素的敏感性,它们还能影响脂代谢及脂肪因子,降低胰岛素作用。另外H. pylori感染者的胃肠激素水平有明显改变,H. pylori感染升高血清胃泌素浓度和降低生长抑素的浓度,胃泌素增加食物和糖刺激的胰岛素释放,生长抑素调节胰腺胰岛素的分泌,抑制胰岛素的释放,通过负反馈调节导致胰岛素抵抗,提示H. pylori感染可能通过主要慢性炎症和影响胃肠激素对胰岛素的调节,而导致胰岛素抵抗,为恶性肿瘤的发生创造了条件[24-25]。通常情况下生物体内的活细胞均可产生氧自由基,因存在着包括超氧化物歧化酶在内的自由基清除系统,可及时地清除体内过剩的自由基,维持自由基的动态平衡;H. pylori感染致不同程度的急、慢性炎症,多形核嗜中性粒细胞等在吞噬H. pylori时产生大量的超氧自由基(O2·-)、过氧化氢(H2O2)和羟基自由基(·OH)等活性氧,释放至细咆介质及体液内,导致体内氧化和抗氧化平衡失调及一系列自由基反应加剧[26]。过量氧自由基通过血液进入支气管上皮细胞,促使支气管上皮细胞发生脂质过氧化及启动新的自由基反应,增加细胞恶变的风险性。这可能是H. pylori感染可单独增加及与PPAR-γ2 基因-C34G与NADPH氧化酶p22phox 亚基基因-C242T突变基因型协同增加ESCC发生风险性的重要原因。
上述数据为ESCC BroderⅠ级、Ⅱ级和Ⅲ级各组分别和健康对照组配对行χ2检验所得,显示H. pylori感染与-C34G(CG)、-C34G(GG)、-C242T(CT)和-C242T(TT)基因型均是ESCC发生的易患因素,H. pylori感染与基因多态性的交互作用增加了ESCC发生风险。为进一步了解H. pylori感染与基因多态性及交互作用在ESCC进展中作用,本研究又对Ⅰ级、Ⅱ级和Ⅲ级之间的H. pylori 感染频率、-C34G和-C242T基因型频率和等位基因频率进行χ2检验和相对危险度比较,研究显示,无论是单纯H. pylori感染、单纯-C34G或-C242T突变基因型、联合突变基因型、H. pylori感染联合突变基因型的分布频率及相应OR值在Ⅰ级、Ⅱ级和Ⅲ之间的具有明显差异(P<0.01),这进一步揭示H. pylori 感染、-C34G 和-C242T基因变异不仅增加ESCC发生的风险,而且在ESCC病情进展演变发挥重要作用。
ESCC是涉及环境因子和多种基因相互作用的复杂过程,本研究提示PPAR-γ2基因-C34G突变纯合型与NADPH氧化酶p22phox亚基基因-C242T突变基因型的个体属ESCC高危险人群, ESCC防治方案中应加以重视,虽然尚不能通过改变其ESCC易感的基因型来防治ESCC,但可以通过PPAR-γ2基因-C34G突变纯合型与NADPH氧化酶p22phox亚基基因-C242T基因检测,预测个体发生ESCC的风险性,采取相应的控制环境病因的措施如根除H. pylori或调控基因表达以达到有效预防ESCC的目的。
| [1] | Holzer R, Fulford D, Nedderman M, et al. Tumor cell expression ofvascular endothelial growth factor receptor 2 is an adverseprognostic factor in patients with squamous cell carcinoma of thelung[J]. PLoS One, 2013, 8 (11): e80292. DOI: 10.1371/journal.pone.0080292. |
| [2] | Orgel E, Mittelman D. The links between insulin resistance,diabetes, and cancer[J]. Curr Diab Rep, 2013, 13 (2): 213-22. DOI: 10.1007/s11892-012-0356-6. |
| [3] | Sehitogullar? A, Aslan M, Say?r F, et al. Serum paraoxonase-1enzyme activities and oxidative stress levels in patients withesophageal squamous cell carcinoma[J]. Redox Rep, 2014, 19 (5): 199-205. DOI: 10.1179/1351000214Y.0000000091. |
| [4] | Cheng XJ, Lin JC, Tu SP. Etiology and Prevention of Gastric Cancer[J]. Gastrointest Tumors, 2016, 3 (1): 25-36. DOI: 10.1159/000443995. |
| [5] | Ohba R, Iijima K. Pathogenesis and risk factors for gastric cancerafter Helicobacter pylori eradication[J]. World J GastrointestOncol, 2016, 8 (9): 663-672. DOI: 10.4251/wjgo.v8.i9.663. |
| [6] | Deng B, Li YF, Zhang Y, et al. Helicobacter pylori infection andlung cancer: a review of an emerging hypothesis[J]. Carcinogenesis, 2013, 34 (6): 1189-95. DOI: 10.1093/carcin/bgt114. |
| [7] | Tu KS, Zheng X, Dou CW, et al. MicroRNA-130b promotes cellaggressiveness by inhibiting peroxisome proliferator-activatedreceptor gamma in human hepatocellular carcinoma[J]. Int J MolSci, 2014, 15 (11): 20486-99. |
| [8] | Wang R, Dashwood M, Nian H, et al. NADPH oxidaseoverexpression in human colon cancers and rat colon tumorsinduced by 2-amino-1-methyl-6-phenylimidazo [4,5-b] pyridine(PhIP)[J]. Int J Cancer, 2011, 128(11): 2581-90. |
| [9] | Deyhimi Parviz, Torabinia Nakisa, Torabinia Aitin. A comparativestudy of histological grade and expression of Ki67 protein in oralsquamous cell carcinoma in young and old patients[J]. Dent Res J(Isfahan), 2013, 10 (4): 514-7. |
| [10] | Rey JW, Noetel Andrea, Hardt A, et al. Pro12Ala polymorphism ofthe peroxisome proliferator-activated receptor γ2 in patients withfatty liver diseases[J]. World J Gastroenterol, 2010, 16 (46): 5830-7. DOI: 10.3748/wjg.v16.i46.5830. |
| [11] | de Oliveira Alvim R, Santos P Caleb, Dias RG, et al. Associationbetween the C242T polymorphism in the p22phox gene witharterial stiffness in the Brazilian population[J]. Physiol Genomics, 2012, 44 (10): 587-92. DOI: 10.1152/physiolgenomics.00122.2011. |
| [12] | Khoury J, Wagener K. Epidemiological evaluation of the use ofgenetics to improve the predictive value of disease risk factors[J]. Am J Hum Genet, 1995, 56 (4): 835-44. |
| [13] | Friedenreich CM, Langley AR, Speidel TP, et al. Case-controlstudy of markers of insulin resistance and endometrial cancer risk[J]. Endocr Relat Cancer, 2012, 19 (6): 785-92. DOI: 10.1530/ERC-12-0211. |
| [14] | Zhao X, Xue J, Wang L, et al. Involvement of hepatic peroxisomeproliferator-activated receptor α/γ in the therapeutic effect ofosthole on high-fat and high-sucrose-induced steatohepatitis in rats[J]. Int Immunopharmacol, 2014, 22 (1): 176-81. DOI: 10.1016/j.intimp.2014.06.032. |
| [15] | Kim HW, Lim EJ, Jang HH, et al. 24-Methylenecycloartanylferulate, a major compound of γ-oryzanol, promotes parvin-betaexpression through an interaction with peroxisome proliferatoractivatedreceptor-gamma 2 in human breast cancer cells[J]. Biochem Biophys Res Commun, 2015, 468 (4): 574-579. DOI: 10.1016/j.bbrc.2015.10.147. |
| [16] | Yao YS, Li J, Jin YL, et al. Association between PPAR-γ2 Pro12Alapolymorphism and obesity: a meta-analysis[J]. Mol Biol Rep, 2015, 42 (6): 1029-38. DOI: 10.1007/s11033-014-3838-6. |
| [17] | Youssef M, Mohamed N, Afef S, et al. Combined effects of theC161T and Pro12Ala PPARγ2 gene variants with insulin resistanceon metabolic syndrome: a case-control study of a central Tunisianpopulation[J]. J Mol Neurosci, 2014, 52 (4): 487-92. DOI: 10.1007/s12031-013-0161-y. |
| [18] | 李秀丽, 章琳, 李影娜, 等. PPARγ2基因Pro12Ala多态性与2型糖尿病及其一级亲属血脂的相关性研究[J]. 西安交通大学学报: 医学版, 2013, 34 (5): 632-6. |
| [19] | Shetty SR, Babu S, Kumari S, et al. Status of salivary lipidperoxidation in oral cancer and precancer[J]. Indian J Med PaediatrOncol, 2014, 35 (2): 156-8. DOI: 10.4103/0971-5851.138990. |
| [20] | Borrego S, Vazquez A, Dasí F, et al. Oxidative stress and DNAdamage in human gastric carcinoma: 8-Oxo-7'8-dihydro-2'-deoxyguanosine (8-oxo-dG) as a possible tumor marker[J]. Int JMol Sci, 2013, 14 (2): 3467-86. |
| [21] | Ge JY, Ding ZJ, Song Y, et al. Smoking dose modifies theassociation between C242T polymorphism and prevalence ofmetabolic syndrome in a Chinese population[J]. PLoS One, 2012, 7 (3): e31926. DOI: 10.1371/journal.pone.0031926. |
| [22] | Hashad M, Abdel Rahman F, Abdel-Maksoud M, et al. C242Tpolymorphism of NADPH oxidase p22phox gene reduces the riskof coronary artery disease in a random sample of Egyptianpopulation[J]. Mol Biol Rep, 2014, 41 (4): 2281-6. DOI: 10.1007/s11033-014-3081-1. |
| [23] | Genius J, Grau J, Lichy C. The C242T polymorphism of the NAD(P)H oxidase p22phox subunit is associated with an enhanced riskfor cerebrovascular disease at a young age[J]. Cerebrovasc Dis, 2008, 26 (4): 430-3. DOI: 10.1159/000155639. |
| [24] | Abenavoli L, Milic N, Masarone M, et al. Association betweennon-alcoholic fatty liver disease, insulin resistance and Helicobacterpylori[J]. Med Hypotheses, 2013, 81 (5): 913-5. DOI: 10.1016/j.mehy.2013.08.011. |
| [25] | Polyzos SA, Kountouras J, Papatheodorou A, et al. Helicobacterpylori infection in patients with nonalcoholic fatty liver disease[J]. Metabolism, 2013, 62 (1): 121-6. DOI: 10.1016/j.metabol.2012.06.007. |
| [26] | Na HK, Woo JH. Helicobacter pylori Induces hypermethylation ofCpG islands through upregulation of DNA methyltransferase:Possible involvement of reactive oxygen/nitrogen species[J]. JCancer Prev, 2014, 19 (4): 259-64. DOI: 10.15430/JCP.2014.19.4.259. |
 2016, Vol. 36
2016, Vol. 36