2. 海军总医院妇产科 ;
3. 海军总医院病理科,北京 100048
2. Department of Gynecology and Obstetrics ;
3. Department of Pathology, Navy General Hospital, Beijing 100048, China
众所周知,真核生物主要通过糖酵解和氧化磷酸化两种途径完成能量代谢,获得ATP。研究发现,在肿瘤组织能量代谢过程中,糖酵解与氧化磷酸化间存在相互制约、此消彼长的关联[1-2];因此,酵解增强且氧化磷酸化减弱被认为是肿瘤增殖旺盛的标志[3];反之,当氧化磷酸化增强且糖酵解减弱,则往往意味着肿瘤增殖受抑、进展延缓[4-5]。ATP合酶抑制因子1(IF1)是一种内源性小分子蛋白,可通过抑制ATP合酶(ATPase)功能,从而抑制氧化磷酸化并促进糖酵解[6-7]。研究证实,IF1活化与pH值密切相关。大量由糖酵解所产生的乳酸,可导致肿瘤组织内环境pH值降低,促使IF1活化形成二聚,并结合两个单位F1-ATPase,从而导致ATPase 功能受抑[8],并最终促进肿瘤细胞增殖、侵袭和存活[9-10]。因此有学者认为,IF1是一个潜在的致瘤因子,可作为肿瘤早期诊断及复发、转移的预测指标[11-13]。
目前,关于IF1在女性生殖系统正常及病变组织中表达的系统研究尚未见报道。为此,本研究将通过检测IF1在女性生殖系统正常及病变组织中的表达,初步了解IF1与低氧能量代谢及细胞增殖、细胞恶性转化的关联,为进一步探索其生理功能及治疗女性生殖系统疾病新方法提供依据。
1 材料和方法 1.1 样本来源及处理全部试验设计及操作流程均已经过解放军总医院伦理委员会批准,并获得患者书面知情同意。样本选自2013~2015年我院患者手术切除的组织(表 1),患者均月经周期规律,且术前3个月均无激素治疗史。肿瘤组织样本均取自初次手术且未经放化疗的患者(25~69岁);其余组织取自手术患者(25~49岁),其中正常肌壁和子宫肌瘤取自同一患者因子宫肌瘤行子宫全切术的组织,正常子宫内膜组织取自因子宫肌瘤手术的组织,子宫异位症在位内膜及异位病灶取自同一患者子宫内膜异位症手术切除的组织,蜕膜及绒毛组织来自早孕8~10周行人工流产的组织,正常输卵管来自宫外孕行手术切除的组织,正常卵巢来自子宫内膜卵巢异位手术切除的组织。样本以4%中性多聚甲醛液固定,常规石蜡制片;其中部分子宫内膜及异位病灶样本以4 ℃生理盐水洗去血液后,迅速置于液氮中低温冻存待用。
| 表 1 样本类型及例数 Table 1 Characteristics and number of the samples |
石蜡切片脱蜡至水,以EDTA 抗原修复缓冲液(pH9.0)微波修复,3% H2O2阻断内源性过氧化物酶10 min,PBS浸洗,3%BSA室温封闭10 min,以IF1一抗(1:50, ab197806, Abcam, USA)4 ℃孵育过夜,PBS浸洗,加二抗(K500711, Dako, Denmark)室温孵育1 h,PBS浸洗,DAB(K500711, DAKO, Denmark)显色,苏木素复染,常规脱水、透明、封片。随后每张切片200×光镜下观察,随机取3个视野拍照,图像采用CMIAS软件(CMIAS, Beijing University of Aeronautics and Astronautics, China)进行分析,得到每个视野中对应抗原表达的面密度,求出每张切片的均值。
1.3 Western blotting法检测IF1含量低温冻存的组织,常规提取总蛋白,采用BCA法进行蛋白定量,以4×上样缓冲液稀释后,95 ℃热变性15 min 后作为样本。样本上样量50 μg,12% SDS-PAGE电泳,转PVDF膜,5%脱脂奶粉室温封闭1 h,TBS-T浸洗,以IF1(1:50, ab197806, Abcam, USA)、β-actin(1:100,ab16039, Abcam, USA)一抗4 ℃孵育过夜,TBS-T 浸洗,以HRP标记的二抗(BS13278, Bioworld, USA)室温孵育1 h,TBS-T浸洗,ECL发光液显色(BLH01S020, Bioworld, USA),随后以凝胶扫描成像及图像分析系统(SCA/fluorCho, Alpha Inotech, USA)观察拍照,并对结果进行灰度值分析,随后求出IF1/β-actin 的比值作为IF1的相对表达量。
1.4 RT-PCR法检测IF1 mRNA表达低温冻存的组织,经液氮充分碾磨后,加入Trizol reagent(15596-026, Invitrogen, USA)常规提取RNA。引物信息为:IF1-forward 5'-GGGCCTTCGGAAAG AGAG-3';IF1-reverse 5'-TTCAAAGCTGCCAGTTG TTC-3';β-actin-forward 5'-GGAGATTACTGCCCTG GCTCCTA-3';β-actin-reverse 5'-GACTCATCGTACT CCTGCTTGCTG-3'。随后依次配制以下液体,A液:样本RNA 9 μL,加入Random primer 1 μL,70 ℃金属浴5 min,立即0 ℃冷却5 min;B液:采用GoScript Reverse Transcription system(Promega, USA),参照说明书,配制10 μL Reverse Transcription mix;混合A、B液,25 ℃退火5 min,42 ℃延伸1 min,70 ℃灭活逆转录酶5 min,完成cDNA合成。随后采用SYBR Green PCR MasterMix(Applied Biosystems, USA)配制反应体系,设定仪器7500Real Time PCR System(Applied Biosystems, USA)40个PCR循环(95 ℃ 15 s, 60 ℃ 1 min)进行扩增,并读取各样本目的基因和内参基因的Ct值,随后计算出目的基因/内参基因的相对表达量,每个样本进行3 个复孔实验,取均值作为该样本目的基因表达量。
1.5 统计学分析数据以均数±标准差表示,采用SPSS 17.0软件进行单因素方差分析,以P<0.05认为差异具有统计学意义。
2 结果 2.1 IF1在女性生殖系统恶性肿瘤中呈强阳性表达免疫组化结果显示(图 1A),IF1在女性生殖系统正常组织中均有不同程度表达,其中增殖期子宫内膜表达最强(++),宫颈上皮、输卵管上皮及卵巢次之(+),子宫肌壁表达最弱(+/-);在绒毛、蜕膜及女性生殖系统恶性肿瘤组织中,IF1则均呈强阳性表达(+++)。图像分析统计结果显示(图 1B),与对应来源的正常组织比较,子宫内膜腺癌(P<0.01)、宫颈鳞癌(P<0.01)、输卵管壶腹部腺癌(P<0.01)、卵巢内膜样腺癌(P<0.01)IF1表达均显著增加,但绒毛与蜕膜、正常子宫肌壁与子宫肌瘤之间,IF1表达无显著差异。
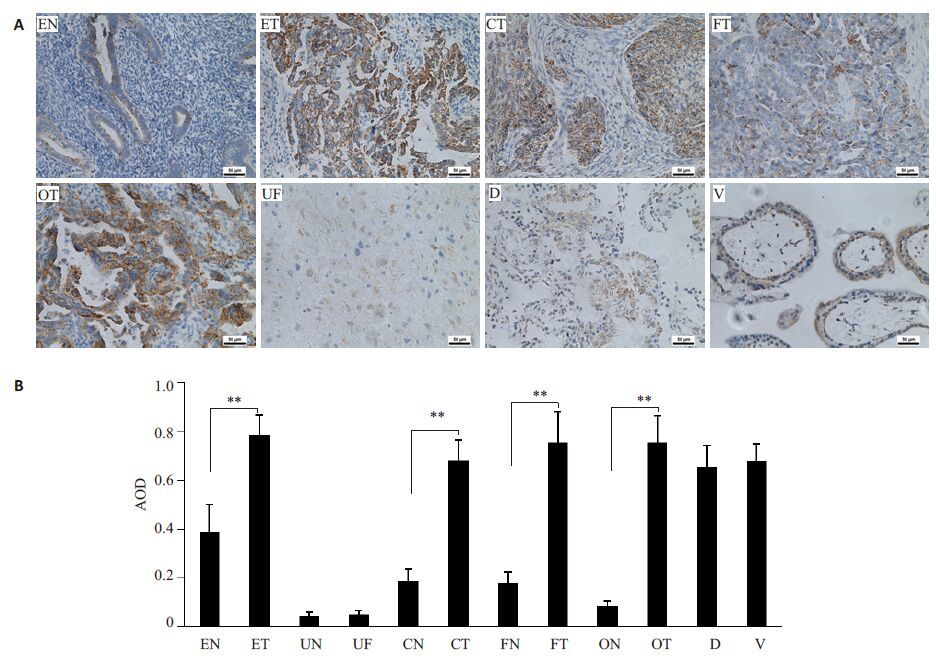
|
图 1 IF1在女性生殖系统及其原发肿瘤组织中的表达 Figure 1 Expression of IF1 in nomal andmalignant tissues of the female reproductive system. A: Immunohistochemical results (Original magnification: ×200) ; B: Image analysis results. *P<0.05, **P<0.01 vs normal tissue. EN: Normal endometrium; ET:Adenocarcinoma of endometrium; UN: Normal uterine myoideum; UF: Uterine fibroids; CN: Normal cervix; CT:Squamous carcinoma of cervix; FN: Normal fallopian tubes; FT: Adenocarcinoma of fallopian tube; ON: Normal ovary; OT:Ovarian endometrial adenocarinoma; D: Decidua; V: Villus). |
免疫组化结果显示(图 2A),IF1在正常增殖期子宫内膜呈阳性表达(++),但在分泌期基本不表达或弱表达(+/-);图像分析统计结果显示(图 2B),IF1在增殖期子宫内膜表达显著高于分泌期(P<0.01)。
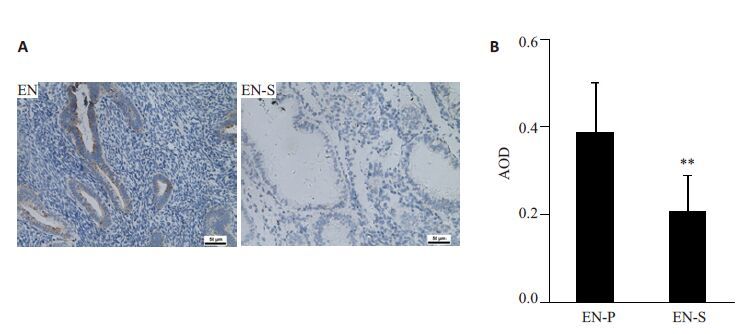
|
图 2 IF1在增殖期及分泌期子宫内膜中的表达 Figure 2 Expression of IF1 in endometrium in the proliferation and secretory phase. A: Immunohistochemical results (×200) ; B: Image analysis results. *P<0.05, **P<0.01 vs EN. (EN-P: Proliferative endometrium; EN-S:Secretory endometrium). |
免疫组化及Western blot结果显示(图 3A,B),IF1在EMs异位病灶表达最强(+++),而在正常子宫内膜及EMs患者原位内膜表达较弱。图像分析统计结果显示(图 3A,B),EMs异位病灶IF1表达较正常子宫内膜(P<0.01)及EMs患者在位内膜(IHC-P, P<0.01;WB, P<0.05)均显著增强。RT-PCR检测统计分析结果显示(图 3C),IF1 mRNA在正常子宫内膜、EMs在位内膜及异位病灶中表达未见显著差异(P>0.05)。
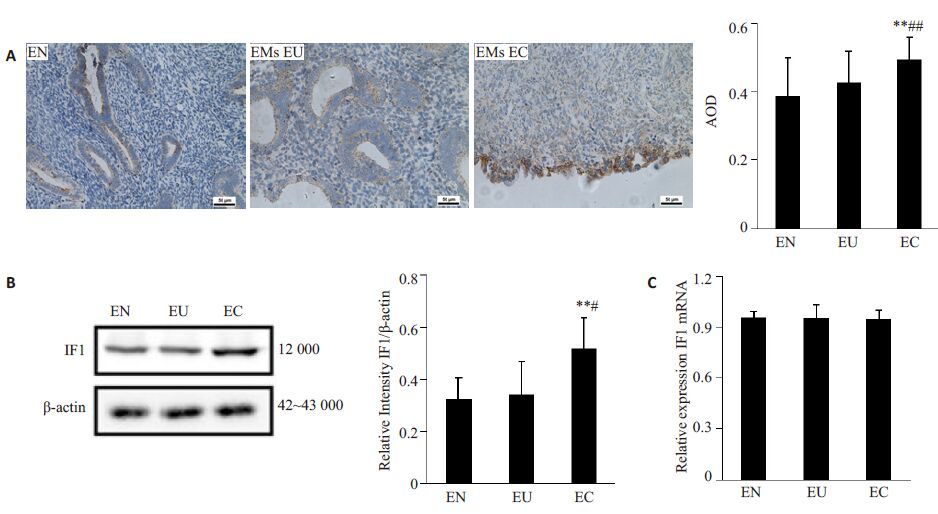
|
图 3 IF1及其mRNA在正常子宫内膜、内异症在位内膜及异位病灶的表达 Figure 3 Expression of IF1 in normal and EMs endometrium. A: Immunohistochemical results (× 200) ; B: Western blotting results; C: RT-PCR results. *P<0.05, **P<0.01 vs EN. #P<0.05, ##P<0.01 vs EU (EN: Normal endometrium; EU: Eutopic endometrium from EMs; EC: Ectopic endometrium from EMs). |
以往的研究普遍认为,在肿瘤组织中,由于线粒体发生不可逆损伤,氧化磷酸化途径被高度抑制,肿瘤主要通过糖酵解途径获取能量,这一独特的能量代谢方式又被称为“Warberg效应”[14]。在糖酵解过程中,产生的ATP虽然较少但速度快,并可产生乳酸等适于肿瘤增殖的产物,为肿瘤生长微环境创造良好条件,因此糖酵解较氧化磷酸化更加适合肿瘤快速生长的需要[15-16, 33]。目前,多种以抑制糖酵解为作用机理的药物(例如:2-脱氧葡萄糖、氯尼达明等)已被应用于临床,用于控制肿瘤的生长,但其往往对生长迅速的肿瘤有效,而对生长缓慢的肿瘤效果欠佳[17-18]。
在氧化磷酸化过程中,ATPase是其催化作用的核心酶。在正常生理条件下,ATPase可将ADP磷酸化生成高能化合物ATP,从而为细胞提供能量;在缺氧等应激情况下,则可逆向催化ATP 水解[19]。研究发现,ATPase表达在多种肿瘤组织中普遍下降[20],且更低表达的ATPase也被发现与肿瘤耐药性增强和预后不佳存在关联[21-24]。因此有研究认为通过对ATPase表达水平及活性的调控,有可能影响肿瘤的生长和生存[9, 25]。
1963年,Pullman和Monroy首次发现了一种内源性ATPase功能抑制蛋白,并将其命名为ATP合酶抑制因子1[26]。IF1是由106~109个氨基酸组成的小分子蛋白(10 000),其基因编码在不同的种属中显示出高度保守性,这也提示了其在生物功能中具有重要地位[27]。研究发现,IF1在肝、肺等多种恶性肿瘤组织中异常增高[6, 13, 28]。本研究结果则显示,IF1在子宫内膜腺癌、宫颈鳞癌、输卵管腺癌,卵巢内膜样腺癌等女性生殖系统恶性肿瘤组织中,表达较其来源的正常组织均异常增高。该结果进一步证实,IF1在恶性肿瘤能量代谢过程中发挥重要作用。
EMs虽然属于良性疾病,但与恶性肿瘤具有相似的生物学习性,具有浸润、复发的特点并有可能发生恶变。有研究指出线粒体功能紊乱是EMs发生的高危因素[29]。本研究发现,与正常内膜及EMs在位内膜比较,EMs异位内膜IF1表达均显著增加。该结果提示,EMs 异位内膜的生长及代谢方式与肿瘤细胞类似,有通过糖酵解途径提供能量。但IF1 mRNA表达在正常内膜、EMs在位及异位内膜间,未见明显差异,该结果提示IF1 基因存在转录后调控。
有研究认为,从氧化磷酸化转向糖酵解代谢,同时伴随IF1表达增加,是细胞增殖旺盛的表现[30]。本研究发现,正常子宫内膜也有IF1的高表达,并且增生期子宫内膜表达高于分泌期,而在正常子宫及宫颈肌壁均呈极低或低表达。此外,尽管子宫肌瘤组织氧分压(0~5 mmHg)明显低于正常子宫肌壁组织(PO2, 5~20 mmHg)[31];且有研究发现由氯化钴诱导的低氧损伤,能够增加体外培养的大鼠肝细胞IF1的表达[32];但本研究发现IF1在子宫肌瘤及正常子宫肌壁均呈低表达且无显著差异。与此同时,绒毛和蜕膜组织均增殖旺盛,且具有丰富的血供,不存在缺氧状态,在本研究中均发现呈现IF1高表达。以上结果提示,在体内环境中,IF1表达应该与组织是否低氧状态无关,而与其增殖和代谢活性相关。即增殖缓慢、代谢需求较低的组织中IF1呈低表达;增殖旺盛、代谢需求相对高的组织IF1呈高表达。
目前,关于IF1在女性生殖系统的表达,及其与女性生殖系统疾病关联的研究均未见报道。本研究发现,IF1在女性生殖系统正常组织中呈不同程度阳性表达,其表达与组织增殖和代谢活性正相关;IF1在女性生殖系统恶性肿瘤中表达异常增高,并存在转录后调控;IF1有可能通过抑制ATPase功能,参与肿瘤能量代谢的调控,从而影响肿瘤细胞的生存和生长。综上所述,我们认为对女性生殖系统恶性肿瘤,IF1可作为其诊断指标之一,并有可能成为新的治疗靶点。
| [1] | Kinnaird A, Michelakis ED. Metabolic modulation of cancer: a newfrontier with great translational potential[J]. J Mol Med (Berl), 2015, 93 (2): 127-42. DOI: 10.1007/s00109-014-1250-2. |
| [2] | Smolková K, Plecitá-Hlavatá L, Bellance N, et al. Waves of generegulation suppress and then restore oxidative phosphorylation incancer cells[J]. Int J Biochem Cell Biol, 2011, 43 (7): 950-68. DOI: 10.1016/j.biocel.2010.05.003. |
| [3] | Vander Heiden MG, Cantley LC, Thompson CB. Understanding thewarburg effect: the metabolic requirements of cell proliferation[J]. Science, 2009, 324 (5930): 1029-33. DOI: 10.1126/science.1160809. |
| [4] | Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+Channel axis is suppressed in cancer and its normalizationpromotes apoptosis and inhibits cancer growth[J]. Cancer Cell, 2007, 11 (1): 37-51. DOI: 10.1016/j.ccr.2006.10.020. |
| [5] | Garcia-Cao I, Song MS, Hobbs RM, et al. Systemic elevation ofPTEN induces a tumor-suppressive metabolic state[J]. Cell, 2012, 149 (1): 49-62. DOI: 10.1016/j.cell.2012.02.030. |
| [6] | Sanchez-Cenizo L, Formentini L, Aldea MA, et al. Up-regulation ofthe ATPase inhibitory factor 1 (IF1) of the mitochondrial H+-ATPsynthase in human tumors mediates the metabolic shift of cancercells to a warburg phenotype[J]. J Biol Chem, 2010, 285 (33): 25308-13. DOI: 10.1074/jbc.M110.146480. |
| [7] | Garcia-Bermudez J, Cuezva JM. The ATPase inhibitory factor 1(IF1): A master regulator of energy metabolism and of cell survival[J]. Biochim Biophys Acta, 2016, 1857 (8, SI): 1167-82. DOI: 10.1016/j.bbabio.2016.02.004. |
| [8] | Solaini G, Harris DA. Biochemical dysfunction in heart mitochondriaexposed to ischaemia and reperfusion[J]. Biochem J, 2005, 390 (Pt2): 377-94. |
| [9] | Formentini L, Sánchez-Aragó M, Sánchez-Cenizo L. et al themitochondrial ATPase inhibitory factor 1 triggers a ROS-mediatedretrograde prosurvival and proliferative response[J]. Mol Cell, 2012, 45 (6): 731-42. DOI: 10.1016/j.molcel.2012.01.008. |
| [10] | Song R, Song H, Liang Y, et al. Reciprocal activation betweenATPase inhibitory factor 1 and NF-kappaB drives hepat ocellularcarcinoma angiogenesis and metastasis[J]. Hepatology, 2014, 60 (10): 1659-73. |
| [11] | Gao YX, Chen L, Hu XG, et al. ATPase inhibitory factor 1expression is an Independent prognostic factor in non-small celllung cancer[J]. Am J Cancer Res, 2016, 6 (5): 1141-8. |
| [12] | Wu JH, Shan Q, Li PD, et al. ATPase inhibitory factor 1 is apotential prognostic marker for the migration and invasion ofglioma[J]. Oncol Lett, 2015, 10 (4): 2075-80. |
| [13] | Faccenda D, Tan CH, Seraphim A, et al. IF1 limits the apoptoticsignallingcascade by preventing mitochondrial remodelling[J]. Cell Death Differ, 2013, 20 (5): 686-97. DOI: 10.1038/cdd.2012.163. |
| [14] | Mathupala SP, Ko YH, Pedersen PL. Biochim biophys Acta.thepivotal roles of mitochondria in cancer: warburg and beyond andencouraging prospects for effective therapies[J]. Biochim BiophysActa, 2010, 1797(6/7): 1225-30. |
| [15] | Brooks GA. Cell-cell and intracellular lactate shuttles[J]. J Physiol, 2009, 587 (23): 5591-600. DOI: 10.1113/jphysiol.2009.178350. |
| [16] | Hanahan D, Weinberg RA. Hallmarks of cancer: the next Generation[J]. Cell, 2011, 144 (5): 646-74. DOI: 10.1016/j.cell.2011.02.013. |
| [17] | Azevedo-Silva J, Queiros O, Baltazar F, et al. The anticancer agent3-bromopyruvate: a simple but powerful molecule taken from theLab to the bedside[J]. J Bioenerg Biomembr, 2016, 48 (4): 349-62. DOI: 10.1007/s10863-016-9670-z. |
| [18] | Cervantes-Madrid D, Romero Y, Duenas-Gonzalez A. Revivinglonidamine and 6-Diazo-5-oxo-L-norleucine to be used incombination for metabolic cancer therapy[J]. Biomed Res Int, 2015, 14 (6): 690492. |
| [19] | Daichi O, Ryota I, Hiroyuki N. Rotation and structure of F0F1-ATPsynthase[J]. J Biochem, 2011, 149 (6): 655-64. DOI: 10.1093/jb/mvr049. |
| [20] | Vazquez-Martin A, Corominas-Faja B, Cufi SA, et al. Themitochondrial H+-ATP synthase and the lipogenic Switch New corecomponents of metabolic reprogramming in induced pluripotentstem (iPS) cells[J]. Cell Cycle, 2013, 12 (2): 207-18. DOI: 10.4161/cc.23352. |
| [21] | Krasnov GS, Dmitriev AA, Snezhkina AV, et al. Deregulation ofglycolysis in cancer: glyceraldehyde-3-phosphate dehydrogenase asa therapeutic target[J]. Expert Opin Ther Targets, 2013, 17 (6): 681-93. DOI: 10.1517/14728222.2013.775253. |
| [22] | Creaney J, Dick IM, Yeoman D, et al. Auto-Antibodies to beta-F1-ATPase and vimentin in malignant mesothelioma[J]. PLoS One, 2011, 6 (10): 0026515. DOI: 10.1371/journal.pone.0026515. |
| [23] | Sanchez-Arago M, Formentini L, Martinez-Reyes I, et al. Expression,regulation and clinical relevance of the ATPase inhibitory factor 1in human cancers[J]. Oncogenesis, 2013, 24 (2): e46. |
| [24] | Yin T, Lu L, Xiong ZG, et al. ATPase inhibitory factor 1 is aprognostic marker and contributes to proliferation and invasion ofhuman gastric cancer cells[J]. Biomed Pharmacother, 2015, 70 (8): 90-6. |
| [25] | Lin PC, Lin JK, Yang SH, et al. Expression of beta-F1-ATPase andmitochondrial transcription factor A and the change inmitochondrial DNA content in colorectal cancer: clinical dataanalysis and evidence from an in vitro study[J]. Int J Colorectal Dis, 2008, 23 (12): 1223-32. DOI: 10.1007/s00384-008-0539-4. |
| [26] | Pullman ME, Monroy GC. A naturally occurring inhibitor ofmitochondrial adenosine triphosphatase[J]. J Biol Chem, 1963, 238 (10): 3762-69. |
| [27] | Bason JV, Montgomery MG, Leslie AG. Pathway of binding of theintrinsically disordered mitochondrial inhibitor protein toF-1-ATPase[J]. Proc Natl Acad Sci USA, 2014, 111 (31): 11305-10. DOI: 10.1073/pnas.1411560111. |
| [28] | Formentini L, Sánchez-Aragó M, Sánchez-Cenizo L, et al. Themitochondrial ATPase inhibitory factor 1 triggers a ROS-mediatedretrograde pro-survival and proliferative response[J]. Mol Cell, 2012, 45 (4): 731-42. |
| [29] | Govatati S, Deenadayal M, Shivaji SA. Mitochondrial displacementloop alterations are associated with endometriosis[J]. Fertil Steril, 2013, 99 (7): 1980. DOI: 10.1016/j.fertnstert.2013.02.021. |
| [30] | Wei SH, Fukuhara H, Kawada C, et al. Silencing of ATPaseinhibitory factor 1 inhibits cell growth via cell cycle arrest inbladder cancer[J]. Pathobiology, 2015, 82 (5): 224-32. DOI: 10.1159/000439027. |
| [31] | Mayer A, Hoeckel M, Wree A, et al. Lack of hypoxic response inuterine leiomyomas despite severe tissue hypoxia[J]. Cancer Res, 2008, 68 (12): 4719-26. DOI: 10.1158/0008-5472.CAN-07-6339. |
| [32] | Huang LJ, Chuang IC, Dong HP, et al. Hypoxia-inducible factor 1alpha regulates the expression of the mitochondrial atpase inhibitorprotein (if1) in rat liver[J]. Shock, 2011, 36 (1): 90-6. DOI: 10.1097/SHK.0b013e318219ff2a. |
| [33] | Kroemer G. Mitochondria in cancer[J]. Oncogene, 2006, 25 (34): 4630-2. DOI: 10.1038/sj.onc.1209589. |
 2016, Vol. 36
2016, Vol. 36

