2. 西安交通大学第二附属医院病理科,陕西 西安 710004 ;
3. 西安交通大学第二附属医院陕西省肝脾疾病临床医学研究中心,陕西
2. Department of Pathology, Second Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710004, China ;
3. Shaanxi Provincial Clinical Research Centerfor Hepatic and Splenic Diseases, Xi'an 710004, China
肝细胞癌(Hepatocellular carcinoma, HCC)是世界上最常见的恶性肿瘤,我国是原发性肝癌的高发国家,2015年新发HCC病例数达46.6万,在所有新发肿瘤中,仅次于肺癌、胃癌和食道癌,排第4位[1]。肿瘤发生率存在性别差异是HCC一个显著的流行病学特点,HCC多发于男性,男女比例在国内为2.8~6.4:1,同时女性患者通常肿瘤结节数较少,肿瘤较小,且较少出现血管浸润,患者预后较好,存活时间较男性HCC 患者延长[1-2]。
Naugler 等[3]的研究显示雌激素可抑制Kupffer 细胞产生白介素-6,抑制STAT3 信号通路的活化与女性患者HCC发生风险降低有关, 而且切除卵巢后化学药物诱导大鼠HCC成瘤率和肺转移率增高、肝肿瘤平均直径明显增大[4]。研究还显示HCC患者血清雌激素水平较低,肝癌组织中雌激素受体表达与肿瘤的分期有关[5-7],而且雌激素可通过与其受体结合抑制NF-KB活性,从而控制肿瘤的生长[6, 8]。
近年来虽然HCC的治疗不断发展,但由于高侵袭和高复发的特点,总体治疗效果较差。干扰素诱导跨膜蛋白3(IFITM3)、沉默信息调节因子3(SIRT3)与肝细胞癌的增殖和侵袭密切相关[9-10],基质金属蛋白酶(Matrix metalloproteinases, MMPs)被认为是促使肿瘤细胞完成侵袭转移过程的关键性分子,其中最具有代表性的是MMP-2 和MMP-9,其与HCC的发生发展及预后密切相关[11-12]。AKT信号通路在HCC发生发展过程中发挥重要作用,包括肝癌细胞凋亡、增殖、化疗耐药、侵袭转移过程等[13-16]。AKT信号通路能够通过调节MMP-9的表达发挥调节HCC侵袭转移的作用[17]。雌激素是否通过调节AKT信号通路活性抑制肝癌细胞侵袭转移尚不清楚。本研究拟观察雌激素是否通过调节AKT信号通路活性抑制肝癌细胞侵袭转移能力。
1 材料和方法 1.1 材料人肝细胞癌MHCC97H细胞株由本实验室保有。DMEM和胎牛血清购自Hyclone公司。AKT和p-AKT 购于cellsignal 公司,beta-actin 购自Santa-crus 公司。17-β-雌二醇(Estradiol)为Sigma公司产品。
1.2 细胞培养与干预MHCC97H肝癌细胞使用含有10%胎牛血清的DMEM培养基培养,当细胞融合率达到70%~80%时进行传代,传代间隔约为2~3 d。17-β-雌二醇采用二甲基亚砜(DMSO)溶解,DMSO的最终浓度<0.1%,其后用PBS稀释至工作浓度。待MHCC97H细胞长到融合后,PBS洗涤3次,加入无血清DMEM培养基培养24 h,之后按照实验要求加入雌激素,PBS(对照)。雌激素的浓度均为0、0.1和1 μmol/L,处理时间为24 h。其后提取总蛋白进行免疫印迹分析。
1.3 细胞侵袭试验取对数生长期MHCC97H肝癌细胞,胰酶常规消化后利用血清浓度为2%的培养基制成5×105细胞/mL 的细胞悬液,在Transwell小室上室中加入含有不同浓度雌激素的细胞悬液0.4 mL,下室中加入血清浓度为10%的常规培养基。24 h后取出小室对细胞进行固定,用棉签去除上室中残留细胞并对小室底部细胞进行固定、染色和拍照,并在显微镜下进行计数。
1.4 划痕实验取对数生长期MHCC97H细胞,以合适的密度将细胞接种于6孔板,使用含2%血清的DMEM培养基,置于37 ℃孵箱中培养。待培养细胞生长至汇合80%时,用200 μL tip枪头在细胞表面制造“伤口”,加入不同浓度雌激素进行培养(0、0.1和1 μmol/L),分别在其后0和24 h后,用倒置显微镜观察,拍照记录伤口间距离。
1.5 免疫印迹试验雌激素处理MHCC97H细胞24 h,常规消化细胞后冰PBS洗涤2次,加入裂解液裂解细胞,离心提取蛋白。利用BCA蛋白定量试剂盒检测蛋白浓度,并根据蛋白提取物浓度确定上样量。每次试验之前将蛋白煮沸变性、然后在SDS凝胶中每孔加入等量蛋白,根据目的蛋白分子量调整电泳时间和电压,电泳结束后转膜,将PVDF膜置于5%脱脂牛奶中封闭1 h。根据抗体说明书配置一抗浓度,然后将膜封闭于含有各种抗体的溶液中,4 ℃摇床过夜。次日PBST洗膜3次,然后常温封闭相应二抗1 h、再次用PBST 洗涤3 次,最后一次用PBS洗涤,洗涤时间均为15 min。最后利用成像系统对结果图像进行采集,并对数据进行分析。
1.6 统计学分析所有数据以均数±标准差表示,组间均数比较采用单因素方差分析或t检验。取P<0.05为差异具有统计学意义,本实验数据用SPSS17.0统计软件进行分析处理。
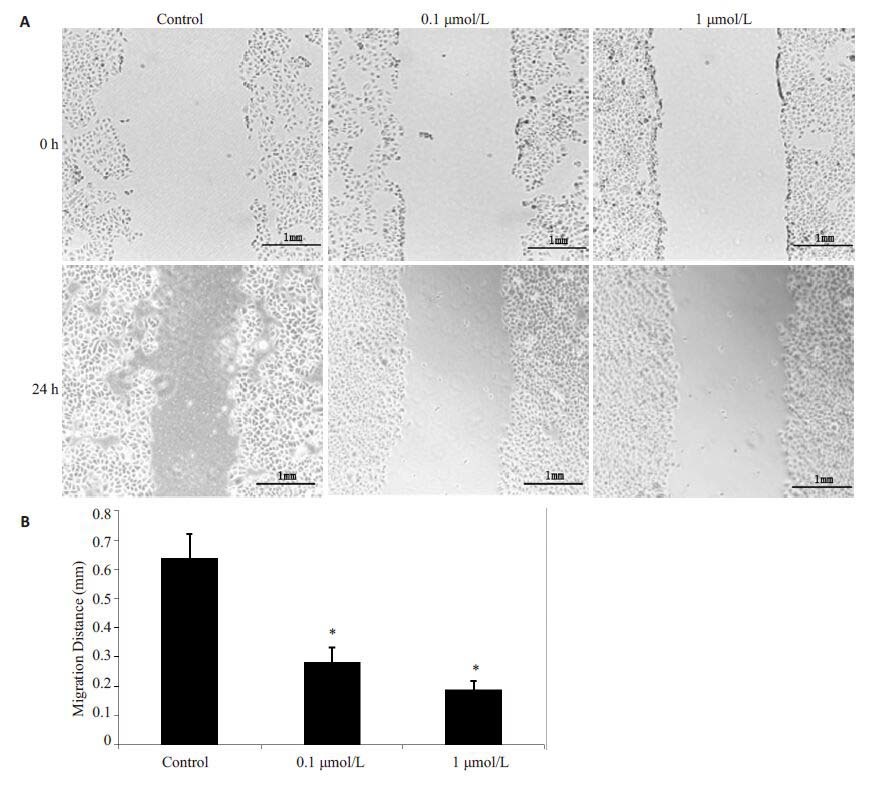
2 结果 2.1 雌激素对MHCC97H肝癌细胞迁移的影响MHCC97H肝癌细胞具有较强的迁移能力,我们实验结果显示在划痕24 h后MHCC97H肝癌细胞的划痕能够愈合50%左右,但是在雌激素干预后,MHCC97H 肝癌细胞划痕的愈合速度明显减慢,随着浓度的升高,这种作用变得更加明显(图 1)。
|
图 1 雌激素干预对MHCC97H细胞划痕愈合的影响 Figure 1 Effect of estrogen on wound healing of MHCC97H cells (Original magnification: ×20) . A: Migration of MHCC97H cells after estrogen treatment; B: Compared with the control cells, estrogen-treated MHCC97H cells showed significantly decreased migration distance. *P<0.05. |
|
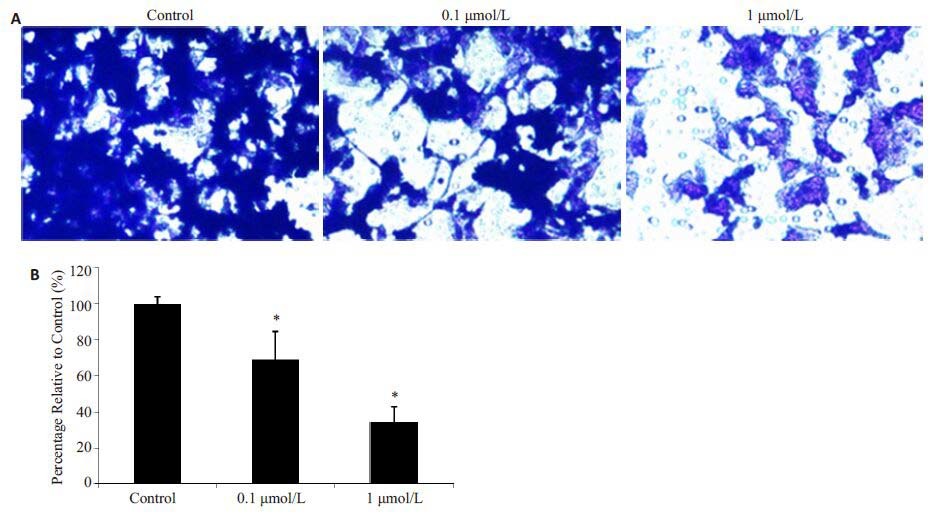
图 2 雌激素对MHCC97H细胞侵袭转移能力的影响 Figure 2 Inhibitory effect of estrogen on invasion of MHCC97H cells. A: Cells penetrating the matrigel to arrive at the bottom of the chamber (× 400) ; B:Percentage of cells reaching the bottom of the chamber in different groups. *P<0.05. |
|
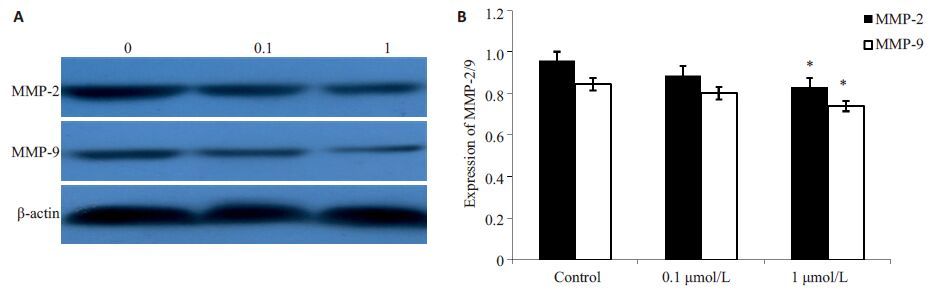
图 3 雌激素对MHCC97H细胞中MMP-2和MMP-9蛋白表达水平的影响 Figure 3 Inhibitory effect of estrogen on expressions of MMP-2 and MMP-9 proteins in MHCC97H cells. A: Western blotting of MMP-2 and MMP-9in cells treated with estrogen; B: Relative expression level of MMP-2 and MMP-9. *P<0.05 vs control. |
|
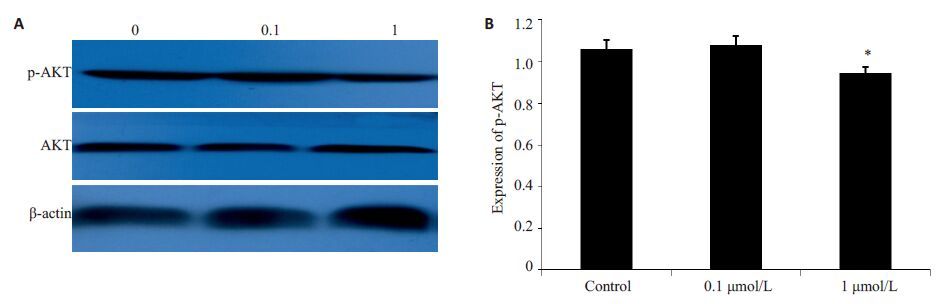
图 4 雌激素对AKT 信号通路活性的影响 Figure 4 Effect of estrogen on activity of AKT signal pathway. A: Western blotting of protein expressions of p-AKT in cells treated with estrogen; B: Relative expression of p-AKT. *P<0.05 vs control. |
MHCC97H肝癌细胞的侵袭能力较强,但在雌激素干预后,MHCC97H肝癌细胞的侵袭能力受到明显抑制,穿过基质胶到达小室底端的肝癌细胞数量明显减少,随着雌激素浓度的增加,穿过基质胶到达小室底端的MHCC97H肝癌细胞的数目逐渐减少,0.1 μmol/L和1 μmol/L浓度组MHCC97H肝癌细胞穿过基质胶到达小室底端的细胞数目,分别为对照组的(68.99±15.74)%和(34.28±8.17)%(P<0.05)。
2.3 雌激素对MHCC97H 肝癌细胞中MMP-2 和MMP-9表达的影响MMP-2和MMP-9在肝癌的侵袭转移过程中发挥重要作用。在雌激素干预后,MHCC97H肝癌细胞中,MMP-2和MMP-9的蛋白表达水平明显降低,当浓度达到1 μmol/L时,差异具有统计学意义(P<0.05)。
2.4 雌激素对MHCC97H肝癌细胞中AKT信号通路活性的影响AKT信号通路能够通过调节MMP-2和MMP-9等的表达与活性,调节肿瘤细胞的侵袭转移,而AKT的磷酸化水平能够反映AKT信号通路的活性。我们的结果显示,在雌激素作用后AKT的磷酸化水平明显降低,当浓度达到1 μmol/L 时,磷酸化水平降低为对照组的(90±2)%,差异有统计学意义(P<0.05)。
3 讨论肝细胞癌恶性程度较高且治疗选择有限,流行病学研究发现HCC在男性中的发病率远高于女性,且预后较差[1-2, 8, 18]。男性患者中慢性肝病发展为肝硬化的进程也较为迅速,且肝硬化导致的肝癌多发生于男性和绝经后女性患者[19]。进一步研究显示雌激素可抑制炎症诱导的HCC的发生,从而降低女性患者发生HCC风险,通过抑制NF-KB活性控制肿瘤生长[3, 6, 8]。这些研究结果提示,雌激素在HCC的发生发展过程中发挥重要作用。
肝细胞癌的发生发展是多种因素共同作用的结果,累及到多个信号通路包括STAT3,NF-KB,Wnt/β-catenin,JNK等信号通路[3, 6, 8, 20-22]。肿瘤细胞的侵袭转移过程也极为复杂,许多分子参与其中。在这个过程中肿瘤细胞需要从原发部位脱离,经过诸多环节最终到达转移位点。肿瘤细胞完成这一过程,需要获得特别的性能,这些新特性的获得能够帮助它们从原发肿瘤脱离、迁移进入周围组织、进入循环系统、到达远处并最终在到达部位形成新的肿瘤病灶。MMPs是促使肿瘤细胞完成侵袭转移过程的关键性分子,其中MMP-2 和MMP-9与HCC的发生发展及预后密切相关[11-12]。AKT 信号通路在HCC发生发展过程中发挥重要作用,该通路可通过调节MMP-9的表达抑制肝癌细胞侵袭转移[17]。研究还发现PTEN能够通过调节AKT信号通路进一步调节MMP-2和MMP-9的表达,抑制HCC的侵袭转移[23]。此外,在乳腺癌相关的研究中显示,雌激素能够通过调节AKT信号通路的活性,发挥其在乳腺癌发生发展中的作用[24-25]。雌激素对肝癌细胞侵袭转移的影响是否与AKT信号通路活性有关尚未见有文献报道。因此,我们假设雌激素有可能通过调节AKT信号通路活性抑制肝癌细胞侵袭转移。
已有文献报道17-β雌二醇能够抑制心肌细胞中MMP-9的表达[26],同时临床研究也显示肝癌组织中高表达MMP-9与肿瘤的侵袭转移有关,伴有门静脉癌栓形成HCC患者MMP-9的表达水平明显高于不伴有门静脉转移的HCC患者[6]。我们的结果显示雌激素可抑制MHCC97H肝癌细胞的迁移和侵袭转移能力,且随着雌激素浓度的增加抑制作用增强,这些结果进一步支持雌激素对HCC发生发展的保护作用,与以前报道的文献一致[3, 6, 8]。我们的结果还显示雌激素干预后,MHCC97H肝癌细胞MMP-2和MMP-9的蛋白表达水平明显降低,伴随有AKT磷酸化水平的明显降低。这些结果证实了我们的假设,支持雌激素抑制肝癌的发生发展,至少部分通过调节AKT信号通路活性。
综上所述,我们的研究存在一些局限性,如选择单一的肝癌细胞株进行体外实验,仅有2个雌激素干预浓度,没有动物实验,没有肝癌患者的临床分期和预后的相关研究结果等。但是,我们的研究结果提示雌激素能够有效抑制MHCC97H肝癌细胞的侵袭转移,其可能部分通过调节AKT信号通路的活性进一步调节MMP-2和MMP-9的表达,这有待进一步的研究。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66 (2): 115-32. DOI: 10.3322/caac.21338. |
| [2] | Li T, Qin LX, Gong X, et al. Clinical characteristics, outcome, andrisk factors for early and late intrahepatic recurrence of femalepatients after curative resection of hepatocellular carcinoma[J]. Surgery, 2014, 156 (3): 651-60. DOI: 10.1016/j.surg.2014.04.008. |
| [3] | Naugler WE, Sakurai T, Kim S, et al. Gender disparity in livercancer due to sex differences in MyD88-dependent IL-6 production[J]. Science, 2007, 317 (5834): 121-4. DOI: 10.1126/science.1140485. |
| [4] | 王永仓, 许戈良, 英卫东, 等. 生理性雌激素对大鼠肝癌生成的保护作用[J]. 中华实验外科杂志, 2011, 28 (7): 1105-6. |
| [5] | El MahdyKorah T, Abd Elfatah Badr E, Mohamed Emara M, et al. Relation between sex hormones and hepatocellular carcinoma[J]. Andrologia, 2016, 48 (9): 948-55. |
| [6] | Sheng ML, Xu GL, Zhang CH, et al. Aberrant estrogen receptoralpha expression correlates with hepatocellular carcinomametastasis and its mechanisms[J]. Hepatogastroenterology, 2014, 61 (129): 146-50. |
| [7] | Kim JH, Choi YK, Byun JK, et al. Estrogen-related receptor γ isupregulated in liver cancer and its inhibition suppresses liver cancercell proliferation via induction of p21 and p27[J]. Exp Mol Med, 2016, 48 : e213. DOI: 10.1038/emm.2015.115. |
| [8] | Xu HW, Wei YN, Zhang Y, et al. Oestrogen attenuates tumourprogression in hepatocellular carcinoma[J]. J Pathol, 2012, 228 (2): 216-29. DOI: 10.1002/path.v228.2. |
| [9] | 吴荣寿, 邬林泉, 李科浩, 等. 沉默干扰素诱导跨膜蛋白3可抑制肝癌细胞HepG2增殖和侵袭[J]. 南方医科大学学报, 2016, 36 (2): 244-9. |
| [10] | 陶颖, 陈娟. 沉默信息调节因子3对肝癌细胞增殖的影响[J]. 南方医科大学学报, 2016, 36 (2): 195-9. |
| [11] | Asha Nair S, Karunagaran D, Nair MB, et al. Changes in matrixmetalloproteinases and their endogenous inhibitors during tumorprogression in the uterine cervix[J]. J Cancer Res Clin Oncol, 2003, 129 (2): 123-31. |
| [12] | Chen KL, Zhang S, Ji YY, et al. Baicalein inhibits the invasion andmetastatic capabilities of hepatocellular carcinoma cells viadown-regulation of the ERK pathway[J]. PLoS One, 2013, 8 (9): e72927. DOI: 10.1371/journal.pone.0072927. |
| [13] | Sui Y, Zheng X, Zhao D. Rab31 promoted hepatocellular carcinoma(HCC) progression via inhibition of cell apoptosis induced by PI3K/AKT/Bcl-2/BAX pathway[J]. Tumour Biol, 2015, 36 (11): 8661-70. DOI: 10.1007/s13277-015-3626-5. |
| [14] | Gedaly R, Angulo P, Hundley J, et al. PKI-587 and sorafenibtargeting PI3K/AKT/mTOR and Ras/Raf/MAPK pathwayssynergistically inhibit HCC cell proliferation[J]. J Surg Res, 2012, 176 (2): 542-8. DOI: 10.1016/j.jss.2011.10.045. |
| [15] | Ma S, Lee TK, Zheng BJ, et al. CD133+ HCC cancer stem cellsconfer chemoresistance by preferential expression of the Akt/PKBsurvival pathway[J]. Oncogene, 2008, 27 (12): 1749-58. DOI: 10.1038/sj.onc.1210811. |
| [16] | Carr BI, Wang Z, Wang M, et al. c-Met-Akt pathway-mediatedenhancement of inhibitory c-Raf phosphorylation is involved invitamin K1 and sorafenib synergy on HCC growth inhibition[J]. Cancer Biol Ther, 2011, 12 (6): 531-8. DOI: 10.4161/cbt.12.6.16053. |
| [17] | Chen JS, Wang Q, Fu XH, et al. Involvement of PI3K/PTEN/AKT/mTOR pathway in invasion and metastasis in hepatocellularcarcinoma: Association with MMP-9[J]. Hepatol Res, 2009, 39 (2): 177-86. DOI: 10.1111/hep.2009.39.issue-2. |
| [18] | Singal AG, El-Serag HB. Hepatocellular carcinoma from epidemiologyto prevention: translating knowledge into practice[J]. ClinGastroenterol Hepatol, 2015, 13 (12): 2140-51. |
| [19] | Shimizu I. Impact of oestrogens on the progression of liver disease[J]. Liver Int, 2003, 23 (1): 63-9. DOI: 10.1034/j.1600-0676.2003.00811.x. |
| [20] | 谢海亮, 蒋晗, 吴福生. Wnt/β-catenin信号通路在肝细胞癌中的促进作用[J]. 南方医科大学学报, 2014, 34 (6): 913-6. |
| [21] | Maeda S, Kamata H, Luo JL, et al. IKKbeta couples hepatocytedeath to cytokine-driven compensatory proliferation that promoteschemical hepatocarcinogenesis[J]. Cell, 2005, 121 (7): 977-90. DOI: 10.1016/j.cell.2005.04.014. |
| [22] | Sakurai T, Maeda S, Chang L, et al. Loss of hepatic NF-kappa Bactivity enhances chemical hepatocarcinogenesis through sustainedc-Jun N-terminal kinase 1 activation[J]. Proc Natl Acad Sci USA, 2006, 103 (28): 10544-51. DOI: 10.1073/pnas.0603499103. |
| [23] | Tian T, Nan KJ, Guo H, et al. PTEN inhibits the migration andinvasion of HepG2 cells by coordinately decreasing MMPexpression via the PI3K/Akt pathway[J]. Oncol Rep, 2010, 23 (6): 1593-600. |
| [24] | Ray S, Darbre PD. Crosstalk with insulin and dependence on PI3K/Akt/mTOR rather than MAPK pathways in upregulation of basalgrowth following long-term oestrogen deprivation in three humanbreast cancer cell lines[J]. Horm Mol Biol Clin Investig, 2011, 5 (2): 53-65. |
| [25] | Seow HF, Yip WK, Loh HW, et al. Immunohistochemical detectionof phospho-Akt, phospho-BAD, HER2 and oestrogen receptorsalpha and beta in Malaysian breast cancer patients[J]. Pathol OncolRes, 2010, 16 (2): 239-48. |
| [26] | Lee JY, Choi HY, Na WH, et al. 17β-estradiol inhibits MMP-9 andSUR1/TrpM4 expression and activation and thereby attenuatesBSCB disruption/hemorrhage after spinal cord injury in male rats[J]. Endocrinology, 2015, 156 (5): 1838-50. DOI: 10.1210/en.2014-1832. |
 2016, Vol. 36
2016, Vol. 36

