经皮腔内成形术(PTA)在下肢动脉闭塞性疾病(LEAOD)的治疗中应用越来越广泛,逐渐成为首选的血运重建策略[1-2],它是通过腔内置入球囊或支架的扩张等作用消除血管的狭窄或闭塞,但是远期通畅率低一直是制约这项微创技术发展的瓶颈,50%~60%的患者PTA术后1年内出现再狭窄、再闭塞[3-4]。各种药物涂层支架的出现能有效降低再狭窄率、提高近远通畅率[5],但是下肢动脉病变弥漫、血管迂曲等特点一定程度上限制了其在该领域的应用,且其本身仍存在支架断裂、移位及支架内再狭窄[4]等问题。球囊扩张成形术方法相对简单,不遗留支架于管腔内,且较少受动脉管径和部位的限制,大小动脉、关节弯曲处、动脉分叉处、长段狭窄均可施实,有学者认为球囊扩张成形术将发展成为LEAOD腔内治疗的主要方法[6]。为了减低球囊扩张成形术后靶病变血管再狭窄发生率,药涂球囊(DCB)应运而生,在动物试验及冠状动脉病变领域已经证实了DCB成形术可观的疗效及安全性[7-8]。然而在LEAOD领域其疗效及安全性仍在广泛争议,多个关于DCB成形术和其他腔内技术在治疗LEAOD的临床相关随机对照试验(RCT)持有不同结论:大多数试验支持DCB成形术疗效及安全性更优越,也有试验结果认为其疗效无显著优势甚至安全性方面逊于其他腔内技术[9, 16-17]。因此,本文采用Meta分析的方法评价DCB对比非药涂球囊(UCB)成形术治疗LEAOD的疗效及安全性,为临床应用提供科学±据。
1 资料和方法 1.1 文献纳入与排除标准纳入标准:(1)DCB成形术对比UCB成形术治疗LEAOD;(2)RCT;(3)意向治疗分析;(4)随访时间不短于6个月;(5)语言限制为中英文。排除标准:(1)治疗血管段涉及除下肢动脉外其他任何血管;(2)主要干预措施含DEB成形术、UCB成形术外其他方案;(3)重复研究,回顾性研究,个案报道,动物试验;(4)病例数小于20,失访率大于10%。
1.2 检索策略计算机检索Cochrane 图书馆临床对照试验资料库、Pubmed、Embase、万方数据库、中国学术期刊全文数据库、中国生物医学文献数据库、维普数据库,检索文章时间为各大数据库建库至2016 年6 月。中文检索词包括:下肢动脉、股腘动脉、膝下动脉、经皮球囊成形术、药涂球囊、随机对照试验及其近意词,英文检索词包括:lower extremity artery,femoropoplitealartery,infrapopliteal artery,percutaneous transluminalangioplasty,drug-coated balloon,randomized controlledtrial及其近意词。
1.3 资料筛选及质量评价 1.3.1 文献筛选及资料提取由2名评价员对文献进行独立筛查和资料提取,筛查过程中严格遵循纳入标准和排除标准。2名评价员意见不一致时通过讨论或咨询专家解决;相关资料不全时,联系作者进行资料补充。按照事先设计好的资料提取表提取以下信息:试验的基本情况、两组患者的基本情况、术后6个月再狭窄率(随访动脉造影病变段管腔狭窄≥50%即定义为再狭窄)、晚期管径丢失(LLL,术前与术后6个月动脉造影狭窄段最小直径的差值)、术后1年TLR率、术后1年通畅率、术后1年的死亡率及截肢率。
1.3.2 文献质量评价由2名评价员按照Cochrane协作网提供的方法,分别对各独立研究从以下几个方面进行质量评估,以考察各项研究是否存在偏倚及其影响程度:(1)是否随机序列产生;(2)是否分配隐藏;(3)是否实施研究对象盲法;(4)是否实施研究者盲法;(5)是否存在不完整数据报道;(6)是否存在选择性结果报道。
1.4 统计学方法采用Cochrane 协作网的RevMan5.3 软件进行Meta分析,异质性检验采用χ2检验。若纳入研究具有临床同质性,且P>0.1、I2≤50%,表明异质性无统计学意义,采用固定效应模型进行分析。当P≤0.1、I2>50%时,表明异质性存在统计学意义,尽量寻找异质性来源,进行敏感性分析,采用随机效应模型进行分析。计数资料以优势比作为效应尺度的指标,连续变量选用加权均数差表示分析结果,各效应量均以95%可信区间表示;潜在的发表偏倚则采用软件提供的“倒漏斗图”来判断,检验水准α=0.05。
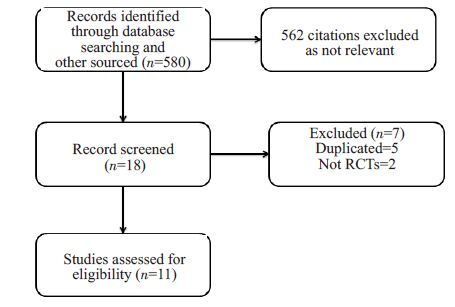
2 结果 2.1 文献检索结果及纳入研究的一般情况根据文献筛选流程(图 1),共纳入11个临床RCT,其中9个试验为多中心设计[10-11, 14-20]。所有RCT中药涂球囊均为紫杉醇涂层球囊,药物浓度为2~3.5 μg/mm2。其中1个试验设计有中介组,干预措施为采用UCB腔内成形和溶解有一定剂量紫杉醇药物的造影剂造影,包含有52 例患者,此次分析将该52 例患者排除[20];其余10个试验均将患者随机分入DCB组和UCB组。最终一共纳入1853名患者共包含2150处动脉病变进行分析,其中DCB组有1110名患者,包含1288处动脉病变,UCB组有743 名患者,包含862 处动脉病变,纳入研究患者的主要特征见表 1。11 个试验中有2 个试验研究病变涉及股、腘及膝下动脉[10, 13],6 个试验研究病变涉及股动脉及腘动脉[14, 16-20],3个试验研究病变仅涉及膝下动脉[11-12, 15],所有纳入研究病变段动脉的主要特征(表 2)。
|
图 1 文献筛选流程图 Figure 1 Flow chart of the trial selection process. |
| 表 1 纳入研究患者的主要特征 Table 1 Main characteristics of patients enrolled in the trials |
| 表 2 纳入研究病变段动脉的主要特征 Table 2 Main characteristics of target lesion in the trials |
所有患者均接受药物抗血小板治疗,腔内成形术前口服阿司匹林、氯吡格雷负荷剂量,术后口服阿司匹林、氯吡格雷双通道抗血小板维持时间不少于1月。纳入研究中少部分病变段(约7.0%)因球囊成形术后病变段管腔仍残留严重狭窄而接受金属裸支架植入。平均随访时间16.4月,所有试验的主要观察指标均包含随访第6~12月行动脉造影检查资料。
2.2 纳入研究的质量评价所有研究均实施随机方法,部分研究提及分配隐藏,所有研究均实施研究对象盲法,因DCB和UCB特殊外观差异无法实施研究者盲法,所有研究均无不完整数据报道和选择性结果报道(表 3)。
| 表 3 质量方法学评价 Table 3 Evaluation of the quality and methodology of the trials |
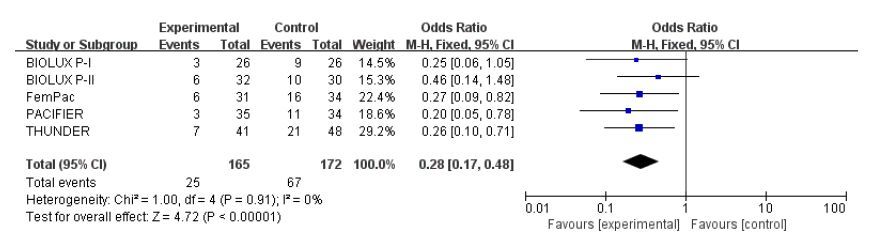
共有5项试验报道了术后6个月再狭窄率,各研究间异质性无统计学意义(I2=0,P=0.91),具有较好同质性,采用固定效应模式。Meta分析结果显示:两组间存在统计学差异,DCB组再狭窄率明显低于UCB组(15.2% vs 39.0%;OR:0.28;95%CI:0.17~0.48;P<0.000 01,图 2)。
|
图 2 术后6个月再狭窄率的meta分析结果 Figure 2 Meta-analysis of restenosis rate at 6 months after operation. |
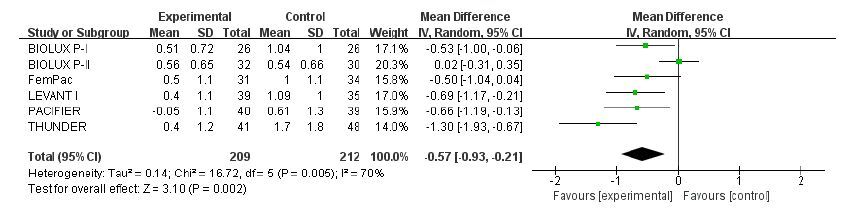
共有6个试验报道了术后6个月管径丢失,各研究间存在统计学异质性(I2=70%,P=0.005),故采用随机效应模式。Meta分析结果显示:两组间存在统计学差异,DCB组LLL 明显小于UCB组(range-0.05 to 0.56 vs 0.54 to 1.7;WMD:-0.57;95%CI:-0.93~-0.21;P=0.002,图 3)。
|
图 3 术后LLL的meta分析结果 Figure 3 Meta-analysis of LLL after operation. |
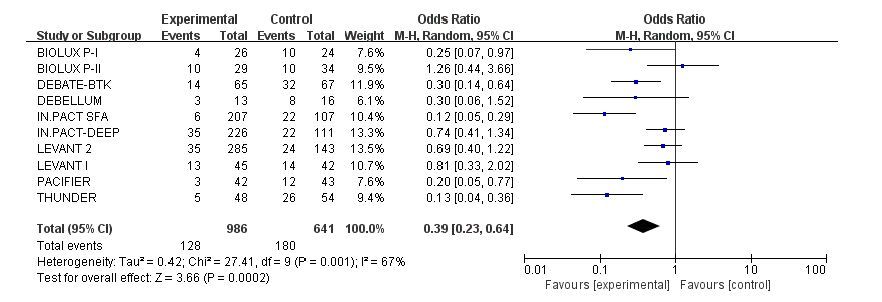
共有10个试验报道了术后1年TLR 率,各研究间存在统计学异质性(I2=67%,P=0.001),故采用随机效应模式。Meta分析结果显示:两组间存在统计学差异,DCB组TLR率明显低于UCB组(13.0% vs 28.1% ;OR:0.39;95% CI:0.23~0.64;P=0.000 2,图 4)。
|
图 4 术后1年靶病变血运重建率的meta分析结果 Figure 4 Meta-analysis of TRL at 1 year after operation. |
共有3个试验报道了术后1年通畅率,各研究间存在统计学异质性(I2=73%,P=0.02),故采用随机效应模式。Meta分析结果显示:两组间存在统计学差异,DCB 组术后1 年通畅率高于UCB 组(71.8% vs 52.9%;OR:2.32;95%CI:1.21~4.43;P=0.01,图 5)。
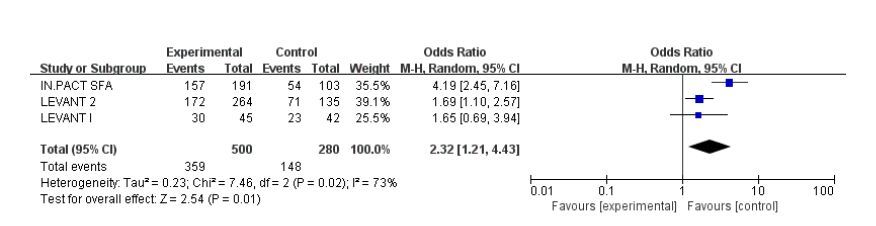
|
图 5 术后1年通畅率的meta分析结果 Figure 5 Meta-analysis results of patency rate at 1-year after operation. |
共有9个试验报道了术后1年的死亡率,各研究间异质性无统计学意义(I2=0,P=0.63),具有较好同质性,采用固定效应模式。Meta分析结果显示:DCB组与UCB组两组间术后1年的死亡率比较无统计学意义(4.8% vs 5.0%;OR:1.00;95%CI:0.62~1.63;P=0.99,图 6)。
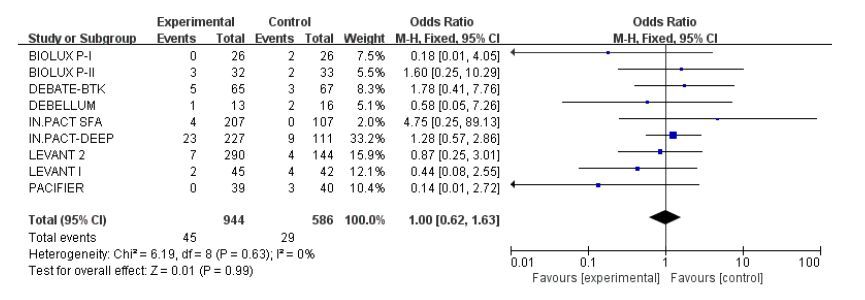
|
图 6 术后1年的死亡率的meta分析结果 Figure 6 Meta-analysis of mortality rate at 1 year after operation. |
共有8个试验报道了术后1年的截肢率,各研究间异质性无统计学意义(I2=0,P=0.66),具有较好同质性,采用固定效应模式。Meta分析结果显示:DCB组与UCB组两组间术后1年的截肢率比较无统计学意义(3.4% vs 2.9%;OR:1.41;95%CI:0.74~2.70;P=0.30,图 7)。
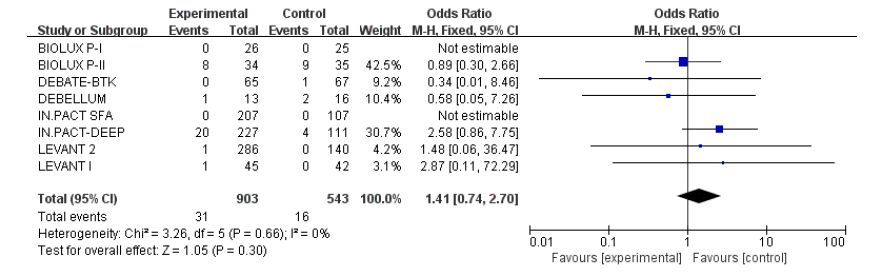
|
图 7 术后1年的截肢率的meta分析结果 Figure 7 Meta-analysis of amputation rate at 1 year after operation. |
6个Meta分析结果中有3个统计结果(LLL、术后1年TLR率及通畅率)出现了异质性,但采用随机效应模型及固定效应模型分析得出的结果是一致的。在LLL的分析中,发现试验BLOLUX P-Ⅱ[11]异质性较大,去除该试验后同质性较好(I2=12%,P=0.43),Meta分析结果无改变(WMD:-0.69;95%CI:-0.93~-0.46;P<0.000 01)。术后1 年TLR率分析中未发现明显异质性较大的研究。术后1 年通畅率的分析中,发现试验IN.PACTSFA[16]异质性较大,去除该试验后同质性较好(I2=0,P=0.97),Meta 分析结果无改变(OR:1.68,95%CI:1.15~2.45,P=0.007)。分析异质性的原因可能与各个试验中心术者的操作熟练程度有关,同时各个试验方法学质量也有差异,故在临床及统计学两方面均可能存在异质性,但其不同的效应模型及去除异质性较大试验后的分析结果是一致的。
2.5 发表偏倚为反映纳入研究的发表偏倚情况,采用主要指标术后1年的死亡率对纳入文献进行漏斗图分析,结果显示,代表 9项RCT的散点基本呈漏斗状,对称分布于有效线两侧,都落在95%线性范围内,发表偏倚较小(图 8)。
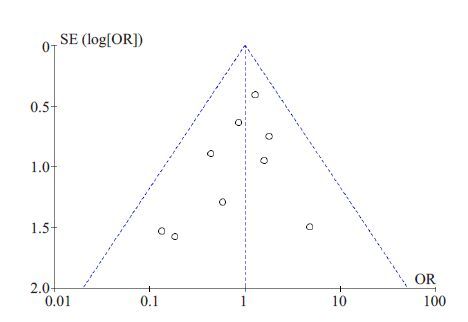
|
图 8 术后1年死亡率的漏斗图 Figure 8 Funnel plot of mortality rate at 1-year after operation. |
PTA术后再狭窄主要是由于内膜增生和动脉粥样硬化导致的,是血管壁受到机械刺激后的一种过度反映。腔内操作本身导致不同程度的血管壁损伤,大量胶原纤维的暴露会导致血小板在损伤处沉积形成血栓,中性粒细胞、巨噬细胞和T 细胞等炎性细胞在损伤区域聚集导致的炎症反应使血管平滑肌细胞的癌基因被激活从而大量增殖最终导致管腔狭窄[21]。DCB 通过在球囊表面涂上紫杉醇、西罗莫司等抗增殖抗炎药物,通过球囊扩张使涂层药物与病变血管壁充分接触,75%的药物能够迅速渗透到动脉壁中通过抗增生,抗炎作用抑制和延缓平滑肌细胞的迁移和增殖进而预防PTA 再狭窄[22]。理论上讲DCB既能够提高靶血管近远期通畅率,也规避了植入支架的潜在风险。本研究对所纳入的11个临床RCT(共1853名患者包含2150处动脉病变)进行了Meta分析,结果显示:LEAOD与UCB扩张术相比较,DCB扩张术明显降低了术后6个月的再狭窄率及晚期管径丢失程度,可避免靶血管再次血运重建,死亡率及截肢率的差异无统计学意义。因此结合本分析结果,可以认为DCB扩张术能有效的抑制和延缓平滑肌细胞的迁移和增殖,进而预防术再狭窄、提高通畅率。本研究推荐在LEAOD的腔内治疗中,特别是膝下动脉、分叉动脉及末梢动脉等复杂病变处,可优先考虑使用DEB成形术,成功率高,适用动脉范围广,术后无残留支架,较为突出的优势即对今后再次腔内治疗的选择无任何限制。
本次分析存在一定局限性,可能对分析结果的论证强度产生负面影响。首先,分析纳入的11个临床RCT中仅4个实施分配隐藏[10, 12, 14, 20],因DCB和UCB器械特殊外观差异全部无法实施研究者盲法;第二,各试验没有统一的抗血小板药物方案以及实施TLR指针无统一标准;第三,纳入试验的平均随访时间为16.4个月,仍需要更长时间的随访资料来评估DEB成形术的远期疗效;第四,纳入的各个试验并非采用统一标准的球囊装置,且目前介入相关器材工艺不断革新,陆续有各种新型药物涂层装置问世,故仍需要更多的相关的临床试验研究。
综上所述,与UCB成形术治疗LEAOD相比,DCB成形术是一种疗效更显著,安全性无明显差异的腔内治疗方法。但是随着腔内技术的不断革新,仍需要更多关于DCB的对比研究,在临床实践中不断探索与发展。
| [1] | Norgren L, Hiatt WR, Dormandy JA, et al. Inter-society consensus for the management of peripheral arterial disease(TASC II)[J]. Eur J Vasc Surg,2007, 45 (suppl S) : S1-70. |
| [2] | Tendera M, Aboyans V, Bartelink ML, et al. ESC guidelines on the diagnosis and treatment of peripheral artery diseases[J]. Eur Heart J,2011, 32 (6) : 2851-906. |
| [3] | Rocha KJ, Jaff MR, Crabtree TR, et al. Performance goals and endpoint assessments for clinical trials of femoropopliteal bare nitinol stents in patients with symptomatic peripheral arterial disease[J]. Catheter Cardiovasc Interv,2007, 69 (6) : 910-9. DOI: 10.1002/(ISSN)1522-726X. |
| [4] | Klein AJ, Chen SJ, Messenger JC, et al. Quantitative assessment of the conformational change in the femoropopliteal artery with leg movement[J]. Catheter Cardiovasc Interv,2009, 74 (5) : 787-98. DOI: 10.1002/ccd.v74:5. |
| [5] | Laird JR, Katzen BT, Scheinert D, et al. Nitinol stent implantation vs. balloon angioplasty for lesions in the superficial femoral and proximal popliteal arteries of patients with claudication: three-year follow-up from the resilient randomized trial[J]. J Endovascular Therapy,2012, 19 (1) : 1-9. DOI: 10.1583/11-3627.1. |
| [6] | Krokidis M, Spiliopoulos S, Katsanos K, et al. Peripheral applications of drug-coated balloons: past, present and future[J]. Cardiovasc Intervent Radiol,2013, 36 (2) : 281-91. DOI: 10.1007/s00270-012-0467-0. |
| [7] | Joner M, Byrne RA, Lapointe JM, et al. Comparative assessment of drug-eluting balloons in an advanced porcine model of coronary restenosis[J]. Thromb Haemost,2011, 105 (5, SI) : 864-72. DOI: 10.1160/TH10-11-0698. |
| [8] | Toelg R, Merkely B, Erglis A, et al. Coronary artery treatment with paclitaxel-coated balloon using a BTHC excipient: clinical results of the international real-world DELUX registry[J]. Euro Intervention,2014, 10 (5) : 591-9. |
| [9] | Siablis D, Kitrou PM, Spiliopoulos S, et al. Paclitaxel-coated balloon angioplasty versus drug-eluting stenting for the treatment of infrapopliteal long-segment arterial occlusive disease the ideas randomized controlled trial[J]. JACC Cardiovasc Interv,2014, 7 (9) : 1048-56. DOI: 10.1016/j.jcin.2014.04.015. |
| [10] | Scheinert D, Schulte KL, Zeller T, et al. Paclitaxel-releasing balloon in femoropopliteal lesions using a BTHC excipient: twelve-month results from the BIOLUX P-I randomized trial[J]. J Endovascular Therapy,2015, 22 (1) : 14-21. DOI: 10.1177/1526602814564383. |
| [11] | Zeller T, Beschorner U, Pilger E, et al. Paclitaxel-coated balloon in infrapopliteal arteries 12-month results from the BIOLUX P-II randomized trial (BIOTRONIK'S-First in man study of the passeo- 18 LUX drug releasing PTA balloon catheter vs. the uncoated passeo-18 PTA balloon catheter in subjects requiring revascularization of infrapopliteal arteries)[J]. JACC Cardiovasc Interv,2015, 8 (12) : 1614-22. DOI: 10.1016/j.jcin.2015.07.011. |
| [12] | Liistro F, Porto I, Angioli P, et al. Drug-eluting balloon in peripheral intervention for below the knee angioplasty evaluation (Debate- BTK): A randomized trial in diabetic patients with critical limb ischemia[J]. Circulation,2013, 128 (6) : 615-21. DOI: 10.1161/CIRCULATIONAHA.113.001811. |
| [13] | Fanelli F, Cannavale A, Corona M, et al. The"DEBELLUM"-lower limb multilevel treatment with drug eluting balloon-randomized trial:1-year results[J]. Cardiovasc Surg(Torino),2014, 55 (4) : 207-16. |
| [14] | Werk M, Langner S, Reinkensmeier B, et al. Inhibition of restenosis in femoropopliteal arteries: paclitaxel-coated versus uncoated balloon: femoral paclitaxel randomized pilot trial[J]. Circulation,2008, 118 (13) : 1358-65. DOI: 10.1161/CIRCULATIONAHA.107.735985. |
| [15] | Zeller T, Baumgartner I, Scheinert D, et al. Drug-eluting balloon versus standard balloon angioplasty for infrapopliteal arterial revascularization in critical limb ischemia: 12-month results from the IN.PACT deep randomized trial[J]. J Am Coll Cardiol,2014, 64 (15) : 1568-76. DOI: 10.1016/j.jacc.2014.06.1198. |
| [16] | Laird JR, Schneider PA, Tepe G, et al. Durability of treatment effect using a drug-coated balloon for femoropopliteal lesions 24-month results of IN.PACT SFA[J]. J Am Coll Cardiol,2015, 66 (21) : 2329-38. DOI: 10.1016/j.jacc.2015.09.063. |
| [17] | Rosenfield K, Jaff MR, White CJ, et al. Trial of a paclitaxel-coated balloon for femoropopliteal artery disease[J]. N Engl J Med,2015, 373 (2) : 145-53. DOI: 10.1056/NEJMoa1406235. |
| [18] | Scheinert D, Scheinert D, Duda S, et al. The Levant I (lutonix paclitaxel-coated balloon for the prevention of femoropopliteal restenosis) trial for femoropopliteal revascularization first-inhuman randomized trial of low-dose drug-coated balloon versus uncoated balloon angioplasty[J]. JACC Cardiovasc Interv,2014, 7 (1) : 11-9. DOI: 10.1161/CIRCINTERVENTIONS.113.000679. |
| [19] | Werk M, Albrecht T, Meyer DR, et al. Paclitaxel-coated balloons reduce restenosis after femoropopliteal angioplast:evidence from the randomized PACIFIER trial[J]. Circ Cardiovasc Interv,2012, 5 (12) : 831-40. |
| [20] | Tepe G, Zeller T, Albrecht T, et al. Local delivery of paclitaxel to inhibit restenosis during angioplasty of the leg[J]. N Engl J Med,2008, 358 (14) : 689-99. |
| [21] | Finn AV, Nakazawa G, Joner M, et al. Vascular responses to drug eluting stents: importance of delayed healing[J]. Arterioscler Thromb Vasc Biol,2007, 27 (7) : 1500-10. DOI: 10.1161/ATVBAHA.107.144220. |
| [22] | Herdeg C, Oberhoff M, Baumbach A, et al. Local paclitaxel delivery for the prevention of restenosis: biological effects and efficacy in vivo[J]. J Am Coll Cardiol,2000, 29 (35) : 1969-76. |
 2016, Vol. 36
2016, Vol. 36
