2. 广州医科大学医学实验中心 ;
3. 广州医科大学生理教研室,广东 广州 511436
2. Experimental Medical Research Center ,Guangzhou Medical University ;
3. Department of Physiology, Guangzhou Medical University, Guangzhou 511436, China
经皮冠状动脉介入治疗(percutaneous coronaryintervention,PCI)是目前治疗冠状动脉粥样硬化所致缺血性心脏病的有效方法之一,但由于手术引起的脂肪斑破裂、内皮剥脱、肌层损伤等原因,术后3~6 月内,30%~50%患者可能在手术局部形成再狭窄[1]。目前,相关的机理还未阐明,防治手段也很有限。Ca2 +/CaM-CaN-NFATc 信号系统是调控免疫系统基因转录的关键通路。晚近研究表明,该通路也存在于神经、骨胳、心脏、平滑肌等细胞,参与诸多生理功能调节及病理过程。目前,其在心肌肥大中的作用已得到广泛和深入的研究,但在再狭窄方面的研究还很有限。NFAT家族由5个亚型构成,可促进血管平滑肌细胞(VSMC)的迁移和增殖,通过阻断该信号可减少损伤动脉新生内膜的形成[2-3],但各个亚型的具体作用还不清楚。NFATc3参与低氧所致的肺动脉重构[4]、通过COX2调节内皮迁移和血管新生[5],其是否参与PCI术后损伤血管的再狭窄过程,目前还不清楚。
血管壁炎症反应在PCI术后再狭窄中起了关键作用[6-7]。其中,单核细胞向血管壁浸润常见于病变的早期,该过程为趋化因子MCP-1等趋化因子所介导,后者诱导单核细胞迁移,进而参与血管疾病的形成。阻断MCP-1可以防止颈动脉球囊扩张后的内膜新生[8]。在再狭窄的形成中,CaN-NFATc通路与MCP-1之间是否存在联系,目前还未阐明。
本研究通过大鼠腹主动脉球囊损伤再狭窄模型,观察CaN、NFATc3 以及炎性因子MCP-1的改变,初步探讨CaN-NFATc通路与MCP-1之间的关系,并观察相关的抑制剂CsA对血管再狭窄的干预作用。
1 材料和方法 1.1 主要仪器和手术器械PTCA球囊导管(20 mm×1.5 mm,雅培公司),超薄切片机(德国莱卡RM2015),倒置式荧光生物显微镜(1500X/CC)(德国Leica公司),ABI7500荧光定量PCR仪(美国ABI公司),PCR仪(美国Bio-rad公司),冷冻离心机(5415型,德国Eppendorf公司),核酸蛋白定量仪(美国Nano Drop公司)。
1.2 主要试剂荧光定量PCR试剂盒(TaKaRa公司),反转录试剂盒(TaKaRa公司),Trizol试剂(Invitrogen公司),PCR引物(Invitrogen公司),大鼠MCP-1 Elisa试剂盒,CaN一抗(ABCAM公司)。
1.3 动物分组36 只体质量350~450 g,10~12 周的雄性SD大鼠(购自广东省实验动物监测所),随机分为假手术组、球囊组、CsA组,每组12只大鼠。球囊组大鼠行腹主动脉球囊扩张术;CsA 组大鼠从术前3 d 至实验结束灌喂CsA 12.5 mg/kg.d;假手术组仅插入球囊导管而不扩张,也不进行任何干预。
1.4 动物模型的建立参照石永英[9]的方法,用3%戊巴比妥钠溶液按50 mg/kg 腹腔注射麻醉。将PTCA球囊导管(2 mm×15 mm)自左颈总动脉插至腹主动脉末端,注入生理盐水充盈球囊,保持压力为6 ATM,扩张30 s,回缩球囊,间歇60 s,再注入生理盐水充盈球囊,保持压力为6ATM,重复3次,撤出球囊。假手术组除不插入球囊导管外,其余操作同手术组。术后30 d处死动物,取材检验。
1.5 常规病理检查取损伤血管段,经石蜡包埋、切片,苏木素—伊红(HE)染色。采用光学显微镜和Image-Pro Plus6.0图像分析系统对各组HE染色切片进行图像分析。先测量外弹力膜、内弹力膜以及管腔的轮廓的周长,再根据公式周长=2πr,算出各个截面的半径,逐步测算血管新生内膜厚度、中膜厚度。其中,内膜厚度=(内弹力膜周径-管腔周径)/2π,中膜厚度=(外弹力膜周径-内弹力膜周径)/2π。每张切片测3次。
1.6 荧光定量PCR检测CaN、NFATc3表达按Trizol 试剂说明提取样品总RNA。用TaKaRa逆转录试剂盒和荧光定量PCR试剂盒分别进行逆转录反应和荧光定量PCR 反应。反应结束后确认RealTime PCR的扩增曲线和融解曲线,记录下各管的CT值。计算相对表达量的方法:△△Ct=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组,本实验以假手术组为对照组,其余各组mRNA 的相对表达量用对照组的2-△△Ct倍表示(表 1)。
| 表 1 CaN、NFATc3和β-actin的引物序列 Table 1 Primer sequences of CaN,NFATc3 and β-actin for real-timePCR |
取大鼠静脉血制备的上清,用Elisa 法检测MCP-1水平。将待测样品(10 μL)加入样本稀释液(40 μL),37 ℃下孵育30 min,洗涤后加酶标工作液50 μL,置37 ℃下孵育30 min,洗板后每孔先后加入显色液A和B各50 μL,轻摇30 s,37 ℃避光显色15 min。加入终止液50 μL终止反应,在15 min内,在酶标仪上用450 nm波长测量各孔的吸光值(A值)。根据标准品的浓度及对应的A值,计算出标准曲线的直线回归方程,进而根据样本的A值计算出对应的浓度。最终浓度为实际测量值乘以稀释倍数。
1.8 免疫组化染色组织切片(5 μm)常规脱蜡至水,经抗原修复、封闭后,滴加CaN抗体(一抗稀释度1∶1000,Abcam公司),4 ℃过夜。加入二抗后,以DAB显色,细胞质或细胞核中出现黄色或棕褐色处为阳性信号。利用Image-ProPlus6.0图像分析系统,测定平均光密度值以表示阳性产物的强度,平均值越大,其阳性反应产物表达强度越强,表明蛋白的含量越高。
1.9 统计分析运用SPSS13.0统计软件处理实验数据,实验数据以平均值± 标准差表示,采用单因素方差分析(ANOVA),并作样本均数两两比较。P<0.05,认为差异有统计学意义。
2 结果 2.1 病理形态学检测假手术组血管壁呈圆形,厚度均一,管腔内侧内皮细胞排列整齐均称,内、外弹力板清晰、完整,内皮层下未见有VSMC潜入。球囊组显示管腔面积缩小,管壁凹凸不平,可见内弹力板断裂,有显著新生内膜形成,厚度不均,胞外基质增加,无内皮细胞,内弹力板附近有大量VSMC,排列紊乱,局部平滑肌纵向排列,呈现向内膜方向生长的趋势。CsA组管腔面积较单纯模型组有所扩大,内膜下仅见轻微的新生内膜(图 1)。球囊损伤组、CsA组内膜厚度、内膜厚度/中膜厚度显著高于假手术组(P<0.05),而CsA治疗组内膜厚度、内膜厚度/中膜厚度显著低于球囊损伤组(P<0.05,表 2)。
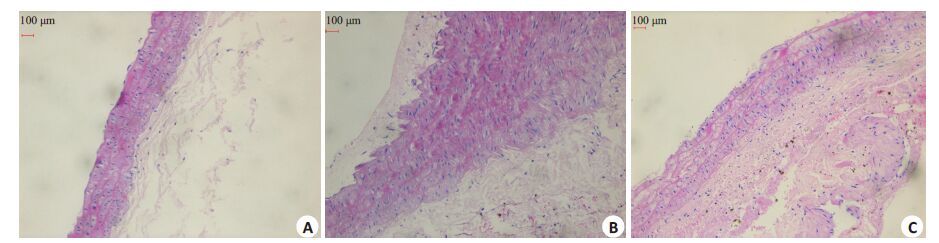
|
图 1 各组内膜增生程度 Figure 1 Intimal hyperplasia of the abdominal aorta in each group (Original magnification: × 200). A: Sham group; B: Ballon injurygroup; C: CsA group.100 μm 100 μm 100 μmA B C |
| 表 2 血管球囊损伤后各组动物内膜增生情况 Table 2 Intimal hyperplasia of rat abdominal aorta induced by ballon injury in each group (Mean±SD) |
如图 2 所示,假手术组血管壁几乎不表达CaN。球囊组血管中膜和内膜VSMC细胞大部分细胞质内出现棕黄色或棕褐色颗粒,与假手术组比,表达量显著增加(0.068 92±0.018 56 vs 0.007 12±0.002 29,P<0.05);与球囊组比,环孢菌素组中膜和内膜VSMC细胞表达明显下降(0.016 10 ± 0.002 20 vs 0.068 92 ±0.018 56,P<0.05)。
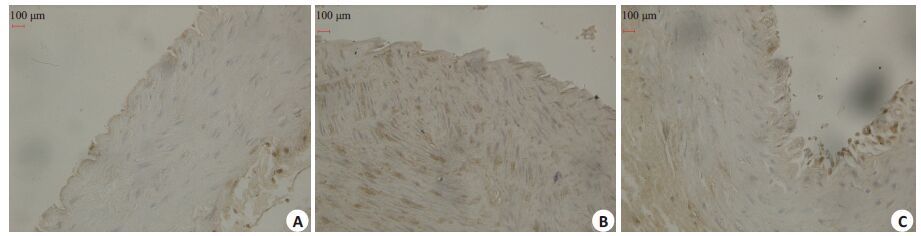
|
图 2 各组血管壁CaN表达 Figure 2 Expression of CaN in abdominal aorta in each group (×400). A: Sham group; B: Ballon injury group; C: CsA group. *P<0.05 vssham-operated group; ΔP<0.05 vs ballon injury group. |
与假手术组相比,球囊组血管组织CaN及其下游NFATc3 表达显著增加(P<0.05),而CsA 组CaN、NFATc3表达明显低于球囊组(P<0.05),但较假手术组有所增加(表 3)。
| 表 3 各组血管壁CaN、NFATc3 mRNA相对表达量 Table 3 Expression of CaN and NFATc3 mRNA in the abdominalaorta of each group (Mean±SD) |
球囊组血浆MCP-1 的水平较假手术组升高48%(813±110 vs 423±66,P<0.05),CsA组显著低于球囊组(439±53 vs 813±110,P<0.05),且与假手术组无明显差别。
3 讨论PCI术后再狭窄是多因素共同作用的结果,损伤局部的平滑肌细胞增生、基质分泌、平滑肌细胞向内膜迁移等,使内膜过度增厚,继而导致再狭窄的发生[10]。上述一系列反应均与炎症反应相关,损伤局部的炎症细胞所释放的各种生长因子和细胞因子可能是再狭窄病变的始动环节。Ca2+/CaM-CaN-NFATc 信号系统是免疫反应的关键通路,在炎症反应中有着明确的作用;而晚近的研究进一步发现其参与肥大、增殖等细胞生长过程[11]。以往体外实验结果表明,NFTAc的转位与血管平滑肌增生有关—— 大鼠主动脉VMSCs 经PDGF-BB促增生后,NFATc3有明显核转位,CaN抑制剂CsA 或NFATc 抑制剂INCA-6 均可有效减少PDGF-BB 的作用[12];NFATc 抑制剂VIVIT 可干预PDG3F-BB 对VAMCs的促增殖效应[13]。AngII(10-8~10-6 mol/L)以浓度±赖性方式增加VAMCs的CaN活性,促进细胞增殖;CsA 可明显降低AngⅡ刺激的VSMCs增殖活度及核内PCNA的表达水平[14]。本实验以在体动物模型为研究对象,通过球囊损伤造成动脉再狭窄,经CsA干预后动脉内膜增生得到明显改善,内膜下仅见轻微的新生内膜,管腔面积也较单纯模型组有所扩大。Haixiang等[15]也报道,NFAT-CaN 相互作用抑制剂MCV1可抑制NFAT活化,并减轻颈动脉剥脱术后再狭窄的形成。在本实验中,我们仅用球囊扩张导致动脉损伤,目的是更接近于临床实际情况,结果与目前大多数实验室采用的剥脱方式相近,即抑制Ca2 +/CaMCaN-NFATc信号系统可有效干预血管损伤后再狭窄的形成。
本实验进一步发现,损伤血管CaN 和NFATc3mRNA表达水平也明显升高。NFATc 包括NFATc1、(NFAT2/c)、NFATc2(NFAT1/p)、NFATc3(NFAT4/x)、NFATc4(NFAT3)及NFAT5等5个核转录因子。各个亚型是否均参与再狭窄形成以及其具体作用还不清楚。体外VSMCs刮伤实验表明,NFATc1 蛋白表达瞬时增加,同时向核内聚集[16]。冠状动脉置入裸金属支架后,局部血管内膜出现增生,伴有NFATc4 表达增加[17]。NFATc3对再狭窄的作用目前还不清楚。有研究证明,过氧化损伤可激活NFATc3,后者促进肺动脉血管平滑肌细胞增殖,导致血管重构[4];NFATc3促进内皮细胞中COX2的表达和活化,介导COX2±赖的内皮细胞迁移和增殖[5]。有些结果间接提示NFATc3 与再狭窄的关系,与血管疾病相关的慢性炎症因子OPN在高糖刺激下表达增加,抑制NFATc3可减轻糖尿病鼠OPN在动脉的高表达[18];炎症过程中产生两种蛋白AIF-1 和IRT-1,其中AIF-1可刺激VMSCs的迁移和增殖,IRT-1的效应则相反,沉默NFATc3基因可降低AIF-1/IRT-1比例[19]。本研究直接在再狭窄动物模型上证实了NFATc3的表达改变,提示其可能参与再狭窄的病理过程。
MCP-1是一种重要的炎性因子,由单核细胞、巨噬细胞、内皮细胞和平滑肌细胞等分泌,在炎性的发生发展中起着重要的作用[20-21]。它对单核细胞、巨噬细胞、嗜碱性粒细胞有趋化和激活作用,聚集的单核/巨噬细胞又可进一步促进MCP-1生成。当血管内皮细胞损伤时可使MCP- 1分泌增多,趋化单核/巨噬细胞至血管损伤处。单核/巨噬细胞在损伤动脉的新生内膜中浸润,可合成分泌大量炎性细胞因子和生长因子,刺激中膜VSMCs向内膜移行、增殖,并产生大量细胞外基质,导致新生内膜形成及再狭窄。此外,MCP-1可调节血管内皮细胞粘附分子的表达,并直接诱导VSMCs迁移和增殖,从而参与再狭窄的形成[22]。CaN 信号途径与MCP-1在再狭窄中的相互关系目前罕有报道,Hiroshi等[23]发现活化CaN可促进VMSCs中MCP-1表达,CsA可抑制AngⅡ诱导的MCP-1表达。本研究发现单纯球囊损伤组的大鼠外周血MCP-1明显增高,并为CsA所抑制,提示血管损伤后的炎症反应可能是全身性的。推测CsA可能是通过抑制炎性因子如MCP-1的产生,从而抑制了单核/巨噬细胞聚集到损伤动脉的新生内膜中,减轻损伤动脉局部炎症,最终抑制了中膜VSMCs向内膜移行、增殖。最近,已有NFATc各亚型与MCP-1相互关系的研究报道,敲除NFATc1 可阻断MCP-1诱导的cyclin D1-CDK6-CDK4-Pak1信号轴活化,后者可介导VSMCs增殖、迁移以及血管损伤后的内膜形成[24]。NFATc3 与MCP-1的相互关系还不清楚,有待进一步研究阐明。
| [1] | Siontis GC, Stefanini GG, Mavridis D, et al. Percutaneous coronary interventional strategies for treatment of in-stent restenosis: a network meta-analysis[J]. Lancet,2015, 386 (9994) : 655-64. DOI: 10.1016/S0140-6736(15)60657-2. |
| [2] | Hassoun PM, Mouthon L, Barberà JA, et al. Inflammation, growth factors, and pulmonary vascular remodeling[J]. J Am Coll Cardiol,2009, 54 (1, Suppl) : S10-9. DOI: 10.1016/j.jacc.2009.04.006. |
| [3] | Oller J, Alfranca A, Mendez-Barbero NA, et al. C/EBP beta and Nuclear Factor of Activated T Cells Differentially Regulate Adamts-1 Induction by Stimuli Associated with Vascular Remodeling[J]. Mol Cell Biol,2015, 35 (19) : 3409-22. DOI: 10.1128/MCB.00494-15. |
| [4] | Ramiro-Diaz JM, Giermakowska W, Weaver JM, et al. Mechanisms of NFATc3 activation by increased superoxide and reduced Hydrogen peroxide in pulmonary arterial smooth muscle[J]. Am J Physiol Cell Physiol,2014, 307 (10) : C928-38. DOI: 10.1152/ajpcell.00244.2014. |
| [5] | Urso K, Alfranca A, Martínez-Martínez S. NFATc3 regulates the transcription of genes involved in T-cell activation and angiogenesis[J]. Blood,2011, 118 (3) : 795-803. DOI: 10.1182/blood-2010-12-322701. |
| [6] | Okura H, Takagi T, Yoshida K. Therapies targeting inflammation after stent implantation[J]. Curr Vasc Pharmacol,2013, 11 (4) : 399-406. DOI: 10.2174/1570161111311040004. |
| [7] | Montone RA, Sabato V, Sgueglia GA, et al. Inflammatory mechanisms of adverse reactions to Drug-Eluting stents[J]. Curr Vasc Pharmacol,2013, 11 (4) : 392-8. DOI: 10.2174/1570161111311040003. |
| [8] | Arefieva TI, Krasnikova TL, Potekhina AV, et al. Synthetic peptide fragment (65-76) of monocyte chemotactic protein-1 (MCP-1) inhibits MCP-1 binding to heparin and possesses anti-inflammatory activity in stable angina patients after coronary stenting[J]. Inflamm Res,2011, 60 (10) : 955-64. DOI: 10.1007/s00011-011-0356-z. |
| [9] | 石永英, 张元春, 许端敏, 等. 大鼠血管球囊损伤后平滑肌细胞的增殖与雷帕霉素的干预[J]. 心脏杂志,2005, 17 (6) : 542-5. |
| [10] | Palmerini T, Biondi-Zoccai G, Della Riva DA, et al. Stent thrombosis with Drug-Eluting stents is the paradigm shifting[J]. ? J Am Coll Cardiol,2013, 62 (21) : 1915-21. DOI: 10.1016/j.jacc.2013.08.725. |
| [11] | Singh NK, Kundumani-Sridharan V, Kumar S, et al. Protein kinase N1 is a novel substrate of NFATc1-mediated cyclin D1-CDK6 activity and modulates vascular smooth muscle cell division and migration leading to inward blood vessel wall remodeling[J]. J Biol Chem,2012, 287 (43) : 36291-304. DOI: 10.1074/jbc.M112.361220. |
| [12] | Rita IJ, Andrew JW, Marilyn H. Nuclear translocation of calcineurin Abeta but not calcineurin Aalpha by platelet-derived growth factor in rat aortic smooth muscle[J]. Am J Physiol Cell Physiol,2007, 292 (6) : e2213-25. DOI: 10.1152/ajpcell.00139.2005. |
| [13] | Yu HX, Sliedregt-Bol K, Overkleeft H, et al. Therapeutic potential of a synthetic peptide inhibitor of nuclear factor of activated T cells as antirestenotic agent[J]. Arterioscler Thromb Vasc Biol,2006, 26 (7) : 1531-7. DOI: 10.1161/01.ATV.0000225286.30710.af. |
| [14] | 李映红, 欧阳静萍, 李柯. 钙调神经磷酸酶信号通路在AngII刺激的大鼠VSMCs增殖中的作用[J]. 武汉大学医学报,2002, 23 (4) : 326-9. |
| [15] | Yu HX, Bot I, Sliedregt K, et al. Selective modulation of nuclear factor of activated T-Cell function in restenosis by a potent bipartite peptide inhibitor[J]. Circ Res,2012, 110 (2) : 200. DOI: 10.1161/CIRCRESAHA.111.240895. |
| [16] | Chow W, Hou GP, Bendeck MP. Glycogen synthase kinase 3 beta regulation of nuclear factor of activated T-cells isoform c1 in the vascular smooth muscle cell response to injury[J]. Exp Cell Res,2008, 314 (16) : 2919-29. DOI: 10.1016/j.yexcr.2008.07.010. |
| [17] | Hamada N, Miyata M, Eto H, et al. Tacrolimus-eluting stent inhibits neointimal hyperplasia via calcineurin/NFAT signaling in porcine coronary artery model[J]. Atherosclerosis,2009, 10 (2) : 97-103. DOI: 10.1016/S1567-5688(09)70102-3. |
| [18] | Nilsson-Berglund LM, Zetterqvist AV, Nilsson-Ohman J. Nuclear factor of activated T cells regulates osteopontin expression in arterial smooth muscle in response to diabetes-induced hyperglycemia[J]. Arterioscler Thromb Vasc Biol,2010, 30 (2) : 218-24. DOI: 10.1161/ATVBAHA.109.199299. |
| [19] | Berglund LM, Kotova O, Osmark P, et al. NFAT regulates the expression of AIF-1 and IRT-1: yin and yang splice variants of neointima formation and atherosclerosis[J]. Cardiovasc Res,2012, 93 (3) : 414-23. DOI: 10.1093/cvr/cvr309. |
| [20] | Niu J, Kolattukudy PE. Role of MCP-1 in cardiovascular disease: molecular mechanisms and clinical implications[J]. Clin Sci (Lond),2009, 117 (3) : 95-109. DOI: 10.1042/CS20080581. |
| [21] | Fougerat A, Smirnova NF, Gayral S, et al. Key role of PI3K gamma in monocyte chemotactic protein-1-mediated amplification of PDGF-induced aortic smooth muscle cell migration[J]. Br J Pharmacol,2012, 166 (5) : 1643-53. DOI: 10.1111/j.1476-5381.2012.01866.x. |
| [22] | Inami N, Nomura S, Shimazu T, et al. Adiponectin incompletely prevent MCP-1-dependent restenosis after percutaneous coronary intervension in patients with coronary artery disease[J]. J Thromb Thrombolysis,2007, 24 (3) : 267-73. DOI: 10.1007/s11239-007-0042-8. |
| [23] | Hiroshi S, Suzuki E, Nishimatsu H. Calcineurin promotes the expression of monocyte chemoattractant protein-1 in vascular myocytes and mediates vascular inflammation[J]. Circ Res,2004, 94 (5) : 693-700. DOI: 10.1161/01.RES.0000118250.67032.5E. |
| [24] | Kundumani-Sridharan V, Singh NK, Kumar S, et al. Nuclear factor of activated T cells cl mediates p21-activated kinase 1 activation in the modulation of chemokine-induced human aortic smooth muscle cell f-actin stress fiber formation, migration, and proliferation and injury-induced vascular wall remodeling[J]. J Biol Chem,2013, 288 (30) : 22150-62. DOI: 10.1074/jbc.M113.454082. |
 2016, Vol. 36
2016, Vol. 36
