甲基苯丙胺(MA)是目前非常流行的一种新型毒品,具有很强的中枢兴奋作用,长期使用会产生以精神异常为主的依赖反应,尤其对中枢神经系统造成损伤。而戒断后会出现抑郁、焦虑和缺少快感等精神方面的问题。有研究表明,MA对动物及人类大脑多巴胺(DA)能神经元具有明显毒性作用[1-2],其毒性机制主要表现为对多巴胺信号转导的影响和DA氧化作用[3-4]、谷氨酸介导的兴奋性毒性作用[5]、氧化应激和细胞因子的形成[6-7]、线粒体功能紊乱及诱导神经细胞发生凋亡[8]、神经胶质细胞的活化[4]等。作为儿茶酚胺生物合成过程中的关键酶—酪氨酸羟化酶(TH),其含量的变化可以反映DA递质的变化[9]。本课题组前期研究结果表明[10-11],在MA能诱导的大鼠条件性位置偏爱(CPP)模型上,大鼠脑内谷氮酸的N -甲基- D-天门冬氨酸(NMDA)受体表达明显增强。而在CPP 大鼠伏隔核内α-氨基羟甲基恶唑丙酸型(AMPA)受体表达增多,下丘脑内AMPA受体则表达减低。
目前对于苯丙胺类中枢兴奋剂依赖的治疗还没有明显疗效的药物。钩藤碱是茜草科植物钩藤[Uncaria rhynchophylla (Miq) Miq. ex Havil.]的主要有效成分,常作为治疗毒瘾的药物。我们的前期结果表明[10-12],钩藤碱能明显对抗苯丙胺依赖大鼠产生的位置偏爱效应,抑制苯丙胺引起的大鼠脑内NR2B蛋白表达的上调,可使MA依赖大鼠脑内GLUR2/3的表达恢复正常水平。这些结果提示钩藤碱是一个有应用前景的抗苯丙胺类物质依赖的中药活性成分。尽管钩藤碱对于药物依赖大、小鼠模型的影响已有较多研究,但钩藤碱对于模式生物斑马鱼药物依赖模型的影响,目前国内外均未见相关报道。斑马鱼作为一种新兴的模式生物,正逐步应用于药物依赖领域。本研究采用本课题组前期已建立的斑马鱼条件性位置偏爱模型[13],观察钩藤碱对MA诱导斑马鱼位置偏爱形成的影响,研究MA依赖斑马鱼行为学指标的改变及斑马鱼脑内NR2B、TH和GLUR2三种蛋白表达的变化,对MA诱导的斑马鱼药物依赖形成及中药活性成分的干预作用进行深入分析和研究。
1 材料和方法 1.1 材料 1.1.1 主要试剂盐酸甲基苯丙胺(methamphetamine),购自国家麻醉品实验室,批号1212-9802)。钩藤碱,Wako Pure Chemical Industries, Ltd.生产,批号184- 01931。Tricaine methanesulfonate(MS222),购自sigma 公司。Anti-NR2B(AB1557P),Anti-GLUR2(MAB397),购自Millipore。Magic Mark(LC5602),购自Invitrogen 。盐酸氯胺酮注射液,购自江苏恒瑞医药股份有限公司,批号:KH090701。鱼用生理盐水,自配。
1.1.2 实验动物野生型AB系雄性斑马鱼,由南方医科大学斑马鱼实验中心提供,鱼龄:3~6个月,体质量:0.5~1.0g。养鱼系统为北京爱生公司净水系统,制系统温度在28.5~29.5 ℃;盐浓度为0.03%~0.04%;pH7.2~7.6;昼夜光照控制14 h光照(8∶30 am~10∶30 pm),10 h 黑夜。
1.1.3 实验设备条件性位置偏爱鱼缸(CPP鱼缸)[13]:缸体积为16 cm×9 cm×9 cm。鱼缸中间有一活动隔板,可以将鱼缸分成体积相等的两个箱,将隔板抽起后,鱼可以在两个箱体之间自由游动。箱体的一侧为褐色,另一侧为透明,透明侧的底部有两个直径为2 cm的黑色圆点。Noldus Ethovision XT system (Noldus Information Technology, Netherlands, http://www.noldus.com)。
1.2 方法 1.2.1 甲基苯丙胺诱导斑马鱼CPP模型的建立及行为学检测动物分组:根据文献[13]以及预实验结果,成年斑马鱼的天然偏爱箱为褐色箱,故选择透明箱作为伴药箱。给药前用动物行为学分析系统对实验成年斑马鱼进行位置偏爱测定,剔除不符合天然偏爱习惯的动物。测定前将实验箱中间隔板抽出,当成年斑马鱼处于两个箱体之间时开始计时,逐条观察15 min,以成年斑马鱼头部为准,记录成年斑马鱼在白箱中的停留时间。取经过自然位置偏爱测定合格的成年斑马鱼50条,按随机分组原则分为:(1)空白对照组;(2)甲基苯丙胺模型组;(3)模型+钩藤碱低剂量组(50 mg/kg);(4)模型+钩藤碱高剂量组(100 mg/kg);(5)模型+氯胺酮组(150 mg/kg)。每组10条。
CPP 模型的建立:整个实验需要进行9 d。(1)基线测定:将斑马鱼置于独立的用于训练的CPP箱内,每个CPP箱的水位不低于5 cm,以保证足够的水压,适应性喂养2 d。第3 天测试正常状态下所有斑马鱼的位置偏爱箱的停留时间(15 min 内),并且用Noldus Ethovision XT 软件来跟踪其路线图(5 min 内);(2)训练:在第4、6、8 天,除空白组外,将各组斑马鱼浸入200 mg/L MS222 溶液中进行浅麻醉,用微量注射器迅速腹腔注射甲基苯丙胺(40 μg/g),然后将其置于非偏爱箱(伴药箱)45 min。非偏爱箱与偏爱箱之间用一个透明挡板隔开,使鱼不能游过去,但又不会遮挡其视线。45 min后,将鱼移至较大的有蓝色环境的鱼缸,并且用70%的乙醇清洁黑白箱,最后用系统水冲洗。空白组斑马鱼用200 mg/L MS222 溶液浅麻醉后注射等体积鱼用生理盐水,10 μL/条,其他处理与模型组一致;(3)在第5、7 天,给予各组斑马鱼腹腔注射鱼用生理盐水,10 μL/条,然后将其置于偏爱箱(非伴药箱)45 min。按上述(2)相同的步骤,对斑马鱼进行训练;(4)检测:在末次注射24 h 后(即第9 天),采用Noldus Ethovision XT system 测试所有斑马鱼在非位置偏爱箱(伴药箱)的停留时间以及在CPP箱的运动路线图,比较它们在非偏爱箱前后时间的差值及其游动距离。
药物给予:每天给斑马鱼注射甲基苯丙胺或生理盐水训练12 h后,将各给药组斑马鱼经MS222浅麻醉后用微量注射器迅速腹腔注射相应的药物溶液(低剂量组注射钩藤碱50 mg/kg,高剂量组注射钩藤碱100 mg/kg,氯胺酮组注射氯胺酮150 mg/kg),然后将其移至较大的有蓝色环境的鱼缸。空白对照组和模型组斑马鱼注射等体积鱼用生理盐水(10 μL/条),其他处理与给药组一致,连续给药5 d。
1.2.2 斑马鱼脑内NR2B、TH和GLUR2蛋白表达检测上述各组的斑马鱼行为学指标测定后,将鱼处死,取出鱼脑,匀浆,提取蛋白,测试蛋白浓度,采用western blotting 的方法分别检测斑马鱼脑中NR2B、TH 和GLUR23种蛋白表达,并以β-actin为内标。
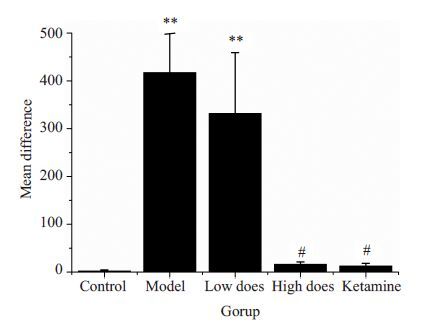
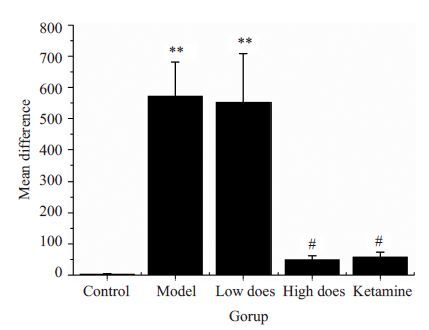
2 结果 2.1 甲基苯丙胺诱导斑马鱼CPP模型行为学检测结果模型组斑马鱼甲基苯丙胺诱导训练前后在伴药箱的停留时间差与空白组相比,有显著性差异(P<0.01),表明斑马鱼经甲基苯丙胺诱导后,形成显著的条件性位置偏爱。与模型组斑马鱼训练前后时间差相比,钩藤碱高剂量组和氯胺酮组斑马鱼训练前后在伴药箱的停留时间差明显减小(P<0.05),而钩藤碱低剂量组斑马鱼训练前后时间差则未见显著性差异(P>0.05,图 1)。与空白组相比,模型组斑马鱼训练后在伴药箱的游动距离有显著性差异(P<0.01)。与模型组相比,钩藤碱高剂量组和氯胺酮组斑马鱼在伴药箱的游动距离也有显著性差异(P<0.05)。钩藤碱低剂量组斑马鱼在伴药箱的游动距离与模型组无明显差别(P>0.05,图 2)。各组斑马鱼造模前后在CPP箱的运动线路图见图 3 。
|
图 1 各组斑马鱼训练前后在伴药箱活动时间的差值 Figure 1 Changes in the staying time of the zebrafish in the drug box after training in each group (n=10, Mean± SD). **P<0.01 vs control group; #P<0.05 vs model group. |
|
图 2 各组训练后斑马鱼15 min内在伴药箱的游动距离 Figure 2 Changes in the swimming distance of the zebrafish in the drug box within 15 min in each group (n=10, Mean±SD). **P<0.01 vs control group; #P<0.05 vs model. |

|
图 3 各组斑马鱼造模后在CPP箱的运动路线图 Figure 3 Tracking map of zebrafish in CPP box in each group. |
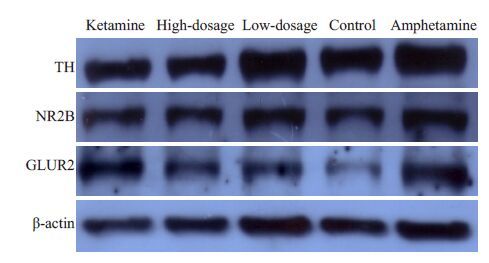
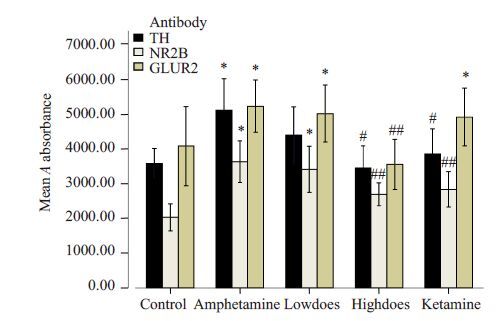
以适当比例稀释抗体后,采用Western blotting 方法检测各组斑马鱼脑内NR2B、TH和GLUR23种蛋白表达。结果表明,与空白组相比,模型组斑马鱼脑内的TH、NR2B、GLUR2表达有显著性差异(P<0.05)。与模型组相比,钩藤碱高剂量组和氯胺酮组斑马鱼脑内的TH、NR2B、GLUR2 表达有显著性差异(P<0.05 或PP<0.01);而钩藤碱低剂量组无显著性差异(P>0.05,图 4、5)。
|
图 4 免疫印迹检测各组相关蛋白表达结果 Figure 4 Expressions of related proteins detected by Western blotting. |
|
图 5 各组不同蛋白表达的A值 Figure 5 Expressions of different proteins in zebrafish brain (n=10. Mean±SD). *P<0.05 vs control group; #P<0.05, ##P<0.01 vs model group. |
斑马鱼早期发育与人类极为相似,其血液系统、内脏器官、视觉系统以及神经中枢系统,在基因水平上85%与人类同源。斑马鱼凭借繁殖能力强、胚胎透明、 生长速度快以及其基因与人类基因相似性高等优点,越来越受到生物学家们的青睐。在国外,已经有一些研究者使用斑马鱼成功地对药物依赖戒断症状和成瘾物质诱导的条件性位置偏爱进行了研究,证明了斑马鱼在成瘾医学领域的应用是可行的。据文献报道[14-15],咖啡因、 乙醇、吗啡以及安定均可导致斑马鱼成瘾及戒断,而且上述成瘾性物质均能对斑马鱼的行为以及内分泌产生影响,证实了斑马鱼可以作为模式生物来进行药物依赖方面的研究。Bretaud等[16]发现仔鱼在经过吗啡预暴露后,在含吗啡的一侧水域中停留时间的显著增加,而这种明显增加可以通过阿片类受体或多巴胺受体拮抗剂的预处理而减少。本课题组在前期研究中,根据文献以及本身的实验环境,已成功建立了甲基苯丙胺诱导的斑马鱼CPP模型[13]。本文在此基础上,采用斑马鱼CPP模型,检测中药有效成分钩藤碱对甲基苯丙胺诱导的斑马鱼CPP的影响。结果显示,与空白组相比,训练后模型组斑马鱼在伴药箱停留时间的变化以及运动距离都有明显增加,表明甲基苯丙胺诱导斑马鱼产生较强的条件性位置偏爱。与模型组相比,钩藤碱高剂量组和氯胺酮组斑马鱼在伴药箱停留时间和运动距离明显缩短,提示高剂量钩藤碱或氯胺酮能明显抑制斑马鱼对甲基苯丙胺诱导的位置偏爱的形成。而低剂量钩藤碱对斑马鱼的位置偏爱效应形成的影响不显著。本实验的结果表明甲基苯丙胺诱导的斑马鱼CPP模型可应用以中药戒毒的研究。
中脑边缘多巴胺系统(MLDS)、内源性阿片肽系统及γ-氨基丁酸/谷氨酸能神经系统是目前与药物滥用及精神依赖密切相关的3个系统,而多巴胺[17]、谷氨酸和5- 羟色胺[18]等中枢神经递质与药物依赖的产生也有着密切的关系。谷氨酸受体(GluRs) 大量地存在于动物的脑内,其中NMDA受体和AMPA受体与药物依赖关系密切[19]。AMPA受体分为GluR1-4 四种亚型,在中枢神经系统内大多数AMPA受体以GluR2/3的形式存在[20]。有研究表明,AMPA受体对中枢神经系统的神经发育、信号传导以及突触的可塑性(包括学习和记忆)等功能都起着关键的作用。NMDA受体是一种配体门控型阳离子通道,由基本亚基NR1和至少一个NR2调节亚基组成异聚体。Kato 等[21]研究表明,NR2B的氨基酸残基磷酸化在吗啡诱导的奖赏作用中起到了重要作用,酪氨酸激酶如Src家族激酶能通过增加NR2B亚基C端的酪氨酸残基磷酸化,来增强NMDA受体的功能。多巴胺作为中枢神经系统中重要的神经递质之一,能够影响自主运动、激素分泌及情绪控制等行为或生理调控机制。而酪氨酸羟化酶(TH)作为儿茶酚胺生物合成过程中的关键酶,是多巴胺能神经元的标记酶,可以通过其含量反应多巴胺的含量[22]。因此,本文选择与甲基苯丙胺依赖相关的NR2B、GLUR2亚基和TH作为生化指标,检测在甲基苯丙胺依赖形成过程中斑马鱼脑内这三个指标表达的变化,以阐明与甲基苯丙胺相关的神经生化机制。本研究结果表明,与空白组相比,模型组斑马鱼脑中TH、NR2B、GLUR2的表达明显增强。表明斑马鱼对甲基苯丙胺依赖的形成可能与这3种蛋白表达增加有关。与模型组相比,低剂量钩藤碱组斑马鱼脑中TH、 NR2B、GLUR2的表达变化不明显。高剂量钩藤碱组斑马鱼脑中TH、NR2B、GLUR2的表达明显减弱。这些生化检测结果与上述行为学结果基本一致,提示钩藤碱可以在一定程度上抑制斑马鱼产生甲基苯丙胺依赖,其机制可能与TH、NR2B、GLUR2等蛋白表达有关,这些结果为钩藤碱抗甲基苯丙胺依赖提供了实验依据。
氯胺酮是N-甲基-D-天冬氨酸(NMDA)受体非竞争性拮抗剂,作为阳性对照药用于本文实验研究中。结果表明,氯胺酮150 mg/kg腹腔注射能明显抑制甲基苯丙胺诱导的斑马鱼位置偏爱效应,并能显著减少甲基苯丙胺引起的斑马鱼脑内TH、NR2B、GLUR2 的表达增强。从本研究结果看,氯胺酮对于苯丙胺类药物诱导的斑马鱼CPP形成有抑制作用。尽管多种NMDA受体拮抗剂对吗啡等成瘾性物质的奖赏效应具有一定的抑制作用,但由于氯胺酮本身具有一定的精神依赖性和滥用成瘾性,因此,对氯胺酮的抗药物依赖作用尚不能形成统一认识,仍需进一步的研究与验证。
| [1] | El Ayadi A, Zigmond MJ. Low concentrations of methamphetamine can protect dopaminergic cells against a larger oxidative stress injury: mechanistic study[J]. PLoS One,2011, 6 (10) : e24722. DOI: 10.1371/journal.pone.0024722. |
| [2] | Shin EJ, Bach JH, Nguyen TT, et al. Gastrodia elata bl attenuates methamphetamine-induced dopaminergic toxicity via inhibiting oxidative burdens[J]. Curr Neuropharmacol,2011, 9 (1) : 118-21. DOI: 10.2174/157015911795016967. |
| [3] | Karila L, Weinstein A, Aubin HJ, et al. Pharmacological approaches to methamphetamine dependence: a focused review[J]. Br J Clin Pharmacol,2010, 69 (6) : 578-92. DOI: 10.1111/bcp.2010.69.issue-6. |
| [4] | Abdul MM. S alikunju, a M szlachetka, J haorah.methamphetamine inhibits the glucose uptake by human neurons and astrocytes: stabilization by acetyl-L-carnitine[J]. PLoS One,2011, 6 (4) : e19258. DOI: 10.1371/journal.pone.0019258. |
| [5] | Izquierdo A, Belcher AM, Scott L, et al. Reversal-specific learning impairments after a binge regimen of methamphetamine in rats: possible involvement of striatal dopamine[J]. Neuropsychopharmacology,2010, 35 (2) : 505-14. DOI: 10.1038/npp.2009.155. |
| [6] | Hozumi H, Asanuma M, Miyazaki I, et al. Protective effects of interferon-gamma against methamphetamine-induced neurotoxicity[J]. J Pharmacol Sci,2008, 106 (1) : 175P. |
| [7] | Zhang X, Dong F, Mayer GE, et al. Selective inhibition of cyclooxygenase-2 exacerbates methamphetamine-induced dopamine depletion in the striatum in rats[J]. Neuroscience,2007, 150 (4) : 950-8. DOI: 10.1016/j.neuroscience.2007.09.059. |
| [8] | Kanthasamy K, Gordon R, Jin HJ, et al. Neuroprotective effect of resveratrol against Methamphetamine-Induced dopaminergic apoptotic cell death in a cell culture model of neurotoxicity[J]. Curr Neuropharmacol,2011, 9 (1) : 49-53. DOI: 10.2174/157015911795017353. |
| [9] | Jing XU, LI Yan, XF Zeng, et al. Dopaminergic toxicity in related brain areas of rats after methamphetamine intoxication[J]. Progress in Modern Biomedicine,2011, 11 (12) : 2230-3. |
| [10] | Liu W, QX Peng, X L Lin, et al. Effect of rhynchophylline on the expression of p-CREB and sc-Fos in triatum and hippocampal CA1 area of methamphetamine-induced conditioned place preference rats[J]. Fitoterapia,2014, 92 (3) : 16-22. |
| [11] | Li JK, Liu W, Peng QX, et al. Effect of rhynchophylline on conditioned place preference on expression of NR2B in methamphetamine-dependent mice[J]. Biochem Biophys Res Commun,2014, 452 (3) : 695-700. DOI: 10.1016/j.bbrc.2014.08.127. |
| [12] | Zhou JY, Mo ZX, Zhou SW. Effect of rhynchophylline on central neurotransmitter levels in amphetamine-induced conditioned place preference rat brain[J]. Fitoterapia,2010, 81 (7) : 844-8. DOI: 10.1016/j.fitote.2010.05.007. |
| [13] | 陈毅飞, 翁建霖, 张文清, 等. 甲基苯丙胺诱导的斑马鱼位置偏爱模型研究[J]. 中华行为医学与脑科学杂志,2011, 20 (9) : 772-4. |
| [14] | Cachat J, Canavello P, Elegante M, et al. Modeling withdrawal syndrome in zebrafish[J]. Behav Brain Res,2010, 208 (2) : 371-6. DOI: 10.1016/j.bbr.2009.12.004. |
| [15] | Tran S, Chatterjee D, Gerlai R. An integrative analysis of ethanol tolerance and withdrawal in zebrafish (Danio rerio)[J]. Behav Brain Res,2015, 276 (SI) : 161-70. |
| [16] | Lau B, Bretaud S, Huang Y, et al. Dissociation of food and opiate preference by a genetic mutation in zebrafish[J]. Genes Brain Behav,2006, 5 (7) : 497-505. DOI: 10.1111/gbb.2006.5.issue-7. |
| [17] | Parsegian A, See RE. Dysregulation of dopamine and glutamate release in the prefrontal cortex and nucleus accumbens following methamphetamine Self-Administration and during reinstatement in rats[J]. Neuropsychopharmacology,2014, 39 (4) : 811-22. DOI: 10.1038/npp.2013.231. |
| [18] | Thomas DM, Perez MA. DM Francescutti-Verbeem, MM Shah, DM Kuhn. the role of endogenous serotonin in methamphetamineinduced neurotoxicity to dopamine nerve endings of the striatum[J]. J Neurochem,2010, 115 (3) : 595-605. DOI: 10.1111/jnc.2010.115.issue-3. |
| [19] | Yuan J, Darvas M, Sotak B, et al. Dopamine is not essential for the development of methamphetamine-induced neurotoxicity[J]. J Neurochem,2010, 114 (4) : 1135-42. |
| [20] | 周吉银, 莫志贤. 谷氨酸和受体与药物依赖相关的研究进展[J]. 中国药物依赖性杂志,2006, 15 (4) : 255-9. |
| [21] | Kato H, Narita M, Suzuki M, et al. Role of tyrosine kinasedependent phosphorylation of NR2B subunit-containing NMDA receptor in morphine reward[J]. Nihon Arukoru Yakubutsu Igakkai Zasshi,2007, 42 (1) : 13-20. |
| [22] | Volkoff H. The effects of amphetamine injections on feeding behavior and the brain expression of orexin, CART, tyrosine hydroxylase (TH) and thyrotropin releasing hormone (TRH) in goldfish (Carassius auratus)[J]. Fish Physiol Biochem,2013, 39 (4) : 979-91. DOI: 10.1007/s10695-012-9756-4. |
 2016, Vol. 36
2016, Vol. 36
