2. 南方医科大学南方医院检验中心,广东 广州 510515
2. Department of Laboratory Medicine, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
外泌体是由多种细胞类型分泌到细胞外基质中的一种直径约30~150 nm的膜性囊泡[1-2],起源于晚期内涵体-多泡体(MVB),并由MVB界膜向内涵体腔内以出芽的方式形成,与质膜融合分泌在细胞外基质中。早在1987年Johnstone在网织红细胞分化过程中首次发现外泌体,并认为其是红细胞排泄废弃蛋白的一种方式[3],但近有研究表明,外泌体内含多种生物活性物质,如蛋白质、mRNA、microRNA等[4],易与邻近细胞细胞膜发生融合,将生物学活性物质选择性地递送至受体细胞,在细胞与细胞之间起到了重要的通讯作用,参与多方面的生物学功能[5]。外泌体不仅存在于造血细胞如红细胞、血小板、淋巴细胞等的培养上清液中[6],同时也存在于血浆、血清、乳汁、唾液、尿液及精液等许多生物体液中[4, 7]。在人精液中含有许多异质性的纳米级囊泡,主要由男性泌尿生殖系统包括睾丸、输精管、前列腺、精囊腺等组织分泌,通常被称为前列腺小体[8]。2014 年,Madison等[9]首次提出精液来源的囊泡更合适称为精液外泌体,并报道精液来源外泌体具有抗HIV-1的活性,此后对其相关研究不断深入。外泌体的发现与研究为泌尿生殖系统疾病早期诊断和治疗带来了广阔的前景,也为疾病发生机制相关研究带来了新的思路[10-11]。
目前我们对精液来源的外泌体研究尚处于初级阶段,对其在生殖过程中精子成熟、顶体反应、精卵融合等重要功能作用和机制研究尚不清楚[12],欲想实现最终的临床应用,还需解决许多面临的难题。其中,若从成分复杂的生物液体中获得高产量、高浓度、高纯度,并保留其生物学特性的外泌体,是目前的一个难点,这与外泌体分离提取密切相关。目前外泌体的提取方法主要有:超速离心法(差速离心)、蔗糖密度梯度离心、色谱法、超滤离心、磁珠免疫法、试剂提取法等。现在最常用的是差速离心结合蔗糖密度梯度超速离心,但此方法需要样本量大、耗间长,且易受离心率外因的影响[13-14],因而,我们急需寻找到一种能在含量、纯度及生物活性方面均较为理想的外泌体提取方法。聚乙二醇(PEG)方法作为浓缩和纯化病毒已经有五十多年[15],鉴于外泌体和病毒有着相似的生物物理特性,近来的研究报道表明PEG 方法可以成功富集细胞上清的外泌体,并用于深度的蛋白组学及测序分析[16-17]。另有国内研究报道PEG6000 成功应用于血清中胎盘来源的外泌体的提取,结果提示该方法简便、快捷、高效[18],而该方法在精液外泌体的提取尚未见应用报道。由此,本研究采用8%PEG6000富集精液来源的外泌体,对提取物进行透射电子显微镜(TEM)、纳米颗粒跟踪分析仪(NTA)以及蛋白标志物(CD63、ALIX、TSG101)的蛋白印迹鉴定。本实验通过PEG6000方法简便、高效富集精液外泌体并对其鉴定,为后续精液外泌体功能和机制研究奠定了基础。
1 材料和方法 1.1 精液标本的收集 1.1.1 研究对象从2016 年3 月~2016 年6 月,按照WHO第5版诊断标准[19],于南方医科大学南方医院检验中心收集6名正常志愿者的精液样本。参与者禁欲3~7 d,通过手淫方式收集精液样本于干燥无菌的广口杯内,常温下液化。所有精液样本排除液化时间、pH、 精子形态、精浆果糖、酸性磷酸酶、α葡萄糖苷酶等参数异常。本研究经过南方医科大学第三附属医院和南方医院伦理委员会的批准同意,所有志愿者均告知实验研究详情并签署知情同意书。
1.1.2 主要仪器及试剂SCA(Sperm Class analyzer)精子质量分析仪(MicroPtic,西班牙),低温智能超速离心机Optima XPN-100(Beckman,美国);纳米颗粒跟踪分析仪(NanoSight,英国);透射电子显微镜H-7650 (Hitachi,日本);PEG6000(Sangon,上海);0.45 μm和0.22 μm(Millipore,美国);电泳仪和电转仪(Bio-Rad,美国),总蛋白提取试剂盒(Beyotime,上海),蛋白浓度测定试剂盒(Beyotime,上海),兔抗人CD63、TSG101、 ALIX多克隆抗体(abconal,美国),兔抗人Calnexin 多克隆抗体(Bioworld,美国),HRP标记羊抗兔IgG(Ray Antibody,北京),PVDF膜(BioTrace,墨西哥)。
1.2 方法 1.2.1 精液外泌体的分离和提取精液样本室温液化20 min,转移无菌EP 管进行低温4 ℃,1000 g 离心10 min去除精子细胞,4 ℃,12 000 g离心30 min去除小细胞及碎片,取上层精浆按1∶1 比例与PBS混匀后经0.45、0.22 μm滤膜进行滤过去除粒径较大的微囊泡,再用PEG6000 2 ×(16 g PEG6000,5.844 g Nacl 溶于100 mL ddH2O)按1∶1比例充分混合4 ℃过夜(终浓度为8% PEG6000)。次日取混合液进行4 ℃,12 000 g离心30 min,取沉淀用PBS重悬混匀用低温超高速离心机100 000 g 离心90 min 获取沉淀,PBS重悬提取物后,0.22 μm滤膜过滤除菌,-80 ℃保存备用;待用时,BCA 法定量外泌体的总蛋白。
1.2.2 Western blot取外泌体悬液添加上样缓冲液,95 ℃,变性10 min,每个上样孔添加40 μg 样品10% SDS-PAGE凝胶电泳(80 V,30 min;100 V,60 min)分离蛋白;湿法(200 mA,120 min)转印至PVDF膜;用含5% 牛血清白蛋白的TBS 液室温封闭1 h;一抗兔抗人CD63、ALIX、TSG101 多克隆抗体1∶1000、兔抗人Calnexin多克隆抗体1∶1000分别置于4 ℃过夜;TBST 液洗膜5次,5 min/次;二抗兔抗羊IgG 1∶10 000室温孵育1 h;TBST液洗膜5次,5 min/次;ECL发光试剂盒显影;Bio-Rad凝胶成像系统获取图像。
1.2.3 透射电镜取20~40 μL精液外泌体沉淀悬液于载样铜网上,室温静置5 min,用滤纸从侧面吸干液体,滴加4%磷钨酸溶液约10 μL于铜网上,室温负染5 min。滤纸吸干负染液,白炽灯下烤干约10 min,负染10 min 置于透射电子显微镜下观察外泌体形态并拍照。
1.2.4 纳米颗粒跟踪分析纳米颗粒跟踪分析(NTA)是将一束能量集中的激光穿过玻璃棱镜对样品(悬浮精液外泌体的溶液)进行照射,通过装有摄像头的显微镜实现颗粒可视化,捕捉颗粒布朗运动的视频文件,并对每个颗粒的布朗运动进行追踪和分析,快速准确地计算出样本中纳米颗粒的流体力学半径和浓度[20]。按照NTA 仪器操作说明书设定好参数,测量时间为60 s。取精液外泌体,用水按1∶2500比例稀释成1 mL,通过NTA进行测量分析,计算出精液外泌体的粒径和浓度。
2 结果 2.1 基本资料按以上纳入、排除标准,收集6例正常志愿者的精液样本,采用SCA精子质量分析仪对精液样本进行精液常规检测,分析精液样本基本参数,包括年龄、精液量、pH值、前向运动精子率、精子浓度和形态正常精子率(表 1)。
| 表 1 6例精液基本参数 Table 1 Demographic data and semen characteristics of the 6 volunteers |
采用Western blot 检测外泌体标志物蛋白并用精子细胞内质网高表达蛋白Calnexin 验证其提取的纯度。结果表明PEG6000富集的精液外泌体均阳性表达CD63、ALIX、TSG101蛋白,而对应的精子细胞和提取后的精液上清成阴性。同时,Calnexin蛋白只表达精子细胞,精液外泌体和提取后精液上清均成阴性(图 1)。
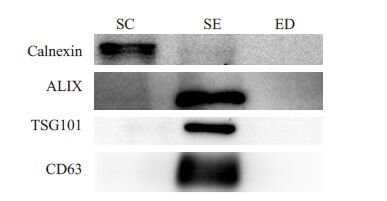
|
图 1 精液外泌体的标志物 Figure 1 Marker expression of the seminal exosomes. SC: Sperm cells; SE: Seminal exosomes; ED: Exosome-depleted. |
透射电子显微镜下观察到精液外泌体有完整双层膜包绕,呈圆形、椭圆形的囊泡,直径约为100 nm,内部含有低电子密度物质(图 2)。
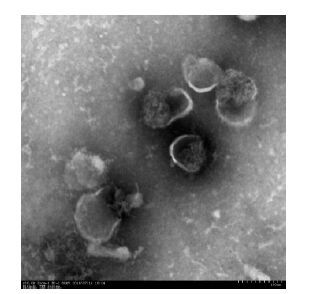
|
图 2 精液外泌体形态 Figure 2 Morphology of the extracted seminal exosomes. |
取精液来源提取物经PBS稀释2500倍,检测精液外泌体浓度大约为2.98E12/mL。结果提示MODE曲线线性流畅,粒径峰值为115 nm(图 3A);颗粒散点图表明外泌体直径大小较为集中,大部分介于30~150 nm间(图 3B);颗粒直径区间累计百分比数据显示0~30 nm、 30~150 nm和>150 nm的颗粒数占总粒数的百分比分别为0.189%、82.253%和17.558%(表 2)。
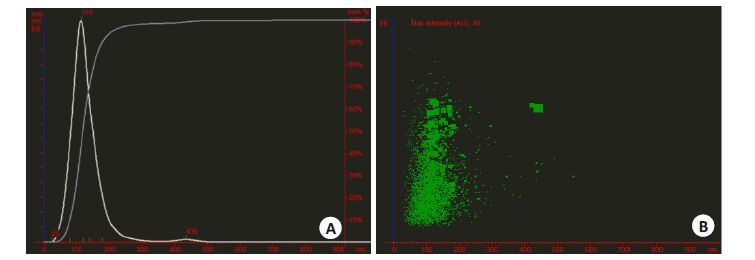
|
图 3 纳米颗粒跟踪分析仪分析精液外泌体 Figure 3 Nanoparticle tracking analysis of seminal exosomes. A: Particle Size/Concentration; B: Particle Size/Relative Intensity. |
| 表 2 NTA检测粒径区间累计百分比 Table 2 Cumulative percentage of particle size |
近些年来,人们对外泌体的研究越来越关注,尽管外泌体研究取得了很大进展,但其生物学功能和机制研究还处于初级阶段。最近研究报道,精液外泌体中携带潜在起调控作用的非编码小RNA[7]。另一项研究表明与正常人对比,发现男性少弱精子症不育病人精液中的胞外囊泡存在microRNA 差异表达谱,并验证了miR-765 和miR-1275 在不育病人中高表达,miR-15a 低表达,这为进一步研究男性不育相关机制开拓了一个新视野[21]。精液外泌体的进一步研究将为男性泌尿生殖领域带来新的方向和思路,发现无创的早期生物标志物以及新型治疗方法,为临床应用提供了更加广阔的前景[10-11]。
随着对外泌体研究的来源、生物学功能不断深入,外泌体的分离提取及鉴定相关研究是该领域进一步探索的重要基础之一。目前外泌体分离提取方法尚没有统一的标准,主要有差速离心法、蔗糖密度梯度超速离心以及商业外泌体提取试剂盒法等。由于超速离心耗时长,商业试剂盒法高成本等缺点不利于后续研究开展。每种方法都有各自的优缺点,但对外泌体分离提取及鉴定方法主要取决于其能否最大程度地减少提取物中的杂蛋白,保证外泌体提取的纯度,鉴定外泌体公认的蛋白标志物,只有提取高纯度、高产量、高浓度的外泌体才能确保后续研究的质量[14]。PEG6000是一种水溶性非离子型聚合物,其亲水性强,可使生物大分子发生脱水而沉淀,也可与生物大分子之间以氢键相互作用形成复合物沉淀。由于外泌体是一种纳米膜性囊泡,其脂质双分子层具有一定疏水特性,PEG6000可通过与疏水性蛋白和脂质分子结合从而沉淀外泌体。2016年,Rider等[16]采用5%~10%、12%这7种不同浓度PEG6000 来提取细胞上清外泌体,发现8% PEG6000方法提取外泌体纯度与传统超高速离心方法类似,且优于商业试剂法。随后从外泌体中提取的总蛋白和RNA质量和数量均可满足蛋白质组学和RNA测序分析,并且共聚焦实验表明外泌体的生物学功能并未受到影响。
因此,本研究在精液中采用终浓度8% PEG6000方法快速高效富集了提取物,通过TEM和NTA检测提取物的形态及大小分布情况,TEM结果提示背景杂质较少,提取物中存在大小不等的纳米囊泡,呈圆形、椭圆形、杯状或不规则,直径约100 nm,内含电子致密物,形态符合外泌体典型特征。与传统动态光散射技术和传统流式细胞仪在检测纳米囊泡粒径应用比较,NTA 具有高分辨力、直观可视、可计算出纳米囊泡浓度等优势[20-22]。NTA 结果发现提取物所含颗粒数量多(2.98E12/mL)、纯度高,粒径集中,且82.253%颗粒直径介于30~150 nm,与外泌体直径理论值和电镜所见囊泡大小范围值相符。其中,少部分颗粒超出该范围,可能是由于聚集成块造成粒径增大,与既往文献报道相符。Vojtech等[7]采用超速离心结合双蔗糖垫的方法在12个志愿者精液中分离提取精液外泌体,其结果显示精液外泌体平均直径为93 nm,大于75%的精液外泌体的粒径分布在50~200 nm 之间,外泌体平均浓度为1.37E13/mL(4.7E11~3.12E13/mL)。Madison 等[9, 23]分别用ExoQuick(SBI)试剂盒法和蔗糖密度梯度超高速离心法提取精液外泌体,结果显示约小于20%、大于40%、大于20%精液外泌体粒径分别分布在28~50、50~ 100、100~150 nm。尽管不同类型的囊泡在大小方面存在重叠,但本研究结果表明PEG6000所富集的提取物大部分都是精液来源的外泌体。再者,外泌体能够稳定表达某些能够参与抗原递呈的蛋白质,如四次跨膜蛋白(CD63、CD81、CD9 等)、热休克蛋白(HSP70、HSP90 等)及参与泡体生物合成的蛋白质(TSG101、ALIX 等)[24]。根据目前研究报道,研究者多采用跨膜蛋白CD63、CD9、热休克蛋白HSP70等蛋白作为精液外泌体存在的标志物[7, 9, 21, 23]。本研究随后通过蛋白免疫印迹检测精液提取物CD63、ALIX、TSG101蛋白的表达,结果显示提取物均阳性表达这3种标志蛋白,而对应的精子细胞和提取后的精液上清液呈阴性,这说明此方法成功富集精液来源的外泌体。此外,Calnexin为普遍存在于细胞内质网膜上的蛋白质,在精子细胞中高表达,而精液来源外泌体中不表达,由此证明PEG6000富集提取精液来源外泌体的纯度,再次证明本实验方法的可靠性。
综上所述,采用PEG6000方法可以快速、高效、便捷富集精液来源的外泌体,为后续进一步研究探讨精液外泌体在男性生殖方面的生物学功能及相关机制奠定了基础,为精液外泌体在临床医学等方面的应用提供有力的理论依据。
| [1] | Lotvall J, Hill AF, Hochberg F, et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles[J]. J Extracell Vesicles,2014, 22 (3) : 26913. |
| [2] | Mathivanan S, Ji H, Simpson RJ. Exosomes: extracellular organelles important in intercellular communication[J]. J Proteomics,2010, 73 (10) : 1907-20. DOI: 10.1016/j.jprot.2010.06.006. |
| [3] | Johnstone RM, Adam M, Hammond JR, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes)[J]. J Biol Chem,1987, 262 (19) : 9412-20. |
| [4] | Raposo G, Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends[J]. J Cell Biol,2013, 200 (4) : 373-83. DOI: 10.1083/jcb.201211138. |
| [5] | Sun DM, Zhuang XY, Zhang SQ, et al. Exosomes are endogenous nanoparticles that can deliver biological information between cells[J]. Adv Drug Deliv Rev,2013, 65 (3) : 342-7. DOI: 10.1016/j.addr.2012.07.002. |
| [6] | Altevogt P, Bretz NP, Ridinger J, et al. Novel insights into exosome-induced, tumor-associated inflammation and immunomodulation[J]. Semin Cancer Biol,2014, 28 (7) : 51-7. |
| [7] | Vojtech L, Woo S, Hughes S, et al. Exosomes in human semen carry a distinctive repertoire of small non-coding RNAs with potential regulatory functions[J]. Nucleic Acids Res,2014, 42 (11) : 7290-304. DOI: 10.1093/nar/gku347. |
| [8] | Ronquist G, Brody I. The prostasome:its secretion and function in man[J]. Biochim Biophys Acta,1985, 822 (2) : 203-18. DOI: 10.1016/0304-4157(85)90008-5. |
| [9] | Madison MN, Roller RJ, Okeoma CM. Human semen contains exosomes with potent anti-HIV-1 activity[J]. Retrovirology,2014, 11 (1) : 102. DOI: 10.1186/s12977-014-0102-z. |
| [10] | Machtinger R, Laurent LC, Baccarelli AA. Extracellular vesicles: roles in gamete maturation, fertilization and embryo implantation[J]. Hum Reprod Update,2016, 22 (2) : 182-93. |
| [11] | Foster BP, Balassa T, Benen TD, et al. Extracellular vesicles in blood, milk and body fluids of the female and male urogenital tract and with special regard to reproduction[J]. Crit Rev Clin Lab Sci,2016, 53 (6) : 379-95. DOI: 10.1080/10408363.2016.1190682. |
| [12] | Poliakov A, Spilman M, Dokland T, et al. Structural heterogeneity and protein composition of exosome-like vesicles(prostasomes)in human semen[J]. Prostate,2009, 69 (2) : 159-67. DOI: 10.1002/pros.v69:2. |
| [13] | Lamparski HG, Metha-Damani A, Yao JY, et al. Production and characterization of clinical grade exosomes derived from dendritic cells[J]. J Immunol Methods,2002, 270 (2) : 211-26. DOI: 10.1016/S0022-1759(02)00330-7. |
| [14] | Zeringer E, Barta T, Li M, et al. Strategies for isolation of exosomes[J]. Cold Spring Harb Protoc,2015 (4) : 319-23. |
| [15] | Albertsson P A, Frick G. Partition of virus particles in a liquid two-phase system[J]. Biochim Biophys Acta,1960, 37 (13) : 230-7. |
| [16] | Rider MA, Hurwitz SN, Meckes J. ExtraPEG: A polyethylene Glycol-Based method for enrichment of extracellular vesicles[J]. Sci Rep,2016, 12 (6) : 23978. |
| [17] | Weng YJ, Sui ZG, Shan YC, et al. Effective isolation of exosomes with polyethylene glycol from cell culture supernatant for in-depth proteome profiling[J]. Analyst,2016, 141 (15) : 4640-6. DOI: 10.1039/C6AN00892E. |
| [18] | 李玉静, 刁振宇, 薛平平, 等. 血清中胎盘来源外泌体的分离与鉴定[J]. 医学研究生学报,2015 (6) : 632-6. |
| [19] | Lu WH, Gu YQ. Insights into semen analysis: a Chinese perspective on the fifth edition of the WHO laboratory manual for the examination and processing of human semen[J]. Asian J Androl,2010, 12 (4) : 605-6. DOI: 10.1038/aja.2010.36. |
| [20] | Dragovic RA, Gardiner C, Brooks AS, et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis[J]. Nanomedicine,2011, 7 (6) : 780-8. |
| [21] | Abu-Halima M, Ludwig N, Hart M, et al. Altered micro-ribonucleic acid expression profiles of extracellular microvesicles in the seminal plasma of patients with oligoasthenozoospermia[J]. Fertil Steril,2016, 106 (5) : 1061-9. DOI: 10.1016/j.fertnstert.2016.06.030. |
| [22] | Filipe V, Hawe A, Jiskoot W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates[J]. Pharm Res,2010, 27 (5) : 796-810. DOI: 10.1007/s11095-010-0073-2. |
| [23] | Madison MN, Jones PH, Okeoma CM. Exosomes in human semen restrict HIV-1 transmission by vaginal cells and block intravaginal replication of LP-BM5 murine AIDS virus complex[J]. Virology,2015, 482 (8) : 189-201. |
| [24] | Colombo M, Raposo G, Thery C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J]. Annu Rev Cell Dev Biol,2014, 30 (7) : 255-89. |
 2016, Vol. 36
2016, Vol. 36
