2. 兰州理工大学生命科学与工程学院,甘肃 兰州
2. College of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China
随着人口结构日趋老龄化,骨质疏松症的防治已成为全球关注的重大课题[1]。虽然采用补充维生素D、增加钙摄入量以及雌激素替代疗法取得了不错的疗效,但却增加了患者罹患高钙血症以及乳腺癌的风险[2-3]。电磁场作为一种物理刺激,因具有无创伤、无疼痛、使用便捷等优点引起了人们的广泛关注。研究表明电磁场可以提高实验动物的骨密度以及骨生物力学性能[4],减缓骨量丢失[5],增加骨质疏松症患者的骨矿盐沉积[6]。但其作用机制仍不十分明确,有待进一步的研究。
G蛋白偶联的cAMP/PKA信号通路参与调节诸多细胞功能。细胞外信号分子与相应受体结合后激活与受体偶联的G蛋白,进而活化腺苷酸环化酶,引起第二信使cAMP浓度升高,cAMP再通过结合底物PKA的调节亚基而使其催化亚基释放,直接或间接地调节一系列细胞活动。研究表明cAMP/PKA/CREB信号通路参与人骨髓间充质干细胞的成骨性分化[7];调节MC3T3的成骨性分化[8],促进骨涎蛋白以及骨钙素的基因表达[9]; 而特异性敲除实验动物G蛋白的α亚基,其骨小梁数量明显减少[10]。那么电磁场是否通过G 蛋白偶联的cAMP/PKA信号通路促进骨形成,对此本文进行了研究,以深入探讨电磁场促进骨形成的分子机理。
1 材料和方法 1.1 低频电磁场细胞处理仪本研究所用低频电磁场细胞处理仪由本课题组自行研制,发明专利号:ZL2011 10423102.0。整套装置由计算机控制模块、数模转化模块、信号放大模块、线圈、磁场传感器和温度传感器组成,可产生正弦波、三角波、方波、脉冲波、锯齿波等不同类型的均匀电磁场,频率5~200 Hz,强度0.0~9.0 mT 精确可调。可确保60 mm培养皿内所有细胞受到相同电磁场处理。实验过程中线圈置于细胞培养箱中,通过导线与外部装置连接(图 1)。

|
图 1 低频电磁场细胞处理仪 Figure 1 The device producing electromagnetic fields for cell exposure. |
出生48 h以内的SPF级Wistar大鼠(甘肃省中医药大学动物实验中心,合格证号:SCXK( 甘)2004- 0006-152);α-MEM培养基、Ⅱ型胶原酶(Gibco,美国); 胎牛血清(兰州民海生物公司);胰蛋白酶(西安科昊生物工程有限责任公司);大鼠cAMP ELISA 试剂盒(R&D,美国);p-PKA抗体、PKA抗体、RUNX-2 抗体、 OSX 抗体(abcam,美国);β-Actin 抗体(bioworld,美国);DDA、KT5720(Sigma,美国);二甲基亚砜(Dimethyl sulfoxide,DMSO,AMRESCO,美国);碱性磷酸酶(ALP)试剂盒(南京建成生物工程研究所);焦碳酸二乙酯(diethypyrocarbonate,DEPC)、SDS-PAGE凝胶制备试剂盒、5×蛋白上样缓冲液、BCA蛋白浓度测定试剂盒、ECL Plus超敏发光液(北京索莱宝科技有限公司);RNAiso Plus Reagent、Prime ScriptTM reagent Kit、 PCR扩增试剂盒(大连宝生物工程有限公司)。
1.3 大鼠颅骨成骨细胞分离培养如文献[11]所述,取出生48 h 以内的Wistar 大鼠5只,置于75%的酒精中消毒后处死,取颅骨,剪成约2 mm2大小的骨碎片,PBS漂洗后置于培养瓶中,加入适量0.25%的胰蛋白酶,37 ℃水浴消化10 min,弃消化液,换用0.1%的Ⅱ型胶原酶37 ℃水浴消化10 min,弃消化液,之后用0.1%的Ⅱ型胶原酶37 ℃水浴消化3次,每次20 min,收集消化液于盛有适量培养液的培养瓶中,200 目细胞筛过滤,1000 r/min离心5 min,弃上清,细胞沉淀使用培养液重悬,调整密度至3×104细胞/mL,接种于90 mm培养皿中,置于37 ℃ 5% CO2培养箱中培养,待细胞生长至90%以上融合时,用0.25%的胰蛋白酶消化传代用于实验。
1.4 细胞内cAMP浓度测定P1代ROBs以3×104/mL的密度均匀接种于60 mm 培养皿中,待生长至接近融合时置于低频电磁场细胞处理仪中分别处理0、5、10、20、40 min、1、2 h,弃培养液,4 ℃预冷的PBS 清洗3 次,加入500 μL 0.1 mol/L HCl室温裂解细胞,收集细胞裂解液并吹打均匀,4 ℃ 12 000 r/min 离心10 min,取上清,按照ELISA试剂盒说明书检测cAMP浓度。
1.5 蛋白表达分析P1代ROBs以3×104/mL的密度均匀接种于60 mm 培养皿中,待生长至接近融合时采用不同条件处理: 50 Hz 0.6 mT低频脉冲电磁场分别处理0、10、20、40 min、 1、2 h 后检测p-PKA及PKA的蛋白表达量;设立对照组、低频脉冲电磁场处理组、KT5720组、KT5720+低频脉冲电磁场处理组,分别予以不同条件处理,即对照组除加入与KT5720等量的DMSO[12]外不做任何处理,低频脉冲电磁场处理组使用50 Hz 0.6 mT低频脉冲电磁场每天处理1.5 h,KT5720组使用10 μmol KT5720[13]处理,KT5720+低频脉冲电磁场处理组在使用10 μmol KT5720 处理的同时采用50 Hz 0.6 mT低频脉冲电磁场每天处理1.5 h,连续处理3 d后检测OSX、RUNX-2、 β-actin 的蛋白表达量,之后弃培养液,4 ℃预冷的PBS 漂洗3 遍,加入PIRA 蛋白裂解液400 μL,充分裂解细胞,收集细胞裂解液,4 ℃ 12 000 r/min离心30 min,收集上清,取25 μL进行蛋白质浓度测定,剩余加入1/4体积的5×蛋白上样缓冲液,沸水浴10 min,待冷却后取20 μg进行SDS-PAGE凝胶电泳,然后电转至PVDF膜上,5%脱脂奶粉室温封闭2 h,一抗(p-PKA:1∶500,PKA:1∶1000;OSX:1∶800;RUNX-2:1∶600;β-Actin: 1∶1000)4 ℃孵育过夜,TBST清洗4 遍,每遍8 min,二抗(1∶10 000)室温振荡孵育2 h,TBST清洗4 遍,每遍8min,ECL Plus超敏发光液暗室发光显影,结果拍照后使用ipp软件进行扫描量化处理。
1.6 ALP活性测定P1代ROBs以3×104/mL的密度均匀接种于30 mm 培养皿中,分别设定对照组、低频脉冲电磁场处理组、 DDA组、DDA+低频脉冲电磁场处理组,待细胞生长至接近融合时分别予以不同条件处理,即对照组除加入与DDA等量的DMSO[12]外不做任何处理,低频脉冲电磁场处理组使用50 Hz 0.6 mT低频脉冲电磁场每天处理1.5h,DDA组使用10 μmol DDA[13-14]处理,DDA+低频脉冲电磁场处理组在使用10 μmol DDA处理的同时采用50 Hz 0.6 mT低频脉冲电磁场每天处理1.5 h,连续处理3、6、9d后测定其ALP活性,检测方法如试剂盒说明书所述,即弃培养基,PBS漂洗3次,加入基质液和缓冲液各250 μL,轻微震荡混匀,37 ℃孵育15 min,加入显色液750 μL,轻微震荡混匀,520 nm处测定吸光值,根据公式换算得到ALP活性值。
1.7 成骨性基因转录分析P1 代ROBs以3×104细胞/mL 的密度均匀接种于60 mm培养皿中,分别设定对照组、低频脉冲电磁场处理组、DDA组、DDA+低频脉冲电磁场处理组、KT5720 组、KT5720+低频脉冲电磁场处理组,待细胞生长至完全融合时分别予以不同条件处理,即对照组除加入与DDA/KT5720等量的DMSO外不做任何处理,低频脉冲电磁场处理组使用50 Hz 0.6 mT低频脉冲电磁场每天处理1.5 h,DDA组使用10 μmol DDA处理,DDA+ 低频脉冲电磁场处理组在使用10 μmol DDA处理的同时采用50 Hz 0.6 mT低频脉冲电磁场每天处理1.5 h,KT5720 组使用10 μmol KT5720 处理,KT5720+低频脉冲电磁场处理组在使用10 μmol KT5720处理的同时采用50 Hz 0.6 mT低频脉冲电磁场每天处理1.5 h,连续处理3 d后弃培养液,4 ℃预冷的PBS漂洗3次,加入1mL RNAiso Plus Reagent于冰上裂解细胞,收集细胞裂解液,加入200 μL氯仿,振荡混匀后4 ℃ 12 000 r/min 离心15 min,吸取上清,加入等体积异丙醇,轻微上下颠倒混匀,4 ℃ 12 000 r/min 离心20 min,弃上清,加入1 mL 75%乙醇(DEPC水现配现用)清洗沉淀,4 ℃ 12 000 r/min离心15 min,弃上清,加入适量DEPC水溶解沉淀,紫外分光光度计于230、260、280、320 nm处检测RNA 质量,根据RNA 浓度使用Prime ScriptTM reagent Kit进行反转录:37 ℃ 15 min,85 ℃ 5 s,反转录产物cDNA使用PCR扩增试剂盒进行扩增:95 ℃ 30 s变性,95 ℃ 5 s退火,60 ℃ 31 s延伸,40个循环。引物序列如表 1所示。数据使用2-△△CT法进行分析。
| 表 1 引物序列 Table 1 Primer sequences |
所有数据使用SPSS 20.0统计软件进行分析,其中组间差异采用单因素方差分析,组间多重比较采用LSD 方法统计分析。结果以平均数±标准差表示,当P<0.05 时表示差异有统计学意义,当P<0.01时表示差异有显著统计学意义。
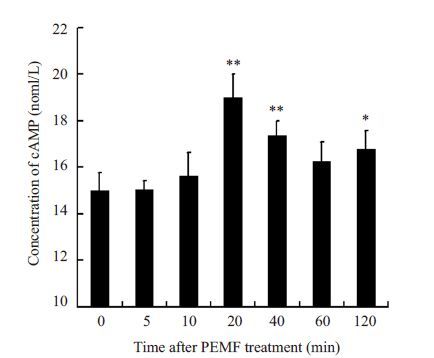
2 结果 2.1 低频脉冲电磁场处理后ROBs内cAMP浓度变化低频脉冲电磁场处理后ROBs内cAMP浓度变化如图 2所示,在电磁场连续处理5、10 min时cAMP浓度未发生明显变化,至处理20 min后出现升高,较对照组有显著的统计学意义(P<0.01),持续至40 min后开始下降,至1 h时较对照组无统计学差异,2 h时再次升高,较对照组有统计学意义(P<0.05),说明低频脉冲电磁场引起第二信使cAMP浓度的升高。
|
图 2 低频脉冲电磁场处理后ROBs内cAMP浓度变化 Figure 2 Changes of cAMP concentrations after PEMF treatment. *P<0.05,**P<0.01. |
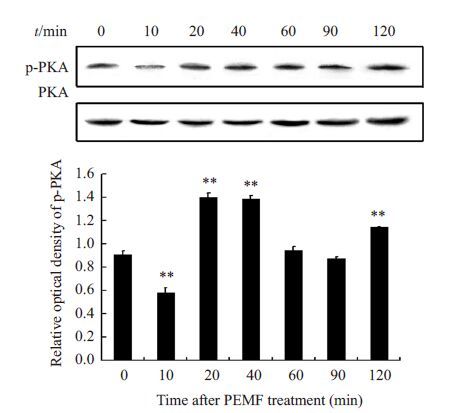
为检测cAMP浓度升高是否引起PKA磷酸化水平的变化,实验检测了低频脉冲电磁场处理后不同时间p-PKA的浓度变化,结果如图 3所示,经电磁场处理后,p-PKA浓度出现短暂降低,之后升高,在20、40 min时较对照组有显著的统计学意义(**P<0.01),之后回归至对照组水平,于2 h时再次升高(**P<0.01),说明第二信使cAMP浓度的升高引起了PKA磷酸化水平的变化。
|
图 3 低频脉冲电磁场处理后ROBs内p-PKA浓度变化 Figure 3 Changes of the levels of p-PKA after PEMF treatment. **P<0.01. |
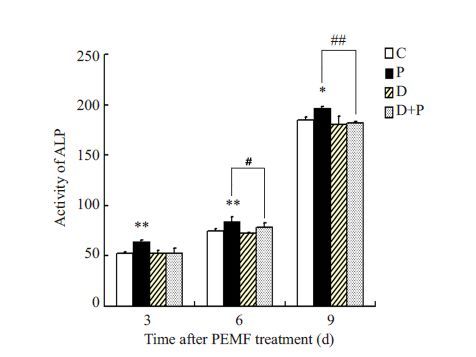
为明确电磁场所引起的成骨性分化过程与第二信使cAMP之间的关系,ROBs经相应分组处理后测定其ALP活性,结果如图 4所示,不论处理3、6 d还是9 d,低频脉冲电磁场处理组ALP活性均显著升高,其差异较对照组有统计学意义(**P<0.01,*P<0.05),单纯DDA 处理未对ROBs 的ALP 活性产生明显影响,而使用DDA抑制AC活性后,低频脉冲电磁场促ALP活性升高的能力减弱,其差异较单纯低频脉冲电磁场处理组有统计学意义(##P<0.01,#P<0.05),说明低频脉冲电磁场促进ALP活性升高与cAMP浓度变化紧密联系。
|
图 4 抑制剂DDA对低频脉冲电磁场处理后ALP活性变化的影响 Figure 4 Effect of DDA on the ALP activities after PEMF treatment. C: Control group; P: PEMP group; D: DDA group; D+P: DDA+PEMP group. *P<0.05,**P<0.01 vs C group,#P<0.05,##P<0.01. |
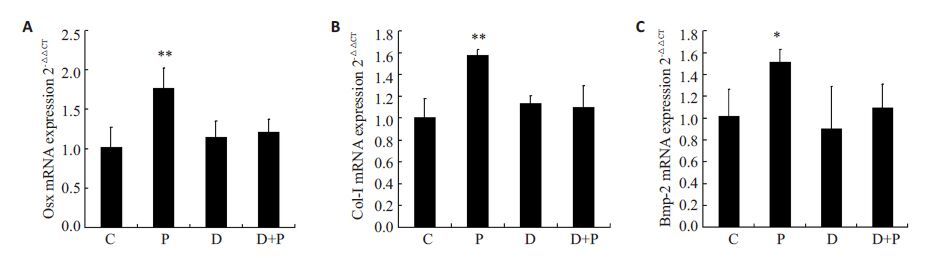
ROBs经分组处理后收集基因检测成骨相关因子的基因转录水平,结果如图 5所示,低频脉冲电磁场处理组Osx、Col-I、Bmp-2的表达量均较对照组显著升高(**P<0.01,*P<0.05),单纯DDA处理未对ROBs的成骨性基因转录产生明显影响,而使用DDA抑制AC活性后,低频脉冲电磁场促Osx、Col-I、Bmp-2基因转录的能力明显削弱,说明低频脉冲电磁场介导的成骨性基因转录增强与cAMP浓度升高相关。
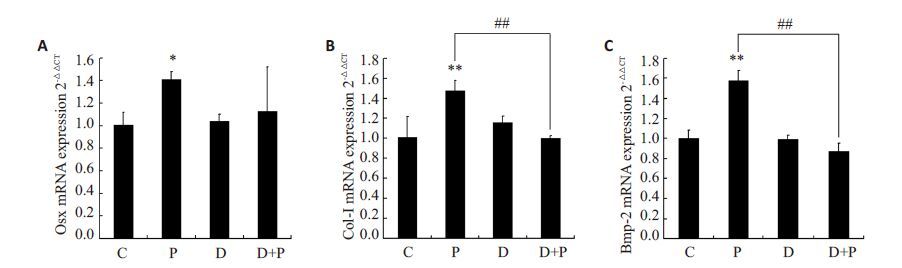
2.5 抑制剂KT5720对低频脉冲电磁场处理后成骨性基因转录变化的影响为检测电磁场骨形成效应与PKA磷酸化之间的关系,实验使用PKA 特异性抑制剂KT5720 预处理ROBs,观察其对电磁场提高成骨性基因转录的影响,结果如图 6所示,低频脉冲电磁场显著提高了成骨性基因Osx、Col-I、Bmp-2的表达(**P<0.01,*P<0.05),抑制剂KT5720未对ROBs成骨性基因的转录产生明显影响,而当其抑制PKA的活性后,由低频脉冲电磁场引起的成骨性基因转录增强的现象消失(##P<0.01),说明cAMP下游底物PKA参与了低频脉冲电磁场促进成骨性基因转录的过程。
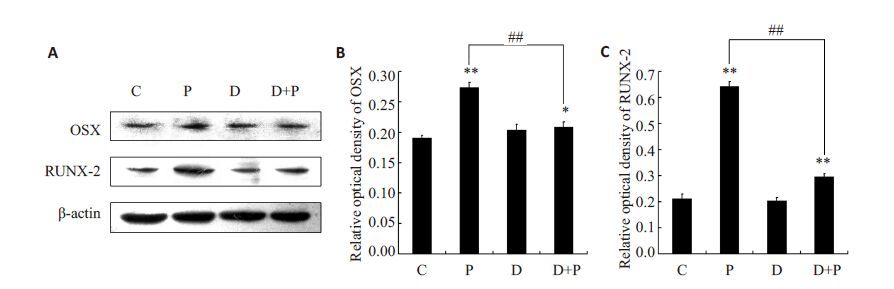
2.6 抑制剂KT5720对低频脉冲电磁场处理后成骨性蛋白表达变化的影响上文显示抑制剂KT5720削弱了电磁场引起的成骨性基因转录的变化,那么其是否也影响了成骨性蛋白的表达呢?为此实验采用Western blotting 检测了KT5720预处理后低频脉冲电磁场对成骨性蛋白表达的影响,结果如图 7所示,低频脉冲电磁场处理后成骨性蛋白的表达升高(**P<0.01),单纯使用KT5720 未对ROBs成骨性蛋白的表达产生明显影响,而KT5720却抑制了低频脉冲电磁场所引起的成骨性蛋白表达的增强(##P<0.01),说明PKA也参与了低频脉冲电磁场引起的成骨性蛋白的表达。
|
图 5 抑制剂DDA对低频脉冲电磁场处理后成骨性基因转录变化的影响 Figure 5 Effect of DDAon the osteogenic gene transcription after PEMF treatment. *P<0.05,**P<0.01. |
|
图 6 抑制剂KT5720对低频脉冲电磁场处理后成骨性基因转录变化的影响 Figure 6 Effect of KT5720 on the osteogenic gene transcription after PEMF treatment. *P<0.05,**P<0.01 vs C group,##P<0.01. |
|
图 7 抑制剂KT5720对低频脉冲电磁场处理后成骨性蛋白表达变化的影响 Figure 7 Effect of KT5720 on the osteogenic protein expression after PEMF treatment. *P<0.05,**P<0.01 vs C Group,##P<0.01. |
低频脉冲电磁场在临床上用于骨折愈合已有近半个世纪的历史[15],许多研究表明低频脉冲电磁场可以促进骨形成[16-17]。本课题组经研究发现50 Hz 0.6 mT低频脉冲电磁场可以显著促进ROBs矿化成熟[18],然而其具体的作用机制仍不十分清楚,有待研究。cAMP作为第二信使,广泛参与调节细胞功能,自发现以来就引起人们的广泛关注。研究表明小分子的cAMP类似物可以特异性地激活PKA,进而促进MC3T3-E1的矿化成熟[19],cAMP/PKA 信号通路参与淫羊藿苷促进骨形成的过程[20]。本文通过一系列研究发现,cAMP/PKA信号通路参与50 Hz 0.6 mT低频脉冲电磁场促进骨形成的过程。
cAMP作为第二信使,在细胞内的浓度受到严格的控制,以完成对细胞功能的精确调控。本文通过检测经低频脉冲电磁场不同时间处理后细胞内cAMP 及p-PKA浓度的变化发现,在电磁场处理20 min后ROBs 内cAMP浓度显著升高,持续至40 min后降低,至2 h时再次升高,PKA的磷酸化也表现出相同的变化趋势,在电磁场处理20、40 min时较对照组有显著的统计学意义,之后降低,2 h时再次升高,说明低频脉冲电磁场激活了cAMP/PKA信号通路。而使用DDA抑制cAMP 的合成后发现,成骨性分化早期指标ALP活性显著下降,成骨相关基因Osx、Col-I和Bmp-2的转录亦显著下降,说明低频脉冲电磁场通过第二信使cAMP 调节ROBs的成骨性分化。同样,使用KT5720抑制PKA的磷酸化之后,由电磁场所引起的成骨性基因转录及蛋白表达的增强亦减弱,说明cAMP下游底物PKA也参与了低频脉冲电磁场促进骨形成的过程。
作为普遍存在于生物有机体中的重要信号转导方式,cAMP/PKA信号通路通过多种方式调节细胞功能,在骨代谢调节过程中发挥着重要作用,本文通过研究发现50 Hz 0.6 mT低频脉冲电磁场通过激活cAMP/PKA 信号通路促进骨形成,然而亦有研究显示cAMP/PKA 信号通路在骨髓间充质干细胞的分化过程中扮演相反的角色,促进其成脂性分化而抑制其成骨性分化[21-22],参与破骨细胞的分化[23],那么,在细胞复杂而高度可控的代谢调节网络中,低频脉冲电磁场通过cAMP/PKA信号通路促进骨形成的过程又受到了哪些调节,与其他信号通路之间存在何种关联,仍有待进一步的研究。
| [1] | 高堪达, 俞永林, 周建伟. 脉冲电磁场治疗骨质疏松症研究进展[J]. 国外医学: 骨科学分册,2005, 25 (5) : 307-9. |
| [2] | Paterson CR. Vitamin-D poisoning: survey of causes in 21 patients with hypercalcaemia[J]. Lancet,1980, 1 (8179) : 1164-5. |
| [3] | Mahavni V, Sood AK. Hormone replacement therapy and cancer risk[J]. Curr opin oncol,2001, 13 (5) : 384-9. DOI: 10.1097/00001622-200109000-00012. |
| [4] | 罗二平, 焦李成, 申广浩, 等. 不同强度脉冲电磁场对兔股骨骨密度及生物力学特性的影响[J]. 生物医学工程学杂志,2006, 22 (6) : 1168-70. |
| [5] | Jing D, Shen G, Huang J, et al. Circadian rhythm affects the preventive role of pulsed electromagnetic fields on ovariectomyinduced osteoporosis in rats[J]. Bone,2010, 46 (2) : 487-95. DOI: 10.1016/j.bone.2009.09.021. |
| [6] | Garland DE, Adkins RH, Matsuno NN, et al. The effect of pulsed electromagnetic fields on osteoporosis at the knee in individuals with spinal cord injury[J]. J Spinal Cord Med,1998, 22 (4) : 239-45. |
| [7] | Kim JM, Choi JS, Kim YH, et al. An activator of the cAMP/PKA/ CREB pathway promotes osteogenesis from human mesenchymal stem cells[J]. J Cell Physiol,2013, 228 (3) : 617-26. DOI: 10.1002/jcp.v228.3. |
| [8] | Ghayor C, Ehrbar M, San Miguel B, et al. cAMP enhances BMP2-signaling through PKA and MKP1-dependent mechanisms[J]. Biochem Biophys Res Commun,2009, 381 (2) : 247-52. DOI: 10.1016/j.bbrc.2009.02.032. |
| [9] | Huang WC, Xie Z, Konaka H, et al. Human osteocalcin and bone sialoprotein mediating osteomimicry of prostate cancer cells: role of cAMP-dependent protein kinase A signaling pathway[J]. Cancer Res,2005, 65 (6) : 2303-13. DOI: 10.1158/0008-5472.CAN-04-3448. |
| [10] | Sakamoto A, Chen M, Nakamura T, et al. Deficiency of the G-protein α-subunit Gsα in osteoblasts leads to differential effects on trabecular and cortical bone[J]. J Biol Chem,2005, 280 (22) : 21369-75. DOI: 10.1074/jbc.M500346200. |
| [11] | 方清清, 李志忠, 陈克明, 等. 50 Hz 1.8 mT 正弦交变电磁场通过调节成骨细胞PGE2 分泌影响Opg/Rankl 的基因表达[J]. 中国生物化学与分子生物学报,2015, 31 (9) : 983-8. |
| [12] | Guicheux J, Lemonnier J, Ghayor C, et al. Activation of p38 Mitogen-Activated Protein Kinase and c-Jun-NH2-Terminal Kinase by BMP-2 and Their Implication in the Stimulation of Osteoblastic Cell Differentiation[J]. J Bone Mine Res,2003, 18 (11) : 2060-8. DOI: 10.1359/jbmr.2003.18.11.2060. |
| [13] | Park YG, Kang SK, Noh SH, et al. PGE 2, induces IL-1β gene expression in mouse osteoblasts through a cAMP-PKA signaling pathway[J]. Int Immunopharmacol,2004, 4 (6) : 779-89. DOI: 10.1016/j.intimp.2004.03.003. |
| [14] | Haslam RJ, Davidson MM, Desjardins JV. Inhibition of adenylate cyclase by adenosine analogues in preparations of broken and intact human platelets. Evidence for the unidirectional control of platelet function by cyclic AMP[J]. Biochem J,1978, 176 (1) : 83-95. DOI: 10.1042/bj1760083. |
| [15] | Heckman JD, Ingram AJ, Loyd RD, et al. Nonunion treatment with pulsed electromagnetic fields[J]. Clin Orthop Relat Res,1981, 161 : 58-66. |
| [16] | Fu YC, Lin CC, Chang JK, et al. A novel single pulsed electromagnetic field stimulates osteogenesis of bone marrow mesenchymal stem cells and bone repair[J]. PloS One,2014, 9 (3) : e91581. DOI: 10.1371/journal.pone.0091581. |
| [17] | McLeod KJ, Rubin CT. The effect of low-frequency electrical fields on osteogenesis[J]. J Bone Joint Surg Am,1992, 74 (6) : 920-9. DOI: 10.2106/00004623-199274060-00014. |
| [18] | Yan JL, Zhou J, Ma HP, et al. Pulsed electromagnetic fields promote osteoblast mineralization and maturation needing the existence of primary cilia[J]. Mol Cell Endocrinol,2015, 404 : 132-40. DOI: 10.1016/j.mce.2015.01.031. |
| [19] | Lo KW, Kan HM, Ashe KM, et al. The small molecule PKAspecific cyclic AMP analogue as an inducer of osteoblast-like cells differentiation and mineralization[J]. J Tissue Eng Regen Med,2012, 6 (1) : 40-8. DOI: 10.1002/term.v6.1. |
| [20] | 石文贵, 李雪雁, 陈克明, 等. 基于cAMP-PKA 信号通路的淫羊藿苷促进骨形成研究[J]. 中国现代应用药学,2015, 32 (2) : 131-6. |
| [21] | Zhao Y, Ding S. A high-throughput siRNA library screen identifies osteogenic suppressors in human mesenchymal stem cells[J]. Proc Natl Acad Sci USA,2007, 104 (23) : 9673-8. DOI: 10.1073/pnas.0703407104. |
| [22] | Siddappa R, Mulder W, Steeqhs I, et al. cAMP/PKA signaling inhibits osteogenic differentiation and bone formation in rodent models[J]. Tissue Eng Part A,2009, 15 (8) : 2135-43. DOI: 10.1089/ten.tea.2008.0512. |
| [23] | Kobayashi Y, Mizoguchi T, Take I, et al. Prostaglandin E2 enhances osteoclastic differentiation of precursor cells through protein kinase A-dependent phosphorylation of TAK1[J]. J Biol Chem,2005, 280 (12) : 11395-403. DOI: 10.1074/jbc.M411189200. |
 2016, Vol. 36
2016, Vol. 36
