2. 重庆医科大学附属永川医院妇产科,重庆 402160
2. Department of Obstetrics and Gynecology, Yongchuan Hospital Affiliated to Chongqing Medical University, Chongqing 402160, China
上皮性卵巢恶性肿瘤是死亡率最高的妇科恶性肿瘤,总的5年的生存率不超过40%,近20年治疗方案及预后改善均有限[1-2]。与肺癌,白血病等恶性肿瘤相比,上皮性卵巢恶性肿瘤的靶向治疗为患者带来的生存获℃仍非常有限。寻找其特异性靶标仍然具有潜在价值。Ras蛋白是一种低分子蛋白,来自G蛋白家族,由近200个氨基酸构成,位于细胞膜内侧,它通过激活状态与非激活状态两种模式的转换控制细胞信号传导,是一个抑制凋亡的公认的原癌基因[3-4],在多种人类肿瘤中发现了Ras基因的点突变[5-7]。Sos1(son of sevenless 1)是鸟苷酸交换因子,促进Ras 由非激活状态转化为激活状态,是Ras的激活蛋白[8]。Ras和Sos1共同构成了调节细胞生理过程的信号通路[9];这个通路上下游的关键分子,如Grb2、Raf-1等都被证实在上皮性卵巢恶性肿瘤细胞的发生、发展、转移过程中起到重要作用[10-11]。种种证据显示,Ras及Ras和Sos1构成的信号通路是治疗转移癌症的优良靶点[12-17]。Ras和Sos1及其构成的信号通路与卵巢癌之间的联系,在细胞及分子水平研究较多,与临床及病理之间联系的研究较少,特别是与无瘤生存时间之间关系,尚未搜索到国内外报道。而本研究旨在研究Ras和Sos1蛋白在上皮性卵巢肿瘤中的表达情况,并探索这两种蛋白表达程度与卵巢肿瘤临床病理恶性程度指标以及无瘤生存时间的相关性,从而为研究Sos1/Ras蛋白及其信号通路在上皮性卵巢恶性肿瘤发生发展做所起作用提供实验±据,为上皮性卵巢恶性肿瘤的生物靶向治疗提供思路。
1 材料和方法 1.1 组织样本选取在2008~2013年重庆医科大学附属第一医院与重庆附属永川医院确诊的62 例上皮性卵巢恶性肿瘤、5例交界性上皮性卵巢肿瘤、15例卵巢上皮性囊腺瘤、18例正常卵巢组织。癌症患者术前未进行放化疗,并在实验前充分知情并签署知情同意书。标本切除后,均及时进行石蜡包埋。其中上皮性卵巢恶性肿瘤临床病理资料情况如表 1所示。为便于比较,按2014版FIGO手术-病理分期,将患者分为Ⅰ~Ⅱ期和Ⅲ~Ⅳ期两组。美国国家癌症综合网络(NCCN)发布的2014年版《卵巢癌包括输卵管癌和原发性腹膜癌临床实践指南》中指出,“肿瘤细胞减灭术力求使残余肿瘤病灶直径<1 cm,最好切除所有肉眼可见病灶”,我们将手术满意度定义为“残余肿瘤病灶直径<1 cm”为“满意”,反之为“不满意”。
1.2 实验试剂免疫组化试组剂盒、DAB 显色剂、柠檬酸抗原修复液(PH 6.0)购自北京中杉金桥有限公司,Ras、Sos1单克隆抗体购自美国Santa。
1.3 实验方法 1.3.1 免疫组化试验试验将石蜡包埋的标本,采用4 μm连续切片,脱蜡、水化后进行微波抗原修复、血清封闭、一抗二抗孵育进行免疫组化染色(SP法),抗体工作浓度1∶250。
1.3.2 免疫组化表达定性定量检测定性判断[18]:至少2位病理医师双盲阅片,镜下随机选择5个高倍镜视野,以光镜下肿瘤细胞内出现棕黄色颗粒染色强度将评分分为4级:(1)不着色-;(2)淡黄色:+;(3)棕黄色:++;(4)深褐色:+++。
定量测定:免疫组化试验显色后,在同一台显微镜下,采用同一曝光值,相同白平衡值拍摄照片。采用图像分析软件ipwin32进行光密度测定,每份标本进行3 个视野光密度测定,取平均值,进行记录。
| 表 1 上皮细胞上皮性卵巢恶性肿瘤患者临床病理资料 Table 1 Clinicopathological data of epithelial ovarian cancer |
统计Ras和Sos1蛋白在各种卵巢组织中阳性表达率,采用四格表χ2检验校正公式两两比较进行定性资料显著性检验,P<0.05为差异有统计学意义;以上皮性卵巢恶性肿瘤的恶性程度指标(包括病理分级、手术病理分期、年龄、病理类型、手术满意度)为自变量,两种蛋白的光密度值为应变量,逐一进行统计学计算,得出相关性系数,并进行显著性检验,P<0.05为差异有统计学意义,以对两种蛋白表达程度与临床病理相关性分析;分析晚期(Ⅲ~Ⅳ期)低分化腺癌及浆液性上皮性卵巢恶性肿瘤患者的生存随访资料,以该类患者的开始治疗时间为无瘤生存的起始时间,复发时间为无瘤生存的终止时间,失访、复发前死亡病例均视为截尾数据,按光密度中位值将患者分为高表达组与低表达组,进行无瘤生存时间分析。以上数据均采用spss19软件进行处理。
2 结果 2.1 Ras和Sos1在不同卵巢组织中的表达两种蛋白在不同卵巢组织中表达情况如表 2,3,图 1,2所示。
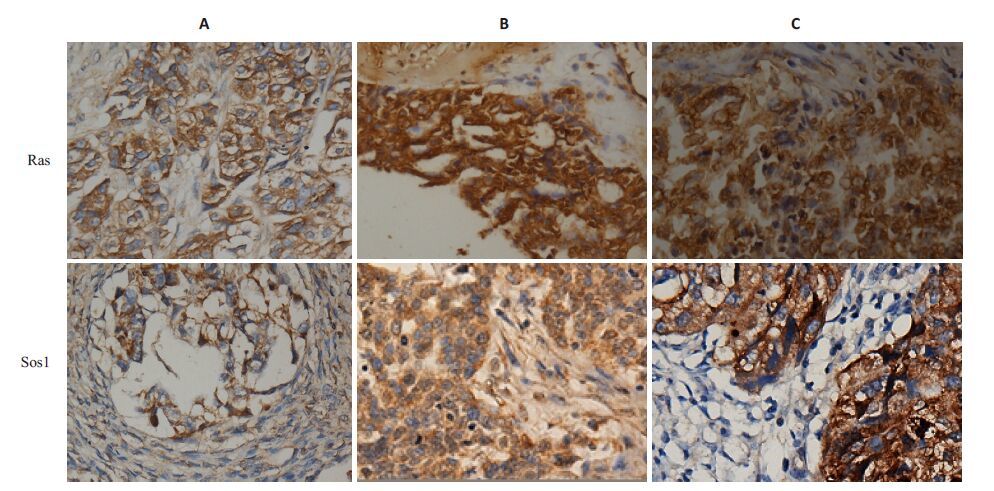
2.2 Ras和Sos1蛋白在上皮性卵巢恶性肿瘤组织细胞中的表达分布Ras和Sos1蛋白在上皮性卵巢恶性肿瘤组织细胞中的表达分布,分别有表达位于细胞膜、细胞浆和细胞膜细胞浆同时表达3种情况。结果如图 3和表 4所示,Sos1蛋白和Ras蛋白在细胞膜和细胞浆中同时表达的阳性(71.19%和82.26%)显著高于仅为细胞膜(3.23%、 1.61%)或细胞浆(4.84%、6.45%)表达的阳性率(P< 0.005),说明两种蛋白在上皮性卵巢恶性肿瘤细胞中的表达部位均以细胞膜和细胞浆同时表达为主。
| 表 2 Ras蛋白在各种卵巢组织中的表达 Table 2 Expressions of Ras protein in different ovarian tissues |
| 表 3 Sos1蛋白在各种卵巢组织中的表达 Table 3 Expressions of Sos1 protein in different ovarian tissues |
|
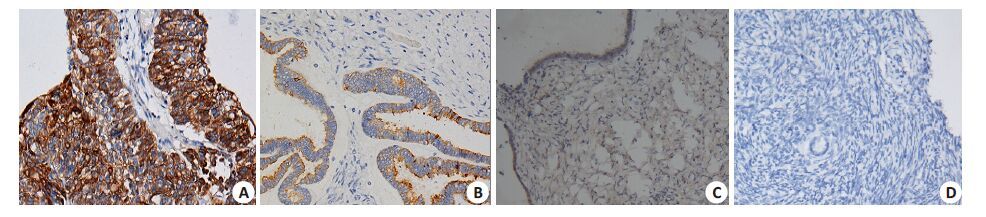
图 1 Ras蛋白在不同组织中的表达 Figure 1 Expression of Ras in different ovarian tissues (Immunohistochemistry,original magnification: × 200). A: Epithelial ovarian cancer; B: Borderline ovarian tumors; C: Serous cystadenoma of the ovary; D: Normal ovarian tissue. |
|
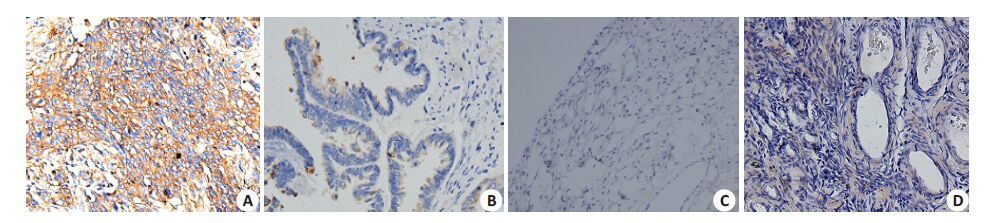
图 2 Sos1在不同组织中的表达 Figure 2 Expression of Sos1 in different tissues (Immunohistochemistry,× 200). A: Epithelial ovarian cancer; B: Borderline ovarian tumor; C: Serous cystadenoma of the ovary; D: Normal ovarian tissue. |
|
图 3 Ras和Sos1蛋白在上皮性卵巢恶性肿瘤中的表达 Figure 3 Expression of Ras and Sos1 protein in ovarian epithelial carcinomas (Immunohistochemistry,×400). A: Expression on the cell membranes; B: Expression in the cytoplasm; C: Expression both on the cell membranes and in the cytoplasm. |
| 表 4 Sos1在卵巢上皮性恶性肿瘤组织中的表达部位 Table 4 Localization of Ras and Sos1 protein expression in ovarian epithelial carcinomas tissue |
利用Spss19.0软件分析上皮性卵巢恶性肿瘤患者年龄、病理类型、手术-病理分期、病理分级和手术满意度与Ras和Sos1 蛋白表达的光密度的相关性,分别计算出相关系数及P值,结果如表 5显示,Ras的表达程度(光密度值)与病理分型有相关性P<0.05,其他组均无显著性差异。
2.4 Sos1和Ras蛋白的表达与晚期低分化腺癌及浆液性上皮性卵巢恶性肿瘤患者的无瘤生存时间分析研究纳入晚期上皮性卵巢恶性肿瘤(Ⅲ~Ⅳ期)患者32例,Ras及Sos1蛋白在这些患者癌灶中表达的光密度的中位数为0.12及0.88。以两组蛋白表达水平的光密度中位数值为临界点,将患者分别分为高表达组与低表达组。其中两组高表达组均为17人,低表达组均为15人。
| 表 5 上皮性卵巢恶性肿瘤患者临床病理资料与Ras 和Sos1蛋白表达光密度值的相关分析 Table 5 Correlation analysis of expression of Ras and Sos1 proteins with clinicopathological data of patients with ovarian cancer |
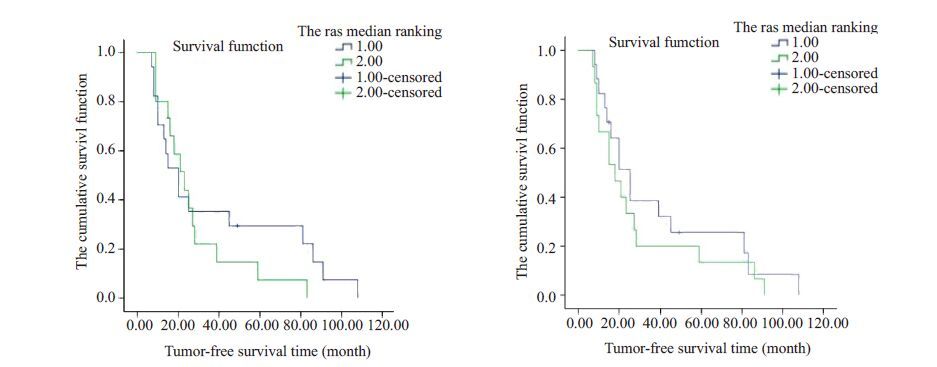
采用Kaplan-Meier 方法,分析两种蛋白表达水平对无瘤生存时间的影响,结果如图 4所示,随着时间的推移,两种蛋白表达程度越高的患者,无瘤生存时间更短,但统计学无显著性差异(P>0.05)。函数图同时显示高表达组的患者无瘤生存曲线总体上较低表达组患者下降更陡直,Log Rank方法进行检验发现,函数分析不具有显著性(P>0.05)。
|
图 4 不同Ras和Sos1蛋白表达组无瘤生存时间函数图 Figure 4 Kaplan-Meier analysis of tumor-free survival of patients with different status of Ras and Sos1 expression. |
自1982年首次Ras被描述为致癌基因[19-20],已有众多以Ras 及Ras 的下游蛋白为目标的研究相继开展。Ras 网络庞大而复杂,由许多连接通路发挥重要作用[21]。据己有的报道,多种不同的肿瘤如癌、肉瘤、神经母细胞瘤、淋巴肉瘤及白血病中,均发现有激活的Ras 基因[22-23]。卞美璐等[24]在对卵巢肿瘤组织进行DNA Southern印记杂交的实验中发现,Ras的基因扩增率为43.8%,其中9例高分化的患者中89%出现了Ras的扩增。而Sos1 作为低相对分子质量G蛋白的正调节因子,其在Ras信号通路中起到促进Ras激活的作用。有研究显示在上皮性卵巢癌中,Sos1表达水平很高,与Ras 蛋白的活化形式Ras-GTP的表达呈正向关[25]。这些研究都是基于分子水平的实验室基础研究,虽然收到了较为满意的实验结果,但在临床的运用上仍然收效甚微。
本研究在实验室进行了对Sos1和Ras两种蛋白在各种卵巢组织中的表达的免疫组化实验,提示这两种蛋白在卵巢癌组织中呈现高表达,这与前述在其他肿瘤中的研究发现是一致的。同时还结合临床及病理,研究了他们的表达与反应肿瘤恶性程度指标(患者的年龄、病理分级、手术病理分期、手术满意度、病理分型)的相关性,虽然结果显示其中Sos1的表达程度(光密度值)与以上临床病理特征均没有相关性(P>0.05),但在Ras蛋白的研究中发现,它在浆液性卵巢癌中的表达程度(光密度值)高于其他类型上皮性卵巢恶性肿瘤。这提示Ras表达可能存在组织类型差异,这个特点可用来支持卵巢浆液性腺癌的特异性诊断:光密度值越高的组织,浆液性腺癌的可能性越大。
本研究中将随访的无瘤生存时间与不同表达的人群进行无瘤生存分析,得出的两种蛋白的函数图均显示高表达组的患者无瘤生存曲线总体上较低表达组患者下降更陡直,这与我们的理论研究是吻合的,可能对临床预后的判断具有指导意义。虽然采用Log Rank、 Breslow、Tarone-Ware方法对这一结果进行检验发现,这些函数分析均不具有显著性,但估计这与我们分析无瘤生存的样本量太小(纳入无瘤生存研究范围内的病例数仅32例)有关。所以关于本研究有继续扩大样本量进一步充分研究的价值,以期将Ras及Sos1的检测运用于卵巢癌的诊断、治疗、预后判断等临床实际工作中去。
| [1] | Ferlay J, Shin H R, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer,2010, 127 (12) : 2893-917. DOI: 10.1002/ijc.v127:12. |
| [2] | Salehi F, Dunfield L, Phillips KP, et al. Risk factors for ovarian cancer: an overview with emphasis on hormonal factors[J]. J Toxicol Environ Health B Crit Rev,2008, 11 (3/4) : 301-21. |
| [3] | 朱一婧, 姜凤超. 以调控Ras信号传导为靶标的抗肿瘤药物研究进展[J]. 药学学报,2009, 44 (1) : 1-10. |
| [4] | Zhao LH, Lobo S, Dong XW, et al. Erf4p and Erf2p form an endoplasmic Reticulum-associated complex involved in the plasma membrane localization of yeast Ras proteins[J]. J Biol Chem,2002, 277 (51) : 49352-9. DOI: 10.1074/jbc.M209760200. |
| [5] | 于法常, 李胜, 牛作兴. K-Ras基因与结直肠癌疗效[J]. 国际肿瘤学杂志,2014, 41 (3) : 214-6. |
| [6] | Hollern DP, Yuwanita I, Andrechek ER. A mouse model with T58A mutations in Myc reduces the dependence on KRas mutations and has similarities to claudin-low human breast cancer[J]. Oncogene,2013, 32 (10) : 1296-304. DOI: 10.1038/onc.2012.142. |
| [7] | Jänne PA, Shaw AT, Pereira JR, et al. Selumetinib plus docetaxel for KRAS-mutant advanced non-small-cell lung cancer: a randomised, multicentre, placebo-controlled, phase 2 study[J]. Lancet Oncol,2013, 14 (1) : 38-47. DOI: 10.1016/S1470-2045(12)70489-8. |
| [8] | 陈慧君, 吴绪峰. 三重复合物SOS1/EPS8/ABI1的完整性决定上皮性卵巢恶性肿瘤细胞 http://cdmd.cnki.com.cn/Article/CDMD-10486-1011065840.htm |
| [9] | 宋艳, 周湘, 李慧芳, 等. 以Ras信号转导通路为靶点的抗肿瘤抑制剂的研究进展[J]. 中南药学,2009, 7 (4) : 293-6. |
| [10] | Bourguignon, Y L, Z hu, et al. Hyaluronan promotes CD44v3-Vav2 interaction with Grb2-p185 HER2 and induces Rac1 and Ras signaling during ovarian tumor cell migration and growth[J]. J Biol Chem,2001, 276 (52) : 48679-92. DOI: 10.1074/jbc.M106759200. |
| [11] | 毛甜甜. 上皮性卵巢恶性肿瘤中EGFR, Raf-1, AKT的表达及其意义[D]. 南昌大学医学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10411-1014116831.htm |
| [12] | Lim K H, Counter C M. Reduction in the requirement of oncogenic Ras signaling to activation of PI3K/AKT pathway during tumor maintenance[J]. Cancer Cell,2005, 8 (5) : 381-92. DOI: 10.1016/j.ccr.2005.10.014. |
| [13] | Brummelkamp TR, Bernards R, Agami R. Stable suppression of tumorigenicity by virus-mediated RNA interference[J]. Cancer Cell,2002, 2 (3) : 243-7. DOI: 10.1016/S1535-6108(02)00122-8. |
| [14] | Singh A, Greninger P, Rhodes D, et al. A gene expression signature associated with "K-Ras addiction" reveals regulators of EMT and tumor cell survival[J]. Cancer Cell,2009, 15 (6) : 489-500. DOI: 10.1016/j.ccr.2009.03.022. |
| [15] | Chin L, Tam A, Pomerantz J, et al. Essential role for oncogenic Ras in tumour maintenance[J]. Nature,1999, 400 (6743) : 468-72. DOI: 10.1038/22788. |
| [16] | Fisher GH, Wellen SL, Klimstra D, et al. Induction and apoptotic regression of lung adenocarcinomas by regulation of a K-Ras transgene in the presence and absence of tumor suppressor genes[J]. Genes Dev,2001, 15 (24) : 3249-62. DOI: 10.1101/gad.947701. |
| [17] | Collins MA, Brisset JC, Zhang Y, et al. Metastatic pancreatic cancer is dependent on oncogenic Kras in mice[J]. Plos One,2012, 7 (12) : e49707-e49707. DOI: 10.1371/journal.pone.0049707. |
| [18] | 商利. 食管鳞癌及癌前病变分子分型标志物研究[D]. 北京协和医学院中国医学科学院/北京协和医学院/中国医学科学院/清华大学医学部, 2014. |
| [19] | Der CJ, Krontiris TG, Cooper GM. Transforming genes of human bladder and lung carcinoma cell lines are homologous to the ras genes of Harvey and Kirsten sarcoma viruses[J]. Proc Natl Acad Sci USA,1982, 79 (11) : 3637-40. DOI: 10.1073/pnas.79.11.3637. |
| [20] | Parada LF, Tabin CJ, Shih C, et al. Human EJ bladder carcinoma oncogene is homologue of harvey sarcoma virus ras gene[J]. Nature,1982, 297 (5866) : 474-8. DOI: 10.1038/297474a0. |
| [21] | Barsagi D. RAS oncogenes: weaving a tumorigenic web[J]. Nat Rev Cancer,2011, 11 (11) : 761-74. DOI: 10.1038/nrc3106. |
| [22] | Mocoy MS. Charaeterizatin of human colon /lung cacrinoma oneogene[J]. Nature,1983, 302 (5903) : 79-81. DOI: 10.1038/302079a0. |
| [23] | Pulciani S, Santos E, Lauver AV, et al. Oncogenes in solid human tumours[J]. Nature,1982, 300 (5892) : 539-42. DOI: 10.1038/300539a0. |
| [24] | 卞美璐, 樊庆泊, 黄尚志, 等. 原癌基因C-myc、C-N-ras、C-Ki-ras、 C-erbB2 在卵巢癌组织中的扩增[J]. 中华妇产科杂志,1995 (7) : 406-9. |
| [25] | 彭慧娟. Crk衔接蛋白介导之DOCK180/Rac1、SOS1/Ras信号通路对浆液性卵巢癌恶性程度的影响[D]. 重庆: 重庆医科大学, 2013. |
 2016, Vol. 36
2016, Vol. 36
