猴免疫缺陷病毒(Simian immunodeficiency virus,SIV)与人类免疫缺陷病毒(Human immunodeficiency Virus,HIV)的同源性较高[1],可以感染恒河猴等猴类动物产生免疫缺陷综合症(Simian acquired immunodeficiency syndrome,SAIDS)[2-3],因此,近年来,SIV感染模型作为HIV一个相关的动物模型已经被广泛应用于HIV的机制、疫苗、药物的筛选等各方面的研究,是研究HIV的一个金标准[4-9]。TaqMan探针法是实时定量PCR最经典,也是至今广泛应用于快速筛查病原体、检测病毒载量等各方面的一种实时定量PCR 技术[10],Allglo探针是美国Allelogic Biosciences公司推出的新一代荧光染料探针[11],具有价格较低、灵敏度高、特异性强、重复性好的优势[12-13]。但相对于TaqMan探针,国内将Allglo 探针荧光定量RT-PCR法应用于SIV/HIV 病毒载量的检测还较少,本实验将对Allglo 探针和TaqMan探针荧光定量RT-PCR检测SIV标准品的病毒载量的方法进行比较评价。
1 材料和方法 1.1 试剂和仪器 1.1.1 SIV标准品采用人慢性髓原白细胞系(CEMx174 细胞)培养SIVmac251(由美国Aron Diamond艾滋病研究中心惠赠SIV 病毒毒种),经美国国立卫生研究院AIDS reagents programme 惠赠的SIVmac251 病毒标准品(病毒载量为1×106 copies/mL,其货号为:1338)进行定量,其病毒载量为4.5×108 copies/mL,用小牛血清(GIBCO公司)稀释为所需要的浓度。
1.1.2 逆转录及定量PCR试剂逆转录试剂采用MBI 公司的逆转录试剂盒;定量PCR试剂采用ABI公司的定量PCR试剂盒。
1.1.3 仪器ABI7300定量PCR仪购于美国ABI公司。
1.2 引物和探针通过美国ABI Primer Express3.0 软件设计引物、 探针。Allglo探针设计原则为在TaqMan探针基础上将探针序列缩短至20 个碱基以内并保持Tm在60 ℃左右。上游引物序列为AACCTTCGGTTCCAATTCCG GAAC;下游引物序列为:CTTCAACGGTTCATTCCC GGGACC;TaqMan 反应探针序列为FAM-CACTTG CTGAAATGGCCTTAAAGCCAGTTC-TAMRA;llglo 探针:FAM-CACTTGCTGAAATGGCC-Allglo。
1.3 方法 1.3.1 Allglo探针和TaqMan探针荧光定量逆转录PCR(RT-PCR)方法的建立用自制一管式病毒核酸提取试剂(专利号:CN200910039350.8)进行SIVRNA提取,逆转录反应体系为8 μL,其中5×Buffer 1.6 μL,Reverse引物0.4 μL,dNTP(10 mmol/L)0.8 μL,Rnase inhibitor (40 U/μL)0.25 μL,水4.55 μL,逆转录酶0.4 μL,在冰上调制后将逆转录液每个RNA沉淀标本加入8 μL的量加入并吹打混匀,然后置入42 ℃水浴锅中进行逆转录。反应1 h后取出冻存于-20 ℃冰箱待检测。将上述冻存的SIV标准品cDNA常温放置解冻,然后进行定量PCR反应,定量PCR反应采用25 μL体系,组成为:上下游引物各为0.25 μL,探针0.2 μL,水9.8 μL,SIVcDNA 2μL,PCRMix12.5 μL。反应条件为:95 ℃变性10 min,然后95 ℃,15 s;60 ℃,1 min,进行45个循环。
1.3.2 灵敏度检测将SIV病毒标准品用小牛血清稀释为6个浓度,分别为:5×106、5×105、5×104、5×103、5×102 和5×10,并以小牛血清作为阴性对照,提取RNA进行逆转录,用TaqMan探针和Allglo探针进行定量PCR检测,观察出最低检测值。
1.3.3 重复性比较将不同浓度(5×106-5×10 copies/mL)的SIV病毒标准品进行SIVRNA提取,每个浓度同时提取12个标本进行批内差异分析;然后每个标本提取12 次进行批间差异分析。然后以逆转录液进行逆转录,批内差异分析者每个标本12个同时进行逆转录,批间差异分析者分12 次进行逆转录。用TaqMan 探针和Allglo探针进行定量PCR检测,批内差异分析者所有标本同时上机检测,批间差异分析者每个浓度1孔进行检测,分12次检测。检测完毕后用ABI7300定量PCR仪所携带的软件进行定量分析。
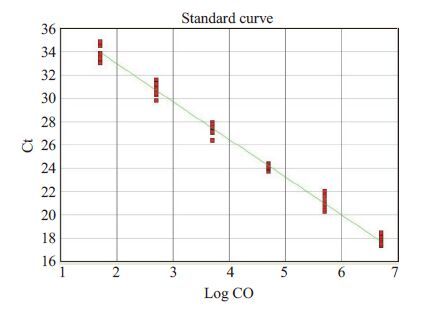
1.3.4 CT值与SIV标准品拷贝数的分析CT值是指每个反应管内的荧光信号到达设定阈值时所经历的循环数,且CT值与模板DNA的起始拷贝数(dRn)成反比[14]。本实验利用已知起始拷贝数的标准品作出标准曲线,其中纵坐标代表CT值,横坐标代表起始拷贝数的对数(如图 2、4所示),从标准曲线中根据相关系数(R2)的值可知Ct值与荧光累积值的相关的密切程度。
|
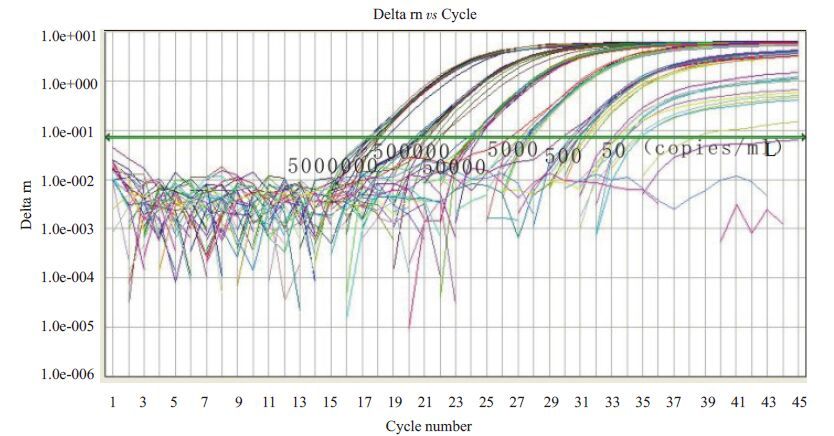
图 1 TaqMan探针法检测SIV标准品cDNA扩增曲线图 Figure 1 Amplification plot of reference SIV cDNA by QPCR using TaqMan probe. |
|
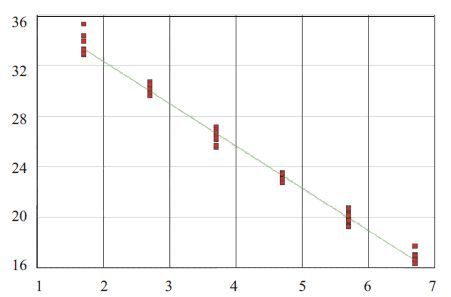
图 2 与图 1应对的标准曲线(去除了50 copies/mL浓度中的2个偏离过多的标本曲线) Figure 2 Standard curve of SIV detection corresponding to Fig. 1 (the two wells with obvious deviation from the concentration of 50 copies/ml were removed). |
|
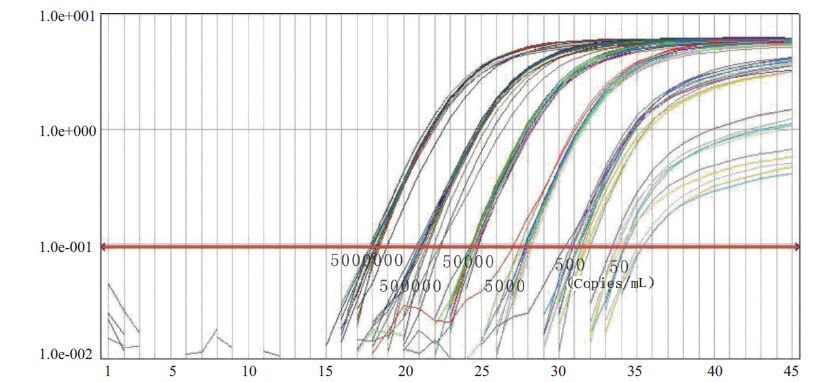
图 3 Allglo探针法检测SIV标准品cDNA扩增曲线图 Figure 3 Amplification plot of reference SIV cDNA by QPCR using Allglo probe. |
将定量PCR运行后的文件用ABI7300定量PCR仪所携带的软件进行分析,用Excel 建立数据库,求取数据的Mean CT值、标准差SD和变异系数CV%。
2 结果 2.1 灵敏度实验结果分析TaqMan探针和Allglo探针在检测SIV标准品的最低检测浓度均为50 copies/mL。但TaqMan探针的扩增曲线显示,在50 copies/mL浓度下12个复孔中有2个偏离较大,如果包括这2个偏离较大的实时扩增曲线则R2会在0.99以下,所以去掉这2个复孔的扩增曲线进行分析,结果R2为0.993,说明标准曲线中CT值与荧光累积值相关性良好(图 1,2)。Allglo探针扩增的SIV标准品cDNA 的扩增曲线和标准曲线显示,每个浓度均为12孔,没有偏离过大的标本孔,所得标准曲线的R2值为0.993,说明标准曲线中CT值与荧光累积值相关性良好(图 3,4)。
2.2 重复性实验结果分析 2.2.1 SIVcDNA用TaqMan探针进行定量PCR批内差异分析Taqman探针法显示去除了50 copies/mL的12 个孔中2个偏离过大的标本显示的实时扩增曲线,变异系数最大的是50 copies/mL浓度的10个复孔,其变异系数为1.33%,最小者为5×104 copies/mL,其变异系数为0.2%,说明变异较小,重复性良好(表 1,图 1,2)。
| 表 1 TaqMan探针法检测SIV标准品cDNA批内差异分析 Table 1 Analysis of variation within batches for detection of SIV cDNA using TaqMan probe |
Allglo探针法显示,变异系数最大的是50 copies/mL 浓度的12个复孔,其变异系数为0.63%,最小者为500 copies/mL,其变异系数为0.33%,说明变异较小,重复性良好(表 2,图 3,4)。
| 表 2 Allglo探针法检测SIV标准品cDNA批内差异分析 Table 2 Analysis of variation within batches for detection of SIV cDNA using Allglo probe |
Taqman 探针法变异系数最大的是5×106 copies/ml浓度的12个复孔,其变异系数为1.86%,最小者为500 copies/mL,其变异系数为1.03%,说明变异较小,重复性良好(表 3)。
| 表 3 TaqMan探针法检测SIV标准品cDNA批间差异分析 Table 3 Analysis of variation between batches for detection of SIV cDNA using TaqMan probe |
Allglo探针法检测SIV标准品cDNA批间差4显示,变异系数最大的是5×106 copies/mK浓度的12个复孔,其变异系数为1.77%,最小者为5×103 copies/mL,其变异系数为0.95%,说明变异较小,重复性良好(表 4)。
| 表 4 Allglo探针法检测SIV标准品cDNA批间差异分析 Table 4 Analysis of variation between batches for detection of SIV cDNA using Allglo probe |
猴免疫缺陷病毒是一种逆转录病毒[15],SIV感染宿主后,能够产生逆转录酶,逆转录酶能够将RNA转录成DNA,再整合到宿主的DNA中,在细胞内包装出成熟病毒并释放到宿主的血液或组织液中[16],在SAIDS模型猴感染的不同阶段,血浆中游离病毒量会有相应的变化[17],因此血浆中游离病毒量是研究病程进展、监测抗病毒治疗效果及预测疾病的预后最主要的指标之一[18-19]。然而有研究表明猴血浆SIV病毒载量在平台期一般低至1×103~1×104 copies/mL[20],如果采用高效联合抗逆转录病毒疗法(Highly active antiretrovival therapy,HAART)等有效方法治疗,还可能低至0.5×102 copies/mL以下,甚至检测不到[21]。目前检验猴血浆病毒载量主要的检测方法有分枝DNA技术、核酸序列依赖性扩增技术和荧光定量PCR[22],且荧光定量PCR相对于另两种方法具有特异性强、敏感度高等特点,已被广泛使用[23]。
实时荧光定量PCR检测SIV病毒载量需选择最优的探针,目前,主要的探针有TaqMan探针,在此探针基础上改进的TaqManMGB探针、双杂交探针、分子信标技术探针、simple 探针、Allglo探针和双标探针。而其中TaqMan探针法是实时定量PCR最经典、至今实验室应用最广的一种实时定量PCR 技术[11, 24],新一代的Allglo 探针具有普通TaqMan探针、TaqManMGB探针及分子信标技术探针的全部优点[25],因此我们选择比较TaqMan探针和Allglo探针荧光定量PCR法检测SIV的病毒载量。TaqMan探针在其5'末端标记一个荧光报告基团,3'末端标记一个荧光淬灭基团,其序列与两引物包含序列内的一段DNA模板完全互补,荧光信号的强度与PCR反应产物的量成正相关,在PCR反应中设立标准品模板系列和阴性对照,利用标准品模板系列绘制出标准曲线,然后结合各样品的Ct值,便可以得知样品的起初模板量。但是Taqman相对于Allglo探针具有背景高、设计较困难等方面的不足[26]。Allglo探针是用几种特殊的染料标记在核苷酸上互为报告基团和粹灭集团,而且结构中含有可显著提高Tm值的化学基团,这种探针的特点是只标记1种染料,无背景荧光,通过结构改变实现荧光粹灭,探针水解完毕后两端的荧光基团又变回为报告基团,因此荧光累积值也较高。
本实验应用荧光定量RT-PCR法对SIV的病毒载量进行检测,将两种探针的灵敏度及重复性进行了比较。从灵敏度的结果分析,TaqMan探针和Allglo探针在检测SIV标准品的最低检测浓度均为50 copies/mL。但TaqMan探针的扩增曲线显示,在50 copies/mL浓度下12个复孔中有2个偏离较大,说明在50 copies/mL浓度下Allglo探针比Taqman探针更稳定。从重复性结果分析,虽然TaqMan探针法去除了50 copies/mL的12个孔中2个偏离过大的标本显示的实时扩增曲线时批内差异结果显示最小变异系数小于Allglo 探针法,但Allglo探针法的批间最大变异系数、最小变异系数与批内最大变异系数皆小于Taqman探针法,说明Allglo探针法荧光定量RT-PCR法检测猴免疫缺陷病毒的重复性优于Taqman探针法。因此,本研究结果表明在荧光定量RT-PCR法检测猴免疫缺陷病毒中,Allglo探针法可能优于TaqMan探针法。
虽然,Taqman探针被广泛用于真菌、细菌、病毒等各种病原的检测及定量[27-32]。但有研究将Allglo探针和TaqMan探针应用于按蚊击倒性抗性基因突变、H7N9 流感病毒、GI型和GII型诺如病毒等相关病原体方面的检测进行比较,结果表明Allglo探针在特异性、敏感度、 重复性以及成本效益方面皆优于TaqMan探针,与本实验的研究结果相一致[11-12, 33]。说明Allglo探针法有望应用于多种病原体的快速筛查,为临床诊断疾病以及其它领域的相关研究提供更加有效的检测方法。
| [1] | 何小周, 陈丹瑛, 王琬玓, 等. 表达SIV Gag/Env基因的DNA疫苗,重组腺病毒和重组痘苗病毒三载体疫苗联合免疫小鼠的细胞免疫研究[J]. 病毒学报,2016 (2) : 170-9. |
| [2] | Rainho JN, Martins MA, Cunyat FA, et al. Nef is dispensable for resistance of simian immunodeficiency Virus-Infected macrophages to CD8(+) T cell killing[J]. J Virol,2015, 89 (20) : 10625-36. DOI: 10.1128/JVI.01699-15. |
| [3] | 何金洋, 符林春, 陈媛, 等. 猴免疫缺陷病毒荧光定量聚合酶链反应检测标准品的体外合成[J]. 广州中医药大学学报,2007, 24 (4) : 351-4. |
| [4] | Gerngross L, Lehmicke G, Belkadi AA. Role for cFMS in maintaining alternative macrophage polarization in SIV infection: implications for HIV neuropathogenesis[J]. J Neuroinflammation,2015, 12 (1) : 1-15. |
| [5] | Bailey AL, Lauck M, Ghai RR, et al. Arteriviruses, pegiviruses, and lentiviruses are common among wild African monkeys[J]. J Virol,2016, 90 (15) : 6724-37. DOI: 10.1128/JVI.00573-16. |
| [6] | 王静, 张鈺, 闵凡贵, 等. 猴免疫缺陷病毒(SIV)实时荧光定量PCR检测方法的建立[J]. 中国比较医学杂志,2013, 23 (9) : 68-72. |
| [7] | Yoshida T, Koyanagi Y, Strebel K. Functional antagonism of rhesus macaque and chimpanzee BST-2 by HIV-1 Vpu is mediated by cytoplasmic domain interactions[J]. J Virol,2013, 87 (24) : 13825-36. DOI: 10.1128/JVI.02567-13. |
| [8] | Deere JD, Chang W, Castillo LD, et al. Utilizing a TLR5- Adjuvanted cytomegalovirus as a lentiviral vaccine in the nonhuman Primate model for AIDS[J]. PLoS One,2016, 11 (5) : e0155629. DOI: 10.1371/journal.pone.0155629. |
| [9] | 梁成钦, 周先丽, 段小群, 等. 鹊肾树体外抗猴免疫缺陷病毒活性部位筛选[J]. 中国实验方剂学杂志,2011, 17 (1) : 120-2. |
| [10] | Stulberg MJ, Huang Q. A TaqMan-Based multiplex qPCR assay and DNA extraction method for phylotype IIB sequevars 1&2(select agent)strains of ralstoniasolanacearum[J]. PLoS One,2015, 10 (10) . |
| [11] | Zhang Y, Mao H, Yan J, et al. Development of novel AllGlo-probebased one-step multiplex qRT-PCR assay for rapid identification of avian influenza virus H7N9[J]. Arch Virol,2014, 159 (7) : 1707-13. DOI: 10.1007/s00705-014-1979-5. |
| [12] | Bai L, Zhu GD, Zhou HY, et al. Development and application of an AllGlo probe-based qPCR assay for detecting knockdown resistance (kdr) mutations in Anopheles sinensis[J]. Malar J,2014, 13 (1) : 1-10. DOI: 10.1186/1475-2875-13-1. |
| [13] | Yu D, Chen Y, Wu S, et al. Simultaneous detection and differentiation of human papillomavirus genotypes 6, 11, 16 and 18 by AllGloquadruplex quantitative PCR[J]. PLoS One,2012, 7 (11) : e48972. DOI: 10.1371/journal.pone.0048972. |
| [14] | 欧阳松应, 杨冬, 欧阳红生, 等. 实时荧光定量PCR技术及其应用[J]. 生命的化学,2004, 24 (1) : 74-6. |
| [15] | González JA. Understanding the process of envelope glycoprotein incorporation into virions in simian and feline immunodeficiency viruses[J]. Viruses,2014, 6 (1) : 264-83. DOI: 10.3390/v6010264. |
| [16] | Marno KM, Ogunkolade BW, Pade CA, et al. Novel restriction factor RNA-associated early-stage anti-viral factor (REAF) inhibits human and simian immunodeficiency viruses[J]. Retrovirology,2014, 11 (1) : 1-9. DOI: 10.1186/1742-4690-11-1. |
| [17] | 丛喆, 涂新明, 李兆忠, 等. SYBR GreenⅠ实时荧光定量PCR法测定猴免疫缺陷病毒(SIV)前病毒DNA拷贝数方法的建立[J]. 中国比较医学杂志,2006, 16 (11) : 680-3. |
| [18] | 刘强, 李菊, 杨贵波, 等. 实时荧光定量RT-PCR监测恒河猴体内人/ 猴免疫缺陷病毒载量在传代过程中的变化[J]. 中华实验和临床病毒学杂志,2007, 21 (2) : 174-6. |
| [19] | Klein D, Leutenegger CM, Bahula C, et al. Influence of preassay and sequence variations on viral load determination by a multiplex real-time reverse transcriptase-polymerase chain reaction for feline immunodeficiency virus[J]. J Acquir Immune Defic Syndr,2001, 26 (1) : 8-20. DOI: 10.1097/00126334-200101010-00002. |
| [20] | Wei L, Wu X, Lu YZ, et al. Andrieu.therapeutic dendritic-cell vaccine for simian AIDS[J]. Nat Med,2003, 9 (1) : 27-32. |
| [21] | Kauffman RC, Villalobos A, Bowen JH, et al. Residual viremia in an RT-SHIV rhesus macaque HAART model marked by the presence of a predominant plasma clone and a lack of viral evolution[J]. PLoS One,2014, 9 (2) : e88258. DOI: 10.1371/journal.pone.0088258. |
| [22] | 李梅. HIV实验室检测及其研究进展[J]. 中国医药导刊,2012, 14 (8) : 1410-1. |
| [23] | De Waal T, Liebenberg D, Venter GJ, et al. Detection of African horse sickness virus in Culicoidesimicola pools using RT-qP[J]. J Vector Ecol,2016, 41 (1) : 179-85. DOI: 10.1111/jvec.2016.41.issue-1. |
| [24] | Nagy A, Cernikova L, Vitaskova E, et al. MeltMan: optimization, evaluation, and Universal application of a qPCR system integrating the TaqMan qPCR and melting analysis into a single assay[J]. PLoS One,2016, 11 (3) : e0151204. DOI: 10.1371/journal.pone.0151204. |
| [25] | 余道军, 吴盛海, 王贤军, 等. AllGlo探针4重荧光定量PCR技术同时检测4 种疱疹病毒[J]. 中华微生物学和免疫学杂志,2012, 32 (1) : 78-83. |
| [26] | 伊鋆, 蔡雪凤. Taqman荧光探针技术在食源性致病菌检测中的应用[J]. 食品工业科技,2013, 34 (7) : 374-7. |
| [27] | WangLP, LeiK. Rapid identification and quantification of aureococcusanophagefferens, by qPCR method(taqman)in the qinhuangdao coastal area: a region for recurrent brown tide breakout in China[J]. Indian J Microbiol,2016, 56 (4) : 1-7. |
| [28] | Pooljun C, Direkbusarakom S, Chotipuntu P, et al. Development of a TaqMan real-time RT-PCR assay for detection of covert mortality nodavirus (CMNV) in penaeid shrimp[J]. Aquaculture,2016, 464 : 445-50. DOI: 10.1016/j.aquaculture.2016.06.044. |
| [29] | Babu B, Jeyaprakash A, Jones D, et al. Development of a rapid, sensitive TaqMan real-time RT-PCR assay for the detection of Rose rosette virus using multiple gene targets[J]. J Virol Methods,2016, 235 : 41-50. DOI: 10.1016/j.jviromet.2016.05.010. |
| [30] | Luan HB, Wang YX, Li Y, et al. Development of a real-time quantitative RT-PCR to detect Rev contamination in live vaccine[J]. Poult Sci,2016, 95 (9) : 2023-9. DOI: 10.3382/ps/pew147. |
| [31] | Huang CH, Tsai RT, Vallad GE. Development of a TaqMan Real- Time polymerase chain reaction assay for detection and quantification of fusarium oxysporum f. sp lycopersici in Soil[J]. J Phytopathol,2016, 164 (7/8) : 455-63. |
| [32] | Kontz B, Adhikari S, Subramanian S, et al. Optimization and application of a quantitative polymerase chain reaction assay to detect diaporthe species in soybean plant tissue[J]. Plant disease,2016, 100 (8) : 1669-76. DOI: 10.1094/PDIS-10-15-1204-RE. |
| [33] | 王毅谦, 郭旸, 吴福平, 等. Allglo 探针与Taqman 探针双重荧光RT-PCR法检测GI型和GII型诺如病毒的比较和应用[J]. 中国卫生检验杂志,2013 (14) : 2924-6. |
 2016, Vol. 36
2016, Vol. 36