2. 西安交通大学医学院第一附属医院肝胆外科,陕西 西安 710000 ;
3. 锦州医科大学武警后勤学院附属医院培养基地,天津 300162 ;
4. 武警后勤学院附属医院救援研究所,天津 300162
2. Department of Hepatobiliary Surgery, First Affiliated Hospital, Xi'an Jiaotong University College of Medicine, Xi'an 710061, China ;
3. Postgradute Training Basement of Jinzhou Medical University, Affiliated Hospital of Logistics University of Chinese People's Armed Police Forces, Tianjin 300162 ;
4. Institute of Disaster Medicine and Public Health, Affiliated Hospital of Logistics University of Chinese People's Armed Police Forces, Tianjin 300162, China
肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌(primary liver cancer,PLC)的91.5%,预后较差,总的5年生存率不足5%[1-2],主要原因是其高转移率及术后的高复发率[3-4]。因此,肝癌的抗侵袭转移成为改善预后的重要治疗策略。血管生成拟态(vasculogenic mimicry,VM)是一种区别于经典的肿瘤血管生成途径、不依赖血管内皮细胞的肿瘤微循环模式,其在肿瘤生长、转移过程中产生重要作用[5-6]。然而,常规的针对血管内皮细胞(VEC)的抗血管治疗方案对VM无效[7],并且治疗过程中造成的肿瘤局部缺血缺氧反而促进了VM的形成[8],增加了肿瘤通过VM侵袭转移的机会。因此,在抗肿瘤血管生成治疗中必须联合抗VM的方案。故寻找针对VM的治疗靶点对于HCC的治疗具有十分重要的意义。
迁移诱导基因7(migration-inducing gene7,Mig-7)表达一种在多种肿瘤细胞膜定位的富含半胱氨酸的蛋白质,在肿瘤的可塑性和VM形成中具有重要作用[9-10]。Mig-7在正常组织和无VM形成的低侵袭性肿瘤细胞中均不表达,只在能形成VM的高侵袭性肿瘤细胞中表达[11-12]。目前有研究表明Mig-7 基因与胃癌中VM的形成有关[13],然而,国内外对于Mig-7 基因对HCC中VM形成及侵袭转移能力影响的报道较少见。在前期实验基础上,我们推测Mig-7对HCC的VM形成和侵袭转移有重要的调控作用,可能是恶性肿瘤靶向治疗的一个理想靶点。
本研究将通过构建特异性Mig-7shRNA逆转录病毒表达载体质粒,转染Mig-7 高表达人HCC 细胞MHCC-97H,观察其对MHCC-97H细胞Mig-7 表达、 VM形成能力及细胞间粘附、侵袭及转移能力的影响。
1 材料和方法 1.1 实验材料人HCC细胞株MHCC-97H购自复旦大学中山医院肝癌研究所。兔抗人Mig-7抗体购自美国Abcam公司;引物由宝生物公司设计和合成;LipofectamineTM 2000 Reagent 购自美国Invitrogen 公司;Matrigel 购自美国BD公司;Transwell小室购自美国Corning公司;重组人血管内皮抑素(ES,商品名:恩度)购自先声麦得津生物公司。
1.2 shRNA的设计合成从Genbank 获得人Mig-7 mRNA 的基因序列(GenBank:DQ080207.2)。依据shRNA的设计原则[14],设计针对Mig-7mRNA基因CDS区的shRNA序列,利用BLAST比较设计的序列和人类基因组数据库,排除和其他基因明显同源的靶序列,设计3条序列,包括2条Mig-7 mRNA的寡核苷酸序列(Mig-7 shRNA-1,Mig-7 shRNA-2)和1 条作为负对照的无关序列(Mig-7 shRNA-N)。Mig-7 shRNAs由宝生物公司设计合成并进行荧光标记,具体如下:Mig-7 shRNA-1 正义链: 5'-GATCCAAAGTTTCATTCTTCGACTTCAAGAGA GTCGAAGAAATGAAACTTTTTTTTTG-3',反义链3'-GTTTCAAAGTAAGAAGCTGAAGTTCTCTCAG CTTCTTTACTTTGAAAAAAAAACTTAA-5';Mig-7 shRNA-2 正义链:5'-GGATCCCACAGCTTGAGTG GAATACTTCAAGAGAGTATTCCACTCAAGCTGTGTTTTTTG- 3',反义链3'-GGTGTCGAACTCACCT TATGAAGTTCTCTCATAAGGTGAGTTCGACACA AAAAACTTAAG-5';Mig-7 shRNA-N 正义链:5'-G GATCCTGATAAACGAACTGCGCGTTTCAAGAG AACGCGCAGTTCGTTTATCATTTT TTG-3',反义链3'-GACTATTTGCTTGACGCGCAAAGTTCTCTTGC GCGTCAAGCAAATAGTAAAAAACTTAAG-5'。
1.3 Mig-7 shRNA转染MHCC-97H细胞MHCC-97H细胞常规培养于37 ℃、5% CO2培养箱中,培养液为含10% FBS的DMEM高糖培养液。转染前24 h,调整细胞浓度为4×105/mL,以0.5 mL/孔于24 孔培养板培养过夜,MHCC-97H细胞培养达到80%~ 90%融合后进行转染,参照LipofectamineTM 2000 Transfection Reagent说明书(Invitrogen)进行转染。将要接受转染的MHCC-97H 细胞分为4 组:(1)转染Mig-7 shRNA-1 组;(2)转染Mig-7 shRNA-2 组;(3)转染Mig-7 shRNA-N组;(4)转染空载体质粒组(Vector)。各组分别在转染24 h后于荧光显微镜下观察细胞内绿色荧光蛋白标记,各组随机选择10个视野,计数绿色荧光蛋白标记阳性细胞数、细胞总数,转染效率为绿色荧光蛋白标记阳性细胞数占细胞总数的百分比。
1.4 半定量PCR检测Mig-7 mRNA表达将培养的MHCC-97H 细胞分为6 组:(1)转染Mig-7 shRNA-1 组;(2)转染Mig-7 shRNA-2 组;(3)转染Mig-7 shRNA-N组;(4)转染空载体质粒组(Vector); (5)ES组:给予ES125 μg/mL[15];(6)MHCC-97H细胞对照组(Control)。提取总RNA,反转录成cDNA,扩增目的基因。反应条件为:94 ℃预变性2 min,94 ℃变性10 s,60 ℃退火、延伸30 s,反应40个循环。扩增基因的特异性引物序列为:β-actin:正义引物:5'-ATCGTGCGT GACATTAAGGAGAAG-3',反义引物:5'-AGGAAG GAAGGCTGGAAGAGTG-3';Mig-7:正义引物:5'-TC TCAGGCAGTCAGTGGG-3',反义引物:5'-GTTGGA TGG GATGTCTCG-3'。
1.5 Western blotting检测实验分组同1.4。转染后提取蛋白,采用0.1% SDS-10%PAGE 电泳后转至硝酸纤维素膜(NC 膜),以含5%脱脂奶粉的TBST封闭2 h。加入一抗(Mig-7,1:200;β-actin,1:500),4 ℃过夜;TBST洗膜。再加入以牛奶封闭的HRP标记二抗(抗兔,1:1000;抗鼠,1: 1000),室温下孵育2 h,TBST洗膜。化学发光(ECL)试剂盒显影。
1.6 三维细胞培养实验分组同1.4。在6孔板中加入50 μL Matrigel,室温下静置20 min,37 ℃静置30 min,待Matrigel凝固后,分别加入100 μL以上6组细胞完全培养液,细胞浓度为1×106/mL。再加入完全培养液2 mL,37 ℃、5% CO2培养箱中培养。
1.7 转染后对MHCC-97H细胞间粘附、侵袭、迁移能力的影响 1.7.1 细胞间粘附能力检测实验分组同1.4。制备单细胞悬液,调整浓度为1×106/mL。将1 mL细胞悬液放入1.5 mL的EP管中,每组细胞各5管。37 ℃培养箱中孵育12 h,分别于2、6、12 h进行细胞计数1次。以剩余单个细胞占总细胞数的百分比作为细胞粘附能力评价指标,比例越低,粘附的细胞越多,其细胞-细胞间粘附能力就越强。
1.7.2 Transwell 侵袭实验检测实验分组同1.4。将Transwell置于24孔培养板中,Matrigel 10 μg/孔,37 ℃静置4 h,待胶凝固。细胞消化,调整细胞浓度至1×105/mL。吸取400 μL细胞悬液加入到Transwell的上室,Transwell 的下室加入10%FBS的DMEM培养基。37 ℃,5% CO2 孵箱培养20 h。甲醇固定,结晶紫染色。普通光学显微镜下观察处于微孔滤膜外侧面上的细胞,镜下计数迁移到滤膜下表面的细胞数,随机计数5个视野的细胞数目。
1.7.3 迁移实验检测实验分组同1.4。转染后消化细胞,每孔加入100 μL细胞悬液,使每孔内细胞数约为1.0×105,下腔室中加入含有20%FBS 的完全培养基。37 ℃培养箱中孵育24 h。取出小室,以棉签小心擦除滤膜上室面的细胞,以甲醇固定黏附在下室面的细胞,结晶紫染色。观察计数方法同1.7.2。
1.8 统计方法全部数据经SPSS20.0统计软件进行统计分析,计量资料以均数±标准差表示,多组间比较采用方差分析并行两两比较,以P<0.05认为差异有统计学意义。
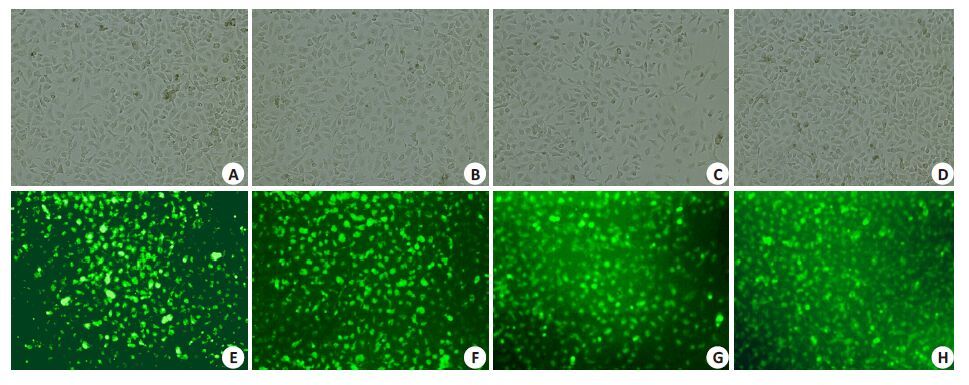
2 结果 2.1 逆转录病毒高效转染MHCC-97H细胞本研究采用的逆转录病毒载体系统携带绿色荧光蛋白,因此可以在荧光倒置显微镜下观察绿色荧光蛋白的表达(图 1)。Mig-7 shRNA-1组、Mig-7 shRNA-2组、 Mig-7 shRNA-N组及空载体质粒组(Vector)镜下均可见稳定转染的绿色荧光蛋白标记阳性的细胞90%以上,这表明本实验所采用的逆转录病毒载体系统可高效、稳定地感染MHCC-97H细胞。
|
图 1 逆转录病毒稳定高效地感染MHCC-97H细胞 Figure 1 Effective and stable retrovirus infection of MHCC-97H cells (Original magnification: × 400). A: Mig-7 shRNA-1 group (light microscope); B: Mig-7 shRNA-2 group (light microscope); C: Mig-7 shRNA-N group (light microscope); D: Vector group (light microscope); E: Mig-7 shRNA-1 group (fluorescence microscope); F: Mig-7 shRNA-2 group (fluorescence microscope); G: Mig-7 shRNA-N group (fluorescence microscope); H: Vector group (fluorescence microscope). |
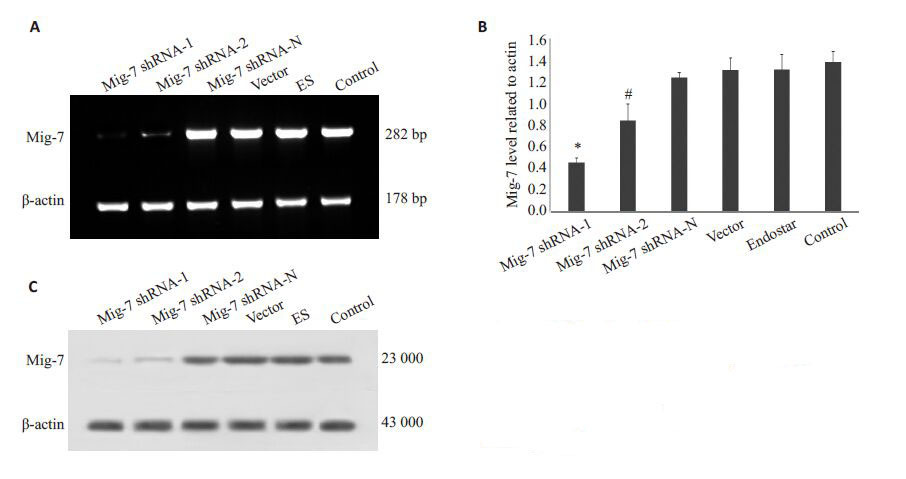
半定量PCR(图 2A,B)显示:Mig-7 shRNA-1组与Mig-7 shRNA-2 组的Mig-7mRNA水平都明显下降,Mig-7 shRNA-1组最为明显。Western blotting结果(图 2C)表明:Mig-7 shRNA-1 组与Mig-7 shRNA-2 组的Mig-7蛋白水平均明显下降,Mig-7 shRNA-1组最为明显。结果说明构建的Mig-7shRNA 能够有效地抑制Mig-7 mRNA及Mig-7蛋白的表达。
|
图 2 转染后各组MHCC-97H细胞Mig-7 mRNA的表达 Figure 2 Expression of Mig-7 mRNA (A,B) and protein (C) in MHCC-97H cells after transfection. *P<0.05 vs Mig-7 shRNA-2,Mig-7 shRNA-N,vector,ES and control groups; #P<0.05 vs Mig-7 shRNA-N,vector,ES and control groups. |
三维细胞培养(图 3)显示:Mig-7 shRNA-1 组与Mig-7 shRNA-2组细胞粘附成团,不能形成VM;Mig-7 shRNA-N组VM形成与转染空载体质粒组(Vector)、ES 处理组、MHCC-97H细胞对照组无明显差别。结果说明:Mig-7干扰后MHCC-97H细胞形成VM的能力受到明显抑制。

|
图 3 各组转染后对MHCC-97H细胞形成VM能力的影响 Figure 3 VM formation in MHCC-97H cells after transfection. A: Mig-7 shRNA-1; B: Mig-7 shRNA-2; C: Mig-7 shRNA-N; D: Vector,E: ES,F: Control. |
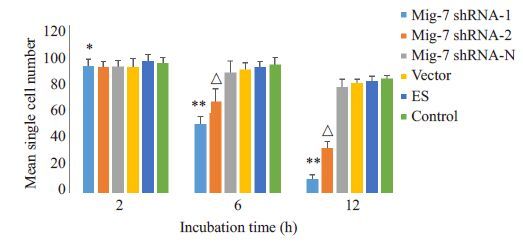
结果(图 4)显示:Mig-7 shRNA-1 组与Mig-7 shRNA-2组MHCC-97H细胞粘附能力明显强于其余各组MHCC-97H 细胞(P<0.05);Mig-7 shRNA-1 组较Mig-7 shRNA-2组细胞粘附能力强(P<0.05);其余4组间相比MHCC-97H细胞粘附能力无差异(P>0.05)。这表明下调Mig-7表达可增加MHCC-97H细胞粘附能力。
|
图 4 转染后对各组MHCC-97H细胞间粘附能力的影响 Figure 4 Changes in intercellular adhesion of MHCC-97H cells after transfection. *P>0.05 vs Mig-7 shRNA-2,Mig-7 shRNA-N,vector,ES and control groups. **P< 0.05 vs Mig-7 shRNA-2,Mig-7 shRNA-N,vector,ES and control groups. △ P<0.05 vs Mig-7 shRNA-N,vector,ES and control groups. |
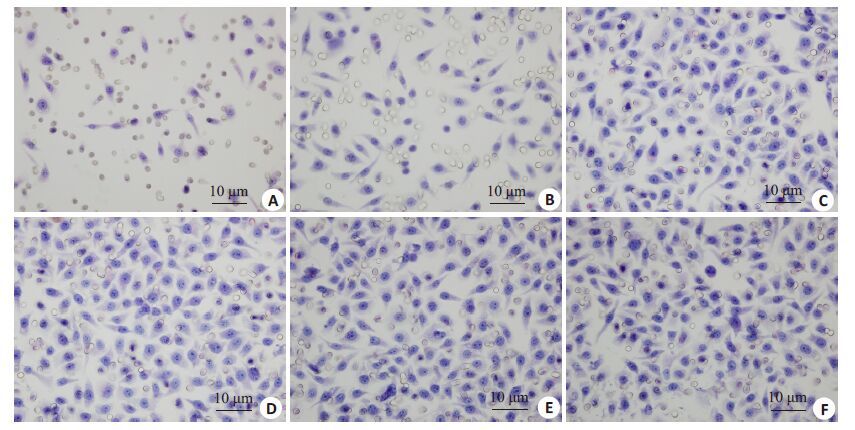
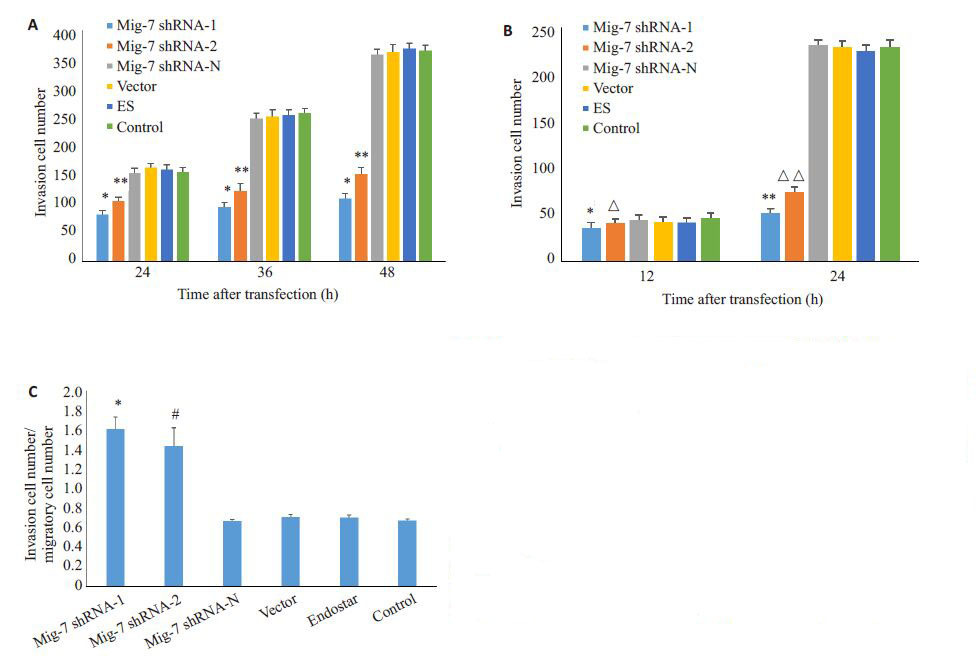
Transwell 侵袭实验结果(图 5,图 6A)显示:Mig-7 shRNA-1组与Mig-7 shRNA-2组穿透的细胞数较其余各组显著减少(P<0.05);而Mig-7 shRNA-N组、转染空载体质粒组(vector)、ES组、MHCC-97H细胞对照组间没有显著差异(P>0.05)。结果说明下调Mig-7表达后MHCC-97H细胞侵袭能力显著降低。
|
图 5 转染后对各组MHCC-97H细胞侵袭力的影响 Figure 5 Changes in invasive ability of MHCC-97H cells after transfection. A: Mig-7 shRNA-1; B: Mig-7 shRNA-2; C: Mig-7 shRNA-N; D: Vector; E: ES; F: Control. |
|
图 6 转染后对各组MHCC-97H细胞侵袭力及迁移能力的影响 Figure 6 Changes in cell invasion and migration of MHCC-97H cells after transfection. A: Transwell invasion assay showed that Mig-7 shRNA inhibited cell invasiveness. *P<0.05 vs Mig-7 shRNA-2,Mig-7 shRNA-N,vector,ES and control groups. **P<0.05 vs Mig-7 shRNA-N,vector,ES and control groups; B: Transwell migration assay showed that the cell migration ability was suppressed by Mig-7shRNA. *P>0.05 vs Mig-7 shRNA-2,Mig-7 shRNA-N,vector,ES and control groups. **P<0.05 vs Mig-7 shRNA-N,vector,ES and control groups. △P>0.05 vs Mig-7 shRNAN,vector,ES and control groups.△ △P<0.05 vs Mig-7 shRNA-N,vector,ES and control groups. C: Ratios of invasive to migratory cell numbers at 24 h. *P<0.05 vs Mig-7 shRNA-2,Mig-7 shRNA-N,vector,ES and control groups. #P<0.05 vs Mig-7 shRNA-N,vector,ES and control groups. |
细胞迁移检测结果(图 6B)显示:在12 h时,各组细胞间没有显著差异(P>0.05);在24 h时,Mig-7 shRNA-1 组与Mig-7 shRNA-2组MHCC-97H细胞迁移能力明显弱于其余各组(P<0.05),Mig-7 shRNA-1组细胞迁移能力明显弱于Mig-7 shRNA-2 组(P<0.05),而Mig-7 shRNA-N组、转染空载体质粒组(Vector)、 ES 组、MHCC-97H细胞对照组之间MHCC-97H 细胞迁移能力无显著性差异(P>0.05)。这说明Mig-7shRNA能够降低MHCC-97H细胞的迁移能力。与此同时,24 h时侵袭细胞数与迁移细胞数之比(图 6C)也表明了Mig-7 shRNA可使MHCC- 97H细胞侵袭转移能力明显下降。
3 讨论肿瘤血管在肿瘤生长、侵袭及转移过程中扮演重要角色,然而,VM的发现使肿瘤的抗血管治疗更加复杂。作为肿瘤微循环的重要补充,VM为肿瘤提供了额外的营养及侵袭转移通道。研究表明,VM与多种恶性肿瘤的侵袭和转移有关,且有VM形成的肿瘤往往预后不良[9, 12]。因此,研究VM形成相关机制及探索VM特异性靶点具有较重要的临床意义。
目前关于VM形成机制研究较多的作用因子主要包括血管内皮细胞钙黏蛋白(VE-cadherin)[16-17]、上皮细胞激酶(EphA2)[18]、磷脂酰肌醇-3-激酶(PI3K)[19-20]、基质金属蛋自酶(MMPs)[9, 12]、层黏连蛋白5γ2链[19]、缺氧诱导因子1α[22]及黏着斑激酶[23]等,然而,明确的VM形成机制仍有待进一步研究。
随着以DNA测序和基因组技术为驱动的“精准医学计划”的开启,人类生命科学的基因应用时代真正来临。寻找靶向VM的特异性基因,抑制VM形成及肿瘤细胞侵袭转移,是目前HCC的研究焦点。
Mig-7 是近年发现的一种新的人类基因,位于1p22.1,cDNA全长1617 bp,编码产物为富含半胱氨酸的蛋白[11]。研究显示,增加Mig-7的表达,能增强结肠癌、子宫内膜癌、肺癌、胃癌、上皮性卵巢癌等的侵袭性,而抑制其表达能有效降低肿瘤的侵袭转移能力[12, 24-25]。然而,目前Mig-7具体作用机制仍不明确,有研究表明Mig-7 主要由生长因子和环氧合酶-2/前列腺素E2 (COX-2/PGE2)途径诱导并通过ZEB-1以及Twist调节EMT并影响肿瘤的侵袭转移[12];也有文献表明Mig-7能够参与活化MT1-MMP,活化的MT1-MMP能够激活MMP-2(MMPs超家族重要成员)并与之共同降解Ln 5γ2链为γ2'和γ2×两个片段,进而增加VM的形成及肿瘤侵袭转移能力[25]。此外,Mig-7只在能形成VM的高侵袭性肿瘤细胞中表达,而在正常组织中不表达[11-12],因此,Mig-7的发现为精准的靶向VM的基因治疗提供了一个潜在的安全、有效的途径。我们设想[26],可以通过RNAi技术抑制HCC中Mig-7的表达,进而抑制VM形成以降低肿瘤细胞侵袭和转移扩散能力,这种靶向HCC细胞Mig-7 的治疗方法具有很大的临床应用潜力。同时,通过设计靶向Mig-7表达进而抑制肿瘤VM 形成的治疗联合目前的多种治疗方法将大大提高常规抗肿瘤药物的疗效,尤其是与传统的靶向内皮的血管生成抑制剂(如:ES等)的联合治疗策略,可能比目前任何单独应用的抗肿瘤血管生成治疗更为有效。
RNAi(RNA interference)即RNA干扰技术,与传统的基因敲除、转基因等方法技术的要求苛刻、过程繁琐、周期过长等缺点相比,RNAi因其快速、可靠、经济的特点吸引了越来越多的生物学家的重视,为探索高效特异的肿瘤基因治疗提供了新方法。本研究利用shRNA 转染MHCC-97H细胞,结果表明,Mig-7 shRNA均表现出显著的抑制能力,以Mig-7 shRNA-1 组质粒最为突出,与负对照组和MHCC-97H细胞组Mig-7的表达具有明显的差异性;负对照组较MHCC-97H细胞组相比Mig-7 mRNA水平略有下降,考虑由于作为外源性基因的质粒导入所引起的非特异性效应。构建的特异性Mig-7 shRNA重组逆转录病毒表达载体质粒能够有效地抑制Mig-7的表达,并显著降低了VM的形成及肿瘤的侵袭、转移能力。表明Mig-7在HCC的VM形成及与VM相关的肿瘤侵袭迁移中起着重要作用。
本研究结果显示:Mig-7shRNA能够在基因和蛋白水平特异、高效地下调MHCC-97H细胞Mig-7的表达; 并可以显著降低MHCC-97H细胞侵袭及形成VM的能力,增加了细胞间粘附作用,在一定程度上逆转了肿瘤细胞的恶性表型。与此同时,ES在本实验中对VM形成无影响,也进一步证明了传统针对VEC的抗血管治疗药物对于VM生成无直接抑制作用。
在将Mig-7基因加入到抗肝癌阵营的同时,我们仍然需要发现更多的相关基因以完善“精准医疗”背景下的多靶点的抗肿瘤治疗方案。最近的一项关于肝癌基因型的研究[4]显示,肝癌患者肝内多发病灶的基因型存在明显的异质性。该研究在对10例肝癌病人的43个肿瘤病灶的基因组变异检测中,发现同一病人的不同病灶共享8%到97%的基因突变,体现了病人不同程度的肿瘤异质性。由此表明,对病人单个病灶的基因测序或许不能完全反映病人肿瘤的确切基因组特性,这对肝癌病人的精准治疗提出了很大挑战。下一步我们仍需要寻找更多的特异性靶点以及它们之间联系的关键基因。
综上所述,利用RNAi方法可以特异、高效的下调Mig-7表达,进而抑制HCC细胞VM形成及侵袭转移能力。这为Mig-7作为HCC基因治疗的特异性靶点提供了依据。同时也发现,ES对HCC细胞的Mig-7 表达、 VM形成及侵袭转移无影响。本研究结果及我们的设想,即靶向VM联合重组人血管内皮抑素抑制肝癌细胞侵袭转移的治疗策略,需要进一步的体内实验验证。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin,2015, 65 (2) : 87-108. DOI: 10.3322/caac.21262. |
| [2] | Kobeisy MA, Morsy KH, Galal M, et al. Clinical significance of elevated alpha-foetoprotein(AFP) in patients with chronic hepatitis C without hepatocellular carcinoma in upper EGYPT[J]. Arab J Gastroenterol,2012, 13 (2) : 49-53. DOI: 10.1016/j.ajg.2012.06.004. |
| [3] | Xu L, Kim Y, Spolverato G, et al. Racial disparities in treatment and survival of patients with hepatocellular carcinoma in the United States[J]. Hepatobiliary Surg Nutr,2016, 5 (1) : 43-52. |
| [4] | Xue R, Li R, Guo H, et al. Variable intra-tumor genomic heterogeneity of multiple lesions in patients with hepatocellular carcinoma[J]. Gastroenterology,2016, 150 (4) : 998-1008. DOI: 10.1053/j.gastro.2015.12.033. |
| [5] | Sestito R, Cianfrocca R, Rosano L, et al. Macitentan blocks endothelin-1 receptor activation required for chemoresistant ovarian cancer cell plasticity and metastasis[J]. Life Sci,2016, 159 (SI) : 43-8. |
| [6] | Tan LY, Mintoff C, Johan MZ, et al. Desmoglein 2 promotes vasculogenic mimicry in melanoma and is associated with poor clinical outcome[J]. Oncotarget, 2016, [Epub ahead of print]. |
| [7] | Van Der Schaft DW, Seftor RE, Seftor EA, et al. Effects of angiogenesis inhibitors on vascular network formation by human endothelial and melanoma cells[J]. J Natl Cancer Inst,2004, 96 (19) : 1473-7. DOI: 10.1093/jnci/djh267. |
| [8] | Liu K, Sun BC, Zhao XL, et al. Hypoxia promotes vasculogenic mimicry formation by the Twist1-Bmi1 connection in hepatocellular carcinoma[J]. Int J Mol Med,2015, 36 (3) : 783-91. |
| [9] | Ren K, Yao N, Wang GY, et al. Vasculogenic mimicry: a new prognostic sign of human osteosarcoma[J]. Hum Pathol,2014, 45 (10) : 2120-9. DOI: 10.1016/j.humpath.2014.06.013. |
| [10] | Ho MY, Hung SW, Liang CM, et al. Recombinant viral capsid protein VP1 suppresses lung cancer metastasis by inhibiting COX-2/ PGE2 and MIG-7[J]. Oncotarget,2014, 5 (11) : 3931-43. DOI: 10.18632/oncotarget. |
| [11] | Crouch S, Spidel CS, Lindsey JS. HGF and ligation of alpha v beta 5 integrin induce a novel, cancer cell-specific gene expression required for cell scattering[J]. Exp Cell Res,2004, 292 (2) : 274-87. DOI: 10.1016/j.yexcr.2003.09.016. |
| [12] | Ho MY, Liang CM, Liang SM. MIG-7 and phosphorylated prohibitin coordinately regulate lung cancer invasion/metastasis[J]. Oncotarget,2015, 6 (1) : 381-93. |
| [13] | Liao S, Gao Q. Expressions and clinical significance of vasculogenic mimicry and related protein Mig-7 and MMP-2 in gastric carcinoma[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2013, 29 (2) : 194-6. |
| [14] | Reynolds A, Leake D, Boese Q, et al. Rational siRNA design for RNA interference[J]. Nat Biotechnol,2004, 22 (3) : 326-30. DOI: 10.1038/nbt936. |
| [15] | Ling Y, Yang Y, Lu N, et al. Endostar, a novel recombinant human endostatin, exerts antiangiogenic effect via blocking VEGF-induced tyrosine phosphorylation of KDR/Flk-1 of endothelial cells[J]. Biochem Biophys Res Commun,2007, 361 (1) : 79-84. DOI: 10.1016/j.bbrc.2007.06.155. |
| [16] | Tang NN, Zhu H, Zhang HJ, et al. HIF-1 alpha induces VEcadherin expression and modulates vasculogenic mimicry in esophageal carcinoma cells[J]. World J Gastroenterol,2014, 20 (47) : 17894-904. |
| [17] | Yang J, Zhang X, Zhang Y, et al. HIF-2 alpha promotes epithelialmesenchymal transition through regulating Twist2 binding to the promoter of E-cadherin in pancreatic cancer[J]. J Exp Clin Cancer Res,2016, 35 : 26. DOI: 10.1186/s13046-016-0298-y. |
| [18] | Guo JQ, Zheng QH, Chen H, et al. Ginsenoside Rg3 inhibition of vasculogenic mimicry in pancreatic cancer through downregulation of VE-cadherin/EphA2/MMP9/MMP2 expression[J]. Int J Oncol,2014, 45 (3) : 1065-72. |
| [19] | Bai R, Ding T, Zhao J, et al. The effect of PI3K inhibitor LY294002 and gemcitabine hydrochloride combined with ionizing radiation on the formation of vasculogenic mimicry of Panc-1 cells in vitro and in vivo[J]. Neoplasma,2016, 63 (1) : 80-92. DOI: 10.4149/neo_2016_010. |
| [20] | Wang H, Lin H, Pan J, et al. Vasculogenic mimicry in prostate cancer: the roles of EphA2 and PI3K[J]. J Cancer,2016, 7 (9) : 1114-24. DOI: 10.7150/jca.14120. |
| [21] | Zhang JT, Sun W, Zhang WZ, et al. Norcantharidin inhibits tumor growth and vasculogenic mimicry of human gallbladder carcinomas by suppression of the PI3-K/MMPs/Ln-5γ2 signaling pathway[J]. BMC Cancer,2014, 14 : 193. DOI: 10.1186/1471-2407-14-193. |
| [22] | Zhou TJ, Huang XH, Gong L, et al. Vasculogenic mimicry and hypoxia-inducible factor-1alpha expression in cervical squamous cell carcinoma[J]. Genet Mol Res,2016, 15 (1) : 15017396. |
| [23] | Zang M, Zhang Y, Zhang B, et al. CEACAM6 promotes tumor angiogenesis and vasculogenic mimicry in gastric cancer via FAK signaling[J]. Biochim Biophys Acta,2015, 1852 (5) : 1020-8. DOI: 10.1016/j.bbadis.2015.02.005. |
| [24] | Huang BH, Yin MZ, Li X, et al. Migration-Inducing gene 7 promotes tumorigenesis and angiogenesis and independently predicts poor prognosis of epithelial ovarian cancer[J]. Oncotarget,2016, 7 (19) : 27552-66. |
| [25] | Petty AP, Wright SE, Rewers-Felkins KA, et al. Targeting migration inducting gene-7 inhibits carcinoma cell invasion, early primary tumor growth, and stimulates monocyte oncolytic activity[J]. Mol Cancer Ther,2009, 8 (8) : 2412-23. DOI: 10.1158/1535-7163.MCT-09-0186. |
| [26] | Qu B, Guo L, Ma J, et al. Antiangiogenesis therapy might have the unintended effect of promoting tumor metastasis by increasing an alternative circulatory system[J]. Med Hypotheses,2010, 74 (2) : 360-1. DOI: 10.1016/j.mehy.2009.08.020. |
 2016, Vol. 36
2016, Vol. 36
