2. 四川大学华西医院肿瘤中心,成都 四川 610041
2. Cancer Research Center of Huaxi Hospital, Sichuan University, Chengdu 610041, China
肝癌是全球发病率最高的几个癌症之一,也是世界上第2大致死性癌症。目前治疗肝癌的方法多种多样,但是均难有好的疗效,尤其是当肝癌发生远处转移或者无法根治性切除时,患者的生存时间往往不会超过6个月[1]。因此,更深层次了解肝癌发生发展机制对肝癌的早期诊断和治疗都极为重要,目前研究较多的是肝癌微环境对肝癌发生、发展以及肿瘤转移的影响[2-3]。
TAMs是肝癌微环境中含量最多的细胞[2, 4-5]。研究表明,肝癌微环境可以促进TAMs呈M2型极化,进而促进肿瘤的发生和发展,但是其具体机制尚不明了[4, 6]。 目前发现的是肝癌微环境中TGF-β可以通过与TAMs 细胞膜上的Tim3作用,进而促进TAMs的M2型极化。
研究表明,受体相互作用蛋白140(receptor interacting protein140,RIP140)作为细胞核受体转录调节因子,在许多生理、病理过程中都起着重要作用,其中就包括能量代谢、炎症应答以及肿瘤的转移等[7-8]。此外,巨噬细胞中的RIP140还参与巨噬细胞极化,巨噬细胞过表达RIP140可以促进其向M1型极化,进而放大炎症反应。相反,巨噬细胞RIP140的降解可以促进其向M2型极化,并且诱导巨噬细胞内毒素耐受,从而减轻炎症反应[9-10]。关于RIP140在影响巨噬细胞极化方面的研究有大量报道,但其对TAMs的极化是否有影响,目前还没有相关报道。本文研究过表达RIP140 的TAMs对TAMs极化的影响以及对肝癌侵袭、增殖的影响,为进一步了解肿瘤微环境以及研究TAMs极化的机制提供依据。
1 材料和方法 1.1 材料及主要试剂人肝癌细胞系HepG2和Huh7细胞,小鼠肝癌细胞系H22 细胞,3 种细胞均为本实验室冻存。过表达RIP140的慢病毒(GOCL3581039001)购自上海吉凯基因化学技术有限公司。胎牛血清、胰酶、DMEM高糖细胞培养液均购自HyClone公司;Annexin V-FITC/PI细胞凋亡试剂盒购自Keygen公司;基质胶购自BD公司; 逆转录试剂盒和实时荧光定量PCR试剂SYBR®Green 购自TaKaRa 公司;所有PCR引物均购自上海生工公司;RIP140 抗体购自购自Abcam公司,PCNA、p-p65、 p65和β-actin抗体购自Cell Signaling公司。
1.2 方法 1.2.1 细胞培养人肝癌细胞系HepG2和Huh7以及小鼠肝癌细胞系H22接种在含10%胎牛血清、1%的青霉素-链霉素双抗的DMEM高糖培养基中,37 ℃、5% CO2 的饱和湿度恒温培养箱中培养。
1.2.2 PMs的提取、培养及转染PMs的提取方法详见参考文献[11]。提取的PMs接种在含10%胎牛血清、 1%的青霉素-链霉素双抗的DMEM高糖培养基中,37 ℃、5% CO2的饱和湿度恒温培养箱中培养,待细胞贴壁后更换培养基,继续培养。24 h后用过表达RIP140 的慢病毒以及不带目的基因的阴性慢病毒(NS)对PMs 进行转染,96 h后荧光显微镜观察慢病毒的转染效率,流式细胞仪检查慢病毒的转染率,并用Western blot和qRT-PCR进行验证。
1.2.3 HCM 的提取及利用H22 细胞在无血清的DMEM高糖中培养24 h,收集上清作为HCM[5-6]。在六孔板中,用含10%的HCM(培养基总体积为2 mL,其余培养基用完全培养基补充)培养PMs 24 h,本组作为实验组,用完全培养基培养PMs同等时间作为对照组。
1.2.4 BALB/c裸鼠皮下肝癌模型的建立以及肝癌组织HE染色和免疫组化实验取10只4周大的BALB/c裸鼠,将H22细胞和PMs以4:1的比例混匀,注入裸鼠皮下成瘤,以后每周处死2只裸鼠,用于测量裸鼠皮下瘤的体积,将第4周处死的裸鼠皮下瘤用于做后续的HE 染色实验和免疫组化实验。HE染色与免疫组化的具体方法详见参考文献[12]。简单来说,将皮下成瘤的肝癌组织放入福尔马林浸泡,石蜡包埋,切片,将玻片放入60 ℃恒温箱中1 h,取出玻片,放入二甲苯Ⅰ和二甲苯Ⅱ 中脱蜡水化,各30 min,然后用梯度酒精脱水,将玻片放入盛有稀释后的枸橼酸钾溶液的烧杯中,进行90 ℃ 微波抗原热修复10 min,然后室温冷却,PBS 缓冲液冲洗3 次×5 min,依次滴加3% H2O2室温下灭活内源性过氧化物酶10 min,加入5%的山羊血清室温封闭30 min,倾去封闭液(勿冲洗),每张片子加入80 μL PCNA一抗(1:100浓度稀释),将玻片放入湿盒,4 ℃过夜孵育24 h,PBS冲洗3次×5 min,加入适量对应的二抗工作液37 ℃孵育1 h,PBS冲洗3次×5 min,显色剂显色3~5 min,自来水充分冲洗,复染、脱水、透明和中性树胶封片。待中性树胶干后,于正置显微镜下观察或采图。
1.2.5 Western blot实验PMs经慢病毒转染96 h后,提取细胞总蛋白,BCA法测定蛋白浓度,所得蛋白样品与上样缓冲液以4:1比例混合后变性,取100 μg/孔蛋白样品上样,依次进行电泳、转膜,5%的BSA在37 ℃封闭1h,分别加入RIP140 抗体(1:1000)和β-actin 抗体(1:3000)4 ℃过夜孵育,TBST洗3遍×10 min,加入对应的二抗(1:2000)37 ℃孵育2 h,TBST 洗3 遍×10 min,ECL化学发光显影。
1.2.6 qRT-PCR 实验qRT-PCR 检测核酸表达,以GAPDH为内参。具体引物序列如下:CD206 上游引物:5'-GGGACTCTGGATTGGACTCA-3',下游引物: 5'-CCAGGCTCTGATGATGGACT-3';Arg-1上游引物: 5'-CCCCAGTACCAACAGGACTACC-3',下游引物: 5'-TGAACGTGGCGGAATTTTGT-3';PPAR上游引物: 5'-TCCCATACACAACCGCAGTCGC-3',下游引物: 5'-GGGGTCATTTGGTGACTCTGGGGT-3';TNF-α上游引物:5'-GGATCTCAAAGACAACCAAC-3',下游引物:5'-ACAGAGCAATGACTCCAAAG-3';NF-κB 上游引物:5'-AGTGTGGAGGCTGCCTTGCGAATG-3',下游引物:5'-TGGGCTTTCAAGACTGGAACGGT C-3';GAPDH上游引物:5'-CACCCACTCCTCCACC TTTG-3',下游引物:5'-CCACCACCCTGTTGCTGTA G-3'。
1.2.7 细胞流式实验和Transwell侵袭实验慢病毒的转染率以及细胞的凋亡实验用流式细胞仪分析;细胞的侵袭能力用Transwell 实验分析:选用24 孔板配套的transwell小室。在上室的聚碳酸酯膜上加入稀释后的Matrigel(1:8)60 μL,置于细胞培养箱中37 ℃ 30 min 使Matrigel聚合成凝胶。上室加入100 μL密度为1×105 的肝癌细胞,下室加入500 μL密度为1×105的PMs,放入细胞培养箱中共培养24 h后,取出上室,放入含有多聚甲醛的24 孔板中室温固定30 min,PBS 清洗3 次×5min/次,结晶紫染色10 min,PBS清洗3次×5 min/次,去掉上室液体,将棉签轻轻擦去上室细胞,风干后显微镜下观察并计数下室细胞数。
1.2.8 细胞免疫荧光实验将PMs接种在含有拔片的24 孔板中培养24 h,PMs用4%的多聚甲醛在37 ℃固定10 min,再用0.1%的Triton 在37 ℃孵育10 min 进行透膜,用PBS洗至少3 次×1 min/次,用山羊血清在37 ℃封闭10 min,加入适量的RIP140 抗体4 ℃过夜孵育,用PBS 洗3 次×1 min/次,加入山羊抗兔的荧光二抗在37 ℃避光孵育1 h,用PBS 洗3 次×2 min/次,加入适量DAPI 在37 ℃孵育3~5 min,固定、封片、正置显微镜观察。
1.3 统计学分析采用SPSS 17.0统计软件分析数据,数据以均数± 标准差表示,进行正态性、方差齐性检验,两样本均数比较采用独立样本t 检验,以P<0.05 为差异有统计学意义。采用GraphPad Prism 5软件制图。
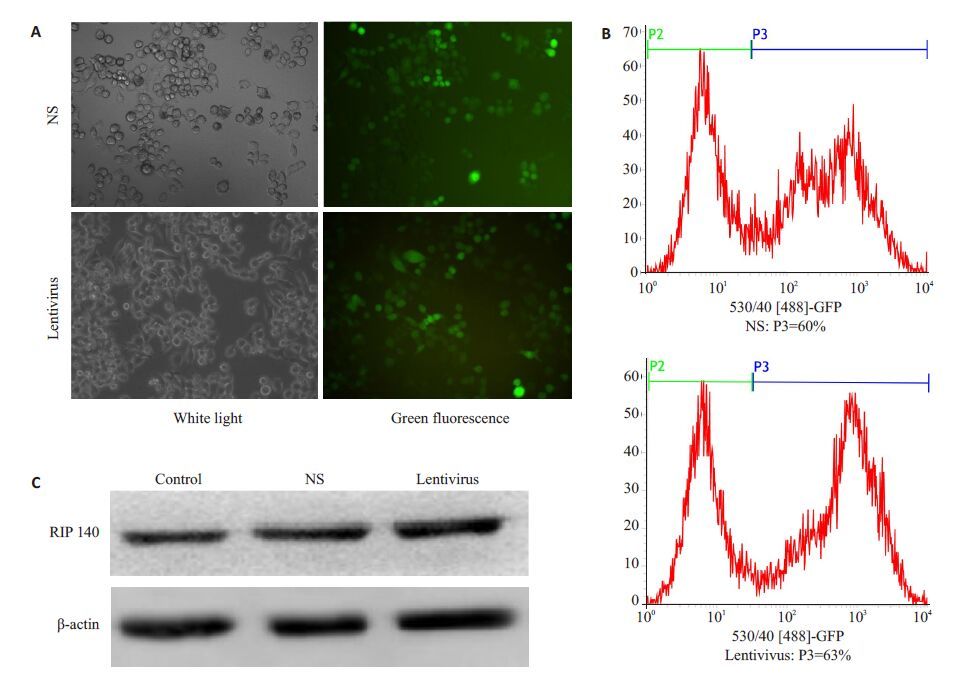
2 结果 2.1 慢病毒介导的PMs RIP140过表达为了了解慢病毒转染情况,我们在慢病毒转染PMs 96 h 后用荧光显微镜观察PMs绿色荧光的表达(图 1A);与此同时,用流式细胞仪定量检测PMs慢病毒的转染率(转染率为图 1B 中P3),其中,空载慢病毒(NS)转染率约为60%,目的基因慢病毒(Lentivirus)转染率约为63%(图 1B)。qRT-PCR检测PMs中RIP140 的核酸表达水平,目的基因转染后,PMs RIP140的核酸表达水平明显高于对照组(P<0.05)。用Western blot检测PMs中RIP140的蛋白表达水平(图 1C)。表达水平明显提高。
|
图 1 慢病毒介导的PMs RIP140过表达 Figure 1 Lentivirus-mediated RIP140 over-expression in PMs. A: Fluorescence microscopy showing green fluorescence in the PMs 96 h after transfection; B: Flow cytometry for detecting the transfection rate; C: Western blot analysis of RIP140 protein expression in PMs. |
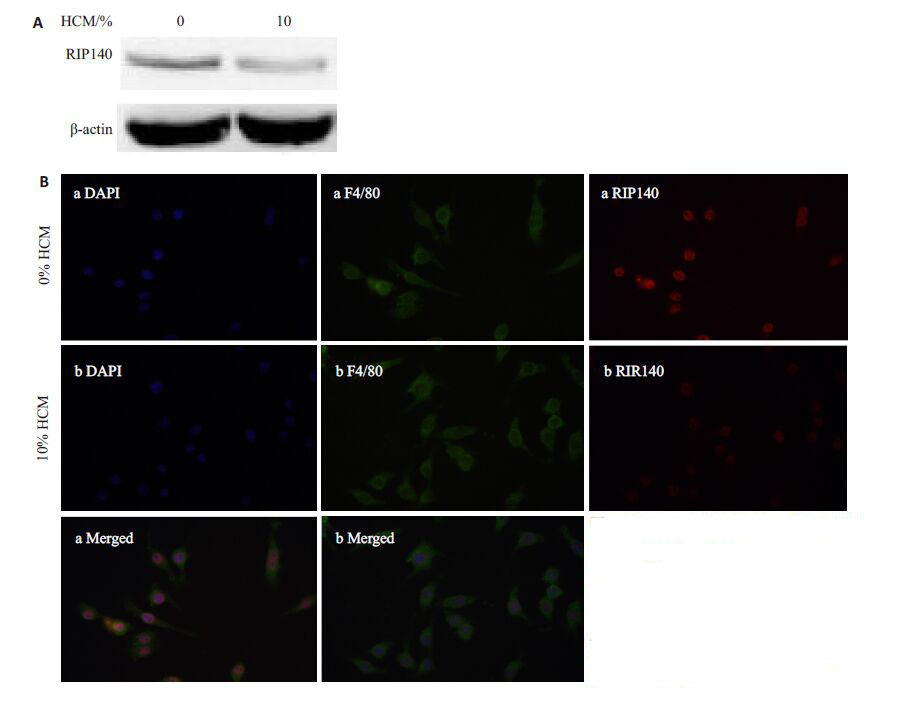
用10%的HCM(总体积2 mL,其余培养基用完全培养基补充)培养PMs 24 h 后,PMs中RIP140 的蛋白(图 2A)表达水平较正常组明显降低。如图 2B所示,PMs 用10%HCM刺激24 h 后,细胞免疫荧光检测到TAMs细胞核RIP140的表达明显低于对照组。
|
图 2 肝癌微环境抑制TAMs中RIP140 表达 Figure 2 HCC microenvironment inhibits the expression of RIP140 in TAMs. A: Western blot analysis of RIP140 protein expression in TAMs; B: Immunofluorescence for detecting RIP140 expression in TAMs. |
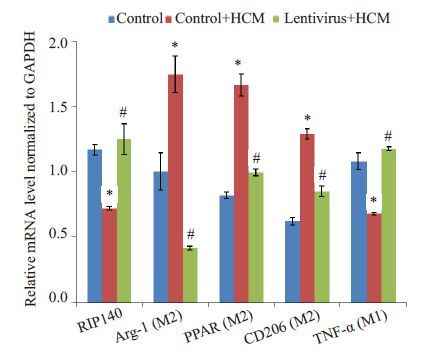
HCM刺激PMs后可促进TAMs呈M2型极化并抑制TAMs向M1型极化,与巨噬细胞M2型极化相关的标记物,如CD206、Arg-1和PPAR等表达升高,与巨噬细胞M1型极化相关的标记物,如TNFα表达明显降低; PMs 过表达RIP140 后再用HCM 刺激,可明显抑制HCM介导的TAMs向M2型极化的趋势,促进TAMs向M1型极化的趋势(图 3,P<0.05)。
|
图 3 过表达RIP140 的TAMs 可抑制肝癌微环境介导的TAMs M2型极化 Figure 3 Over-expression of RIP140 in TAMs inhibits HCC microenvironment-mediated M2-like polarization of TAMs. *P<0.05 vs control group; #P<0.05 vs control+HCM group. |
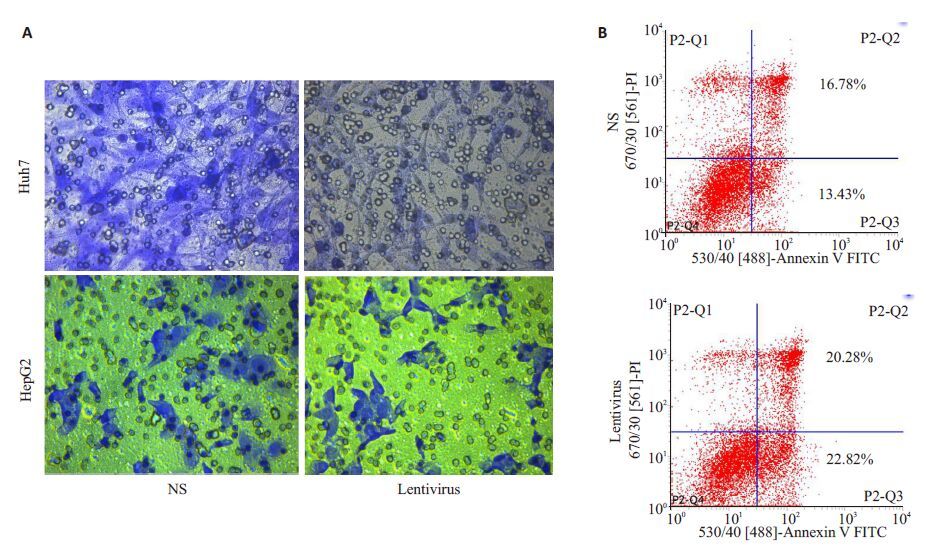
如图 4A所示,TAMs过表达RIP140后可以明显抑制HepG2 和Huh7 细胞的侵袭能力;如图 4B 所示,TAMs过表达RIP140 后可以明显促进H22 细胞凋亡(凋亡率为P2-Q2+P2-Q3,P<0.05),对照组凋亡率约为30%,TAMs RIP140过表达组凋亡率约43%。
|
图 4 TAMs RIP140的过表达可抑制肝癌侵袭并促进肝癌细胞凋亡 Figure 4 Over-expression of RIP140 in PMs suppresses invasion and induces apoptosis of HCC cells. A: Transwell assay for analyzing the invasion of HepG2 cells and Huh7 cells; B: Flow cytometry for detecting apoptosis of H22 cells. |
细胞的生长如图 5A所示,TAMs细胞RIP140过表达组肝癌组织的大小以及体质量均较对照组明显降低(P<0.05);肝癌组织HE染色。如图 5B所示,对照组中出现大片坏死的肝癌细胞(红色箭头所指),而在TAMs细胞RIP140 过表达组未见或者仅有少量坏死的肝癌细胞,提示TAMs过表达RIP140 抑制肝癌细胞的生长;肝癌组织增殖细胞核抗原(PCNA)免疫组化染色,PCNA的高表达提示细胞增殖活跃。如图 5C所示,TAMs细胞过表达RIP140可明显减少肝癌细胞中PCNA的表达(红色箭头指向PCNA阳性的细胞,P<0.05)。图 5A~C均提示,TAMs过表达RIP140 可明显抑制肝癌细胞生长和增殖。
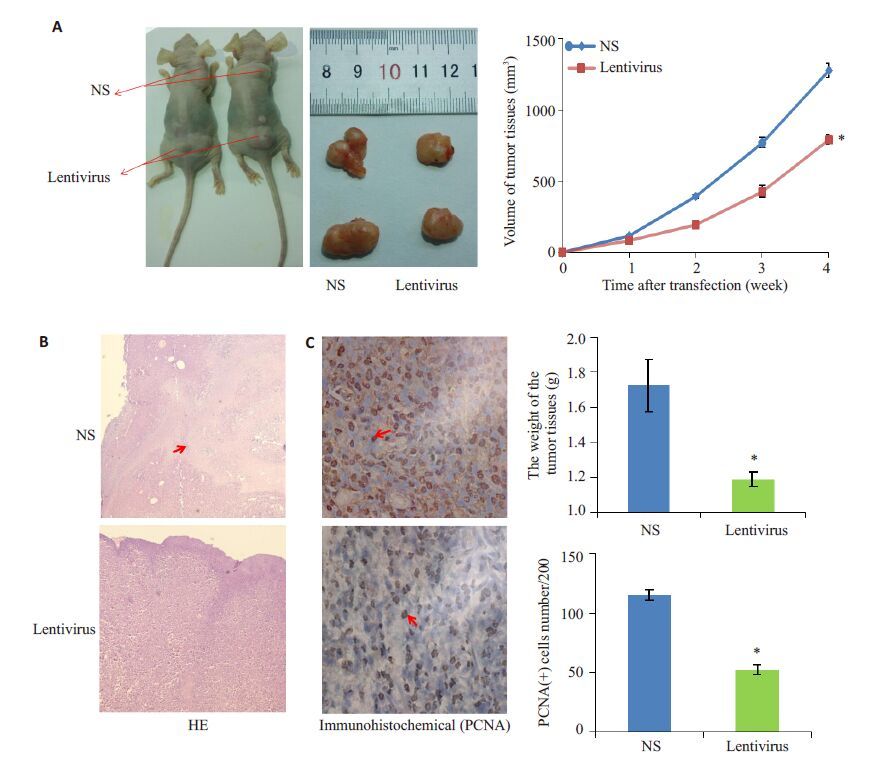
|
图 5 过表达RIP140的TAMs抑制BALB/c裸鼠肝癌皮下瘤的生长 Figure 5 Over-expression of RIP140 in TAMs suppresses the growth of H22 cell subcutaneous xenograft in BALB/c nude mice. A: Tumour size at 4 weeks; B: HE staining of the tumor sections. Red arrows indicate the necrotic area; C: Immunohistochemical staining of PCNA in the tumor sections. Red arrows indicate PCNA-positive cells. *P<0.05. |
我们通过Western blot和qRT-PCR检测了p-p65和p65 的蛋白和NF-κB和IL-6 的核酸表达,如图 6 所示,TAMs过表达RIP140可以明显抑制NF-κB和IL-6的表达(P<0.05)。
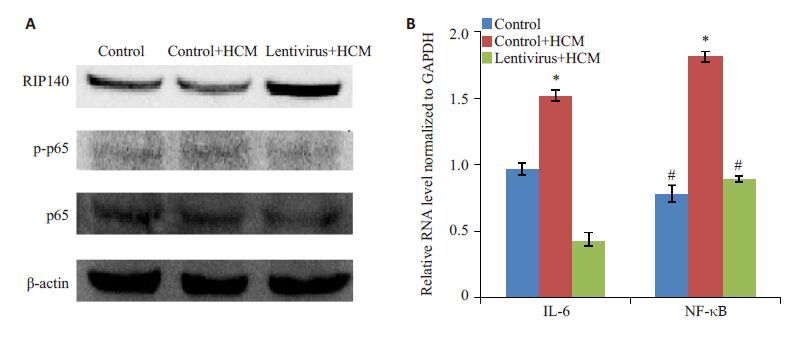
|
图 6 TAMs中NF-κB和IL-6的表达 Figure 6 Over-expression of RIP140 in TAMs inhibits NF-κB/IL-6 axis in TAMs. A: Western blotting was performed to detect the indicated proteins; B: Relative NF-κB and IL-6 levels normalized to GAPDH. *P<0.05 vs control group; #P<0.05 vs control+HCM group. |
大量研究发现,HCM刺激巨噬细胞后巨噬细胞呈M2型极化,M2型极化的巨噬细胞可促进肿瘤细胞的侵袭、迁移和增殖并抑制肿瘤细胞凋亡[5-6, 13-14]。过表达RIP140的巨噬细胞可以抑制HCM刺激下巨噬细胞的M2型极化。为了探讨过表达RIP140的TAMs是否可以抑制肝癌细胞的侵袭以及是否可以促进肝癌细胞凋亡,我们将TAMs和肝癌细胞进行共培养,分别做了Transwell实验和细胞凋亡实验。实验中证实肿瘤微环境中TAMs RIP140 呈低表达,TAMs呈M2 型极化,过表达RIP140的TAMs抑制TAMs M2 型极化趋势。许多研究已经证实HCM是通过激活NF-κB/IL-6通路,促进炎性因子IL-6的释放,进而促进了肿瘤的生长[3, 15-17]。 本实验中证实了对肝癌细胞的生长和增殖具有抑制作用,其具体机制可能与TAMs过表达RIP140 后抑制NF-κB-IL-6轴的激活,进而抑制IL-6的释放有关。
RIP140作为细胞核受体转录调节因子,存在于机体各个细胞中,在调节能量代谢、炎症应答以及肿瘤的发生、转移等方面起着重要作用[8]。在炎症调节上,巨噬细胞过表达RIP140可以促进其向M1型极化,进而放大炎症反应,相反,巨噬细胞RIP140的降解可以促进其向M2型极化,并且诱导巨噬细胞内毒素耐受,从而减轻炎症反应。无论是RIP140介导的M1型极化还是M2 极化,均与NF-κB介导的炎症通路有关[9-10]。我们知道,肿瘤的发生发展与肿瘤微环境中TAMs介导的慢性炎症有关,因此,我们猜测,肝癌微环境通过调节TAMs中RIP140的表达,参与肿瘤相关的免疫应答,进而调节肿瘤的生长和增殖。本研究结果发现HCM刺激PMs后TAMs RIP140表达降低并且细胞呈M2型极化;TAMs 细胞过表达RIP140可以抑制巨噬细胞M2型极化,促进巨噬细胞M1型极化趋势,并抑制肝癌的生长增殖,促进肝癌细胞的凋亡;其机制可能与TAMs过表达RIP140 后抑制NF-κB-IL-6 轴的激活,进而抑制IL-6 的释放有关。
本研究发现过表达RIP140 的TAMs具有治疗肝癌的潜力,为TAMs极化的进一步研究提供了基础。
| [1] | Bruix J, Gores GJ, Mazzaferro V. Hepatocellular carcinoma: clinical frontiers and perspectives[J]. Gut,2014, 63 (5) : 844-55. DOI: 10.1136/gutjnl-2013-306627. |
| [2] | Zhou WC, Ke SQ, Huang Z, et al. Periostin secreted by glioblastoma stem cells recruits M2 tumour-associated macrophages and promotes malignant growth[J]. Nat Cell Biol,2015, 17 (2) : 170. DOI: 10.1038/ncb3090. |
| [3] | Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature,2008, 454 (7203) : 436-44. DOI: 10.1038/nature07205. |
| [4] | Nywening TM, Wang-Gillam A, Sanford DE, et al. Targeting tumour-associated macrophages with CCR2 inhibition in combination with FOLFIRINOX in patients with borderline resectable and locally advanced pancreatic Cancer: a single-centre, open-label, dose-finding, non-randomised, phase 1b trial[J]. Lancet Oncol,2016, 17 (5) : 651-62. DOI: 10.1016/S1470-2045(16)00078-4. |
| [5] | Colegio OR, Ngoc-Quynh C, Szabo AL, et al. Functional polarization of tumour-associated macrophages by tumour-derived lactic acid[J]. Nature,2014, 513 (7519) : 559. DOI: 10.1038/nature13490. |
| [6] | Yan WJ, Liu X, Ma HX, et al. Tim-3 fosters HCC development by enhancing TGF-beta-mediated alternative activation of macrophages[J]. Gut,2015, 64 (10) : 1593-604. DOI: 10.1136/gutjnl-2014-307671. |
| [7] | Lapierre M, Bonnet S, Bascoul-Mollevi CA, et al. RIP140 increases APC expression and controls intestinal homeostasis and tumorigenesis[J]. J Clin Invest,2014, 124 (5) : 1899-913. DOI: 10.1172/JCI65178. |
| [8] | Nautiyal J, Christian M, Parker MG. Distinct functions for RIP140 in development, inflammation, and metabolism[J]. Trends Endocrinol Metab,2013, 24 (9) : 451-9. DOI: 10.1016/j.tem.2013.05.001. |
| [9] | Ho PC, Yc T, Feng X, et al. NF-κB-mediated degradation of the co-activator RIP140 regulates inflammatory response and contributes to endotoxin tolerance[J]. Nat Immunol,2012, 13 (4) : 379-86. DOI: 10.1038/ni.2238. |
| [10] | Liu PS, Lin YW, Burton FH, et al. M1-M2 balancing act in white adipose tissue browning-a new role for RIP140[J]. Adipocyte,2015, 4 (2) : 146-8. DOI: 10.4161/21623945.2014.981428. |
| [11] | Pineda-Torra I, Gage M, de Juan A, et al. Isolation,culture,and polarization of murine bone marrow-derived and peritoneal macrophages[J]. Methods Mol Biol,2015, 1339 : 101-9. DOI: 10.1007/978-1-4939-2929-0. |
| [12] | Otali D, Fredenburgh J, Oelschlager DK, et al. A standard tissue as a control for histochemical and immunohistochemical staining[J]. Biotech Histochem,2016, 91 (5) : 309-26. DOI: 10.1080/10520295.2016.1179342. |
| [13] | Hernandez-Gea V, Toffanin S, Friedman SL, et al. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma[J]. Gastroenterology,2013, 144 (3) : 512-27. DOI: 10.1053/j.gastro.2013.01.002. |
| [14] | Flecken T, Sarobe P. Tim-3 expression in tumour-associated macrophages: a new player in HCC progression[J]. Gut,2015, 64 (10) : 1502-3. DOI: 10.1136/gutjnl-2014-309094. |
| [15] | Chang CP, Yc S, Lee PH, et al. Targeting NF-kB by autophagy to polarize hepatoma-associated macrophage differentiation[J]. Autophagy,2013, 9 (4) : 619-21. DOI: 10.4161/auto.23546. |
| [16] | Mancino A, Lawrence T. Nuclear factor-kappa B and Tumor- Associated macrophages[J]. Clin Cancer Res,2010, 16 (3) : 784-9. DOI: 10.1158/1078-0432.CCR-09-1015. |
| [17] | Wan S, Zhao E, Kryczek I, et al. Tumor-associated macrophages produce interleukin 6 and signal via STAT3 to promote expansion of human hepatocellular carcinoma stem cells[J]. Gastroenterology,2014, 147 (6) : 1393-404. DOI: 10.1053/j.gastro.2014.08.039. |
 2016, Vol. 36
2016, Vol. 36
