睾丸癌是20~35岁青壮年男性高发的实体肿瘤,恶性程度高[1]。以顺铂为主的多药联合化疗对睾丸癌具有良好的治疗作用。然而骨髓抑制和肾脏毒性等不良反应严重限制了顺铂的临床应用。因此,寻找特异性较高,可增强睾丸癌对顺铂敏感性的新靶点对提高其临床疗效和减少不良反应具有重要的意义。
Pannexins是由Panchin等[2]在2000年率先报道发现的一类新型通道蛋白,由6个pannexin蛋白环绕在一起形成一个“六聚体通道”,允许相对分子质量小于1000 的物质通过,沟通细胞内与细胞外微环境的物质交换和信号转导。Pannexin通道参与多种重要的生理病理过程,例如:细胞凋亡、介导ATP释放和钙波传递等[3-4]。在目前发现的3 种亚型中(pannexin1,pannexin2,pannexin3),以pannexin1(Panx-1)的研究最为广泛。
近年来,大量文献报道了在化疗药诱导肿瘤细胞凋亡过程中,Panx-1通道可介导ATP释放到细胞外[5-8]。
细胞外ATP 可作用于细胞膜表面的P2Y受体,激活三磷酸肌醇(IP3)通路[4]。IP3是重要的凋亡调节第二信使,可诱导内质网释放Ca2+,引起细胞凋亡[9-10]。然而Panx-1 通道对顺铂诱导睾丸癌细胞凋亡的影响以及是否有可能与ATP/IP3信号通路有关尚未见报道。
本研究采用Panx-1 通道抑制剂甘珀酸(carbenoxolone,CBX)作为工具药,初步探究Panx-1 通道在顺铂诱导睾丸癌Ⅰ-10 细胞凋亡中的作用及可能的机制。
1 材料和方法 1.1 细胞株与细胞培养小鼠睾丸癌细胞株Ⅰ-10 购于ATCC 公司。采用F12高糖培养基,加入2.5%(V/V)胎牛血清,15%(V/V)马血清,100 U/ml青霉素,100 U/ml链霉素。细胞贴壁生长于25 cm2透气培养瓶中,置于37 ℃、含体积分数5% CO2以及饱和湿度的细胞培养箱中。0.25%胰酶细胞消化液(含0.02% EDTA)消化传代,每周传代2~3次。
1.2 主要试剂F12 高糖培养基、胎牛血清、马血清购于Gibco 公司;顺铂(cisplatin,DDP),四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、Hoechst 33258染色试剂盒、CBX均购于Sigma-Aldrich公司;FITC-Annexin V/PI双染试剂盒购于BD Biosciences公司;胰酶、ATP检测试剂盒购于碧云天公司;小鼠1,4,5-三磷酸肌醇(IP3)ELISA试剂盒购于CUSABIO公司;其他常用试剂均为国产分析级。
1.3 细胞存活率检测-MTT法取对数生长期细胞,以5×104 cells/mL密度接种于96孔板,每组5个复孔。待细胞长至约40%~50%愈合后,更换新鲜含药培养基(血清65 ℃灭活处理2 h[6],因为血清中的核苷酸酶会分解ATP),分为单用顺铂组、顺铂和CBX合用组,顺铂浓度分别为0、2、4、8、16、32、64、 128 μmol/L,CBX浓度为100 μmol/L。培养24 h后,每孔加入MTT 15 μL(5 mg/mL)继续孵育4 h。然后弃去培养基,每孔加入150 μL DMSO置于37 ℃烘箱中孵育30 min,酶标仪检测A值,震荡10 min,检测波长570 nm。样品检测全程避光操作。根据公式计算细胞存活率。
| $细胞存活率=\frac{A药物处理组-A校正组}{A对照组-A校正组}$ |
取对数生长期细胞,以2×105 cells/mL密度接种于12孔板。24 h后更换灭活血清的新鲜含药培养基,分为空白组、单用CBX组、单用顺铂组、顺铂和CBX合用组,顺铂浓度为100 μmol/L,CBX浓度为100 μmol/L。8h 后用不含DETA的胰酶消化收集细胞(2000 r/min离心5 min),预冷PBS洗涤细胞2 次(2000 r/min 离心5min),收集1×105~5×105细胞。先加入100 μL的Binding Buffer 悬浮细胞,再加入5 μL Annexin-V和5 μL PI 吸吹混匀,室温避光下反应15 min,最后补足400 μL的Binding buffer,流式细胞仪检测。
1.5 细胞晚期凋亡检测-Hoechst 33258染色法细胞接种与药物处理方法同1.4。16 h后弃去培养液,PBS洗2次,4%多聚甲醛固定15 min,PBS洗2次,每孔加入500 μL Hoechst 33258(10 μg/mL)室温避光染色30 min。PBS洗去染料后,荧光显微镜下观察,拍照,随机取5个视野对晚期凋亡细胞进行计数并计算凋亡率。
1.6 细胞外ATP浓度检测-化学发光法细胞接种与药物处理方法同1.4。分别于8、16、24 h 后取细胞外培养基,离心,再取上清液为样品。在不透明96孔板中,每孔预先加入100 μLATP检测工作液,然后每孔再加入20 μL样品混匀,多功能酶标仪测化学发光度数,激发光1 s,灵敏度200。样品检测全程避光冰上操作。
1.7 细胞内IP3含量检测-ELISA法细胞接种与药物处理方法同1.4。分别于8、16、24 h 后取出培养板置于冰上,冷PBS洗涤1次后,将细胞转移至1.5 mL的离心管中,-20 ℃过夜。经过2次反复冻融破坏细胞膜后,4 ℃ 5000 g 离心5 min,取上清液用PBS稀释200倍为样品。酶标板每孔加入100 μL样品37 ℃孵育2 h后,每孔再加入100 μL生物素标记抗体工作液37 ℃孵育1 h,洗板3次,每孔加入100 μL辣根过氧化物酶标记亲和素工作液37 ℃孵育1 h,洗板5次,每孔加入90 μL底物溶液37 ℃避光显色30 min,最后每孔加入50 μL终止液,5 min内用酶标仪在450 nm波长检测A值。
1.8 统计学分析所有实验数据来自至少3次独立实验,以均数±标准差表示。统计分析使用SPSS 16.0软件,两组之间的数据比较采用两独立样本的t检验,多组之间的数据比较采用单因素方差分析,P<0.05认为有统计学意义。
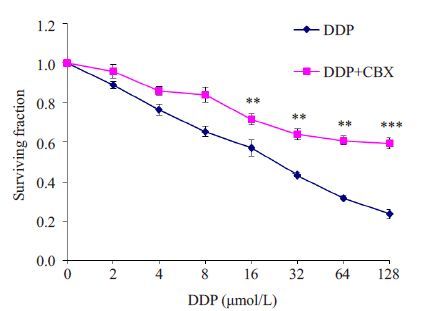
2 结果 2.1 CBX对顺铂细胞毒性的影响采用MTT法检测细胞生存率。单用16、32、64、 128 μmol/L 顺铂时,Ⅰ-10 细胞的生存率为0.57±0.03、 0.43±0.03、0.32±0.02、0.24±0.03。顺铂与CBX合用后,Ⅰ-10 细胞的生存率提高为0.71±0.04、0.64±0.01、0.61± 0.01、0.59±0.02。CBX与顺铂合用可明显提高Ⅰ-10 细胞的生存率,P值均小于0.01,差异有统计学意义(图 1)。
|
图 1 CBX对顺铂作用后Ⅰ-10细胞生存率的影响 Figure 1 Effect of CBX on surviving fraction of Ⅰ-10 cells treated with cisplatin. Data represent Mean±SD of 5 wells from 3 independent experiments. **P<0.01,***P<0.001 vs DDP group. |
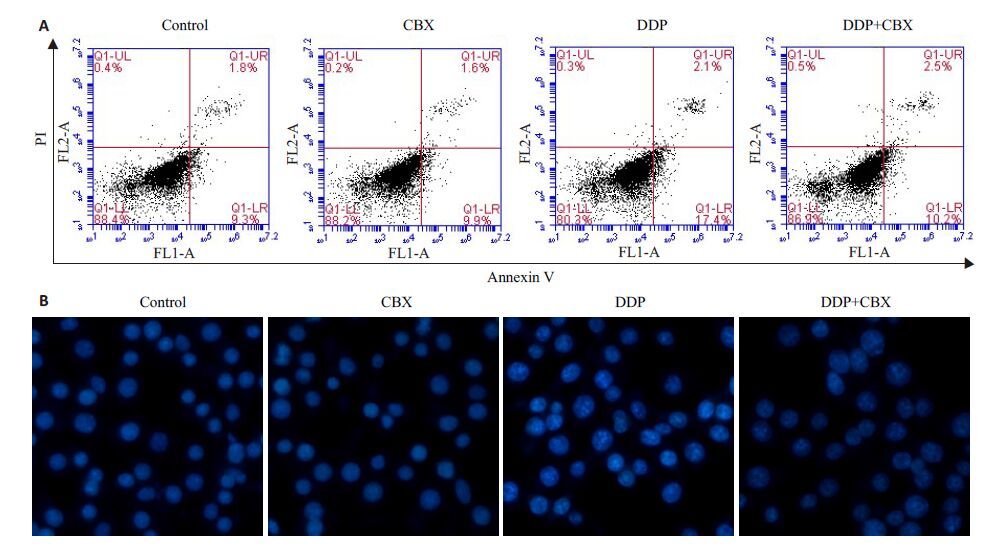
顺铂主要通过诱导细胞凋亡产生抗肿瘤作用,细胞凋亡分为早期凋亡和晚期凋亡。Annexin V/PI双染法检测早期凋亡(图 2A,右下象限),单用顺铂组的细胞早期凋亡率为17.34%±0.57 %,顺铂与CBX合用组的早期凋亡率为10.76%±0.44%,低于单用顺铂组,P<0.001,差异有统计学意义。Hoechst 33258染色法检测晚期凋亡(图 2B,出现细胞核浓集、碎裂、呈亮蓝色),单用顺铂组的细胞晚期凋亡率为52.13%±4.31%,顺铂与CBX合用组的晚期凋亡率为25.46%±1.73%,低于单用顺铂组,P<0.01,差异有统计学意义。
|
图 2 CBX对顺铂作用后Ⅰ-10细胞凋亡的影响 Figure 2 Effect of CBX on apoptosis rate of Ⅰ-10 cells treated with cisplatin (Original magnification: × 200). A: early-stage apoptosis; B: late-stage apoptosis. |
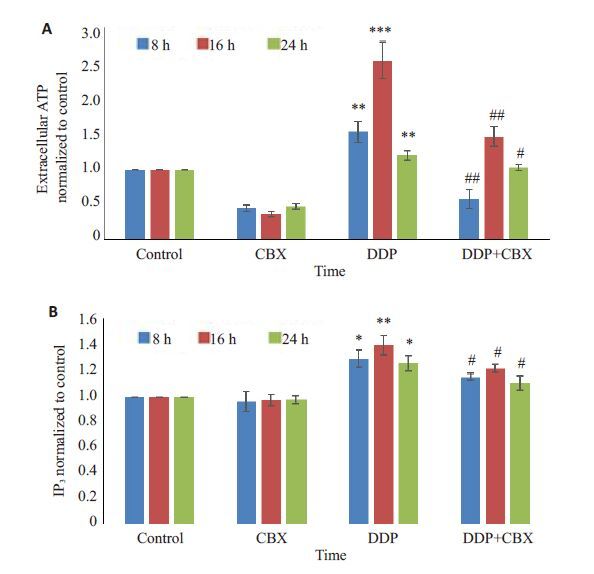
为了证实CBX抑制顺铂诱导的凋亡是否与Panx-1 通道介导的ATP/IP3通路有关。本实验分别检测了8、 16、24 h时ATP和IP3的含量(图 3)。8、16、24 h时,单用顺铂组的细胞外ATP 和细胞内IP3含量分别为1.54± 0.15 与1. 29±0.07;2.55±0.26 与1.40 ±0.08;1.20±0.07 与1.26±0.06,顺铂与CBX合用组的细胞外ATP和细胞内IP3含量分别为0.58±0.13与1.16±0.03;1.47±0.14与1.22±0.03;1.03±0.04与1.11±0.05,均低于单用顺铂组,P值均小于0.05,差异有统计学意义。
|
图 3 CBX对顺铂诱导Ⅰ-10细胞凋亡过程中ATP/IP3通路的影响 Figure 3 Effect of CBX on ATP/IP3 pathway during cisplatin-induced apoptosis in Ⅰ-10 cells. A: ATP; B: IP3. Data represent Mean±SD of 3 wells from 3 independent experiments. *P<0.05,**P<0.01,***P<0.001 vs control group,#P<0.05,##P<0.01 vs DDP group. |
顺铂是应用最为广泛的化疗药物之一,也是睾丸癌化疗的一线药物[11]。顺铂进入肿瘤细胞后,氯原子被水分子取代,形成有活性的亲核基团,可与DNA结合,从而抑制DNA的复制、转录和修复,最终导致肿瘤细胞的凋亡[12]。然而,只有5%~10%的顺铂可以和DNA共价结合[13]。因此,在顺铂诱导肿瘤细胞凋亡的过程中,可能还存在其他作用机制。本研究首次发现,应用Panx-1 通道抑制剂CBX后可以明显降低顺铂对睾丸癌Ⅰ-10细胞的毒性(图 1)和诱导凋亡作用(图 2)。因此,Panx-1 通道可能在顺铂对Ⅰ-10细胞产生抗肿瘤作用的过程中扮演重要角色。最新的研究显示Panx-1通道参与了多种细胞的死亡过程。Draganov的结果证明伊佛霉素诱导肿瘤细胞死亡需要Panx-1通道参与[14]。Cheung报道了Panx-1 通道参与微损伤之后骨细胞的凋亡过程[15]。 Yang的研究表明内毒素休克导致细胞死亡需要Panx-1 通道的介导[16]。
Panx-1 通道是一类位于细胞膜上的半通道,组成通道的Panx-1蛋白在各种组织中都有表达,比如:脑、心脏、肝、肺、睾丸等[17],并且半衰期长达32 h[18]。我们的结果显示顺铂作用于睾丸癌Ⅰ-10细胞株后可导致ATP的大量释放,应用Panx-1通道抑制剂CBX则明显抑制该过程(图 3A),这表明Panx-1通道可能是ATP释放的主要途径。Panx-1蛋白的羧基端有一小段46个氨基酸构成的自抑制结构域,所以在基础状态下,Panx1通道的开放程度很低。Boyd-Tressler的研究认为在多种化疗药(anti-Fas、十字孢碱、依托泊苷、阿霉素)诱导细胞凋亡的过程中,ATP大量释放的机制是由于caspase-3切除Panx-1蛋白羧基端的自抑制结构域,从而不可逆地激活Panx-1通道[6]。顺铂诱导肿瘤细胞凋亡的过程中可以激活caspase-3的活性[19-20],这可能是顺铂诱导Ⅰ-10 细胞释放ATP的机制。
细胞外ATP是一种信号分子,可作用于细胞表面的嘌呤受体引起细胞内IP3含量的增加[4]。我们的研究表明顺铂作用于睾丸癌Ⅰ-10细胞株后还可以导致细胞内IP3含量的增加,应用CBX可以抑制IP3含量的增加(图 3B)。这可能是由于CBX抑制了Panx-1通道释放ATP,从而抑制了ATP诱导细胞内IP3含量的增加。IP3 是重要的凋亡调节第二信使,其作用于IP3受体后可以导致Ca2+从内质网中释放[21-23]。Eugenin的研究[9]认为,在星形胶质细胞感染HIV病毒之后,死亡细胞内的IP3 通过缝隙连接扩散到周边细胞中,引起未感染细胞内Ca2+浓度增加,随后线粒体内Ca2+集聚并释放出细胞色素C,最终导致未感染星形胶质细胞的凋亡。因此,我们推测细胞内IP3含量的增加可能是顺铂诱导Ⅰ-10细胞凋亡机制之一。
综上所述,我们的研究证明Panx-1通道参与了顺铂诱导睾丸癌Ⅰ-10 细胞的凋亡,其机制可能与介导ATP/IP3信号通路有关。这将为以Panx-1通道作为靶点提高顺铂对睾丸癌的化疗效果提供新思路。但是,目前还未发现可以特异性增强Panx-1 通道的药物,而且Panx-1蛋白在细胞内合成与代谢过程的调控尚不明确,这些可以作为后续研究的重点。
| [1] | 谭于龙. microRNA 在睾丸肿瘤中的最新进展[J]. 实用癌症杂志,2016, 31 (4) : 694-6. |
| [2] | Panchin Y, Kelmanson I, Matz M, et al. A ubiquitous family of putative gap junction molecules[J]. Curr Biol,2000, 10 (13) : R473-4. DOI: 10.1016/S0960-9822(00)00576-5. |
| [3] | Penuela S, Gehi R, Laird DW. The biochemistry and function of pannexin channels[J]. Biochim Biophys Acta,2013, 1828 (1, SI) : 15-22. DOI: 10.1016/j.bbamem.2012.01.017. |
| [4] | Mohammad M, Habib HS. Pannexin channels: the emerging therapeutic targets[J]. Curr Drug Targets,2014, 15 (3) : 272-80. DOI: 10.2174/13894501113146660217. |
| [5] | Sandilos JK, Chiu YH, Chekeni FB, et al. Pannexin 1, an ATP release Channel, is activated by caspase cleavage of its pore-associated C-terminal autoinhibitory region[J]. J Biol Chem,2012, 287 (14) : 11303-11. DOI: 10.1074/jbc.M111.323378. |
| [6] | Boyd-Tressler A, Penuela S, Laird DW, et al. Chemotherapeutic drugs induce ATP release via caspase-gated pannexin-1 channels and a caspase/pannexin-1-independent mechanism[J]. J Biol Chem,2014, 289 (39) : 27246-63. DOI: 10.1074/jbc.M114.590240. |
| [7] | Suadicani SO, Iglesias R, Wang J, et al. ATP signaling is deficient in cultured Pannexin1-null mouse astrocytes[J]. Glia,2012, 60 (7) : 1106-16. DOI: 10.1002/glia.v60.7. |
| [8] | D'hondt C, Ponsaerts R, De Smedt H, et al. Pannexin channels in ATP release and beyond: An unexpected rendezvous at the endoplasmic reticulum[J]. Cell Signal,2011, 23 (2) : 305-16. DOI: 10.1016/j.cellsig.2010.07.018. |
| [9] | Eugenin EA, Berman JW. Cytochrome c dysregulation induced by HIV infection of astrocytes Results in bystander apoptosis of uninfected astrocytes by an IP3 and calcium-dependent mechanism[J]. J Neurochem,2013, 127 (5) : 644-51. DOI: 10.1111/jnc.2013.127.issue-5. |
| [10] | Decrock E, Krysko DV, Vinken M, et al. Transfer of IP through gap junctions is critical, but not sufficient, for the spread of apoptosis[J]. Cell Death Differ,2012, 19 (6) : 947-57. DOI: 10.1038/cdd.2011.176. |
| [11] | Mendoza J, Martinez J, Hernandez C, et al. Association between ERCC1 and XPA expression and polymorphisms and the response to cisplatin in testicular germ cell tumours[J]. Br J Cancer,2013, 109 (1) : 68-75. DOI: 10.1038/bjc.2013.303. |
| [12] | Hato SV, Khong A, de Vries IJ, et al. Molecular pathways: the immunogenic effects of platinum-based chemotherapeutics[J]. Clin Cancer Res,2014, 20 (11) : 2831-7. DOI: 10.1158/1078-0432.CCR-13-3141. |
| [13] | Fuertes M, Alonso C, Perez JM. Biochemical modulation of Cisplatin mechanisms of action: enhancement of antitumor activity and circumvention of drug resistance[J]. Chem Rev,2003, 103 (3) : 645-62. DOI: 10.1021/cr020010d. |
| [14] | Draganov D, Gopalakrishna-Pillai S, Chen Y, et al. Modulation of P2X4/P2X7/pannexin-1 sensitivity to extracellular ATP via ivermectin induces a non-apoptotic and inflammatory form of Cancer cell death[J]. Sci Rep,2015, 5 : 16222. DOI: 10.1038/srep16222. |
| [15] | Cheung WY, Fritton JC, Morgan SA, et al. Pannexin-1 and P2X7- Receptor are required for apoptotic osteocytes in fatigued bone to trigger RANKL production in neighboring bystander osteocytes[J]. J Bone Miner Res,2016, 31 (4) : 890-9. DOI: 10.1002/jbmr.2740. |
| [16] | Yang DH, He Y, Munoz-Planillo R, et al. Caspase-11 requires the pannexin-1 Channel and the purinergic P2X7 pore to mediate pyroptosis and endotoxic shock[J]. Immunity,2015, 43 (5) : 923-32. DOI: 10.1016/j.immuni.2015.10.009. |
| [17] | Baranova A, Ivanova DV, Petrash N, et al. The mammalian pannexin family is homologous to the invertebrate innexin gap junction proteins[J]. Genomics,2004, 83 (4) : 706-16. DOI: 10.1016/j.ygeno.2003.09.025. |
| [18] | Penuela S, Bhalla R, Gong XQ, et al. Pannexin 1 and pannexin 3 are glycoproteins that exhibit many distinct characteristics from the connexin family of gap junction proteins[J]. J Cell Sci,2007, 120 (21) : 3772-83. DOI: 10.1242/jcs.009514. |
| [19] | 赵素容, 张媛媛, 吴成柱, 等. 3-溴丙酮酸增强肝癌细胞对顺铂敏感性的作用[J]. 南方医科大学学报,2014 (1) : 25-30. |
| [20] | 宋乐乐, 马琳艳, 张旭东, 等. 衣霉素联合顺铂对人鼻咽癌细胞增殖和凋亡的影响[J]. 南方医科大学学报,2012, 32 (6) : 766-71. |
| [21] | 王桂君, 姚玉胜, 王洪新. 肿瘤坏死因子α通过PI3K-IP_3R-Ca-(2+)途径诱导乳鼠心肌肥大[J]. 中国病理生理杂志,2016 (1) : 21-6. |
| [22] | Decrock E, De Bock M, Wang N, et al. Connexin and pannexin signaling pathways, an architectural blueprint for CNS physiology and pathology[J]. Cell Mol Life Sci,2015, 72 (15) : 2823-51. DOI: 10.1007/s00018-015-1962-7. |
| [23] | Sáez JC, Cisterna BA, Vargas A, et al. Regulation of pannexin and connexin channels and their functional role in skeletal muscles[J]. Cell Mol Life Sci,2015, 72 (15) : 2929-35. DOI: 10.1007/s00018-015-1968-1. |
 2016, Vol. 36
2016, Vol. 36
