2. 南方医科大学南方医院神经外科, 广东广州 510515
2. Biosafety Level-3(BSL-3) Laboratory, School of Public Health, Southern Medical University, Guangzhou 510515, China
脑胶质瘤是最常见的中枢神经系统疾病之一,临床上患者虽经放化疗、手术等干预治疗,但因其恶性程度高,侵袭性强使得患者病死率居高不下。因此,迫切需要发展高效、安全的抗肿瘤药物。替莫唑胺(temozolomide, TMZ)因其脂溶性高,易于通过血脑屏障,且不良反应轻,是脑胶质瘤化疗首选药[1-2],目前广泛用于临床,但是单用替莫唑胺易导致脑胶质瘤产生耐药,积极治疗后患者中位生存期仍然少于15个月[3],临床效果还有待提高。寻找可能的治疗新靶点和有效的药物联用策略是目前治疗脑胶质瘤研究的热点[4]。RITA(Reactivator of p53 and Induction of TumorApoptosis, 肿瘤凋亡和p53再生化合物)是新近发展起来的一种潜在的抑癌小分子药物,在肿瘤生长抑制、诱导凋亡中凸显出高效性[5-7]。研究表明,在机体内,RITA与p53靶向结合,激活野生型p53,促进p53的累积,恢复肿瘤细胞里p53的凋亡诱导功能,但其促凋亡作用的分子机制尚不明确[6]。本研究探讨了RITA、替莫唑胺、RITA和替莫唑胺联合使用在胶质瘤U87细胞中的抑制作用和敏感性,并初步分析其可能机制,为进一步开展替莫唑胺联合RITA治疗脑胶质瘤的临床前研究提供依据。
1 材料和方法 1.1 主要药物、试剂与仪器人脑胶质瘤细胞U87(本室保种);TMZ,DMSO(Sigma);RITA(Cayman);胎牛血清,DMEM-高糖培养基,青链霉素,PBS磷酸钾缓冲液(Hyclone);MTS试剂盒(Promega);Trizol试剂(Invitrogen);PCR试剂盒,电泳凝胶回收试剂盒(TaKaRa);BCA法蛋白含量检测试剂盒,Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物发展有限公司);RIPA裂解液、一抗稀释液(碧云天,P0013,相应二抗为羊抗兔IgG(H+L);结晶紫染料(实验室自配);96孔板细胞培养板(Nest);巴氏吸管(Jet Biofit 3 mL);荧光定量PCR仪(SmartCyclerⅡ);电泳仪(Biorad, ProteanⅡ XL);酶标仪(美国BioTex ELX808IU);流式细胞仪(BD calibur);酶联免疫斑点仪器(德国AID iSpot system);洁净工作台(SW-CJ-IFD);低速离心机(中佳,SC3614);细胞恒温培养箱(Thermo scientific, HERACELL150i)。
1.2 实验方法 1.2.1 细胞培养U87细胞用含10%胎牛血清和1%青链霉素的DMEM-高糖培养基于5% CO2,37 ℃的培养箱中传代培养。
1.2.2 药物处理取对数增长期细胞进行药物处理。分4组:(1)DMSO(对照组,浓度为0.05%);(2)RITA;(3)TMZ;(4)RITA+TMZ(半剂量),每组药物设置4种浓度:1、5、10、20 μmol/L,以DMSO为溶剂配制。注:RITA母液(20 mmol/mL)需要-20 ℃保存,TMZ 2~8 ℃即可。
1.2.3 MTS法检测细胞存活采用MTS法进行检测。取各药物处理后的细胞,制成浓度为1×105个/mL的细胞悬液,分到96孔板中,100 μL/孔,每种浓度药物组各设3个复孔。收集各个时间点的细胞(0、24、48、72 h)加入cell Titer 96AQ单溶液细胞增殖检测试剂(MTS),比例为1:10(即100 μL培养液加入10 μL检测液)。在5% CO2,37 ℃培养箱中孵育4 h后,酶标仪检测波长490 nm处吸光度值(A值)。
1.2.4 qRT-PCR法定量检测细胞中p53和p21基因的mRNA表达水平(1)取对数增长期U87细胞,调成每孔800个细胞悬液接种于6孔板,置于37 ℃,5% CO2培养箱中培养24 h后分别加入1、5 μmol/L RITA,TMZ和RITA+TMZ,同时设DMSO对照组,每组3个复孔,培养168 h;(2)收集处理过的U87细胞,Trizol法分离提取总RNA,使用RNase-free的DNase(І Promega)去基因组;紫外分光光度仪检测所提取RNA的纯度;1%琼脂糖凝胶电泳仪检测完整度;Promega逆转录试剂盒反转录合成cDNA链;(3)根据NCBI数据库所公布的p53和p21基因的序列信息设计引物:
p53-F:5'-TTCTACAGTTGGGCAGCT-3',
p53-R:5'-GCAGTAAGCCAAGATCAC-3';
p21-F:5'-TGGTGGCAGTAGAGGCTATG-3',
p21-R:5'-AGTCCAGGCCAGTATGTTAC-3';
定量PCR仪扩增目的基因,获得并且分析扩增曲线和熔解曲线。
1.2.5 蛋白质印迹法检测P53,P21,MDM2,Bax,PUMA和Caspase3蛋白表达取1.2.4(1)处理过的细胞,用PBS冲洗,在冰上充分裂解后,置于4 ℃下14 000 r/min离心(r=6.41 cm)5 min,取上清液,加入上样缓冲液沸水中煮沸10 min,进行SDS-PAGE电泳,低温条件下,100 V恒压转膜60~120 min,取出膜封闭1 h,加一抗稀释液4 ℃过夜,次日加入相应二抗稀释液37 ℃孵育1 h,放至暗盒,显影。
1.2.6 流式细胞Annexin V/PI双染色法检测细胞凋亡取对数增长期U87细胞接种于6孔板过夜,弃上清,按1.2.2项分组处理细胞,每组设3个复孔,培养48 h后,将培养板上各组培养基分别转移带15 mL锥形管中并置于冰上备用;PBS润洗细胞,胰酶消化后将细胞重悬于上一步所得培养基中;把细胞悬液转移至一干净离心管,加入1.25 μL Annexin V-FITC,室温(18~24 ℃)避光反应15 min;室温2349 r/min离心(r=16.2 cm)5 min,去除上清,用0.5 mL结合缓冲液重悬后加入10 μL碘化丙啶(PI);立即用流式细胞仪检测细胞凋亡。
1.2.7 克隆形成实验用5 μmol/L RITA,10 μmol/LTMZ和2.5 μmol/L RITA+10 μmol/L TMZ处理细胞;用胰酶消化收集不同处理组的细胞,用1 mL培养基重悬细胞计数,调整细胞浓度到1×103/mL,接种于96孔板,吸50 μL、100 μL、200 μL接种,各孔补加培养基使每孔终体积为300 μL,各组均设3个复孔,同时设DMSO对照组;培养7 d后吸去各孔培养基,PBS漂洗2次,各孔加入200 μL结晶紫染色液并充分覆盖孔低,20 min后将96孔板置于水下冲洗,晾干后计算集落数;使用酶联斑点图像自动分析仪分析,扫描拍照。
1.3 统计学方法肿瘤细胞抑制率(IR)=(1-实验组A值均值÷对照组A值均值)×100%(同一时间)。SPSS20.0对实验数据进行统计学整理和分析。实验结果数据以均数±标准差表示,两样本显著性比较用独立样本t检验,相关性分析用线性回归,双侧P < 0.05为差异有统计学意义。
2 结果 2.1 RITA、TMZ单独及联合应用时对U87细胞增殖的影响MTS结果经计算到各处理组U87细胞增殖率和抑制率变化(图 1),单用RITA对U87细胞存活有显著的抑制作用(P=0.000),1、5、10、20 μmol/L RITA作用72 h细胞抑制率分别为25.94%、31.58%、38.16%和41.38%,药物反应敏感,抑制作用随浓度和时间增加而增强。浓度≥5 μmol/L时TMZ对U87细胞存活也有抑制作用(P=0.012),1、5、10、20 μmol/L TMZ作用72 h细胞抑制率分别为3.84%、5.55%、6.46%和8.20%,效果不及RITA单用时显著。对RITA和TMZ浓度减半后进行药物敏感试验,联合用药的结果是细胞存活抑制显著(P=0.000),抑制率率高于TMZ或RITA的单用(除1 μmol/LRITA对比1 μmol/L(RITA+TMZ)差异不显著,其余对比P < 0.01),1、5、10、20 μmol/L RITA+TMZ作用72 h细胞抑制率分别为29.21%、38.59%、44.67%和52.11%,且非二者药效的简单相加,同时存在与浓度和作用时间的正相关。
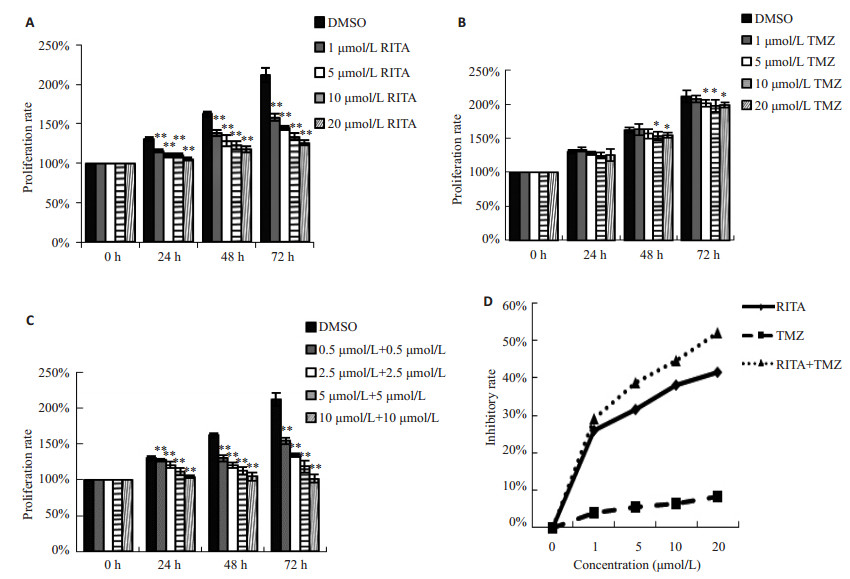
|
图 1 单用RITA、TMZ及二者联用对U87细胞增殖的影响 Figure 1 Effect of RITA (A), TMZ (B) and RITA +TMZ (C) on proliferation of U87 cells. D: Inhibitory rate of U87 cells treated with different doses of the drugs at 72 h (Mean±SD, n=4). *P < 0.05, **P < 0.01 vs DMSO group. |
联合用药时,计算合并效应,采用q值判断联用效果。根据金正均法,也称概率相加法:q=EA+B/(EA+EB-EA·EB)。(注:EA代表A单独给药时的效应,EB代表B药单独给药时的效应,EA+B代表A、B两药合并给药后的效应,它是两药合并效应的期望值)。q值的意义:0.85~1.15为单纯相加;1.15~20为增强;大于20为显著增强;0.85~0.55为拮抗;小于0.55为明显拮抗。RITA和TMZ联合作用计算的q值结果如表 1所示。最适宜的联用作用浓度组合是5 μmol/L RITA+5 μmol/LTMZ,时间为作用后的48 h。
| 表 1 RITA和TMZ联合作用的q值计算 Table 1 q values of combined effect of RITA and TMZ |
qRT-PCR法数据经计算处理后结果(图 2)表明,与DMSO组对比,RITA组和RITA+TMZ组肿瘤凋亡相关基因p53和p21 mRNA表达均增加,尤以RITA和TMZ二者联用效果更为显著。其中p21表达量与浓度呈正相关(RITA组:F=632.793,RR=0.997,P=0.025;RITA+TMZ组:F=374.488,RR=0.995,P=0.033)。单用TMZ组p53 mRNA表达量变化不显著,p21表达量增加但不及单用RITA(P < 0.01)和二者联用(P < 0.01)显著。
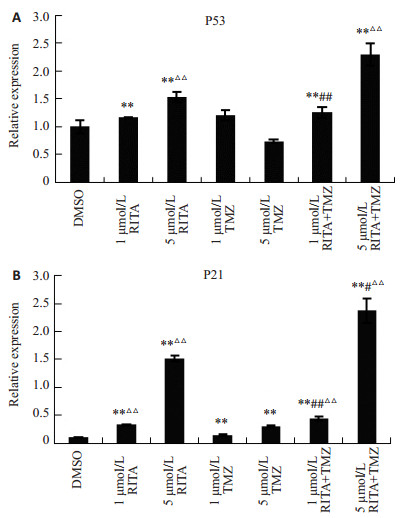
|
图 2 单用RITA、TMZ及二者联用对U87细胞中p53(A)和p21(B)基因mRNA相对表达量的影响 Figure 2 Relative expression of p53 (A) and p21 (B) mRNA in U87 cells treated with RITA, TMZ and RITA + TMZ (Mean±SD, n=3). **P < 0.01 vs DMSO group; #P < 0.05, ##P < 0.01 vs RITA group; △△P < 0.01 vs TMZ group. |
Western blotting结果显示,5 μmol/L RITA组和RITA+TMZ组肿瘤凋亡相关蛋白P53, P21,MDM2,Bax,PUMA和Caspase3蛋白表达量均明显增多,1 μmol/L RITA组P53、PUMA和Bax表达量略有减少,TMZ组各蛋白表达量变化不明显或略有减少(图 3)。qRT-PCR法和western blotting法结果均表明RITA联合TMZ能有效提高肿瘤凋亡相关蛋白质P53,P21和PUMA等的表达。
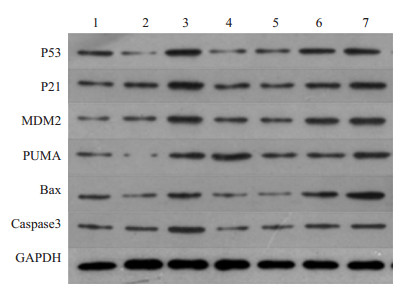
|
图 3 Western blotting检测U87细胞中P53, P21,MDM2, Bax, PUMA和caspase3蛋白表达结果 Figure 3 Western blotting of P53, P21, MDM2, Bax, PUMA and caspase-3 proteins in U87 cells. 1: DMSO; 2: 1 μmol/L RITA; 3: 5 μmol/L RITA; 4: 1 μmol/L TMZ; 5: 5 μmol/L TMZ; 6: 1 μmol/L (RITA+TMZ); 7: 5 μmol/L (RITA+TMZ). |
流式细胞术Annexin V/PI双染色法检测细胞凋亡结果显示,单用TMZ组细胞早期凋亡率略有增多但不显著,而单用RITA组和二者联用组则有低、高浓度早期凋亡率降低,中等浓度明显增高的现象,与单用RITA/TMZ相比,5 μmol/L RITA+5 μmol/L TMZ效果最显著(P < 0.01,P < 0.05,图 4)。与DMSO组对比,单用RITA,TMZ以及二者联用均能使U87细胞晚期凋亡及坏死率明显增多(P均 < 0.01),1 μmol/L TMZ组高于1 μmol/L RITA组(P < 0.01),联用组合以10 μmol/L RITA+10 μmol/LTMZ效果最显著。结果表明,在实验浓度范围内,TMZ促细胞凋亡作用受浓度影响较小,中等浓度RITA促细胞早期凋亡作用较强而高浓度RITA促细胞晚期凋亡及坏死作用较显著。
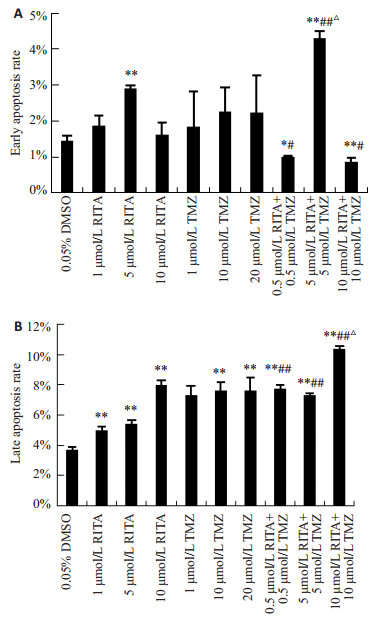
|
图 4 RITA、TMZ以及二者联用对U87细胞凋亡的影响 Figure 4 Effect of RITA, TMZ and RITA + TMZ on U87 cells apoptosis. A: Early apoptosis rate; B: Late apoptosis rate. (Mean±SD, n=3). *P < 0.05, **P < 0.01 vs DMSO group; #P < 0.05, ##P < 0.01 vs RITA group; △P < 0.05 vs TMZ group. |
与DMSO组对比,5 μmol/L RITA处理组(P=0.000)和10 μmol/L TMZ处理组(P=0.000)细胞克隆均减少,克隆形成率分别为DMSO组(119±14)%,RITA组(82±12)%,TMZ组(76±11)%。与单用RITA和TMZ相比,2.5 μmol/L RITA与10 μmol/L TMZ联用可明显减少细胞克隆(P=0.000和P=0.000),克隆形成率为(46±6)%。表明RITA与TMZ联用具有增强细胞增殖抑制的作用。
3 讨论本实验结果表明,与单用RITA/TMZ相比,RITA联用TMZ具有更高效抑制U87细胞增殖、克隆形成,促进细胞凋亡的作用。在实验浓度(≤20 μmol/L)下,抑癌小分子RITA对人脑胶质瘤细胞的生长抑制作用明显强于目前临床常用抗癌药替莫唑胺,能有效地抑制细胞增殖。与单用TMZ相比,RITA协同TMZ可有效抑制U87细胞增殖,促进肿瘤凋亡相关基因p53,p21,mdm2,bax,puma和caspase3基因的表达,具有显著促细胞凋亡作用。通过q值计算得出二者联用具有较显著的增强效果。同时,我们发现在本实验各浓度组中5 μmol/LRITA联合5 μmol/L TMZ促凋亡作用和联用效果最佳。为了平行比较药物作用的敏感性,本实验中选用了替莫唑胺低剂量的实验浓度,该浓度小于其有效治疗浓度。
替莫唑胺仍是目前人脑胶质瘤手术后主要的化疗药物,但总体预后不乐观[4],进一步在脑胶质瘤治疗中寻找和确定靶向促细胞凋亡、抗凋亡因子和多种细胞周期调节的靶标或药物具有重要意义[8-9],也是近年来的研究热点。研究表明[6, 10-11],RITA在机体内,能通过激活p53,发挥抑癌基因p53的正性调控机理来抑癌,也能通过与p53通路的相关蛋白(如ASK1、HIPK2等)结合,切断关键致癌路径上抗凋亡蛋白Mcl-1,Bcl-2,MAP4和生成素的表达水平,阻断AKt通路、并下调c-Myc,cyclin E,和β-catenin相关蛋白来起作用。野生型p53基因具有阻滞细胞周期、诱导细胞凋亡、维持基因组稳定和抑制肿瘤血管生成等作用[12]。p21是位于p53基因下游的细胞周期素依赖性激酶抑制因子,可与p53共同构成细胞周期G1检查站,p21可通过p53依赖凋亡途径激活,发挥促凋亡作[13],实验中RITA作用后p53,p21基因表达增加。尤其是p21,可能与RITA促进p53表达后通过p53依赖凋亡途径迅速诱导大量P21蛋白表达有关。人体中发生的所有恶性肿瘤中,有一半以上会发生p53基因的突变或缺失,且突变型p53可通过上调肿瘤细胞内MGMT蛋白的表达从而使细胞对替莫唑胺等抗癌药物产生耐受[14-16],p53功能的缺失还可导致脑胶质瘤细胞的放射抵抗[17]。研究表明,RITA对含突变型p53基因的U251脑胶质瘤细胞有较强的抑制作用[18-19]且可增强宫颈癌原代细胞的体外放射敏感性[20]。本实验中RITA和TMZ联用的协同效应初步表明RITA可能具有提高脑胶质瘤细胞U87对TMZ敏感性的作用。从实验结果可以看出RITA作用后细胞中p53表达增加,通过本实验和相关文献可以推断,RITA协同TMZ作用于脑胶质瘤细胞后抑制作用的增强可能与细胞内p53基因的(重新)激活有关。先前研究表明RITA对正常细胞的毒性作用低于对肿瘤细胞,且不表现出明显的副作用和基因毒性[21-22]。
综合文献调查,当前RITA以及RITA与替莫唑胺的联合治疗尚没有在人脑胶质瘤细胞中展开。本实验通过利用MTS检测技术、qRT-PCR mRNA定量技术、Western蛋白质印迹法和流式细胞检测细胞凋亡等技术,探讨出RITA单用、以及RITA联用TMZ能有效抑制人脑质瘤细胞U87的增殖、克隆形成以及促进细胞凋亡,且RITA上调P53蛋白表达、提高肿瘤细胞对替莫唑胺敏感性的作用提示,RITA在脑胶质瘤临床治疗的应用对解决肿瘤耐药性和放射抵抗性问题具有重要意义和前景。实验结果表明在U87细胞中RITA作为靶向抗癌药具有高效、敏感的特点,与替莫唑胺药物联用后抗癌协同作用更强。该结果为进一步RITA临床药物治疗脑胶质瘤提供实验依据,也为替莫唑胺与药物联用后提高其药效提供参考。
| [1] | Reardon DA, Rich JN, Friedman HS, et al. Recent advances in the treatment of malignant astrocytoma[J]. J Clin Oncol,2006, 24 (8) : 1253-65. DOI: 10.1200/JCO.2005.04.5302. |
| [2] | 张勇, 马继伟, 李海莹, 等. 替莫唑胺联合粉防己碱对人脑胶质瘤U87细胞的抑制作用[J]. 中国药理学与毒理学杂志,2014, 28 (3) : 367-72. |
| [3] | 郭珊珊, 阎昭. 替莫唑胺治疗脑胶质瘤耐药机制的研究进展[J]. 药物评价研究,2014, 37 (6) : 561-5. |
| [4] | Thomas AA, Brennan CW, Deangelis LM. Emerging therapies for glioblastoma[J]. JAMA Neurol,2014, 71 (11) : 1437-44. DOI: 10.1001/jamaneurol.2014.1701. |
| [5] | Zhao CY, Szekely L, Bao WJ, et al. Rescue of p53 function by Small-Molecule RITA in cervical carcinoma by blocking E6-Mediated degradation[J]. Cancer Res,2010, 70 (8) : 3372-81. DOI: 10.1158/0008-5472.CAN-09-2787. |
| [6] | Issaeva N, Bozko P, Enge M, et al. Small molecule RITA binds to p53, blocks p53-HDM-2 interaction and activates p53 function in tumors[J]. Nat Med,2004, 10 (12) : 1321-8. DOI: 10.1038/nm1146. |
| [7] | Girardini JE, Del Sal G. Improving pharmacological rescue of p53 function:RITA targets mutant p53[J]. Cell Cycle,2014, 9 (11) : 2062. |
| [8] | Wang GX, Dai F, Yu K, et al. Resveratrol inhibits glioma cell growth via targeting oncogenic microRNAs and multiple signaling pathways[J]. Int J Oncol,2015, 46 (4) : 1739-47. |
| [9] | Kim EL, Wüstenberg R, Rübsam A, et al. Chloroquine activates the p53 pathway and induces apoptosis in human glioma cells[J]. Neuro Oncol,2010, 12 (4) : 389-400. DOI: 10.1093/neuonc/nop046. |
| [10] | Stegh AH. Targeting the p53 signaling pathway in cancer therapythe promises, challenges and perils[J]. Expert Opin Ther Targets,2012, 16 (1) : 67-83. DOI: 10.1517/14728222.2011.643299. |
| [11] | Surqet S, Descamps G, Brosseau C, et al. RITA(Reactivating p53 and inducing tumor apoptosis)is efficient against TP53abnormal myeloma cells independently of the p53 pathway[J]. BMC Cancer,2014, 14 : 437. DOI: 10.1186/1471-2407-14-437. |
| [12] | 李文娟, 潘庆杰, 李美玉. p53基因及其功能研究进展[J]. 生物技术通讯,2014, 25 (2) : 282-5. |
| [13] | 付晶晶, 万福生. p53上调凋亡调制物的促凋亡作用[J]. 生命的化学,2010, 30 (2) : 286-90. |
| [14] | 王翔, 刘艳辉, 毛庆, 等.突变P53对人脑胶质母细胞瘤化疗敏感性和耐药性的影响及作用机制[C]//中国医师协会神经外科医师分会第六届全国代表大会论文编汇, 2011:115-6. |
| [15] | Luo H, Chen ZX, Wang S, et al. c-Myc-miR-29c-REV3L signalling pathway drives the acquisition of temozolomide resistance in glioblastoma[J]. Brain,2015, 138 (12) : 3654-72. DOI: 10.1093/brain/awv287. |
| [16] | Hegi ME, Diserens AC, Gorlia T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma[J]. N Engl J Med,2005, 352 (10) : 997-1003. DOI: 10.1056/NEJMoa043331. |
| [17] | Dokic I, Mairani A, Brons S, et al. High resistance to X-rays and therapeutic carbon ions in glioblastoma cells bearing dysfunctional ATM associates with intrinsic chromosomal instability[J]. Int J Radiat Biol,2015, 91 (2) : 157-65. DOI: 10.3109/09553002.2014.937511. |
| [18] | 冯小丽, 何小艳, 吴清华, 等. 检测肿瘤凋亡和p53再生化合物对不同p53状态人脑胶质瘤细胞的生长抑制作用[J]. 中国卫生检验,2016, 26 (13) : 1825-8. |
| [19] | Miao W, Liu XD, Wang HQ, et al. p53 upregulated modulator of apoptosis sensitizes drug-resistant U251 glioblastoma stem cells to temozolomide through enhanced apoptosis[J]. Mol Med Rep,2015, 11 (6) : 4165-73. |
| [20] | 伍岳. P53-靶向小分子Rita对宫颈癌原代细胞体外放射增敏的初步研究[D].长沙:中南大学, 2013. |
| [21] | Zhao CY, Szekely L, Bao W, et al. Rescue of p53 function by small-molecule RITA in cervical carcinoma by blocking E6-mediated degradation[J]. Cancer Res,2010, 70 (8) : 3372-81. DOI: 10.1158/0008-5472.CAN-09-2787. |
| [22] | Issaeva N, Bozko P, Enge M, et al. Small molecule RITA binds to p53, blocks p53-HDM-2 interaction and activates p53 function in tumors[J]. Nat Med,2004, 10 (12) : 1321-8. DOI: 10.1038/nm1146. |
 2016, Vol. 36
2016, Vol. 36
