2. 浙江大学第四附属医院口腔科, 浙江义乌 322000 ;
3. 蚌埠医学院人体解剖学教研室, 安徽蚌埠 233030 ;
4. 蚌埠医学院组织移植安徽省重点实验室, 安徽蚌埠 233030
2. Department of Stomatology, Fourth Affiliated Hospital of Zhejiang University, Yiwu 322000, China ;
3. Department of Anatomy, Bengbu Medical College, Bengbu 233030, China ;
4. Anhui Key Laboratory of Tissue Transplantation, Bengbu 233030, China
阿尔茨海默病(AD)是一种老年人群中常见的神经退行性疾病,早期临床表现主要是对近期事件进行性记忆力减退等。β-淀粉样蛋白(β-amyloid, Aβ)异常沉积引起的慢性神经炎性反应是AD形成和发展的关键因素[1]。AD早期就有突触的丢失等,晚期尤甚,并与认知障碍密切相关[2-3]。
二烯丙基二硫(DADS)是大蒜中的一种脂溶性的有效成分,在大蒜油中占60% [4]。DADS具有抗氧化,抗炎和抗凋亡效应[5],大蒜提取物在AD转基因模型Tg2576中抑制炎性反应,抑制Tau蛋白的缠结和抑制淀粉样蛋白的形成[6],可以减轻脂多糖诱导的记忆力的下降,减轻胶质细胞的活化、炎性介质的表达等[7]。
DADS能否改变AD模型小鼠脑内的病理变化,引起海马内神经元突触结构和功能的改变,改善AD模型小鼠的学习记忆能力,国内外鲜有报道。
本文通过对AD模型鼠灌服DADS一个月后,检测小鼠的学习记忆能力和海马神经元树突棘和突触的形态结构和突触相关蛋白和基因的表达,探讨DADS对AD模型小鼠学习记忆能力及海马突触的影响。
1 材料和方法 1.1 实验动物和分组采用8~10周雄性昆明小鼠(体质量22~25 g)48只,蚌埠医学院实验动物中心提供。
侧脑室立体定位[4]注射3 μL凝聚态[5]的Aβ1-42作为模型组,对照组注射等剂量的生理盐水,21 d后Morris水迷宫进行学习记忆能力检测,学习记忆能力低下者为造模成功的小鼠,随后进行后续实验。将造模成功的小鼠随机分成4组,分别给予DADS溶液0、10、50和100 mg/kg/d灌胃处理,每组10只,1个月后进行Morris水迷宫检测,取海马组织进行银染、电镜、蛋白印迹和RT-PCR检测。
1.2 主要试剂和仪器Aβ1-42:Sigma公司产品,配制成1 mg/mL浓度-20 ℃保存,用前37 ℃孵育1周形成凝聚态的Aβ1-42;DADS:Sigma公司产品,纯度80%。小鼠单克隆抗GAPDH抗体(碧云天)、兔多克隆抗PSD95抗体(Cell SignalingTechnology, CST)、兔多克隆抗SYP抗体(CST)。脑立体定位仪(淮北正华)等。
1.3 Morris水迷宫Morris水迷宫实验历时4 d,每天上午和下午2个时段,每时段训练2次。小鼠运动轨迹由水迷宫上方连接于显示系统的摄像机采集。训练时固定一个象限的入水点,将小鼠面向池壁放入水中,观察并记录在60 s内找到隐形平台的时间(逃避潜伏期),30 min后再选择和第一个象限与平台等距离的另一个象限点,观察小鼠找到平台的时间。下午重复上午实验内容。如果小鼠在60 s内未能找到平台,则人为引导至平台停留10 s后移开,时间记为60 s。
1.4 银染(Golgi改良法)参照康亚妮等[10]Golgi改良法的浸银染色,各组小鼠常规灌注、脑组织后固定、修块、3.5%重铬酸钾铬化4 d、1.5% AgNO3双蒸水溶液浸银1周、常规脱水透明、石蜡包埋和切片、脱蜡和封片。
1.5 电镜检测常规灌注取材后,将脑组织冠状切开,选取CA1区修成1 mm3小块,固定于2.5%戊二醛固定液内。后经过1%锇酸固定,常规的乙醇脱水、环氧树脂包埋。瑞典产LKB-NOVA型超薄切片机进行70 nm厚超薄切片,醋酸铀和枸橼酸铅染色后,日产JEM-1230型透射电镜进行观察摄片。
1.6 蛋白印迹检测 1.6.1 样品的制备将小鼠麻醉后,右侧颈静脉放血,剪开脑部皮肤和颅骨,去除脑膜,分离出海马,经清洗后,置于含有蛋白酶抑制剂的RIPA裂解液中,按1 mL裂解液/100 mg海马组织加入,匀浆后冰上静置30 min;12 000 r/min 4 ℃离心30 min;取上清液,小部分用于蛋白质浓度的测定(BCA法测定),大部分置-80 ℃冰箱中备用。
1.6.2 Western blotting根据测得的蛋白质浓度,计算出各样品的上样量。常规电泳和转膜后,用5%脱脂牛奶封闭,加抗PSD95抗体或抗SYP抗体等一抗4 ℃孵育过夜。漂洗后,用HRP标记的二抗室温下孵育2 h。ECL发光液孵育、全自动凝胶成像系统(Image Lab 3.0)拍照保存。用GIS凝胶图像分析软件读取目的蛋白PSD95、SYP和内参GAPDH条带的灰度值,目的蛋白灰度值和GAPDH灰度值的比值,经归一调整后,作为目的蛋白表达的相对水平。
1.7 RT-PCR检测采用Trizol一步法提取各组双侧海马组织总RNA,逆转录合成c DNA,以为c DNA模板,进行PCR扩增。扩增条件:94 ℃预变性3 min;94 ℃ 30s变性;β-actin 58 ℃ 30 s;PSD95 60 ℃ 30 s;SYP 61.7 ℃ 30 s退火;72 ℃,45 s延伸;35个循环;72 ℃,8 min。将PCR扩增产物与溴酚兰混匀,于1.5%琼脂糖凝胶电泳,溴化乙锭显色。在GIS凝胶图像处理系统中拍摄保存,并使用图象分析软件行读取灰度值作半定量分析,以目的基因的灰度值与β-actin灰度值之比,经归一调整后,作为目的基因PSD95和SYP mRNA的相对表达。
引物的设计与合成:由上海生工生物公司合成,引物序列如表 1。
| 表 1 RT-PCR引物序列表 Table 1 Primer sequences used for RT-PCR (bp) |
实验数据用SPSS l3.0的软件进行统计学分析,结果用均数±标准差表示。样本均数的比较用单因素方差分析(ANOVA),两两比较用LSD检验。数据之间的差异,P < 0.05,认为差异有统计学意义。
2 结果 2.1 Morris水迷宫检测Morris水迷宫检测结果(表 2)显示,和模型组相比,低剂量DADS1组小鼠逃避潜伏期虽有所下降,但无统计学意义(P > 0.05),中剂量DADS2组和高剂量DADS3组的逃避潜伏期显著下降,差异有统计学意义(△P < 0.05;△△P < 0.01)。
| 表 2 Morris水迷宫检测结果 Table 2 Escape latency in Morris water maze test in different groups (Mean±SD) |
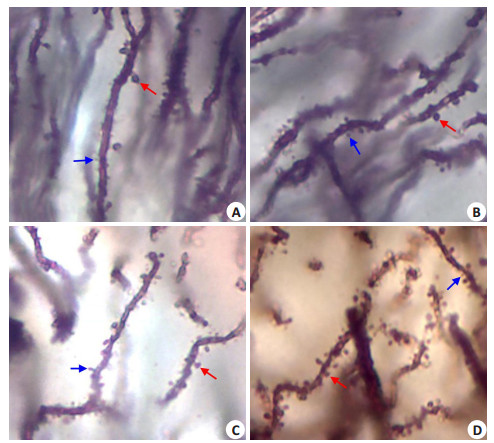
小鼠海马CA1区银染检测结果(图 1)显示,模型组小鼠树突上细小的丝状突起较多,球团状树突棘(直径在1.5~2 μm)数量较少(1.92±0.65/20 μm树突);低剂量DADS1组小鼠树突上丝状突起增粗,末端常增厚,球团状树突棘数量较少(2.28±0.74/20 μm树突,P > 0.05 vsModel group);中剂量DADS2组和高剂量DADS3组小鼠丝状突起较少,球团状树突棘明显增多(3.06±0.92和4.61±0.90/20 μm树突,P < 0.01 vs Model group)。
|
图 1 银染(Golgi改良法)检测 Figure 1 The silver staining (Golgi modified) detection (Original magnification: ×1000).A: Model group; B: DADS1 group; C: DADS2 group; D: DADS3 group. Red arrow indicates pellet liked process (Dendritic spine). Blue arrow indicates filamentose process. |
电镜检测结果(图 2)显示,模型组小鼠突触前、后膜清楚较厚,突触间隙清晰可见,突触小泡结构清楚、数量较多(典型的稳定型兴奋性突触),突触较少;DADS1组小鼠突触体积较小,突触前、后膜和突触间隙结构不清,突触小泡较少,突触较多。DADS2组和DADS3组小鼠,既有较多结构典型的稳定型兴奋性突触,也有较多的突触前、后膜和突触间隙不清楚,突触小泡较少的突触。

|
图 2 透射电镜检测 Figure 2 The transmission electron microscope detection (× 40 000). A: Model group; B: DADS1 group; C: DADS2 group; D:DADS3 group. Red arrow indicates the presynaptic membrane. Blue arrow indicates the postsynaptic membrane. Rose round indicates synaptic vesicles. Hollow arrow indicates structure unclear synapse. |
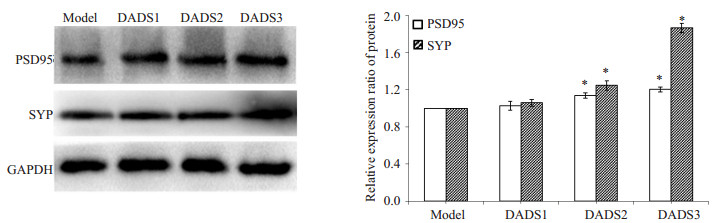
Western blot检测结果(图 3)显示,和模型组小鼠相比,DADS1组小鼠PSD95和SYP蛋白表达相对水平有所增加,但差异没有统计学意义(P > 0.05);DADS2组和DADS3组小鼠PSD95和SYP蛋白表达相对水平显著增多,差异有统计学意义(P < 0.01)。
|
图 3 蛋白印迹检测 Figure 3 Western blotting for detecting SYP and PSD95 expression in the hippocampus of the mice. *P < 0.01 vs model group. |
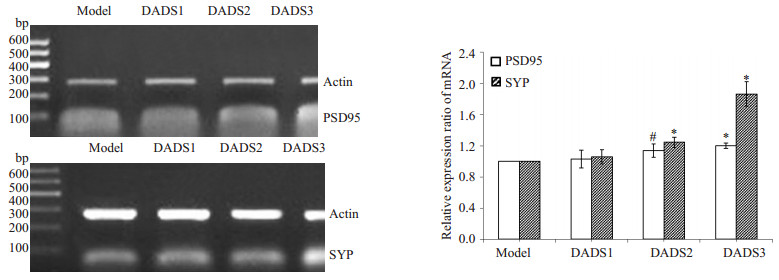
RT-PCR检测结果(图 4)显示,和模型组小鼠相比,DADS1组小鼠PSD95 mRNA表达相对水平有所增加,但差异没有统计学意义(P > 0.05);DADS2组和DADS3组小鼠PSD95 mRNA表达相对水平显著增多,差异有统计学意义(#P < 0.05和*P < 0.01)。
|
图 4 RT-PCR检测 Figure 4 RT-PCR detection of mRNA expressions of SYP and PSD95 in the hippocampus of the mice. #P < 0.05, *P < 0.01 vs model group. |
RT-PCR检测结果(图 4)显示,和模型组小鼠相比,DADS1组小鼠SYP mRNA表达相对水平有所增加,但差异没有统计学意义(P > 0.05);DADS2组和DADS3组小鼠SYP mRNA表达相对水平显著增多,差异有统计学意义(*P < 0.01)。
3 讨论 3.1 DADS改善AD模型小鼠学习记忆能力AD是老年人群中最常见的也是最重要的一种神经退行性疾病,临床上以进行性认知功能障碍,特别是空间学习记忆能力的进行性丧失为主要特点。Aβ异常沉积引起的慢性神经炎性反应是AD形成和发展的关键因素[1]。本文通过凝集态Aβ1-42侧脑室注射制备动物模型,经Morris水迷宫检测,小鼠的学习记忆能力低下者为AD模型小鼠。
DADS是大蒜中的一种脂溶性的有效成分,在大蒜油中占60%,同系衍生物还有二烯丙基一硫和二烯丙基三硫等[4]。DADS对受到氧化应激损伤的PC细胞具有保护作用[11]。DADS具有抗氧化,抗炎和抗凋亡效应[5]。本文采用不同浓度的DADS灌胃处理AD模型小鼠一个月后,经Morris水迷宫检测结果显示,中高剂量的DADS组小鼠的学习记忆能力增强,说明灌服一定剂量的DADS一定时期后可以改善AD模型小鼠的学习记忆能力。这和大蒜中分离出来的含硫化合物可以减轻脂多糖诱导的记忆力下降[7]的功能相似。以上资料表明,DADS可以改善AD模型小鼠的学习记忆能力,可能通过抑制AD脑内的炎症、氧化应激或凋亡等途径对AD模型小鼠起到预防和治疗的作用。
3.2 DADS调节AD模型小鼠海马突触的可塑性海马是大脑皮质边缘系统的一个重要脑区,在学习记忆与空间记忆方面发挥着重要作用,而海马CA1区则是突触后可塑性形成的关键部位[12]。树突棘作为突触后的主要结构,参与了绝大部分兴奋性突触的组成,其形态变化及动态活动均可影响突触后可塑性[13]。本文Golgi染色结果表明,随着DADS剂量的增加,AD模型小鼠海马CA1区神经元上较多的丝状突起逐渐转变形成球团状树突棘。这和刘畅等的观点相似,他们认为树突棘的发育经历了一个从无到有,从细长的丝状伪足结构逐渐变短变宽,最后至成熟蘑菇形结构的变化过程[14]。
树突棘的发育是一个与突触的形成和发生相互关联的过程,树突棘从开始形成到成熟就一直在不断进行着活跃的动态变化,以此来调节突触后的可塑性[14]。近年来研究表明,AD早期就有突触的丢失发生,在晚期尤甚,并与认知障碍密切相关[2-3]。本文电镜结果显示,AD模型组小鼠突触数量较少,但突触前后膜和突触小泡结构清晰;中高剂量的DADS组小鼠突触数量有所增多,既有结构典型的突触,也有较多的新生突触。这表明DADS可以调节AD模型小鼠海马CA1区突触的可塑性。
3.3 DADS升高AD模型小鼠脑内突触蛋白的表达量突触后密度蛋白-95(postsynaptic density protein-95, PSD-95)是兴奋性突触中最有特征的突触蛋白,因SDS电泳的相对分子质量为90~95 000而命名,是PSD中最丰富的蛋白之一,存在于所有皮层结构中,包括小脑,大脑皮层和海马等[15]。突触素(SYP),是一种相对分子质量为38 000的钙结合蛋白,特异性存在于突触前成分的突触囊泡膜上,参与通道的形成,囊泡的转运、导入和融合,Ca2+依赖性神经递质的释放,参与突触囊泡的再循环维持突触的功能。SYP的表达和突触的形成是一致的,突触重建时SYP含量明显增多。SYP作为突触囊泡膜的分子标记,其表达的水平能有效地反映突触的结构和功能状态[16-17]。SYP和PSD-95为突触功能的分子标志,分别代表了突触前和突触后的可塑性过程,在突触可塑性中发挥作用。突触可塑性过程是突触前和后的统一和相互促进,从而引起学习及记忆的发生[15]。
AD病人和模型小鼠海马内突触的数量、密度[2-3]及突触蛋白PSD95 [18]和SYP等表达降低[19-20]。本文研究结果显示,DADS灌服一个月后,和AD模型组小鼠相比,海马内PSD95和SYP表达增多。这说明,DADS可改善AD模型小鼠海马内突触受损的状态,调节突触的可塑性,改善突触的结构和功能,可能对AD起到预防和治疗的作用。
| [1] | 胡小令, 桂婷, 黄涛波, 等. 雷公藤内酯醇对阿尔茨海默病模型大鼠海马iNOS表达和突触超微结构的影响[J]. 中国老年学杂志,2014, 34 (22) : 6379-81. |
| [2] | Selkoe DJ. Alzheimer's disease is a synaptic failure[J]. Science,2002, 298 (5594) : 789-91. DOI: 10.1126/science.1074069. |
| [3] | Coleman P, Federoff H, Kurlan R. A focus on the synapse for neuroprotection in Alzheimer disease and other dementias[J]. Neurology,2004, 63 (7) : 1155-62. DOI: 10.1212/01.WNL.0000140626.48118.0A. |
| [4] | 尹珊辉, 潘德锋, 王刚, 等. 二烯丙基二硫对人白血病K562细胞增殖及Bcl-2表达的影响[J]. 现代生物医学进展,2010, 10 (13) : 2435-8. |
| [5] | Chauhan NB. Multiplicity of garlic health effects and Alzheimer's disease[J]. J Nutr Health Aging,2006, 9 (6) : 421-32. |
| [6] | Chauhan NB. Effect of aged garlic extract on APP processing and tau phosphorylation in Alzheimer's transgenic model Tg2576[J]. J Ethnopharmacol,2006, 108 (3) : 385-94. DOI: 10.1016/j.jep.2006.05.030. |
| [7] | Lin GH, Lee YJ, Choi DY, et al. Anti-amyloidogenic effect of thiacremonone through anti-inflamation in vitro and in vivo models[J]. J Alzheimers Dis,2012, 29 (3) : 659-76. |
| [8] | Maurice T, Lockhart BP, Privat A. Amnesia induced in mice by centrally administered beta-amyloid peptides involves cholinergic dysfunction[J]. Brain Res,1996, 706 (2) : 181-93. DOI: 10.1016/0006-8993(95)01032-7. |
| [9] | Yang SF, Yang ZQ, Zhou QX, et al. Effect of ecdysterone on the expression of c-fos in the brain of rats induced by microinjection beta-AP25-35 into the hippocampus[J]. Yao Xue Xue Bao,2004, 39 (4) : 241-4. |
| [10] | 康亚妮, 王世忠, 刘皓, 等. 石蜡切片浸银染色显示大脑皮质神经元的Golgi改良法[J]. 天津医科大学学报,2006, 12 (2) : 294-5. |
| [11] | Koh SH, Kwon H, Park KH, et al. Protective effect of diallyl disulfide on oxidative stress-injured neuronally differentiated PC12 cells[J]. Brain Res Mol Brain Res,2005, 133 (2) : 176-86. DOI: 10.1016/j.molbrainres.2004.10.006. |
| [12] | Hussain RJ, Carpenter DO. Development of synaptic responses and plasticity at the SC-CA1 and MF-CA3 synapses in rat hippocampus[J]. Cell Mol Neurobiol,2001, 21 (4) : 357-68. DOI: 10.1023/A:1012602105208. |
| [13] | Segal M. Dendritic spines, synaptic plasticity and neuronal survival:activity shapes dendritic spines to enhance neuronal viability[J]. Eur J Neurosci,2010, 31 (12) : 2178-84. DOI: 10.1111/(ISSN)1460-9568. |
| [14] | 刘畅, 范文娟, 程维杰, 等. 小鼠海马CA1区锥体神经元树突棘的发育[J]. 解剖学报,2012, 43 (1) : 1-6. |
| [15] | 刘立军, 黄昕艳, 刘爽, 等. Aβ25-35对原代培养小鼠皮层神经元突触素和PSD-95表达的影响[J]. 黑龙江医药科学,2012, 35 (2) : 50-1. |
| [16] | Butterfield DA. Amyloid beta-peptide[1-42]-associated free radical-induced oxidative stress and neurodegeneration in Alzheimer's disease brain:mechanisms and Consequences[J]. Curr Med Chem,2003, 10 (24) : 2651-9. DOI: 10.2174/0929867033456422. |
| [17] | Khvotchev MV, Südhof TC. Stimulus-dependent dynamic homoand heteromultimerization of synaptobrevin/VAMP and synapto physin[J]. Biochemistry,2004, 43 (47) : 15037-43. DOI: 10.1021/bi048290+. |
| [18] | 孙宏燕, 董联玲, 崔红燕, 等. 红景天对阿尔茨海默病模型大鼠行为学及海马区突触相关蛋白的影响[J]. 中西医结合心脑血管病杂志,2012, 10 (4) : 455-6. |
| [19] | 张晓裕, 何利明, 侯军代, 等. 去痴灵对AD模型小鼠学习记忆及脑内突触体素表达的影响[J]. 中国老年学杂志,2010, 30 (4) : 495-8. |
| [20] | 柴继侠, 姚君茹, 于剑锋, 等. Drebrin和SYP在APP/PS1转基因AD模型小鼠海马内的表达与认知障碍的关系[J]. 神经解剖学杂志,2009, 25 (3) : 273-8. |
 2016, Vol. 36
2016, Vol. 36
