2. 南方医科大学药学院, 广东广州 510515
2. School of Pharmaceutical Sciences, Southern Medical University, Guangzhou 510515, China
5-羟色胺5-HT是褪黑素MT的前体,也是一种神经递质、激素、细胞因子及生长因子;褪黑素是松果腺合成与分泌的吲哚类神经内分泌激素。既往研究显示:1六味地黄方对体外培养的人正常黑素细胞增殖及黑素合成因投药剂量不同而呈剂量-效应关系[1];2不同浓度六味地黄方含药血清对酪氨酸酶活性呈现双向调节作用[2]。人皮肤MC能产生5-羟色胺5-HT并将其转化成褪黑素MT,形成皮肤5-HTs/MTs。人体皮肤及人工培养的正常皮肤和病理性皮肤中均有5-HTs/MTs的表达[3],5-HT既可促进MC和AMMC的增殖,也可明显的抑制其生长,是通过受体介导的凋亡和增殖调节起作用,HIOMT、AANAT是最关键的限速酶[4-5]。许多学者已经关注到外界的信号因子很可能是通过MC膜表面的相关受体进入细胞内,发挥对MC增殖和分化调节[6-7]。在人黑素瘤细胞中,5-HT有抑制黑素生成的作用,呈剂量依赖方式[8]。MT也能抑制紫外线UV对皮肤细胞的损害和对UV辐射的细胞具有强烈的抗氧化作用,从而能促使黑素体聚集而抵御色素沉着[9-10]。
根据皮肤中的5-羟色胺/褪黑素能系统在不同应激状态下对黑素代谢呈上调或下调的特性,提出新的假设:六味地黄方通过皮肤中的5-羟色胺/褪黑素能系统发挥黑素的调节作用,5-HTs/褪黑素能系统可能是六味地黄方发挥量-效关系的中介物质基础。
1 材料和方法 1.1 试剂和材料 1.1.1 培养细胞所需试剂GentamicinCatalog no.15750,DispaseCatalog no.17105,Trypsin-EDTA、1×Catalog no.25300,Defined Trypsin IntitiforCatalog no.R-007-10,黑色素培养基254Catalog no. m254500,5-HTSigma,MTSigma,Trizol总RNA提取试剂sigma,HIOMT、AANAT引物上海杰瑞;甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。
1.1.2 主要材料和仪器CCK-8试剂盒日本同仁;iMark酶标仪BIO-RAD;LC-20A高效液相色谱仪日本岛津;IKAT18组织匀浆机;1/10万电子天平CP225D;SYBR Permix Ex TaqTM试剂盒TaKaRa;PrimeScriPtTM RT reagent KitPerfect Real Time逆转录试剂盒TaKaRa。
1.2 方法 1.2.1 六味地黄方含药血清的制备1中药汤剂制备:选用六味地黄方:A全方组:六味地黄方熟地黄24 g、泽泻9 g、山茱萸12 g、牡丹皮9 g、山药12 g、茯苓9 g;B对照组:生理盐水。将各种药物饮片浸泡30 min,煎煮2次,每次30 min,纱布粗滤去渣,全方药液浓缩为含生药2 g/mL;2给药剂量方式及采血方法:新西兰兔8只分为4组:生理盐水组,低剂量10 mL/kg,中剂量20 mL/kg,高剂量组40 mL/kg。每组2只。按体质量和分组剂量每日灌胃给药1次,连续7 d。心脏采集含药血液,静置分层后取含药血清,37 ℃灭菌30 min,微孔滤膜过滤,-80 ℃保存。
1.2.2 黑素细胞培养方法1将组织剪成小块,浸泡在1% PBS含双抗和20 µg/mL庆大霉素1 h;2再将组织浸泡在0.5%~1% Dispase过夜;3第2天将表皮和真皮分离,将表皮放入0.05%~0.1% Trypsin在37 ℃培养箱孵化15 min,加入等量的10%胰酶抑制剂;41000 g离心7 min,加入1% PBS洗1遍;5分别取3×106细胞放入75 cm2培养瓶,加入相应的黑色素细胞培养液和角质细胞培养液。
1.2.3 角质细胞与黑素细胞共同培养体系的构建取生长状态良好的角质细胞与黑素细胞,消化离心,重悬,计数。最终稀释角质细胞密度至1×105/mL,黑素细胞密度为2×104/mL,角质细胞和黑素细胞按1:5混合均匀,共同培养与6孔板中,2 d换液1次。培养液按照角质细胞和黑素细胞比例混合角质细胞和黑素细胞培养液。
1.2.4 含药血清体外对黑素细胞增殖的影响1细胞计数4×105/mL接96孔板每孔100 µL细胞悬液,将培养板在培养箱预培养24 h37 ℃,5% CO2条件下;2向培养板加入10 µL不同浓度的待测物质;3将培养板在培养箱孵育48 h;4向每孔加入10 µL CCK-8溶液;5培养箱内孵育2 h;6用酶标仪测定在450 nm处的吸光度。
1.2.5 高效液相色谱法检测5-HT含量取细胞悬液10 mL,加入1 mL 10%的TCA溶液匀浆1 min,10 000 r/min,4 ℃离心10 min,吸取上清液用0.45 μm的滤膜过滤;高效液相色谱检测,检测波长为275 nm;使用外标法定量。
1.2.6 高效液相色谱法检测MT含量1色谱条件:色谱柱C18150 mm×4.6 mm,5.0 umwaters公司;流动相为100 mmol/L乙酸铵-甲醇80:20,流量为0.8 mL/min,柱温:常温;检测波长为275 nm,进样量为10 μL;2对照品溶液制备:精密量取MT 10.0 mg,用1 mL甲醇将其溶于1.5 mL EP管中,再精确量取0.1 mL用0.9 mL甲醇稀释制成1.0 mg/mL MT对照品溶液储备液,稀释得到所需浓度。供试品溶液制备:取细胞悬液10 mL,13 000 r/min离心后,精密量取上清液1.0 mL,作为供试品溶液。
1.2.7 荧光实时定量PCR总RNA提取1细胞计数4× 105/mL接6孔板每孔3 mL细胞悬液,将培养板在培养箱预培养24 h37 ℃,5% CO2条件下。之后加入不同浓度的待测物质;2每孔加入Trizol 1 mL试剂,室温静置30 min;3匀浆液中加入200 μL氯仿,振荡混匀30 s;4室温下静置3 min至分层;54 ℃ 14 000 r/min离心15 min;6将上清液转移至1.5 mL RNase-free离心管里注意勿吸取任何中间层物质;7加入500 μL异丙醇至上清液中,轻轻颠倒,室温静置约10 min;84 ℃ 14 000 r/min离心10 min,之后小心将上清液移去,避免丢失RNA沉淀;9用70%的酒精洗涤2次,每次700 μL,4 ℃ 14 000 r/min离心5 min;10小心移去上清液,避免RNA沉淀丢失,室温放置待酒精完全挥发。11加入1 mL DEPC水配制无水乙醇,-70 ℃保存备用。12将沉淀用DEPC水溶解后,检测样品A260 nm和A280 nm的吸收值,检验纯度。13吸取10 μL的样品,加入190 μL DEPC水稀释后,测定样品吸光度A值,根据公式计算RNA浓度:RNA浓度μg/μL=A260 ×稀释倍数×40/1000μg/μL。
1.2.8 统计学分析以均数±标准差表示,运用SPSS 18.0软件进行统计学分析,多组间采用单因素方差分析,两组间差异采用t检验,P < 0.05为有统计学意义。
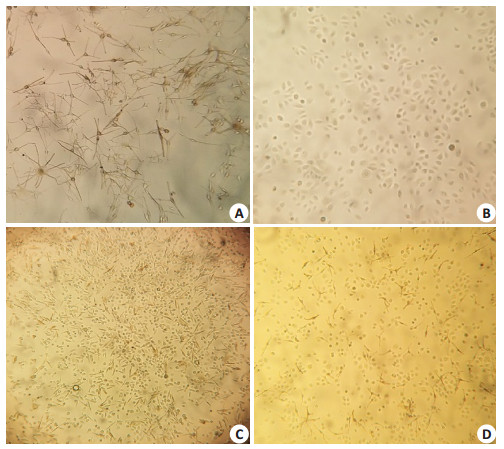
2 结果 2.1 人正常黑素细胞的培养及角质形成细胞共培养模型的建立黑素细胞最初生长缓慢,第3天开始生长速度加快,形成明显的树突,树突多为3~5个;角质形成细胞透明,呈多角形,大小及透光度一致,呈“铺路石”样排列。两种细胞混合培养后,细胞增殖速度较单独培养时快。黑素细胞树突与角质形成细胞分直接接触,形成类似表皮黑素单元结构图 1。
|
图 1 细胞培养结果 Figure 1 Cell culture observation (Original magnification: × 200). A: MC grown for 5 days; B: KC grown for 5 days; C: Cells co-cultured for 3 days; D: Cells co-cultured for 5 days. |
对于人正常黑素细胞与角质形成细胞共培养模型低浓度的含药血清对细胞增殖无影响,中高浓度的六味地黄方含药血清可以抑制共培养模型中细胞的增殖,特别是含药血清浓度为40%时对细胞增殖有显著抑制作用P < 0.05,表 1。
| 表 1 不同浓度六味地黄方对MC与角质形成细胞培养模型中细胞增殖的影响 Table 1 Effects of serum of rabbits fed with Liuwei Dihuang decoction at different concentrations on proliferation of human melanocytes co-cultured with keratinocytes (Mean±SD, n=4) |
对于人正常黑素细胞与角质形成细胞共培养模型中5-HT、MT含量均随含药血清浓度增加含量递减P < 0.05,浓度为40%则明显减少P < 0.01,表 2
| 表 2 不同浓度六味地黄方对MC与角质形成细胞培养模型中5-HTs、MT含量的影响 Table 2 Effects of serum of rabbits fed with Liuwei Dihuang decoction at different concentrations on 5-HTs and MT in melanocytes co-cultured with keratinocytes (Mean±SD) |
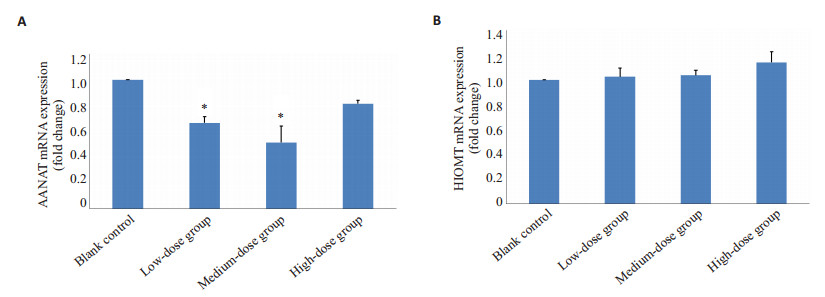
六味地黄方含药血清在低中浓度时对共培养模型中AANAT表达下调,呈浓度剂量依赖性的降低,有统计学意义(P < 0.05),高剂量含药血清对共培养模型中AANAT表达无影响;但六味地黄方含药血清对黑素细胞各用药剂量组HIOMT的mRNA含量无明显变化表 3。
|
图 2 不同浓度六味地黄方对MC与角质形成细胞培养模型中ANNAT、HIOMT活性的影响 Figure 2 Effects of serum of rabbits fed with Liuwei Dihuang decoction at different concentrations on ANNAT and HIOMT activities in human melanocytes co-cultured with keratinocytes. A: Effects of Liuwei Dihuang decoction of different concentration onthe rate limiting enzyme ANNAT; B: Effects of Liuwei Dihuang decoction of different concentration onthe rate limiting enzyme HIOMT. *P < 0.05 vs control group. |
研究发现,人皮肤MC能产生5-HT并将其转化成MT,形成皮肤5-HTs/MTs。人体皮肤及人工培养的正常皮肤和病理性皮肤中均有5-HTs/MTs的表达,这个系统的多步骤的通路开始于色氨酸羟化酶TPH催化下的L-色氨酸的羟化反应。紧接着由5-羟色胺酸脱羧酶AAD催化脱羧形成5-HT,尔后由芳香烷基胺-N-乙酰基转化酶AANAT作用下乙酰化生成N-乙酰5-HTNAS,进一步由羟吲哚氧化甲基转移酶HIOMT催化甲基化生成褪黑素MT[3]。这种模式可通过检测皮肤和培养的皮肤细胞中MT合成最重要的两个限速酶AANTA、HIOMT活性来证实。5-HT既可促进MC和AMMC的增殖,也可明显的抑制其生长,是通过受体介导的凋亡和增殖调节起作用[4-5, 11]。
人体皮肤中存在完整的5-HT能系统的表达和局部5-HT生物合成通路[12]。5-HT受体和褪黑素受体在角质形成细胞、黑素细胞中均有表达,不仅介导细胞增殖和分化活动,并且构建皮肤感光系统[13]。近来有研究者发现:褪黑素及其代谢产物蓄积在人体表皮中,并能抑制表皮黑素细胞的增殖和酪氨酸酶活性[14]。
生理情况下一个黑素细胞与周围36个角质形成细胞形成一个黑素单元,黑素细胞在人体内的生物学行为依赖于角质形成细胞及其他细胞分泌的细胞饮子的作用,单独黑素细胞培养已不能满足体外研究其黑素代谢的需要[15]。因此,本研究通过建立体外黑素细胞和角质形成细胞共培养体系,尝试模拟黑素细胞体内生存环境,以探讨5-HTs/褪黑素能系统在六味地黄方调节黑素代谢中的作用。
由此次实验结果可以看出,六味地黄方对体外培养的人正常黑素细胞及黑素细胞和角质形成细胞共培养模型中细胞增殖的影响因浓度不同而量-效关系不同,且与5-HT、MT含量含量递减情况一致。提示,5-HTs/ MTs能系统可能是六味地黄方调节黑素代谢的中介物质基础。这些发现为中医药治疗色素病提供了一种新的方向,为色素障碍性疾病白癜风的治疗提供了一种新的靶点。
5-HTs/MTs能系统最关键的限速酶HIOMT、AANAT,当六味地黄方在低中浓度时含药浓度越高,AANATmRNA的表达越少,其下降趋势与5-HT、MT呈正相关。但六味地黄方含药血清对各用药剂量组HIOMT的mRNA含量无明显变化。HIOMT是褪黑素在生化合成的最后一个转化酶,关于HIOMT是否是褪黑素的合成限速酶一直存在争议。由此可见,六味地黄方可能通过调控合成限速酶ANNAT来影响5-HTs/ MTs能系统的代谢和通路。
目前国内尚未有对中医药通过调控5-HTs/MTs能系统来影响黑素代谢方面的研究,对于5-HT系统的进一步阐明,不仅有利于色素障碍性疾病的发病机制的进一步阐明和临床治疗探寻新靶点,而且中医中药疗法作为有效治疗手段[16],其治疗色素障碍性疾病的分子机制也得到更进一步的阐述,对于中医药理论的发展和指导临床实践具有重要意义。
| [1] | 邓燕, 刘祯, 肖艳, 等. 六味地黄方对体外培养的人正常黑素细胞增殖及细胞增殖的影响[J]. 南方医科大学学报,2009, 29 (4) : 701-3. |
| [2] | 邓燕, 朱晓雯, 郑晓霞, 等. 六味地黄方含药血清对酪氨酸酶活性的影响[J]. 新中医,2010, 42 (3) : 99-100. |
| [3] | Slominski A, Pisarchik A, Wortsman J. Expression of genes coding melatonin and serotonin receptors in rodent skin[J]. Biochim Biophys Acta,2004, 1680 (2) : 67-70. DOI: 10.1016/j.bbaexp.2004.09.002. |
| [4] | Slominski A, Wortsman J, Tobin DJ. The cutaneous serotoninergic/melatoninergic system:securing a place under the sun[J]. FASEB J,2005, 19 (2) : 176-94. DOI: 10.1096/fj.04-2079rev. |
| [5] | Huang J, Gong Q, Li G. Serotonin in human skin[J]. J Nanjing Medical University,2005, 19 (4) : 167-72. |
| [6] | Basak PY, Adiloglu AK, Ceyhan AM, et al. The role of helper and rugulatory T cells in the pathogenesis of vitiligo[J]. J Am Acad Dermatol,2009, 60 (2) : 256-60. DOI: 10.1016/j.jaad.2008.09.048. |
| [7] | Namian AM, Shahbaz S, Salmanpoor R, et al. Association of interferon-gamma and tumor necrosis factor alpha polymorphisms with susceptibility to vitiligo in Iranian patients[J]. Arch Dermatol Res,2009, 301 (1) : 21-5. DOI: 10.1007/s00403-008-0904-8. |
| [8] | Slominski A, Fischer TW, Zmijewski MA, et al. On the role of melatonin in skin physiology and pathology[J]. Endocrine,2005, 27 (2) : 137-47. DOI: 10.1385/ENDO:27:2. |
| [9] | Izykowska I, Gebarowska E, Cegielski M, et al. Effect of melatonin on melanoma cells subject to UVA and UVB radiation in vitro studies[J]. In Vivo,2009, 23 (5) : 733-8. |
| [10] | Izykowska I, Cegielski M, Gebarowska E, et al. Effect of melatonin on human keratinocytes and fibroblasts subjected to UVA and UVB radiation in vitro[J]. In Vivo,2009, 23 (5) : 739-45. |
| [11] | Duval C, Reginer M, Schmidt R, et al. Distinct melanogenic response of human melanocytes in mono-culture, in co-culture with keratinocytes and in reconstrueted Epidermis, to UV exposure[J]. Pigment Cell Res,2001, 14 (5) : 348-55. DOI: 10.1034/j.1600-0749.2001.140506.x. |
| [12] | Kim TK, Kleszczynski K, Janjetovic Z, et al. Metabolism of melatonin and biological activity of intermediates of melatoninergic pathway in human skin cells[J]. FASEB J,2013, 27 (7) : 2742-55. DOI: 10.1096/fj.12-224691. |
| [13] | Iyengar B. The melanocyte photosensory system in the human skin[J]. Springerplus,2013, 2 (1) : 158. DOI: 10.1186/2193-1801-2-158. |
| [14] | Kim TK, Lin Z, Tidwell WJ, et al. Melatonin and its metabolites accumulate in the human epidermis in vivo and inhibit proliferation and tyrosinase activity in epidermal melanocytes in vitro[J]. Mol Cell Endocrinol,2015, 15 (404) : 1-8. |
| [15] | Verdy C, Branka JE, MekidecheN. Melanosome transfer evaluation by quantitative measurement of Pmel 17 in human normal melanocyte-keratinocyte co-cultures:effect of an Alaria esculenta extract[J]. J Cosmet Sci,2012, 63 (3) : 197-203. |
| [16] | 杨梅玉, 王莒生. 中医药治疗白癫风的现状[J]. 北京中医药大学学报:中医临床版,2008, 15 (2) : 41-3. |
| [17] | 邓燕, 马玲玲, 杨柳. 中医药治疗白癜风的循证医学评价[J]. 新中医,2011, 43 (10) : 106-8. |
 2016, Vol. 36
2016, Vol. 36