2. 东莞市第三人民医院麻醉科, 广东东莞 523326
2. Department of Anesthesiology, Third People's Hospital of Dongguan, Dongguan 523326, China
在临床实践中,肥胖患者在生理及机体组织上的改变,可影响大多数药物的药代动力学特性[1]。顺式阿曲库铵(cis-atracurium, CISA)是常用的中效非去极化肌松药,肥胖患者在围手术期使用时,由于会涉及到麻醉插管时机、肌松起效时间、术后呼吸恢复、肝肾代谢等难题,故调整好肥胖患者顺式阿曲库铵的诱导剂量尤为重要。目前使用中效非去极化肌松药以去脂肪体质量(FFM)为标准计算用药剂量已有相关报道[2-3],但尚无定论。本文正是通过对比顺式阿曲库铵在正常患者与肥胖患者的药代差异,阐述这种给药方式及剂量在临床麻醉中是合理、安全的。
1 资料和方法 1.1 一般资料经过暨南大学第一临床医学院伦理委员会批准(文件批号:[2015]020),患者或其家属签署知情同意书,选择择期行腹腔镜胃旁路手术的单纯性肥胖患者12例为肥胖组,男6例,女6例,年龄20~40岁,ASAⅠ~Ⅱ级,BMI≥35 kg/m2;择期行腹腔镜手术患者12例为正常组,男7例,女5例,年龄20~40岁,ASAⅠ~Ⅱ级,BMI 18.5~24 kg/m2。排除标准:有全麻禁忌证者;有呼吸系统疾病、脑梗塞、神经或精神系统疾病、心脏病者;肝肾功能异常者;对非去极化肌松药过敏者等。
1.2 麻醉方法及血流动力学监测两组患者术前8 h禁食禁水,均未使用术前药,入手术室后开放上肢静脉,然后两组患者分别以乳酸林格氏液持续静滴,并行心电监护,严密监测病人的心率、舒张压、收缩压、平均动脉压呼吸末二氧化碳PetCO2、血氧饱和度(SpO2)相关指标;同时,用麻醉监测仪(型号:Aspect Medical Systems, Newton, MA, USA)以连续监测病人术中的麻醉深度,然后再行桡动脉穿刺置管,并留取麻醉前动脉血做基础药代动力学研究。麻醉前,先给患者面罩吸入O2 5 min,使SpO2保持在95%以上,然后行快速麻醉诱导插管:按患者的去脂肪体质量(FFM)静脉推注咪达唑仑0.05 mg/kg,芬太尼2 μg/kg,按总体质量(TBW)静脉推注丙泊酚1~1.5 mg/kg,待血压稳定后,Ⅰ组按去脂肪体质量、Ⅱ组按总体质量分别给予0.15 mg/kg顺式阿曲库铵,并分别于给药后1、2、4、6、8、10、12、15、20 min采取动脉血3 mL,向EP管中每毫升血浆加入H2SO4使血浆pH达到3,于肝素抗凝管中使之混匀并立即予以离心,同时记录T0~3这四个时间点的心率、舒张压、收缩压、平均动脉压、血氧饱和度SpO2、呼吸末二氧化碳(PetCO2)。肌肉松弛后,均采用气管插管后,通过Datex-Ohmeda麻醉机给予机械通气。术中两组顺式阿曲库铵的维持量按去脂肪体质量0.09 mg/kg/h进行泵注,同时维持患者体温在36~37 ℃之间;以丙泊酚4 mg/(kg·h)、瑞芬太尼0.2 μg/kg/min维持麻醉,使脑电双频指数(Bispect ral index, BIS)值维持在40~60之间,血压波动超过基线20%时使用血管活性药物。
男性[4]FFM=9.27×103×TBW/(6.68×103+216× BMI);女性FFM=9.27×103×TBW/(8.78×103+244× BMI),其中BMI=体质量(kg)/身高(cm)2,BMI为体质量指数,TBW为总体质量,FFM为去脂肪体质量。
1.3 监测指标检测麻醉诱导前、给顺式阿曲库铵后1、2、4、6、8、10、12、15、20 min对应不同时间点的血药浓度,绘制出其标准曲线,并计算出相应的药代动力学参数;记录T0~3这四个时间点的心率(HR)、舒张压(DBP)、收缩压(SBP)、平均动脉压(MAP)、血氧饱和度(SpO2)和呼吸末二氧化碳(PetCO2),以及术中BIS数值及血气结果。
1.4 统计学方法采用SPSS13.0统计软件进行分析,计量资料以均数±标准差表示,并行方差齐性检验。同一时间点多组间计量资料比较采用单因素方差分析(One-way ANOVA方法),两两比较采用LSD法。组内不同时间点比较采用重复测量数据的方差分析(Repeated measures ANOVA),以P < 0.05认为差异有统计学意义。
2 结果 2.1 两组一般情况比较Ⅰ组与Ⅱ组患者的年龄、身高、体温、pH、BIS、Hb差异均无统计学意义(P > 0.05);但红细胞压积Hct、体质量指数BMI差异有统计学意义(P < 0.05,表 1,图 1)。
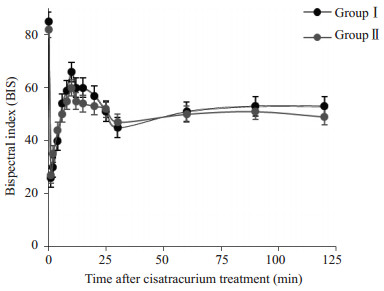
|
图 1 两组术中BIS的情况 Figure 1 Comparison of BIS between the two groups (Mean±SD, n=12). *P>0.05 vs group II. |
| 表 1 两组患者的一般情况比较 Table 1 Comparison of general data between the two groups (Mean±SD, n=12) |
与T0相比,两组组内的SBP、DBP及MAP在T1~3时明显下降(P < 0.05);在T0~3各时点时,两组间在SBP、DBP、MAP、SpO2、PetCO2及HR无统计学意义(P > 0.05,表 2)。
| 表 2 两组患者全麻诱导期SBP、DBP、HR、MAP、PetCO2及SpO2的变化比较 Table 2 Comparison of SBP、DBP、HR、MAP、PetCO2 and SpO2 between the two groups (Mean±SD, n=12) |
经统计学分析,与Ⅱ组相比,Ⅰ组的血药浓度在T1、T2时明显降低(P < 0.05,图 2);Ⅰ组与Ⅱ组的总体清除率、表观分布容积、分布和消除半衰期差异无统计学意义(P > 0.05,表 3)。
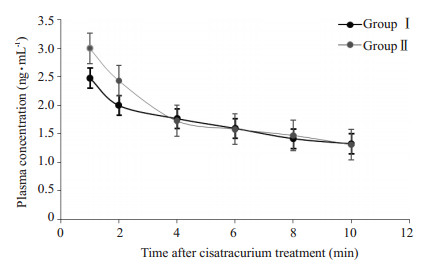
|
图 2 两组患者顺式阿曲库铵血浆药物浓度时间曲线 Figure 2 Plasma concentration-time profile of cisatracurium between two groups. |
| 表 3 两组常用药代动力学参数比较 Table 3 Comparison of pharmacokinetic parameters between two groups (Mean±SD, n=12) |
顺式阿曲库铵是具有与阿曲库铵相似的肌松效应和代谢方式的中效非去极化肌松药[5-6],并且不存在组胺释放[7],对维持心率、血压等生命体征平稳具有重要意义[8]。但大多数肥胖患者在机体生理功能与组织结构方面也发生变化[9-10],并且相应改变顺式阿曲库铵的药代学特性。本文正拟着重从药代学方面分析顺式阿曲库铵在肥胖患者诱导麻醉的变化,并结合其在不同时间点血浆浓度的动态趋势,来解释这种按去脂肪体质量的给药方式更为可靠、准确。
在本研究中发现,正常体质量患者与肥胖患者在予丙泊酚后而未予顺式阿曲库铵之前,两组MAP都明显下降。由于丙泊酚对循环系统有抑制作用,可引起血压瞬时下降,外周血管阻力降低,尤其是在快速分布半衰期极其显著[11-12]。然而,两组于给顺式阿曲库铵后,术中的血流动力学都能保持相对平稳,原因在于顺式阿曲库铵的代谢模式主要是不依赖器官的Hofmann消除,而这不同于阿曲库铵,其代谢产物N-甲基四氢罂粟碱和单季铵盐丙烯酸盐代谢物,虽可影响心血管系统,导致心率血压降低,但其血峰值浓度远不及阿曲库铵的1/10[13],因而仅对血流动力学造成轻微影响。这也提示了术中心率和血压下降主要由于丙泊酚和芬太尼对心血管的抑制作用导致,与顺式阿曲库铵无太大相关。
根据两组在不同时间点血浆顺式阿曲库铵浓度的结果,我们发现,与正常患者相比,肥胖患者的血药浓度在给顺式阿曲库铵后1、2 min时明显降低。分析其原因很可能是:(1)顺式阿曲库铵的作用部位是运动终板的神经肌肉接头处,其药理效能取决于该药物在外周神经肌肉接头处的浓度。与正常患者对比,由于多数肥胖患者往往存在左室离心性肥厚,左室顺应性下降及充盈受损,心搏量降低[14],造成药物通过体循环而作用于神经肌肉接头处的量相对减少,从而药物浓度随之降低;(2)机体的血流速度及分布影响着肌松药在血液循环中的分布和代谢。血液粘稠度与Hct是密切相关的。由于肥胖患者的血液粘稠度普遍都比正常患者轻度升高,而血液粘稠度高可降低机体血流速度,延长顺式阿曲库铵到达靶组织的时间[15],最终导致诱导后相同时间内该处的药峰浓度低,从而使肌松药起效时间延迟,而这结论与本文结果是一致的。鉴于以上因素,在给药后的1~2 min内,较正常患者而言,肥胖患者的血药浓度有可能会出现一过性降低。
本实验在4 min后的4个时间点,两组患者的血药浓度无明显差异,体现两组在体内血药浓度分布已经接近稳态。我们从两组血药浓度时间曲线的趋势可以看出,两组都在顺式阿曲库铵注入体内4 min后各时点的标准曲线基本趋于重叠,且呈平稳下降趋势,这提示了体内顺式阿曲库铵可能存在一定的“封顶效应”作用。同时,有可能是麻醉诱导后持续输注顺式阿曲库铵时,外周室的药物浓度随输注时间的延长逐渐达到饱和状态,停止输注后随着中央室的药物不断被代谢,虽然有更多的顺式阿曲库铵从外周室向中央室进行补充[16],但即使有术中维持肌松药剂量的追加,其诱导剂量的药物效应已经有部分减退,导致血药浓度逐渐下降,且下降速率逐渐减慢,最后趋于平线[17]。
与正常患者相比,两者的表观分布容积、总体清除率、分布及消除半衰期无显著性差异,这说明对于肥胖患者而言,顺式阿曲库铵按去脂肪体质量诱导给药,其在肥胖患者体内的药动学变化与正常患者是相似的。探究其原因,可能在于:(1)机体的成分主要是由去脂肪体质量(包括肌肉、骨骼、重要脏器和细胞外液)和脂肪构成,其中去脂肪体质量所占比例较少,而脂肪较大,肥胖患者尤为突出。Hanley等[18]研究认为药物的理化性质对其在肥胖患者的分布影响甚大。由于亲脂性药物在脂肪组织有高度亲和力,而肥胖患者体内脂肪的含量明显高于正常患者,故其在肥胖患者体内的分布会明显发生改变;相反,本研究中顺式阿曲库铵为高度水溶性药物[19],其多分布于细胞外液,肥胖患者与正常患者相比影响不大[20],故顺式阿曲库铵在两者的分布容积及t1/2α是相似的,而这一结论在本实验所得出的药代参数结果也得到证实;(2)鉴于顺式阿曲库铵非器官依赖的代谢特点,血浆中该药仅有15%依靠肝肾功能代谢,而本实验中两者均无肝肾功能异常,所以两组间的总体清除率差异无统计学意义;(3)本研究中两者t1/2β无显著差异,结果与4 min后两组血药浓度接近平衡的趋势相对应,其原因主要是Hoffman消除,血液中顺式阿曲库铵有接近80%通过此效应自身降解,即由药物进入血管那一刻开始,血浆药物浓度便在降低,再者,两组影响该代谢方式的主要外界因素体温和pH的比较无差异,所以两组的消除半衰期也不会有太大差别[21]。
综上所述,本研究中顺式阿曲库铵按FFM对肥胖患者进行麻醉诱导,从药代动力学角度阐述其在体质量正常患者与肥胖患者之间,于总体清除率、表观分布容积、分布和消除半衰期方面无明显差异,解释肥胖患者按FFM给药方式及剂量是目前临床上较为理想、合理的。结合其血药浓度在1、2 min内会出现一过性降低的结果,肌松起效延迟,建议应用FFM顺式阿曲库铵对肥胖患者行全麻诱导时,气管插管时机应延后1~2 min。
| [1] | Adams JP, Murphy PG. Obesity in anaesthesia and intensive care[J]. Br J Anaesth,2000, 85 (1) : 91-108. DOI: 10.1093/bja/85.1.91. |
| [2] | 徐晓莹, 李玉娟. 以去脂体重为标准计算静脉全麻诱导剂量对重度肥胖病人的影响[J]. 岭南现代临床外科,2013, 4 (13) : 103-12. |
| [3] | 王鑫, 徐世元, 刘辉, 等. 按去脂肪体重给药测定罗库溴铵ED95剂量[J]. 实用医学杂志,2011, 27 (12) : 2194-6. |
| [4] | Janmahasatian S, Duffull SB, Ash S, et al. Quantification of lean bodyweight[J]. Clinical pharmacokinetics,2005, 44 (10) : 1051-65. DOI: 10.2165/00003088-200544100-00004. |
| [5] | 王瑞娟.顺苯磺酸阿曲库铵按无脂肪体重与实际体重给药药效学的比较[D].南方医科大学, 2013, 1-63. |
| [6] | 耿志宇, 吴新民. 顺苯磺酸阿曲库铵用于肥胖患者的神经肌肉阻滞效应[J]. 中华医学杂志,2014, 12 (36) : 2844-6. |
| [7] | Dieye E, Minville V, Asehnoune K, et al. Pharmacodynamics of cisatracurium in the intensive care unit:an observational study[J]. Ann Intensive Care,2014, 4 (1) : 3. DOI: 10.1186/2110-5820-4-3. |
| [8] | Correa CM, Sudo GZ, Sudo RT. Hemodyrnamic effect sofatracurium and cisatracurium and the use of diphenhydramiue and cimetidine[J]. Rev Bras,2010, 60 (1) : 52-63. |
| [9] | 黄晓, 段云飞, 唐海波, 等. 体质指数对超重与肥胖青少年血压的影响[J]. 热带医学杂志,2011, 11 (6) : 713-20. |
| [10] | Peixoto-Souza FS, Piconi-Mendes C, Baltieri L, et al. Lung age in women with morbid obesity[J]. Rev Assoc Med Bras (1992),2013, 59 (3) : 265-9. DOI: 10.1016/j.ramb.2012.12.010. |
| [11] | Möller Petrun A, Kamenik M. Bispectral index-guided induction of general anaesthesia in patients undergoing major abdominal surgery using propofol or etomidate:a double-blind, randomized, clinical trial[J]. Br J Anaesth,2013, 110 (3) : 388-96. DOI: 10.1093/bja/aes416. |
| [12] | Reich DL, Hossain S, Krol M, et al. Predictors of hypotension after induction of general anesthesia[J]. Anesth Analg,2005, 101 (3) : 622-8. DOI: 10.1213/01.ANE.0000175214.38450.91. |
| [13] | Yang CI, Fine GF, Jooste EH, et al. The effect of cisatracurium and rocuronium on lung function in anesthetized children[J]. Anesth Analg,2013, 117 (6) : 1393-400. DOI: 10.1213/ANE.0b013e3182a6d191. |
| [14] | 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2014[J]. 中国实用乡村医生杂志,2014, 42 (24) : 3-10. |
| [15] | Boldt J, Knothe C, Zickmann B, et al. Cardiorespiratory and microcirculatory effects following volume replacement using a new hydroxyethyl starch preparation[J]. Anaesthesist,1992, 41 (6) : 316-23. |
| [16] | 吴燕, 孟尽海, 刘斐, 等. 顺式阿曲库铵两种不同给药方式对肌松残余作用的影响[J]. 临床麻醉学杂志,2014, 30 (2) : 122-4. |
| [17] | Dong YJ, Li X. Comparative study on the pharmacodynamics of cisatracurium:Continuous infusion or intermittent bolus injection[J]. Contemp Clin Trials,2012, 33 (3) : 482-5. DOI: 10.1016/j.cct.2012.01.002. |
| [18] | Hanley MJ, Abernethy DR, Greenblatt DJ. Effect of obesity on the pharmacokinetics of drugs in humans[J]. Clin Pharmacokinet,2010, 49 (2) : 71-87. DOI: 10.2165/11318100-000000000-00000. |
| [19] | Kumar GV, Nair AP, Murthy HS, et al. Residual neuromuscular blockade affects postoperative pulmonary function[J]. Anesthesiology,2012, 117 (6) : 1234-44. DOI: 10.1097/ALN.0b013e3182715b80. |
| [20] | Abernethy DR, Greenblatt DJ. Drug disposition in obese humans[J]. Clin Pharmacokinet,1986, 11 (3) : 199-213. DOI: 10.2165/00003088-198611030-00002. |
| [21] | 鲍杨, 张丽峰, 史东平, 等. 非去极化肌松药发生残余阻滞作用的危险因素[J]. 中国现代应用药学,2010, 27 (7) : 604-7. |
 2016, Vol. 36
2016, Vol. 36
