2. 蚌埠医学院第一附属医院肿瘤外科, 安徽蚌埠 233003
2. Department of Surgical Oncology, First Affiliated Hospital of Bengbu Medical College, Bengbu 233003, China
胃癌作为中国的第2大常见肿瘤,全球每年近40万的新发病例数在我国,相比其他国家,中国的胃癌形势更加严峻[1]。虽然临床对于胃癌的治疗手段已相对成熟,但肿瘤转移和复发仍是难以回避的现实。肿瘤干细胞是近几年研究的热点,人们希望能从这一小群具有自我更新、无限增殖、成瘤能力强的细胞中找到肿瘤转移及复发的根源。乙醛脱氢酶1(ALDH1)作为新发现的肿瘤干细胞标志物,在结直肠癌、肺癌、乳腺癌[2-4]等肿瘤中已有研究报道。趋化因子受体4(CXCR4)属趋化因子家族,为G蛋白偶联的7次跨膜受体蛋白[5],与肿瘤细胞的增殖、侵袭、转移及预后密切相关[6]。上皮型钙黏蛋白(E-cadherin)作为上皮性标志物,其表达的缺失被认为是上皮间质转化现象发生的重要标志[7]。目前,关于E-cadherin介导的上皮间质转化过程以及ALDH1,CXCR4与胃癌临床病理特征及预后的相关性研究,国内外尚未见文献报道。本研究通过对127例胃癌组织中ALDH1,CXCR4及E-cadherin表达水平的检测,分析其与患者临床病理参数、术后生存时间及淋巴结转移的关系,探讨它们在胃癌转移及预后中的作用。
1 资料和方法 1.1 病例资料收集蚌埠医学院第一附属医院病理科2007年1月~2008年6月间外检档案中行根治性切除胃癌标本156例(患者术前未行放疗、化疗)。纳入其中随访资料完备的127例(81.4%)患者作为研究对象。入选病例随访至患者死亡或截止2013年6月,随访时间为6~87月,中位随访期56个月。其中男92例,女35例。年龄36岁~83岁,中位年龄为58岁。肿瘤直径≥3 cm:48例, < 3 cm:79例。浸润深度:未及浆膜层46例,突破浆膜层81例。根据P-TNM分期(AJCC2010版):Ⅰ期26例,Ⅱ期31例,Ⅲ期49例,Ⅳ期21例。高分化癌9例,中分化癌57例,低分化癌61例。淋巴管侵犯阴性39例,阳性88例,远处转移阴性87例,阳性40例。从中随机选取60例不含癌组织的切缘组织为对照组。
1.2 抗体与试剂鼠抗人ALDH1(H-8, sc-166362)单克隆抗体、鼠抗人CXCR4单克隆抗体(型号4G10)购自美国Santa Cruz公司。鼠抗人E-cadherin单克隆抗体、二抗及DAB显色剂购自北京中杉金桥生物技术有限公司。
1.3 免疫组化染色所有标本经10%中性福尔马林溶液固定, 常规石蜡包埋,4 μm连续切片。免疫组化Elivision法检测ALDH1、CXCR4、E-cadherin蛋白的表达,操作步骤按试剂盒说明书进行。以已知阳性切片为阳性对照,以PBS代替一抗为阴性对照。
1.4 结果判定ALDH1蛋白位于细胞浆,以癌细胞胞浆出现淡黄色至棕褐色颗粒为阳性表达。CXCR4以胞浆或胞浆和胞核内着棕黄色为阳性。E-cadherin以细胞膜和细胞浆出现棕黄色颗粒为阳性。染色结果从着色强度和着色范围两方面判定。着色强度:无色,0分;淡黄色,1分;棕黄色,2分;棕褐色,3分。着色范围:计数高倍镜下阳性细胞百分比, < 10%,1分;11%~50%,2分;51%~75%,3分; > 75%,4分。最后以两者结果的乘积计分,积分≤2为阴性, > 2为阳性。每例随机判读10个高倍视野,选取中位值。
1.5 统计学方法采用SPSS 15.0软件进行统计处理,t检验及卡方检验进行单因素分析,相关性分析采用Spearman等级相关分析,生存分析用Kaplan-Meier法,组间比较用log-rank检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 ALDH1、CXCR4、E-cadherin在胃癌中的表达ALDH1、CXCR4、E-cadherin在胃癌中表达的阳性率为57.5%(73/127)、63.8%(81/127)、36.2%(46/127)(图 1~3),3者在对照组中的表达分别为18.3%(11/60)、11.7%(7/60)、91.7%(55/60),差异均有显著性(P < 0.05,表 1)。
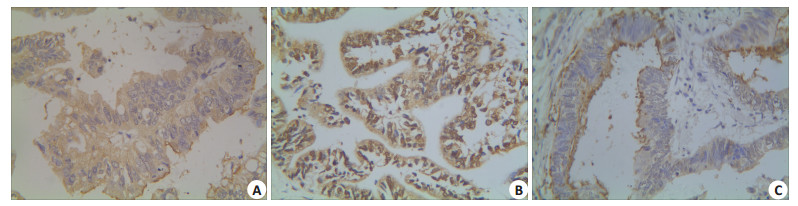
|
图 1 ALDH1、CXCR4、E-cadherin 3者在胃癌中的阴性表达 Figure 1 Expression of ALDH1, CXCR4 and E-cadherin in GAC (Elivision, ×400). A: ALDH1; B: CXCR4; C: GAC. |
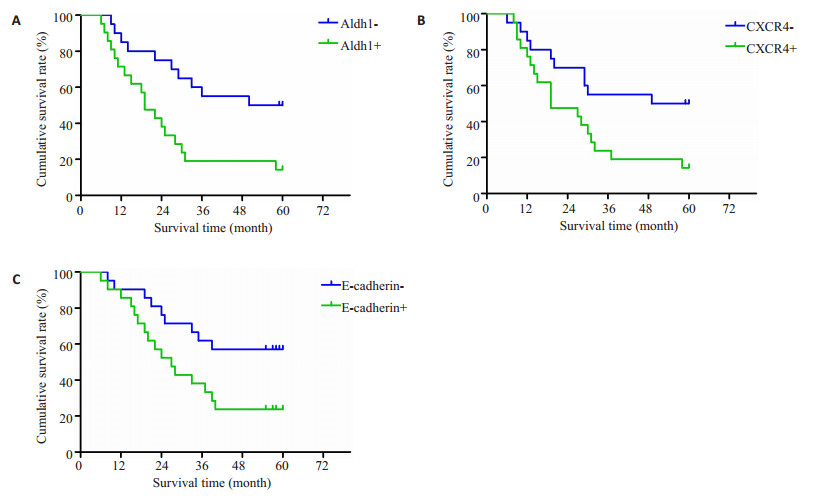
|
图 2 ALDH1、CXCR4、E-cadherin阳性阴性组患者术后生存曲线 Figure 2 Survival curves of patients with positive and negative ALDH1、CXCR4、E-cadherin expression. A: ALDH1; B: CXCR4; C: E-cadherin. |
| 表 1 标本组织中ALDH1、CXCR4、E-cadherin的表达 Table 1 ALDH1, CXCR4, and E-cadherin expression in different gastric tissues |
统计分析表明:随着患者临床分期越晚及淋巴结转移的出现,ALDH1的阳性表达率升高(P < 0.05)。CXCR4蛋白的表达与肿瘤的浸润深度、分化程度、临床分期和淋巴结转移相关(P < 0.05)。E-cadherin蛋白的表达与胃癌的浸润深度、分化程度及淋巴结转移密切相关(P < 0.05,表 2)。
| 表 2 胃癌组织中ALDH1、CXCR4、E-cadherin蛋白的表达与临床病理特征的关系 Table 2 Relationship of ALDH1, CXCR4 and E-cadherin expressions with clinicopathological characteristics of GAC |
经Spearman等级相关分析发现,ALDH1蛋白的表达与CXCR4蛋白的表达呈正相关关系(rs=0.529,P < 0.001);ALDH1蛋白的表达与E-cadherin蛋白的正常表达呈负相关关系(rs=-0.516,P < 0.001);CXCR4蛋白的表达亦与E-cadherin蛋白的正常表达呈负相关关系(rs=-0.579,P < 0.001,表 3)。
| 表 3 胃癌组织中ALDH1、CXCR4、E-cadherin表达的关系 Table 3 Relationship between ALDH1, CXCR4 and E-cadherin expressions in GAC |
ALDH1蛋白在淋巴结转移组阳性表达率为65.9%,无淋巴转移组阳性表达率为38.5%,CXCR4蛋白在淋巴结转移组阳性表达率为72.7%,无淋巴转移组阳性表达率为43.6%,E-cadherin蛋白在淋巴结转移组阳性表达率为61.4%,无淋巴转移组阳性表达率为33.3%。3者在淋巴结转移阳性组表达率均高于阴性组,差异具有统计学意义(P < 0.05)。
2.5 Cox回归分析将表 2中的临床病理因素、ALDH1、CXCR4、E-cadherin蛋白表达等因素引入COX模型进行多因素分析,结果显示:ALDH1、CXCR4、E-cadherin的阳性表达是影响胃癌患者预后的独立危险因素(表 4)。
| 表 4 127例胃癌患者的多因素分析 Table 4 Multivariate survival analysis of 127 patients with GAC |
本组病例总的5年生存率为38.7%。Kaplan-Meier法生存分析显示ALDH1蛋白表达阳性组与阴性组的5年生存率分别为18.2%和59.4%,差异有统计学意义(P < 0.05,图 2A);CXCR4蛋白表达阳性组与阴性组的5年生存率分别为19.9%和58.2%,差异有统计学意义(P < 0.05,图 2B);E-cadherin蛋白表达阳性组与阴性组的5年生存率分别为58.4%和23.7%,差异有统计学意义(P < 0.05,图 2C)。
3 讨论胃癌在中国是高发肿瘤,其发病率位于所有恶性肿瘤的第5位,而死亡率位于第2位[8]。截止目前,胃癌复发和转移的生物学机制仍不清楚,寻找胃癌转移的分子指标,研究其机制对提高胃癌生存率有重要意义。
肿瘤干细胞的研究为解决恶性肿瘤复发、转移及治疗抵抗这些难题带来了曙光。目前对多种强侵袭性实体瘤的研究显示,肿瘤干细胞不仅在恶性肿瘤形成中起关键驱动作用,在转移中的作用同样不容小觑[9-10]。2007年,Ginestier等[11]宣布利用ALDH1在乳腺癌实体组织中发现乳腺癌干细胞,揭开了ALDH1在干细胞领域研究的篇章。研究发现[12]ALDH1阳性乳腺癌总生存率较低,转移可能性是ALDH1阴性乳腺癌的1.76倍。ALDH1阳性乳腺癌患者预后更差,而且抵抗化疗[13]。Li等[14]对4种亚型的乳腺癌细胞系研究发现,ALDH1在ER、PR、HER-2三阴型乳腺癌中的表达高于其他亚型,说明乳腺癌干细胞的存在可能是三阴型乳腺癌预后差的原因。此后ALDH1又被证实为结直肠癌、肺癌、头颈部鳞癌等[15]多种肿瘤的干细胞的标记物,其与患者临床治疗及预后的相关性研究亦逐步展开。本研究发现在127例胃癌组织中,ALDH1蛋白的阳性表达率为57.5%,ALDH1蛋白的表达与肿瘤的临床TNM分期和淋巴结转移密切相关。提示ALDH1表达阳性的患者临床分期晚、易于转移。生存分析也提示ALDH1表达阳性的患者预后差。此外我们发现少数对照组(11/60)也存在ALDH1抗体的表达,这一点说明尽管ALDH1是一个干细胞的标记物,但其在非干细胞群的肿瘤形成过程中也可能起作用。
趋化因子是一类单链小分子的蛋白质超家族,最早发现可控制免疫细胞向炎症定向迁移,产生诱导靶细胞趋化性迁移等多种生理功能[16]。趋化因子受体4(CXCR4)是G蛋白偶联受体超家族成员[17]。CXCR4与其配体CXCL12构成CXCR4/CXCL12生物轴传导特定信号,可促进肿瘤细胞生长、恶性转化、参与造血、抑制免疫、促进肿瘤转移等[18]。近年研究发现:CXCR4在卵巢癌、恶性黑色素瘤、前列腺癌等多种肿瘤中均有表达, 并与肿瘤的复发、转移及不良预后相关[19-21]。本研究发现胃癌组织中CXCR4表达较对照组高,差异有统计学意义。随着胃癌分化的越差、浸润的越深、临床分期越晚以及转移的出现,CXCR4蛋白的检出率就越高,同时患者的五年生存率也越差。在淋巴结转移灶中亦发现CXCR4阳性细胞,其表达在淋巴结转移组与无转移组存在统计学差异,提示CXCR4可能参与胃癌淋巴结转移的分子机制,可能通过CXCR4/CXCL12途径促进肿瘤细胞迁移至淋巴结,从而在胃癌的侵袭转移中发挥作用。本结果与Yasumoto等[22]的研究具有一致性。此外,ALDH1和CXCR4在胃癌原发灶中的表达均高于对照组,两者呈正相关,其联合表达与转移淋巴结比率和转移淋巴结数亦呈正相关关系,推测胃癌ALDH1阳性细胞亚群可能在CXCR4介导下更易发生淋巴管浸润和淋巴结转移,CXCR4及其信号轴可能参与肿瘤起始细胞远处转移的形成过程。
上皮间质转化(EMT)是指具有极性的上皮细胞表型的缺失转化为具有移行能力的间质细胞,从而使肿瘤细胞摆脱了细胞间的粘附,获得侵袭和迁移能力的过程[23]。E-cadherin是广泛存在于上皮组织中的细胞间跨膜黏连糖蛋白,主要介导上皮细胞间以及上皮与间质细胞之间的连接,其变化是EMT的主要控制者,该蛋白表达的下调是EMT发生的重要标志并与肿瘤侵袭能力相关[24]。本实验显示,胃癌中E-cadherin表达较对照组降低且与胃癌的分化程度、浸润深度及淋巴结转移密切相关。分析淋巴结转移灶中E-cadherin的表达其阳性率高于原发灶,说明E-cadherin功能障碍降低癌细胞间的粘附功能,导致癌细胞脱离原发灶,而在转移灶中特定原因使得其重新表达,有利于肿瘤细胞粘附于远处器官形成转移灶。E-cadherin表达的降低或缺失导致了肿瘤细胞彼此之间黏附力的减弱,同时促使了上皮间质转化现象的发生,使得肿瘤细胞易于浸润和转移。在胃癌组织中,肿瘤分化的越差,浸润的越深、淋巴结转移的越多,E-cadherin蛋白的表达率越低,患者的预后也越差,它们之间呈显著负相关关系。对E-cadherin蛋白与ALDH1、CXCR4蛋白的表达进行Spearman相关分析,发现在癌组织中随着E-cadherin表达率的降低,ALDH1、CXCR4表达率显著升高呈负相关,提示三者之间可能存在一定的联系。肿瘤干细胞的存在促进了肿瘤的发生发展,E-cadherin的表达降低或缺失导致癌细胞彼此之间的黏附力减弱,移动性增强,而此时CXCR4蛋白表达的增强进一步赋予肿瘤细胞更强的侵袭能力进而加快胃癌细胞的浸润及转移。
综上所述,ALDH1、CXCR4、E-cadherin在胃癌侵袭转移中起协调作用,ALDH1、CXCR4表达的升高以及E-cadherin表达的降低预示肿瘤有高度侵袭性、高度转移性潜能,进一步探究3者的作用及相互关系有助于阐明胃癌淋巴道转移的机制,为提供胃癌转移基因标记物及靶向治疗提供新思路。
| [1] | Lin Y, Ueda J, Kikuchi S, et al. Comparative epidemiology of gastric cancer between Japan and China[J]. World J Gastroenterol,2011, 17 (39) : 4421-8. DOI: 10.3748/wjg.v17.i39.4421. |
| [2] | Huang EH, Hynes MJ, Zhang T, et al. Aldehyde dehydrogenase 1 is a marker for normal and malignant human colonic stem cells (SC) and tracks SC overpopulation during colon tumorigenesis[J]. Cancer Res,2009, 69 (8) : 3382-9. DOI: 10.1158/0008-5472.CAN-08-4418. |
| [3] | Jiang F, Qiu Q, Khanna A, et al. Aldehyde dehydrogenase 1 is a tumor stem cell-associated marker in lung cancer[J]. Mol Cancer Res,2009, 7 (3) : 330-8. DOI: 10.1158/1541-7786.MCR-08-0393. |
| [4] | Kang EJ, Jung H, Woo OH, et al. Association of aldehydedehydrogenase1 expression and biologically aggressive features in breast cancer[J]. Neoplasma,2014, 61 (3) : 352-62. DOI: 10.4149/neo_2014_045. |
| [5] | Li LK, Wang AH. Prognosis and clinicopathology of CXCR4 in colorectal cancer patients:a meta-analysis[J]. Asian Pac J Cancer Prev,2015, 16 (9) : 4077-80. DOI: 10.7314/APJCP.2015.16.9.4077. |
| [6] | Lin F, Zheng SE, Shen Z, et al. Relationships between levels of CXCR4 and VEGF and blood-borne metastasis and survival in patients with osteosarcoma[J]. Med Oncol,2011, 28 (2) : 649-53. DOI: 10.1007/s12032-010-9493-4. |
| [7] | Klymkowsky MW, Savagner P. Epithelial-mesenchymal transition:a cancer researcher's conceptual friend and foe[J]. Am J Pathol,2009, 174 (5) : 1588-93. DOI: 10.2353/ajpath.2009.080545. |
| [8] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin,2011, 61 (2) : 69-90. DOI: 10.3322/caac.v61:2. |
| [9] | Codony-Servat J, Verlicchi A, Rosell R, et al. Cancer stem cells in small cell lung cancer[J]. Transl Lung Cancer Res,2016, 5 (1) : 16-25. |
| [10] | Beerling E, Seinstra D, De Wit E, et al. Plasticity between Epithelial and Mesenchymal States Unlinks EMT from Metastasis-Enhancing Stem Cell Capacity[J]. Cell Rep,2016, 14 (10) : 2281-8. DOI: 10.1016/j.celrep.2016.02.034. |
| [11] | Ginestier C, Hur MH, Charafe-Jauffret E, et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J]. Cell Stem Cell,2007, 1 (5) : 555-67. DOI: 10.1016/j.stem.2007.08.014. |
| [12] | Charafe-Jauffret E, Ginestier C, Bertucci F, et al. ALDH1-Positive cancer stem cells predict engraftment of primary breast tumors and are governed by a common stem cell program[J]. Cancer Res,2013, 73 (24) : 7290-300. DOI: 10.1158/0008-5472.CAN-12-4704. |
| [13] | Liu SL, Cong Y, Wang D, et al. Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts[J]. Stem Cell Reports,2014, 2 (1) : 78-91. DOI: 10.1016/j.stemcr.2013.11.009. |
| [14] | Li HH, Ma F, Wang HJ, et al. Stem cell marker aldehyde dehydrogenase 1(ALDH1)-expressing cells are enriched in triple-negative breast cancer[J]. Int J Biol Markers,2013, 28 (4) : E357-64. DOI: 10.5301/jbm.5000048. |
| [15] | LeinungM, Ernst B, Döring C, et al. Expression ofALDH1A1 and CD44 in primary head and neck squamous cell carcinoma and their value for carcinogenesis, tumor progression and cancer stem cell identification[J]. Oncol Lett,2015, 10 (4) : 2289-94. |
| [16] | Sayasith K SJ, regulation of stromal cell-derived factor-1. (SDF1) and chemokine CXC motif receptor 4(CXCR4)in equine and bovine preovulatory follicles[J]. Mol Cell Endocrinol,2014, 391 (1/2) : 10-21. |
| [17] | Shi JS, Wei YB, Xia J, et al. CXCL12-CXCR4 contributes to the implication of bone marrow in cancer metastasis[J]. Future Oncol,2014, 10 (5) : 749-59. DOI: 10.2217/fon.13.193. |
| [18] | Gong J, Zhang HL, Xing SS, et al. High expression levels of CXCL12 and CXCR4 predict recurrence of adamantinomatous craniopharyngiomas in children[J]. Cancer Biomark,2014, 14 (4) : 241-51. |
| [19] | Sekiya R, Kajiyama H, Sakai K, et al. Expression of CXCR4 indicates poor prognosis in patients with clear cell carcinoma of the ovary[J]. Hum Pathol,2012, 43 (6) : 904-10. DOI: 10.1016/j.humpath.2011.08.002. |
| [20] | Mitchell B, Mahalingam M. The CXCR4/CXCL12 axis in cutaneous malignancies with an emphasis on melanoma[J]. Histol Histopathol,2014, 29 (12) : 1539-46. |
| [21] | Qin L, Gong C, Chen AM, et al. Peroxisome proliferatoractivated receptor γ agonist rosiglitazone inhibits migration and invasion of prostatecancer cells through inhibition of the CXCR4/CXCL12 axis[J]. Mol Med Rep,2014, 10 (2) : 695-700. |
| [22] | Yasumoto K, Yamada T, Kawashima A, et al. The EGFR ligands amphiregulin and Heparin-Binding EGF-like growth factor promote peritoneal carcinomatosis in CXCR4-Expressing gastric cancer[J]. Clin Cancer Res,2011, 17 (11) : 3619-30. DOI: 10.1158/1078-0432.CCR-10-2475. |
| [23] | Liu J, Brown RE. Immunohistochemical detection of epithelialmesenchymal transition associated with stemness phenotype in anaplastic thyroid carcinoma[J]. Int J Clin Exp Pathol,2010, 3 (8) : 755-62. |
| [24] | Otsuki T, Fujimoto D, Hirono Y, et al. Thrombin conducts epithelialmesenchymal transition via proteaseactivated receptor1 in human gastric cancer[J]. Int J Oncol,2014, 45 (6) : 2287-94. |
 2016, Vol. 36
2016, Vol. 36
