慢性阻塞性肺疾病(COPD)是一种具有气流受限特征的肺部疾病,气流受限不完全可逆,呈进行性发展。我国成人COPD的患病率约为5%~13%,其死亡率居所有疾病死因的第4位[1]。随着吸烟人口增多、人口老龄化发展和环境污染加重,COPD的发病率将呈上升趋势,给家庭和社会造成巨大的经济负担[2]。肺动脉高压是COPD常见的并发症之一,其存在增加了COPD急性发作的入院风险及COPD患者的病死率[3-4]。因此早期诊断、治疗COPD继发性肺动脉高压对改善COPD预后有着重要的临床意义。
目前有多种血清学指标用于早期诊断COPD继发性肺动脉高压,如脑钠肽(BNP)、内皮素-1、C反应蛋白、白介素-6及肿瘤坏死因子-α等[5-8]。糖类抗原CA125(CA125)是肺肿瘤标志物全套中的一个重要指标,不但广泛应用于呼吸系统疾病的诊断,而且在卵巢癌、胃肠道肿瘤、脑胶质瘤等疾病的诊断中具有重要价值[9],还可被用于慢性心力衰竭的鉴别诊断[10]。最新研究表明[11],CA125在继发肺动脉高压的稳定期COPD患者血清中显著升高,且与肺动脉收缩压(PASP)呈正相关,提示CA125可被用于判断稳定期COPD患者是否合并肺动脉高压。CA125的表达受机体炎症反应影响[12],当COPD患者因感染而处于急性加重期(AECOPD)时,血清CA125的表达水平及其与肺动脉高压的关系,迄今仍不清楚。为此,本研究旨在观察CA125在AECOPD伴或不伴肺动脉高压患者血清中水平,为早期识别AECOPD继发性肺动脉高压提供可靠的血清学指标。
1 对象和方法 1.1 研究对象研究对象来源于西安交通大学第二附属医院呼吸内科2014年1月~2014年12月收治的AECOPD患者。入院标准符合2013年GOLD指南新制定的COPD诊断标准[13];通过多普勒心脏彩超检测三尖瓣返流压差,计算PASP,PASP大于35 mmHg认为存在肺动脉高压[14]。排除恶性肿瘤、冠心病、左心功能不全、原发性肺动脉高压、肺栓塞、糖尿病、支气管哮喘、活动性肺结核、支气管扩张及肾功能不全的患者。入院后所有患者均行详细的问诊、体格检查、心脏彩超和肺功能检查。根据临床症状及心脏彩超结果,将入选患者分为以下两组:AECOPD合并肺动脉高压组,46例,年龄65±8岁,其中男性33例;单纯AECOPD组,46例,年龄63±7岁,其中男性31例。另选取本院体检中心38例肺功能正常者作为健康对照组,年龄64±9岁,其中男性27例。本研究通过西安交通大学第二附属医院医学伦理委员会审核,并获得研究对象的知情同意。
1.2 研究方法采用德国耶格公司MasterScreen肺功能仪进行肺功能检测。由有经验的超声专家以Nemio17彩色多普勒超声检测三尖瓣返流量,估测PASP。于入院次日空腹抽取AECOPD患者静脉血3 mL,健康对照组于体检当日空腹抽取静脉血3 mL,之后应用低温离心机以4000 r/min于4 ℃下离心10 min,分离血清,采用电化学发光法检测肺肿瘤标志物全套水平(癌胚抗原CEA、神经元特异性烯醇化酶NSE、非小细胞肺癌相关抗原CYFRA、糖类抗原125CA125和胃泌素释放肽前体PROGRP),并应用化学发光法测定BNP水平。
1.3 统计学方法采用SPSS 17.0统计软件分析。数据以均数±标准差或频数或百分比表示。两组计量资料的比较采用两独立样本t检验,多组计量资料的比较采用单因素方差分析检验,计数资料的比较采用卡方检验。相关性分析:当被检验的两个变量均为正态分布时,采用Pearson直线相关分析;当两个变量不全为正态分布时,采用Spearman秩相关分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 基本资料分析AECOPD合并肺动脉高压组、单纯AECOPD组及健康对照组的基本资料见表 1。研究显示,年龄、性别、体质量指数、吸烟指数在各组之间无统计学差异(P > 0.05)。其中AECOPD合并肺动脉高压组合并高血压5例,单纯AECOPD组合并高血压6例,健康对照组合并高血压5例,各组间比较无统计学差异(P > 0.05)。依据三尖瓣返流压差估算PASP,结果显示AECOPD合并肺动脉高压组的PASP为56.2±11.9 mmHg,单纯AECOPD及健康对照组均无肺动脉高压(PASP < 35 mmHg)。与健康对照组相比,AECOPD合并肺动脉高压或无肺动脉高压组的FEV1%预计值、FEV1/FVC均显著降低,且AECOPD合并肺动脉高压组的肺功能最差,各组间比较有统计学差异(P < 0.05)。AECOPD合并肺动脉高压组患者的PaO2(51.3±9.28)和PaCO2(48.7±7.47)较单纯AECOPD组(63.3±6.34,40.7±6.31)显著加重(P < 0.05)。
| 表 1 研究对象的基本资料比较 Table 1 General demographic and clinical data of the 3 groups |
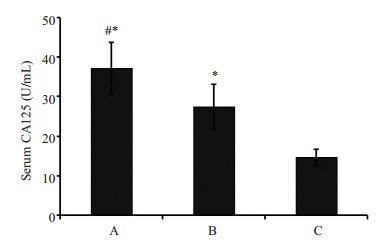
血清学检测显示,单纯AECOPD组患者的血清CA125水平较健康对照组显著升高(27.4±5.67 vs 14.7±2.11 U/mL,P < 0.05),当AECOPD合并肺动脉高压时血清CA125水平(37.2±6.64 U/mL)将进一步升高(P < 0.05,表 2和图 1)。然而其它肺肿瘤标志物CEA、NSE、CYFRA、PROGRP的血清水平在各组间比较无统计学差异(P > 0.05,表 2)。AECOPD合并肺动脉高压组患者的血清BNP水平(183±45.4 pg/mL)亦高于单纯AECOPD组(101±22.6 pg/mL),差异有统计学意义(P < 0.05,表 2)。
|
图 1 血清CA125在各组中水平 Figure 1 Comparison of serum levels of CA125 among the 3 groups. A: AECOPD with pulmonary hypertension group; B: AECOPD group; C: Healthy control group. *P < 0.05 vs group C; #P < 0.05 vs group B. |
| 表 2 血清肺肿瘤标志物和BNP检测结果 Table 2 Serum levels of lung tumor markers and BNP in the 3 groups |
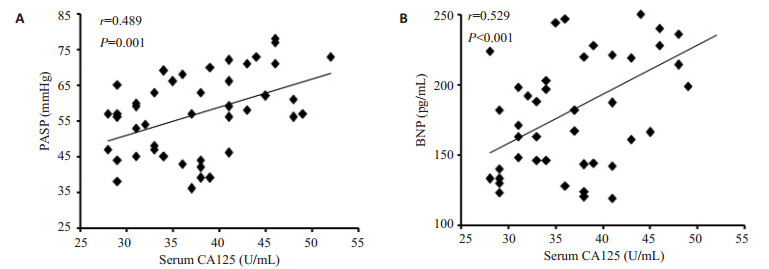
K-S法正态性检验显示,AECOPD合并肺动脉高压组患者的血清CA125、PASP、BNP的P值均大于0.10,可视为正态分布资料,因此它们之间的相关性检验采用Pearson直线相关分析。相关分析结果表明,AECOPD合并肺动脉高压组患者血清CA125与PASP及BNP均呈正相关(r=0.489,P=0.001,r=0.529,P < 0.001,respectively),见图 2。此外,AECOPD合并肺动脉高压组患者的血清BNP与PASP亦呈正相关(r=0.753,P < 0.001)。
|
图 2 AECOPD合并肺动脉高压组患者血清CA125与肺动脉收缩压、脑钠肽的相关性 Figure 2 Correlations of serum CA125 with PASP (A) and BNP (B) in AECOPD patients with pulmonary hypertension. |
COPD是多种因素参与的气道慢性炎症性疾病,除肺部炎症反应外,全身炎症应答亦参与其发病过程[15]。且进一步研究表明,COPD患者的炎症反应强度与肺功能呈负相关[16-17]。在本研究中,我们虽未测定C反应蛋白、白介素-6、白介素-8、肿瘤坏死因子α等炎症指标的水平,但通过肺功能和动脉血气分析,我们推测AECOPD合并肺动脉高压组患者的炎症反应更为强烈。在COPD病程中,多种炎症介质及缺氧可破坏肺部毛细管血管,微血管床重构,甚至微血栓形成,增加了肺循环阻力,导致肺动脉压力升高。目前虽然心脏彩超可确诊COPD继发肺动脉高压,但由于心脏彩超医生的临床经验不足或三尖瓣返流不明显,部分早期肺动脉高压患者可能被漏诊。近年已有多种血清学指标被用于早期预测或诊断COPD患者中肺动脉高压的发生[18],但有关CA125在本病中作用的研究仍相对较少。
CA125是一种糖蛋白,正常人的平均水平≤35 U/mL,当超过正常水平两倍时,需进一步完善相关检查排除恶性肿瘤,尤其对卵巢肿瘤有重要意义[19]。已有文献报道[10, 20],CA125还可被用于心力衰竭的鉴别诊断。进一步研究发现[21],CA125与慢性心力衰竭的严重程度及液体潴留有关,但与射血分数、左心室内径无关;右心功能不全时,CA125与右心室腔扩大有关,但通过对肺动脉压力等多个变量校正后,发现升高的CA125仅仅与右心功能不全有关。以上研究提示,心腔压力增加可能是血清CA125表达水平上调的一个机制。
目前已有少许研究探索CA125在COPD继发肺动脉高压中的作用[11, 22]。研究显示[11],与单纯稳定期COPD患者相比,CA125在继发肺动脉高压的稳定期COPD患者血清中显著升高,且与PASP呈正相关,提示CA125可用于识别稳定期COPD继发肺动脉高压。然而血清CA125是否依然能够反应AECOPD合并肺动脉高压,目前仍不清楚。为此,本研究对可能影响CA125的因素(年龄、性别、体质量指数、吸烟指数及高血压)在各观察组进行充分匹配后,研究表明单纯AECOPD组患者的血清CA125明显升高,当合并肺动脉高压时进一步升高,且与PASP呈正相关,这与CA125在继发肺动脉高压的稳定期COPD患者血清中的变化趋势保持一致[11]。BNP作为COPD继发肺动脉高压的一个独立预测指标[5],本研究亦发现AECOPD合并肺动脉高压组患者的BNP明显升高,且与CA125、PASP呈正相关。因此,CA125的升高与AECOPD临床状态及其恶化有一定的相关性,可用于早期识别AECOPD患者中肺动脉高压的发生。
综上所述,本研究发现CA125不仅在单纯AECOPD患者血清中显著升高,且随着AECOPD患者肺动脉高压的出现更进一步增加,提示早期、动态监测血清CA125水平变化,能够及时发现和估测AECOPD患者肺动脉高压的发生。在后续研究中,我们将观察CA125在COPD继发肺动脉高压患者(急性加重期、稳定期)血清中的动态变化,为进一步明确血清CA125在COPD中的临床价值提供有益数据。
| [1] | 方晓聪, 王向东, 白春学. 慢性阻塞性肺疾病在中国的诊治现状[J]. 国际呼吸杂志,2011, 31 (7) : 493-7. |
| [2] | Fang X, Wang X, Bai C. COPD in China:the burden and importance of proper management[J]. Chest,2011, 139 (4) : 920-9. DOI: 10.1378/chest.10-1393. |
| [3] | Chaouat A, Naeije R, Weitzenblum E. Pulmonary hypertension in COPD[J]. EurRespir J,2008, 32 (5) : 1371-85. |
| [4] | Weitzenblum E, Chaouat A, Kessler R. Pulmonary hypertension in chronic obstructive pulmonary disease[J]. Pneumonol Alergol Pol,2013, 81 (4) : 390-8. |
| [5] | Flessas N, Alexanian I, Parissis J, et al. Plasma activity of B-type natriuretic peptide in patients with biventricular heart failure versus those with right heart failure due to chronic obstructive pulmonary disease[J]. J Cardiovasc Med (Hagerstown),2014, 15 (6) : 476-80. DOI: 10.2459/JCM.0000000000000007. |
| [6] | Kwon YS, Chi SY, Shin HJ, et al. Plasma C-Reactive protein and endothelin-1 level in patients with chronic obstructive pulmonary disease and pulmonary hypertension[J]. J Korean Med Sci,2010, 25 (10) : 1487-91. DOI: 10.3346/jkms.2010.25.10.1487. |
| [7] | He H, Tao Y, Chen X, et al. High levels of interleukin-6 and 8-iso-prostaglandin in the exhaled breath condensate and serum of patients with chronic obstructive pulmonary disease related pulmonary hypertension[J]. Chin Med J,2014, 127 (9) : 1608-12. |
| [8] | Ansarin K, Rashidi F, Namdar H, et al. Echocardiographic evaluation of the relationship between inflammatory factors (IL6, TNFα, hs-CRP) and secondary pulmonary hypertension in patients with COPD. A cross sectional study[J]. Pneumologia,2016, 64 (3) : 31-5. |
| [9] | Bottoni P, Scatena R. The role of CA 125 as tumor marker:biochemical and clinical aspects[J]. Adv Exp Med Biol,2015, 867 (4) : 229-44. |
| [10] | Núñez J, Miñana G, Núñez E, et al. Clinical utility of antigen carbohydrate 125 in heart failure[J]. Heart Fail Rev,2014, 19 (5) : 575-84. DOI: 10.1007/s10741-013-9402-y. |
| [11] | Rahimi-Rad MH, Rahimi P, Rahimi B, et al. Serum CA-125 level in patients with chronic obstructive pulmonary disease with and without pulmonary hypertension[J]. Pneumologia,2014, 63 (3) : 164-6. |
| [12] | Hamdy NM. Relationship between pro-anti-inflammatory cytokines, T-cell activation and CA 125 in obese patients with heart failure[J]. Med Sci Monit,2011, 17 (3) : CR174-9. |
| [13] | Hatipoğlu U, Aboussouan LS. Chronic obstructive pulmonary disease:an update for the primary physician[J]. Cleve Clin J Med,2014, 81 (6) : 373-83. DOI: 10.3949/ccjm.81a.13061. |
| [14] | 姜玉新, 王志刚. 医学超声影像学[M]. 北京: 人民卫生出版社, 2010 : 123 . |
| [15] | Macnee W. Systemic inflammatory biomarkers and co-morbidities of chronic obstructive pulmonary disease[J]. Ann Med,2013, 45 (3) : 291-300. DOI: 10.3109/07853890.2012.732703. |
| [16] | Fogarty AW, Jones S, Britton JR, et al. Systemic inflammation and decline in lung function in a general population:a prospective study[J]. Thorax,2007, 62 (6) : 515-20. DOI: 10.1136/thx.2006.066969. |
| [17] | Donaldson GC, Seemungal TA, Patel IS, et al. Airway and systemic inflammation and decline in lung function in patients with COPD[J]. Chest,2005, 128 (4) : 1995-2004. DOI: 10.1378/chest.128.4.1995. |
| [18] | Joppa P, Petrasova D, Stancak B, et al. Systemic inflammation in patients with COPD and pulmonary hypertension[J]. Chest,2006, 130 (2) : 326-33. DOI: 10.1378/chest.130.2.326. |
| [19] | Weiland F, Martin K, Oehler MK, et al. Deciphering the molecular Nature of ovarian cancer biomarker CA125[J]. Int J Mol Sci,2012, 13 (8) : 10568-82. |
| [20] | Zhuang J, Faggiano P, Li Q, et al. Insights into the clinical implications of carbohydrate antigen 125 as a biomarker of heart failure:a meta-analysis and systematic review of published studies[J]. J Cardiovasc Med (Hagerstown),2014, 15 (12) : 864-72. DOI: 10.2459/JCM.0000000000000051. |
| [21] | Kouris NT, Zacharos ID, Kontogianni DD, et al. The significance of CA125 levels in patients with chronic congestive heart failure. Correlation with clinical and echocardiographic parameters[J]. Eur J Heart Fail,2005, 7 (2) : 199-203. DOI: 10.1016/j.ejheart.2004.07.015. |
| [22] | Uz O, Kardesoglu E, Tas D, et al. CA-125 level is associated with right ventricular echocardiographic parameters in patients with COPD[J]. South Med J,2011, 104 (9) : 624-8. DOI: 10.1097/SMJ.0b013e318229a55c. |
 2016, Vol. 36
2016, Vol. 36
