2. 海军总医院妇产科, 北京 100048 ;
3. 海军总医院病理科, 北京 100048
2. Department of Gynecology and Obstetrics, Navy General Hospital, Beijing 100048, China ;
3. Department of Pathology, Navy General Hospital, Beijing 100048, China
子宫内膜异位症(EMs)指子宫内膜上皮和间质在宫腔以外的部位生长,所引起的疾病。EMs是育龄女性常见病之一,可导致月经紊乱、痛经、性交疼痛及不孕,甚至有可能发生恶变,严重影响了女性的生活质量[27]。目前,EMs的确切病因及发病机制尚未完全明确。由于EMs属雌激素依赖性疾病,现有的治疗方法主要通过药物阻断雌激素供给而使病灶萎缩,或通过手术彻底清除病灶。但停药后EMs往往复发迅速,术后2年复发率甚至高达40% [25],可见现有的以EMs病灶为靶点的治疗方法有效性不高、费用高且副作用大。因此亟待通过进一步对EMs发病机制的研究,以寻求新的治疗思路。
近年来有研究提出“在位内膜决定论” [1],认为EMs患者的在位内膜与正常女性的在位内膜存在本质不同,其脱落后具有更强的生存、增殖能力,从而更易形成异位病灶,因此EMs的启动部位应该是子宫。相关的动物研究由此展开,越来越多的研究结果证实,在位的子宫内膜经缺氧刺激后,其生理功能会发生一定改变,当其随月经脱落并逆流入盆腔后,更能适应盆腔的缺氧环境,从而更易存活、异位粘附和种植,并形成异位病灶[2-5]。
低氧预处理(hypoxic preconditioning, HPC)指在组织细胞面临致死性低氧前,先给予数小时或数天的非致死性低氧处理,使细胞获得低氧保护性机制以抵抗致死性应激,这一方法最初应用于心肌缺血再灌注的研究,由于HPC对细胞的保护作用具有普遍性,故而逐步扩展到神经保护及其它领域的研究[6-9]。目前关于HPC对在位子宫内膜影响的研究则较为罕见,且在大部分相关实验研究中[2-4],移植物与移植受体多为非同种属动物,而经手术切除获得的EMs患者内膜组织也已失去血供,无法准确反映其正常生理状态。为此,本研究将通过EMs同种异体移植动物模型,了解HPC对在位内膜及异位病灶形成的影响,进一步明确低氧与EMs发生的关联并初步探讨其分子机制,从而为EMs的治疗提供实验依据和新思路。
1 材料和方法 1.1 动物分组8~10周龄雌性Lewis大鼠30只,体质量208±19 g,购自并饲养于解放军总医院动物中心。室内12 h昼夜交替,室温24 ℃,相对湿度40%~60%,大鼠可自由进食水。本实验设计已通过解放军总医院动物中心伦理委员会审核。
大鼠以3%戊巴比妥钠(45 mg/kg)腹腔注射麻醉后切除双侧卵巢,每日肌肉注射苯甲酸雌二醇(0.2 mg/kg)(天津金耀)直至实验结束。术后14 d,动物随机分为4组,其中常氧预处理组(Pre-Con)和低氧处理组(Pre-HPC)每组3只动物,常氧移植组(Con)和低氧移植组(HPC)每组12只动物。
1.2 低氧预处理动物实验用低氧舱由解放军总医院动物中心提供,将Pre-HPC组大鼠置于舱中,舱内温度23 ℃,湿度50%;逐渐调节舱内压力,使舱内氧含量为6%~8%(相当于海拔6000 m),持续8 h。Pre-Con组大鼠置于同样温湿度的常氧环境内8 h。
1.3 EMs动物模型建立Pre-Con组大鼠麻醉后,取出双侧子宫角,置于盛有DMEM(Gibco, USA)和青链霉素混合液(索莱宝,中国)的培养皿中,将子宫角完全剖开,并剪成内膜面积约5 mm×5 mm的组织块。Con组大鼠麻醉后,在下腹中部纵向切开皮肤约2 cm,逐层进入腹腔,分别于切口两侧腹壁表面,距切口2 cm处,以3-0丝线1针缝合上述子宫组织块1块,并使子宫内膜面贴合腹腔壁表面,常规缝合术口。Pre-HPC组大鼠子宫角组织参照上述方法移植入HPC组大鼠腹腔。术后各组大鼠连续3 d注射青霉素钠(5U/只, i.m.)抗感染。
术后观察见大鼠术口均无异常,精神状态好、活动灵活、进食水正常。
1.4 样本采集Pre-Con、Pre-HPC组用于移植后剩余的子宫组织-80 ℃冻存待用。Con及HPC组大鼠,在移植手术完成后14 d,常规麻醉,切开腹壁充分暴露移植病灶,以游标卡尺测量病灶最长及最短直径;随后切除病灶,一半置于4%中性多聚甲醛,用于制作石蜡切片,另一半以生理盐水冲洗后,-80 ℃冻存待用;腹主动脉取血并留取腹腔积液,2000 r/min离心3 min,取上清-80 ℃冻存待用。
1.5 ELISA法检测大鼠血清和腹水血管内皮生长因子(VEGF)、TNF-α含量,以及移植病灶Bcl-2、Bax含量将冻存的血清及腹水以生理盐水10倍稀释作为待测样本;将冻存的移植前子宫组织及移植病灶组织称重后置于生理盐水中,以超声仪(XO-1200,先欧科技,China)充分裂解为5%的组织悬液,2000 r/min离心3 min,取上清作为待测样本。参照Elisa试剂盒(上海哈灵生物, China)说明书,依次加样、孵育及显色后,上酶标仪(Model550, BIO-RAD, USA)在450 nm处检测各孔吸光值,根据标准孔浓度及吸光值,绘制标准曲线,随后计算出各样本对应浓度。
1.6 免疫组织化学法检测移植病灶CK18、SMA、CD31、VEGF、Ki67表达移植病灶行常规石蜡制片,切片脱蜡至水,经EDTA(pH9.0)微波修复后,以3% H2O2阻断内源性过氧化物酶10 min,3% BSA室温封闭30 min,一抗(CK18 SMA VEGF, 谷歌生物, China. CD31, Santa Cruz, USA. Ki67, abcom, USA.)4 ℃孵育过夜,PBS浸洗,二抗(DAKO, Denmark)室温孵育60 min,PBS浸洗,DAB(索莱宝,China)显色,苏木素复染后常规脱水、透明、封片,光镜下观察。
Ki67染色切片在400×光镜下随机取6个含有上皮组织的视野拍照,计数所有视野中上皮细胞总数及阳性细胞数,计算得到每张切片的阳性细胞百分比。VEGF染色切片在200×光镜下随机取3个视野拍照,图像采用CMIAS软件(Beijing University of Aeronautics and Astronautics, China)进行分析,得到每个视野中对应抗原表达的面密度并求出均值。
1.7 Tunnel法检测移植病灶组织细胞凋亡移植病灶石蜡切片脱蜡至水,参照Tunnel检测试剂盒(索莱宝,中国)说明书,切片依次以2%过氧化氢浸泡10 min,20 μg/mL蛋白酶K浸泡15 min,PBS浸洗,TdT酶缓冲液浸泡10 min,滴加TdT酶反应液37 ℃孵育1 h,反应终止液浸泡5 min,PBS浸洗,Streptavidin-HRP室温孵育30 min,PBS浸洗,DAB显色,常规脱水、透明、封片,光镜下观察。每张切片在200×光镜下随机取3个视野拍照,图像采用CMIAS软件进行分析,得到每个视野的面密度并求出均值。
1.8 Western boltting检测原位子宫和移植病灶中VEGF、HIF-1α表达常规提取移植前子宫组织及移植病灶组织总蛋白,采用BCA法(碧云天)蛋白定量,以4×上样缓冲液稀释(碧云天)后95 ℃热变性15 min后作为样本。样本上样量50 μg,12% SDS-PAGE电泳,转PVDF膜,5%脱脂奶粉室温封闭1 h,TBS-T浸洗,以HIF-1α、VEGF、β-actin(谷歌生物,Chian)一抗4 ℃孵育过夜,TBS-T浸洗,以HRP标记的二抗(Bioworld, USA)室温孵育1 h,TBS-T浸洗,ECL发光液显色(Bioworld, USA),随后以凝胶扫描成像及图像分析系统(SCA/fluorCho, Alpha Inotech, USA)观察拍照,并对结果进行图像分析。
1.9 RT-PCR检测原位子宫和移植病灶VEGF mRNA表达移植前子宫组织及移植病灶组织经液氮充分碾磨后,加入Trizol reagent(Invitrogen, USA)常规提取RNA。引物信息为:VEGF-forward 5'-ACCATGAAC TTTCTGCTC-3';VEGF-reverse 5'-GGACGGCTTGA AGATATA-3';β-actin-forward 5'-GGAGATTACTGC CCTGGCTCCTA-3';β-actin-reverse 5'-GACTCATCG TACTCCTGCTTGCTG-3'。随后配置A液:样本RNA 9 μL,加入Random primer 1 μL,70 ℃金属浴5 min,立即0 ℃冷却5min;B液:采用GoScript Reverse Transcription system(Promega, USA),参照说明书,配制10 μL Reverse Transcription mix;混合A、B液,25 ℃退火5 min,42 ℃延伸1 min,70 ℃灭活逆转录酶5 min,完成cDNA合成。随后采用SYBR Green PCR Master Mix(Applied Biosystems, USA)配制反应体系,设定仪器7500 Real Time PCR System (Applied Biosystems, USA) 40个PCR循环(95 ℃ 15 s,60 ℃ 1 min)进行扩增,并读取各样本目的基因和内参基因的Ct值,随后计算出目的基因相对表达量,每个样本进行3个复孔实验,取均值作为该样本目的基因表达量。
1.10 统计学分析数据以均数±标准差表示,采用SPSS17.0软进行单因素及两因素方差分析,以P < 0.05认为差异具有统计学差异。
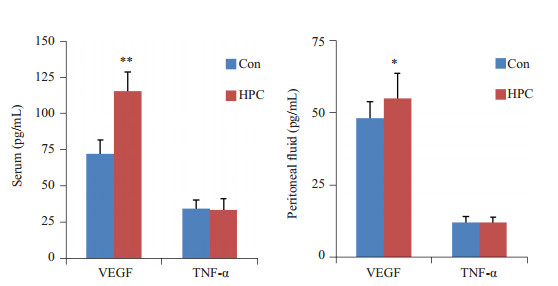
2 结果 2.1 HPC可增加大鼠血清及腹腔液中VEGF含量统计结果显示,HPC组大鼠的血清(n=12, df=1, F=89.320, P=0.000)及腹腔液(n=12, df=1, F=4.964, P=0.036)中VEGF含量均显著高于Con组;但血清(n=12, df=1, F=0.142, P=0.710)及腹腔液(n=12, df=1, F=0.001, P=0.971)TNF-α含量未见改变(图 1)。
|
图 1 HPC对大鼠血清及腹腔液中VEGF和TNFa含量的影响 Figure 1 Changes of VEGF and TNF-α levels in serum and peritoneal fluid after hypoxia pretreatment. vs Con, **P < 0.01, *P < 0.05, n=12. |
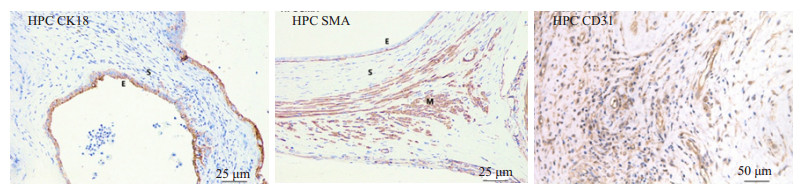
移植术后14 d,大鼠腹腔移植处均形成单个囊泡状病灶,囊泡基底及表面均可见血管形成,内含清亮液体。免疫组化CK18、SMA、CD31染色结果显示(图 2),病灶囊壁内表面为一层子宫内膜腺样上皮(CK18 +++),囊壁及基底组织内可见大量血管(CD31+++)及平滑肌组织(SMA+++)分布;囊腔内可见炎性细胞。上述移植病灶组织形态结构符合EMs病变,提示建模成功。
|
图 2 大鼠移植病灶免疫组化鉴定 Figure 2 Immunohistochemical staining of CK18, SMA and CD31 in endometriotic implants. The lesions show a dilated endometrial glands surrounded by stroma. E: Endometrial gland; S: Endometrial stroma; M: Muscle. |
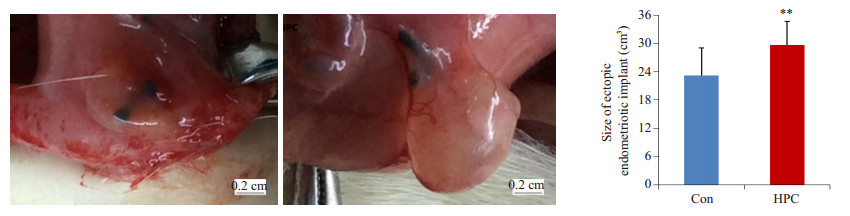
根据测量所得病灶最短和最长直径,应用公式:体积(mm3)=л/4×a2×b(a为病灶最短直径,b为最大直径),计算出病灶体积。单因素方差分析结果显示,HPC组移植病灶体积较Con组显著增大(n=12, df=1, F=8.404, P=0.008,图 2)。
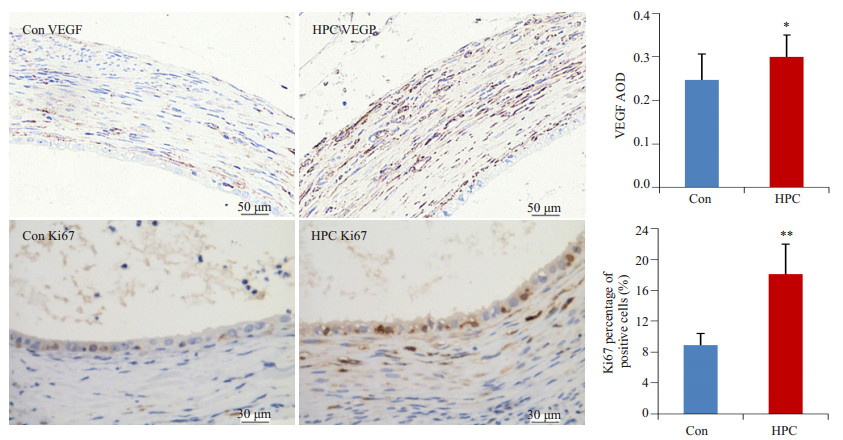
2.4 HPC可增加大鼠移植病灶VEGF、Ki67表达免疫组化染色结果显示,HPC组病灶囊壁及基底组织大量血管内皮增生,VEGF呈强阳性(+++)表达,上皮Ki67阳性细胞率约为25%;Con组病灶也可见新生血管形成,但VEGF阳性程度较弱(++),上皮Ki67阳性细胞率约为10%(图 3、4)。图像分析及单因素方差分析结果显示,HPC组病灶VEGF(n=12, df=1, F=5.539, P=0.028)、CD31(n=12, df=1, F=10.175, P=0.004)表达均较Con组显著增强,其上皮Ki67阳性细胞数量也显著多于Con组(n=12, df=1, F=59.831, P=0.000)。以上结果提示,HPC有可能通过促进移植病灶组织血管生成及细胞增殖,从而促进移植病灶的生长。
|
图 3 HPC对移植病灶体积的影响 Figure 3 Changes of the volume of ectopic endometriotic implant after hypoxia pretreatment. **P < 0.01, n=12. |
|
图 4 HPC对移植病灶VEGF、Ki67表达的影响 Figure 4 VEGF and Ki67 expression of ectopic endometriotic implant after hypoxia pretreatment. vs Con, **P < 0.01, *P < 0.05, n=12. |
Tunnel检测结果显示(图 5),镜下可见Con组病灶约10~15%细胞发生凋亡,HPC组凋亡细胞较Con组少。单因素方差分析结果显示,HPC组移植病灶Tunnel染色切片面密度显著低于Con组(n=12, df=1, F=47.000, P=0.000)。
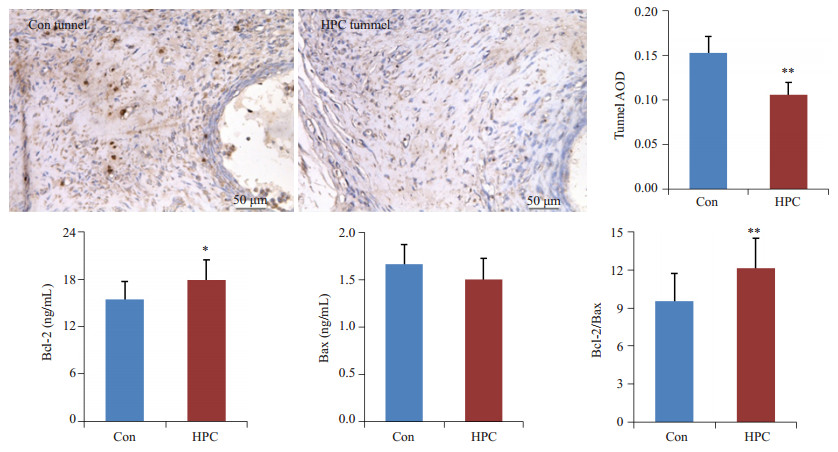
|
图 5 HPC对移植病灶组织细胞凋亡及凋亡相关因子表达的影响 Figure 5 The VEGF, CD31, Ki67 expression of ectopic endometriotic implant after hypoxia pretreatment. vs Con, **P < 0.01, *P < 0.05, n=12. |
ELISA检测结果显示(图 5),HPC组移植病灶Bcl-2表达较Con组显著上调(n=12, df=1, F=5.778, P=0.025),此外尽管二者Bax表达无显著差异(n=12, df=1, F=3.246, P=0.085),但HPC组Bcl-2/Bax比值较Con组显著增加(n=12, df=1, F=7.832, P=0.010)。以上结果提示,HPC有可能通过上调抑凋亡因子Bcl-2表达,从而减少移植病灶组织细胞凋亡发生。
2.6 HPC可上调原位和异位内膜及其间质组织中VEGF mRNA表达,并增加低氧诱导因子(HIF)-1α、VEGF表达检测结果显示(图 6),经HPC 8 h后,大鼠子宫组织HIF-1α表达显著增高(n=12, df=1, F=47.107, P=0.002),同时VEGF mRNA显著上调(n=12, df=1, F=12.812, P=0.023),但VEGF表达未见著变(n=12, df=1, F=12.812, P=0.097);移植术14 d后,与由移植未经HPC子宫组织形成的移植病灶比较,由HPC组织形成的移植病灶组织中VEGF mRNA显著上调(n=12, df=1, F=10.136, P=0.004),且VEGF(n=12, df=1, F=52.817, P=0.000)、HIF-1α(n=12, df=1, F=96.674, P=0.000)表达均显著增加。
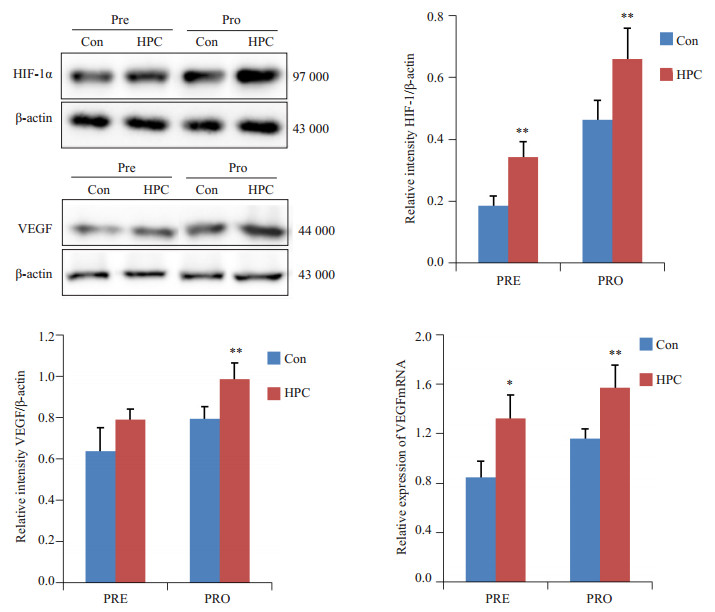
|
图 6 HPC对大鼠子宫和移植病灶HIF-1α、VEGF及VEGFmRNA表达的影响 Figure 6 VEGF, VEGF mRNA and HIF-1α expression in ectopic endometriotic implant of pre-transplantation and pro-transplantation. vs Con, **P < 0.01, *P < 0.05, before hypoxia pretreatment n=3, after hypoxia pretreatment n=12. |
进一步的两因素方差分析结果提示,尽管HPC与移植术两因素间未见显著相互作用,但对原位和异位内膜及其间质组织而言,HPC均可显著上调其中VEGF mRNA(df=1, F=11.968., P=0.002),并增加HIF-1α(df=1, F=75.197, P=0.000)、VEGF(df=1, F=30.368, P=0.000)表达。此外,对无论是否经HPC的子宫内膜及其间质组织而言,由其形成的移植病灶VEGF mRNA(df=1, F=30.381, P=0.000)、VEGF(df=1, F=28.623, P=0.000)、HIF-1α(df=1, F=26.542, P=0.000)表达均较原位组织显著上调。
3 讨论啮齿类动物易于管理且便于手术操作,是构建EMs模型的常用动物。基于子宫内膜同种异体移植的需要,本实验选用可耐受多次手术操作及异体移植的Lewis大鼠。正常雌鼠动情周期约4~5 d,部分血清指标及子宫内膜均呈一定周期性规律改变[26]。为避免动情周期所造成的实验误差,本实验首先将所有大鼠予以去势术及人为雌激素干预处理,恢复14 d后,再次进行移植手术,并于移植术后14 d进行相关检测。两次术后,大鼠均活动自如、饮食正常,无感染或死亡。经免疫组化鉴定,移植灶具有与EMs病变形态结构及生理表现相符合的子宫内膜上皮及间质,该结果提示建模成功。
众所周知,不同强度和持续时间刺激可使细胞发生不同的应激反应。对于体细胞而言,严重低氧会刺激线粒体发出凋亡信号,直接导致细胞死亡。研究发现,抗凋亡因子Bcl-2在分泌晚期子宫内膜腺上皮中基本不表达[20];而月经期脱落的子宫内膜中,大部分细胞已分化为成熟的体细胞,失去子宫血液供应并处于严重缺氧状态。因此,生理状态下,脱落的内膜组织细胞已启动凋亡程序,进入腹腔后发生死亡,随后被腹腔免疫细胞清除,不会再生并形成异位病灶。但与严重缺氧不同的是,短暂、轻度的非致死性的低氧刺激,则可诱发细胞的适应性低氧反应。近年来越来越多的研究证实,EMs发生发展与低氧刺激关系密切[2-4],有研究报道经HPC的EMs患者子宫内膜组织,移植至重症联合免疫缺陷(SCID)小鼠皮下,术后病灶体积较未经HPC的显著增大。本实验证实,与未经HPC的比较,经HPC的子宫组织移植后,形成的移植病灶体积更大、表面新生血管更多。
HIFs是细胞应对低氧应激的主要调节因子之一[10]。研究发现,在低于静脉氧分压(40 mmHg或 < 6% O2)时,细胞往往将启动由HIF-1α所操控的一系列低氧反应[15]。HIF-1α可直接或间接的诱导包括VEGF在内的多种促血管生成因子表达,最终促进血管生成[16-18]。本研究发现,大鼠经HPC 8 h,原位子宫组织中HIF-1α表达即显著增加,这一改变延续至原位组织被移植入正常大鼠腹腔并形成EMs病灶。该结果提示,短期HPC即可激活HIF-1α,HIF-1α的活化应为HPC影响EMs发生发展的上游机制。
VEGF具有强大的促内皮增殖作用,是促血管生成的主导因素。研究发现EMs患者血清及腹腔液中VEGF含量均较正常显著升高[19];与正常在位内膜比较,EMs病灶VEGF表达显著增多,且早期病灶较晚期病灶更为丰富[27]。以上提示VEGF表达水平可直接影响EMs的发生发展。本研究发现,经HPC 8 h,尽管大鼠子宫组织VEGF表达未见著变,但其mRNA显著上调,提示短期HPC即可激活VEGF基因转录。移植术后14 d,与未经HPC的比较,由经HPC的子宫组织形成的移植病灶VEGF mRNA依然显著上调,VEGF表达也显著增加;且HPC组大鼠的血清和腹腔液VEGF含量显著高于Con组。以上结果提示VEGF在HPC影响EMs发生发展中起重要作用。
研究证实,轻度低氧还可诱导VEGF之外多种其它因子表达的改变[12]。有研究发现,HPC可通过减少体外培养细胞促凋亡因子Bax、Bad和Bid表达,同时增加其抗凋亡因子Bcl-2和Bcl-xL表达[21],从而抑制细胞凋亡,增加其对致死性低氧应激的耐受,并增强其存活能力[11]。本研究发现,与未经HPC的比较,由经HPC后的子宫组织所形成的移植病灶组织Bcl-2表达及Bcl-2/Bax值均显著增加,同时细胞凋亡发生率明显降低。由于Bcl-2和Bax是作用相互对立的一对因子,一般认为Bcl-2/ Bax比值增大提示细胞抗凋亡能力增强[28]。由此可见,HPC可通过上调Bcl-2表达,增强细胞抗凋亡能力,从而参与其对EMs发生和发展的影响。
Ki67是应用最广泛的细胞增殖标记物,当细胞增殖旺盛时Ki67表达显著增加。在正常子宫内膜及EMs患者在位内膜中,上皮Ki67表达均随月经周期发生改变,增生期高于分泌期;在EMs患者异位内膜上皮中Ki67则持续表达[29]。本研究尚发现由经HPC后的子宫组织所形成的移植病灶上皮组织内,Ki67阳性细胞数量明显增多。该结果提示,HPC尚可促进移植病灶上皮细胞增殖。
TNF-α由被内毒素激活的巨噬细胞产生,是机体免疫、炎症反应、凋亡等细胞生理功能的调节因子之一。在正常子宫内膜中,TNF-α表达受雌、孕激素的调节。研究发现,TNF-α基因多样性与EMs发生存在关联[24],TNF-α还可通过促进细胞增殖、炎细胞浸润、血管新生和组织粘连等,而参与EMs形成[23]。有研究指出,EMs患者腹腔液中TNF-α含量较正常女性显著增高,且TNF-α含量与EMs的严重程度存在正相关[22]。本实验发现,移植术后14 d,HPC及Con两组大鼠,腹腔液及血清中TNF-α含量无明显差异。由此可见,大鼠血清及腹腔液TNF-α含量不受移植病灶来源组织是否经HPC影响。该结果尚提示,动物模型与真实疾病病灶的形成机理尚存在一定差异,因此动物模型尚未能完全模拟真实疾病的生理改变。
综上所述,本研究首次将HPC方法应用于在位子宫内膜同种异体移植,发现给予大鼠非致死剂量的HPC,可以使其子宫组织获得低氧保护性效应,HPC一方面可通过激活HIF-1α/VEGF体系,使子宫组织分泌促血管生成因子,进而促进移植病灶内血管生成,增加病灶血供;另一方面还可通过上调Bcl-2抑凋亡因子表达,抑制其凋亡,并促进其增殖;最终促进移植病灶的生长。
本研究为进一明确EMs的发生机制及其治疗提供了一定实验依据。基于此,我们推测对于EMs高风险对象或复发患者而言,避免其在位子宫内膜组织反复接受低氧刺激,以及如何在其脱落前即人为干预抑制HIFs/VEGF体系活化,有望成为控制EMs发生发展的措施。
| [1] | Brosens I, Brosens JJ, Benagiano G. The eutopic endometrium in endometriosis:arethe changes of clinical significance[J]. Reprod Biomed Online,2012, 24 (5) : 496-502. DOI: 10.1016/j.rbmo.2012.01.022. |
| [2] | Xu TX, Zhao SZ, Dong M, et al. Hypoxia responsive miR-210 promotes cell survival and autophagy of endometriotic cells in hypoxia[J]. Eur Rev Med Pharmacol Sci,2016, 20 (3) : 399-406. |
| [3] | Tsuzuki T, Okada H, Shindoh H, et al. Effects of the hypoxiainducible factor-1 inhibitor echinomycin on vascular endothelial growth factor production and apoptosis in human ectopic endometriotic stromal cells[J]. Gynecol Endocrinol,2016, 32 (4) : 323-8. DOI: 10.3109/09513590.2015.1121225. |
| [4] | Filippi I, Carrarelli P, Luisi S, et al. Different expression of hypoxic and angiogenic factors in human endometriotic lesions[J]. Reprod Sci,2016, 23 (4) : 492-7. DOI: 10.1177/1933719115607978. |
| [5] | Lu ZC, Zhang WY, Jiang SF, et al. Effect of Oxygen tensions on the proliferation and angiogenesis of endometriosis heterograft in severe combined immunodeficiency mice[J]. Fertil Steril,2014, 101 (2) : 568-76. DOI: 10.1016/j.fertnstert.2013.10.039. |
| [6] | Tang YL, Zhu W, Cheng M, et al. Hypoxic preconditioning enhances the benefit of cardiac progenitor cell therapy for treatment of myocardial infarction by inducing CXCR4 xpression[J]. Circ Res,2009, 104 (10) : 1209-16. DOI: 10.1161/CIRCRESAHA.109.197723. |
| [7] | Jahan A, Sybille DM. Hypoxic-preconditioning enhances theregenerative capacity of neural stem/progenitors in subventricular zone of newborn Piglet brain[J]. Stem Cell Res,2013, 11 (2) : 669-86. DOI: 10.1016/j.scr.2013.04.007. |
| [8] | Hsiao ST, Dilley RJ, Gj D, et al. Ischemic preconditioning for cell-based therapy and tissue engineering[J]. Pharmacol Ther,2014, 142 (2) : 141-53. DOI: 10.1016/j.pharmthera.2013.12.002. |
| [9] | Yeh CH, Hsu SP, Yang CC, et al. Hypoxic preconditioning reinforces HIF-alpha-dependent HSP70 signaling to reduce ischemic renal failure-induced renal tubular apoptosis and autophagy[J]. Life Sci,2010, 86 (3/4) : 115-23. |
| [10] | Lee JW, Bae SH, Jeong JW, et al. Hypoxia-inducible factor (HIF-1) alpha:its protein stability and biological functions[J]. Exp Mol Med,2004, 36 (1) : 1-12. DOI: 10.1038/emm.2004.1. |
| [11] | Verges S, Chacaroun S, Godin-Ribuot D, et al. Hypoxic conditioning as a new therapeutic modality[J]. Front Pediatr,2015 (3) : 58. |
| [12] | Cassavaugh J, Lounsbury KM. Hypoxia-Mediated biological control[J]. J Cell Biochem,2011, 112 (3) : 735-44. DOI: 10.1002/jcb.22956. |
| [13] | Dmitrovic R, Peter B, Cvitkovic-Kuzmic A, et al. Severity of symptoms in primary dysmenorrhea:a Doppler study[J]. Eur J Obstet Gynecol Reprod Biol,2003, 107 (2) : 191-4. DOI: 10.1016/S0301-2115(02)00372-X. |
| [14] | De Sanctis V, Soliman A, Bernasconi SA, et al. Primary dysmenorrhea in adolescents:prevalence, impact and recent knowledge[J]. Pediatr Endocrinol Rev,2015, 13 (2) : 512-20. |
| [15] | D'ignazio L, Rocha S. Hypoxia induced NF-κB[J]. Cells,2016, 5 (1) : pii:E10. DOI: 10.3390/cells5010010. |
| [16] | Zimna A, Kurpisz M. Hypoxia-Inducible factor-1 in physiological and pathophysiological angiogenesis:applications and therapies[J]. Biomed Res Int,2015 : 549412. |
| [17] | Sun XJ, Wei L, Chen Q, et al. CXCR4/SDF1 mediate hypoxia induced chondrosarcoma cell invasion through ERK signaling and increased MMP1 expression[J]. Mol Cancer,2010, 9 (1) : 17. DOI: 10.1186/1476-4598-9-17. |
| [18] | Kakudo N, Morimoto N, Ogawa T, et al. Hypoxia enhances proliferation of human Adipose-Derived stem cells via HIF-1 alpha activation[J]. PLoS One,2015, 10 (10) : e0139890. DOI: 10.1371/journal.pone.0139890. |
| [19] | Otsuki Y, Misaki O, Sugimoto O, et al. Cyclic bcl-2 gene expression in human uterine endometrium during menstrual cycle[J]. Lancet,1994, 344 (8914) : 28-9. |
| [20] | Kianpour M, Nematbakhsh M, Ahmadi SM, et al. Serum and peritoneal fluid levels of vascular endothelial growth factor in women with endometriosis[J]. Int J Fertil Steril,2013, 7 (2) : 96-9. |
| [21] | Harrison LR, Micha D, Brandenburg MA, et al. Hypoxic human cancer cells are sensitized to BH-3 mimetic-induced apoptosis via downregulation of the Bcl-2 protein Mcl-1[J]. J Clin Investig,2011, 121 (3) : 1075-87. DOI: 10.1172/JCI43505. |
| [22] | Harada T, Iwabe T, Terakawa N. Role of cytokines in endometriosis[J]. Fertil Steril,2001, 76 (1) : 1-10. DOI: 10.1016/S0015-0282(01)01816-7. |
| [23] | Yeniel AÖ, Erbas O, Ergenoglu AM, et al. Effect of oxytocin treatment on explant size, plasma and peritoneal levels of MCP-1, VEGF, TNF-α and histopathological parameters in a rat endometriosis model[J]. Eur J Obstet Gynecol Reprod Biol,2014, 175 : 134-9. DOI: 10.1016/j.ejogrb.2013.12.034. |
| [24] | Lyu J, Yang H, Lang JH, et al. Tumor necrosis factor gene polymorphisms and endometriosis in Asians:a systematic review and meta-analysis[J]. Chin Med J (Engl),2014, 127 (9) : 1761-7. |
| [25] | Greene AD, Lang SA, Kendziorski JA, et al. Endometriosis:where are we and where are we going?[J]. Reproduction,2016, 152 (3) : R63-78. DOI: 10.1530/REP-16-0052. |
| [26] | Westwood FR. The female rat reproductive cycle:a practical histological guide to staging[J]. Toxicol Pathol,2008, 36 (3) : 375-84. DOI: 10.1177/0192623308315665. |
| [27] | Jiang Y, Jy T, Wu Y, et al. Vascular endothelial growth factor gene polymorphisms and the risk of endometriosis:a systematic review[J]. Zhonghua Fu Chan Ke Za Zhi,2012, 74 (4) : 179-84. |
| [28] | Walensky LD. BCL-2 in the crosshairs:tipping the balance of Life and death[J]. Cell Death Differ,2006, 13 (8) : 1339-50. DOI: 10.1038/sj.cdd.4401992. |
| [29] | Jone RK, Bulmer JN, Searle RF. Immunohistochemical characterization of proliferation, oestrogen receptor and progesterone receptor expression in endometriosis:comparison of eutopic and ectopic endometrium with normal cycling endometrium[J]. Hum Reprod,1995, 10 (12) : 3272. |
 2016, Vol. 36
2016, Vol. 36
